Heterocyclische verbinding

A. Xantheen
B. Benzothiofeen
C. Heroïne
D. Diazepam (Valium)
E. Nicotine
Een heterocyclische verbinding is een cyclische of polycyclische chemische verbinding waarin twee of meer verschillende elementen voorkomen.[1] De term wordt meestal in de context van de organische chemie gehanteerd. Het gaat hier dan om cyclische verbindingen waarin naast koolstof ook één of meer andere elementen, die heteroatomen worden genoemd, in de ring voorkomen. De belangrijkste en meest voorkomende heteroatomen in deze organische verbindingen zijn stikstof, zuurstof en zwavel. Heterocyclische verbindingen met een aromatisch karakter worden heterocyclische aromatische verbindingen (kortweg: heteroaromaten) genoemd.[2]
In de organische chemie vormen de heterocyclische verbindingen een omvangrijke stofklasse. De plaats van de verbindingen in deze stofklasse hangt af van hun heteroatoom en de verzadigingsgraad van de ring. Bekende voorbeelden van heterocyclische verbindingen zijn adenine, cafeïne, furaan, pyridine, theobromine en tetrahydrofuraan. Heterocyclische verbindingen bezitten uiteenlopende eigenschappen en kunnen zeer specifieke reacties aangaan doordat hetero-atomen meestal elektronegatiever zijn dan koolstof, waardoor gepolariseerde bindingen voorkomen. Bovendien bezitten de heteroatomen een of meer vrije elektronenparen. De moleculaire structuur van een groot aantal geneesmiddelen, zoals diazepam, sildenafil (bekend onder de merknaam Viagra) en zolpidem, bevat één of meer in een ring opgenomen heteroatomen.
Hoewel fosfor en zwavel de plaats van respectievelijk stikstof en zuurstof kunnen overnemen in een heterocyclisch skelet, zijn verbindingen waarin deze twee voorkomen meestal minder stabiel. De grotere atoomorbitalen van zwavel en fosfor en het extra knoopvlak zorgen voor een minder efficiënte overlap met die van koolstof. De nog zwaardere heteroatomen, zoals arseen, seleen, antimoon en telluur, worden slechts zelden in dergelijke verbindingen aangetroffen. Een voorbeeld van heterocyclische verbindingen met seleen zijn de selenazolen. Er zijn ook heterocyclische verbindingen met metalen (ruthenium en osmium) en metalloïden (silicium en germanium) bekend.
De benaming heterocyclisch is afgeleid van het Oudgriekse heteros (ἕτερος), dat anders betekent (verwijzend naar het heteroatoom), en het laat-Latijnse cyclus, dat cirkel betekent (verwijzend naar de cyclische structuur). Cyclische verbindingen die enkel koolstof als ringvormend element bevatten worden carbocyclische verbindingen genoemd.[3] Geheel verzadigde ringen worden aangeduid als alicyclische verbindingen. De algemene term voor cyclische verbindingen die (naast waterstof) uit slechts één atoomsoort bestaan, zoals cyclopentaan, octazwavel of cyclohexasilaan, is homocyclisch.[4] Vroeger was hiervoor ook de term isocyclisch in zwang.
Geschiedenis[bewerken | brontekst bewerken]


Ontdekking en opheldering van structuren[bewerken | brontekst bewerken]
In de 19e eeuw werden de eerste in de natuur voorkomende stoffen met een heterocyclisch gedeelte in de structuur uit plantaardig materiaal geïsoleerd en opgezuiverd. Omdat de toenmalige scheidingsmethoden en analytische mogelijkheden nog erg beperkt waren, vergde het isoleren en karakteriseren van de verbindingen vaak veel tijd. Zo werd morfine, een krachtige pijnstiller, rond 1806 door de Duitse apotheker Friedrich Sertürner in kristallijne vorm geïsoleerd. Toch werd een eerste voorstel tot een structuurformule pas meer dan 40 jaar later gedaan, en werd pas in 1925 de structuur definitief vastgesteld.
In de jaren 40 en 50 van de 19e eeuw werd door Th. von Anderson een reeks van stikstofhoudende heterocyclische verbindingen geïsoleerd uit dierlijk materiaal. Onder deze verbindingen bevonden zich pyridine en picoline, waarvan de structuren pas decennia later werden opgehelderd. Wilhelm Körner droeg in 1869 de hypothese aan dat er een zekere analogie in structuur moest bestaan tussen benzeen en naftaleen enerzijds en pyridine en chinoline anderzijds. Hij postuleerde dat hierbij een CH-eenheid telkens vervangen zou zijn door een stikstofatoom.[5]
Eerste syntheses[bewerken | brontekst bewerken]
Het was de Britse scheikundige en Nobelprijswinnaar William Ramsay die in 1876 de eerste heterocyclische verbinding synthetiseerde. Hij bereidde pyridine door ethyn en waterstofcyanide als gassen door een roodgloeiende ijzeren buis te leiden.[6][7] Kort daarna volgden Adolf von Baeyer en Heinrich Caro met de synthese van indool in een reactie van N-ethylaniline in een roodgloeiende ijzeren buis.[8] Slechts 2 jaar later werd chinoline, door omzetting van N-allylaniline op gloeiende lood(II)oxide, gesynthetiseerd door W. Königs.[9]
Nomenclatuur en indeling[bewerken | brontekst bewerken]
Door de toenemende kennis over de verbindingen zelf en de ontwikkelingen binnen de chemie ervan, ontstond de behoefte aan een logische, uniforme naamgeving. De eerste regels voor het benoemen van deze verbindingen werden in 1887 en 1888 – onafhankelijk van elkaar – opgesteld door de Duitse scheikundigen Arthur Hantzsch[10] en Oskar Widman.[11] Deze regels, die nu bekendstaan als de Hantzsch-Widman-nomenclatuur, zouden in de loop der jaren uitgebreid worden, maar aan de fundamentele opzet ervan is niets veranderd.
Bij het benoemen van de heterocyclische verbindingen werd in 1957, door de internationale organisatie van de scheikunde, de International Union of Pure and Applied Chemistry (IUPAC), het Hantzsch-Widman-systeem overgenomen.[12][13] Toch zijn er naast de officiële naam soms ook nog triviale namen of gebruiksnamen voorhanden die couranter zijn. Zo is de officiële benaming van pyridine bijvoorbeeld azine, maar deze benaming wordt vrijwel nooit gebruikt.
Stamverbindingen[bewerken | brontekst bewerken]
Onderstaande tabel omvat de stamverbindingen waarin stikstof, zuurstof of zwavel voorkomen. De indeling geschiedt op basis van ringgrootte, de aan- of afwezigheid van onverzadigdheden en het type heteroatoom.
| Verzadigde ringen | Onverzadigde ringen | ||||||
|---|---|---|---|---|---|---|---|
| Heteroatoom | Stikstof | Zuurstof | Zwavel | Stikstof | Zuurstof | Zwavel | |
| 3-ringen | |||||||
| IUPAC-naam | Aziridine | Oxiraan | Thiiraan | Azirine | Oxireen | Thiireen | |
| Triviale naam | Ethyleenimine | Ethyleenoxide | Ethyleensulfide | - | Acetyleenoxide | Acetyleensulfide | |
| Structuurformule | |||||||
| 4-ringen | |||||||
| IUPAC-naam | Azetidine | Oxetaan | Thietaan | Azeet | Oxetiumion | Thietiumion | |
| Triviale naam | 1,3-propyleenimine | trimethyleenoxide | Trimethyleensulfide | Azacyclobutadieen | - | - | |
| Structuurformule | |||||||
| 5-ringen | |||||||
| IUPAC-naam | Azolidine | Oxolaan | Thiolaan | Azool | Oxool | Thiool | |
| Triviale naam | Pyrrolidine | Tetrahydrofuran | Tetrahydrothiofeen | Pyrrool | Furaan | Thiofeen | |
| Structuurformule | 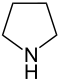 |  |  |  |  |  | |
| 6-ringen | |||||||
| IUPAC-naam | Azinaan | Oxaan | Thiaan | Azine | Oxiniumion | Thiiniumion | |
| Triviale naam | Piperidine | Tetrahydropyraan | Tetrahydrothiopyraan | Pyridine | Pyryliumion | Thiopyryliumion | |
| Structuurformule |  |  | 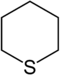 |  |  |  | |
| 7-ringen | |||||||
| IUPAC-naam | Azepaan | Oxepaan | Thiepaan | Azepine | Oxepine | Thiepine | |
| Triviale naam | Hexamethyleenimine | Hexamethyleenoxide | Hexamethyleensulfide | Azatropilideen | Oxacycloheptatrieen | Thiotropilideen | |
| Structuurformule |  |  |  |  |  |  | |
Onder de achtringen vallen azocaan, azocine, oxecaan en thiocaan.
Polycyclische verbindingen[bewerken | brontekst bewerken]
De polycyclische heterocyclische verbindingen ontstaan wanneer één of meerdere stamverbindingen worden gecombineerd met één of meerdere carbocyclische verbindingen. De combinatie kan op enkele manieren geschieden: als gefuseerde of gecondenseerde verbinding (de ringen bezitten een gemeenschappelijke binding) of als spiroverbinding (de ringen bezitten 1 koolstofatoom gemeenschappelijk). Een voorbeeld is indool: deze structuur kan worden opgevat als een benzeenring die gefuseerd is met een pyrroolring. Onderstaande tabel vat de fusieverbindingen tussen een benzeenring en heterocyclische vijf- en zesringen samen:
| Stikstof | Zuurstof | Zwavel | ||||
|---|---|---|---|---|---|---|
| Vijfring | indool | iso-indool | benzofuraan | isobenzofuraan | benzothiofeen | isobenzothiofeen |
 |  |  | 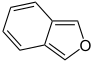 | 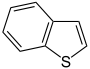 |  | |
| Zesring | chinoline | isochinoline | - | - | ||
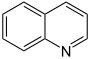 |  | - | - | |||
Daarnaast bestaan ook gebrugde heterocyclische verbindingen, zoals tri-ethyleendiamine, chinuclidine en tropaan. Zij worden ook tot de polycylische structuren gerekend en kunnen formeel opgevat worden als gefuseerde verbindingen die meer dan één binding gemeenschappelijk hebben.
Afgeleide verbindingen[bewerken | brontekst bewerken]
Naast de stamverbindingen en polycylische stamverbindingen is er ook een grote groep aan afgeleide heterocyclische verbindingen, waarbij meerdere heteroatomen (van dezelfde of verschillende atoomsoort) voorkomen of waarbij slechts een deel van de ring verzadigd is. Ook deze verbindingen kunnen gefuseerd zijn met een benzeenring. Onderstaande tabel geeft een overzicht van de meest eenvoudige heterocyclische verbindingen met twee stikstofatomen (met uitzondering van purine dat een fusieverbinding tussen imidazool en pyrimidine is en daardoor 4 stikstofatomen bevat):
| Heterocyclische ringen met 2 stikstofatomen | ||||
|---|---|---|---|---|
| Vijfring | Stamverbinding | pyrazool | imidazool | |
 | ||||
| Gefuseerde verbinding | indazool | benzimidazool | purine | |
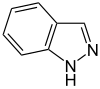 |  |  | ||
| Zesring | Stamverbinding | pyridazine | pyrimidine | pyrazine |
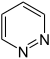 |  | |||
| Gefuseerde verbinding | cinnoline | chinazoline | chinoxaline | |
 |  |  | ||
Heterocyclische verbinding met een stikstofatoom en een zuurstofatoom of een zwavelatoom komen ook voor:
| Stikstof en zuurstof | Stikstof en zwavel | ||||
|---|---|---|---|---|---|
| Stamverbinding | oxazool | isoxazool | thiazool | isothiazool | |
 |  | ||||
| Gefuseerde verbinding | benzoxazool | benzisoxazool | benzothiazool | benzo[d]isothiazool | benzo[c]isothiazool |
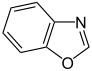 |  |  |  | 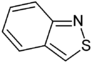 | |
Naast de meest prevalente heteroatomen, stikstof, zuurstof en zwavel, kunnen ook fosfor (in bijvoorbeeld fosforine), arseen (in bijvoorbeeld arsool) en seleen (in bijvoorbeeld 1,3-selenazool) voorkomen als heteroatoom.
Wanneer meerdere heteroatomen voorkomen, kunnen zij ten opzichte van elkaar verschillende posities innemen. Deze positie wordt aangeduid met een specifieke nummering. Voorbeelden zijn 1,4-thiazine, 1,3-dithiaan, 2-imidazoline, 1,2-dioxetaan en 2,3-dihydrothiepine. Bij de nummering krijgt het heteroatoom steeds het laagste cijfer. Indien er meerdere heteroatomen in de ring voorkomen, krijgt het heteroatoom met het hoogste atoomgetal het laagste cijfer. Verder wordt zodanig genummerd dat het totale aantal een zo laag mogelijk getal oplevert.
Wanneer het gaat om heteroaromaten dan zijn vaak gebruiksnamen voorhanden die couranter zijn. Voorbeelden zijn pyrazool, indool, purine, chinoline, isochinoline, fenothiazine, xantheen en benzisoxazool.
 |  |  |  |  |
Metallacyclische verbindingen[bewerken | brontekst bewerken]
Niet enkel hoofdgroepelementen kunnen fungeren als heteroatoom, ook tal van metalen (doorgaans overgangsmetalen) kunnen in een cyclische structuur voorkomen. Een voorbeeld is de Grubbs-Hoveyda-katalysator, waar ruthenium voorkomt in een vijfring.[14] In de Pauson-Khand-reactie worden als intermediairen dikobaltderivaten van cyclobutaan gevormd.[15] Ook in de Nicholas-reactie treden dergelijke intermediairen op.[16]
 |  |  |
(Cy = cyclohexyl) |
Een bijzondere groep heterocyclische verbindingen, met metalen als heteroatomen, vormen de metaalderivaten van benzeen en benzyn. Het gaat hier om onverzadigde zesringen, waaraan via het transitiemetaal een overgangsmetaalcomplex is gekoppeld. Het eerste dergelijk bereide metallabenzeen was een osmiumderivaat.[17] Door het incorporeren van een overgangsmetaal in de benzeenring gaat de aromaticiteit niet verloren en kunnen courante reacties, zoals de elektrofiele aromatische substitutie, relatief gemakkelijk plaatsvinden.[18] Daarnaast bestaat ook de mogelijkheid om drievoudige bindingen (formeel derivaten van het zeer reactieve intermediair benzyn) in de ringstructuur te brengen. In tegenstelling tot benzyn gaan deze organometaalderivaten echter geen additiereacties aan de drievoudige binding aan.
Eigenschappen[bewerken | brontekst bewerken]
Over de chemische en fysische eigenschappen van heterocyclische verbindingen kunnen geen algemene uitspraken worden gedaan, omdat deze erg divers en uiteenlopend zijn. Een aantal specifieke eigenschappen wordt hieronder besproken.
Aromaticiteit[bewerken | brontekst bewerken]
Een belangrijke eigenschap van tal van heterocyclische verbindingen is de aromaticiteit. Het gros van de heterocyclische chemie concentreert zich rond de heteroaromaten. Veelvoorkomende stikstofbevattende heteroaromaten, zoals pyrrool, pyridine, pyrimidine en imidazool, bezitten een vergelijkbare reactiviteit als benzeen. De mesomere stabilisatie van 92-117 kJ/mol is bij deze verbindingen groter dan verwacht kan worden van een niet-aromatisch cyclisch dieen of polyeen, zoals 1,3-cyclohexadieen of cyclooctatetraeen.[19] In zesringen is het kortgesloten pi-systeem met 6 gedelokaliseerde elektronen (regel van Hückel) vergelijkbaar met dat van benzeen: er is een drietal dubbele bindingen aanwezig. In het geval van vijfringen, zoals pyrrool, zijn er twee dubbele bindingen aanwezig; het vrije elektronenpaar op het heteroatoom vervolledigt dan het elektronensextet dat nodig is om aromaticiteit te kunnen verkrijgen. Bij pyridine, een zesring, neemt het vrije elektronenpaar op stikstof niet deel aan het aromatische systeem. Imidazool is een combinatie van beide: het vrije elektronenpaar op het ene stikstofatoom neemt deel aan het aromatisch systeem, dat op het andere stikstofatoom niet.

De eenvoudigste aromatische heterocyclische verbinding is het kation van azirine (het zogenaamde azirinium-ion): het systeem telt 2 gedelokaliseerde elektronen en voldoet daarmee aan de regel van Hückel. Het vormen van het kation is essentieel, omdat hierdoor een p-orbitaal ontstaat dat delokalisatie van deze elektronen toelaat. Van het kation bestaan 3 resonantiestructuren:

Doordat een heteroatoom in de aromatische ring aanwezig is, ontstaat een ongelijkmatige ladingsverdeling. Het heteroatoom is meestal een elektronegatiever element dan koolstof, waardoor de aromaticiteit gereduceerd wordt. Dit kan geïllustreerd worden bij de aromatische vijfringen: daar waar pyrrool zeer goede aromatische eigenschappen bezit, neemt deze met toenemende elektronegativiteit af in de reeks thiofeen en furaan. Zuurstof is immers elektronegatiever dan stikstof en zwavel. De aromaticiteit in furaan (1) is zo zwak dat ze bij het vormen van een diels-alderadduct met een elektrondeficiënt diënofiel (2) zelfs wordt opgeheven:

Basiciteit[bewerken | brontekst bewerken]
De aanwezigheid van één of meer vrije elektronenparen op het heteroatoom maakt dat bepaalde heterocyclische verbindingen zowel een Brønsted- als een Lewisbasekarakter bezitten. Daar waar het vrij elektronenpaar deel uitmaakt van het aromatisch systeem, zoals in pyrrool, bezit de verbinding in kwestie geen basische eigenschappen. Wanneer pyrrool wordt behandeld met een sterk zuur zal de protonering niet op het stikstofatoom optreden, maar op het α-koolstofatoom. Hierbij ontstaat een intermediair dat door resonantie wordt gestabiliseerd.
In het geval van bijvoorbeeld pyridine of pyrrolidine is het vrije elektronenpaar op stikstof wel gevoelig voor protonering. De pKa van het geconjugeerde zuur van pyridine (het pyridinium-ion) bedraagt 5,25, waarmee het iets minder zuur is dan azijnzuur. De positieve lading kan gestabiliseerd worden door resonantie:[19]

Indien meerdere elektronenzuigende heteroatomen in de ring aanwezig zijn, daalt de basiciteit. De reden hiervoor ligt in het feit dat zij elkaar beconcurreren om elektronendichtheid op te nemen, waardoor hun basisch karakter verwaarloosd wordt. Zo bedraagt de pKb van pyridine (bij 20 °C) 8,94, terwijl de pKb van de diazolen hoger ligt: bij pyridazine 11,71, bij pyrimidine 12,87 en bij pyrazine 13,6.
Wanneer op ortho- of para-positie ten opzichte van het heteroatoom sterke elektronenduwende groepen aanwezig zijn, wordt de basiciteit van dit heteroatoom geaccentueerd. Bij 4-dimethylaminopyridine (DMAP) komt dat tot uiting door het genereren van de resonantiestructuren:
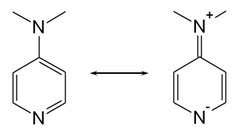
Complexerend vermogen[bewerken | brontekst bewerken]
Op grond van hun Lewisbasiciteit kunnen heterocyclische verbindingen dienstdoen als ligand in metaalcomplexen. Verzadigde verbindingen (zoals tetrahydrofuraan of morfoline) bezitten in de regel een typisch donerend karakter, terwijl de heteroaromaten eerder π-acceptoren zijn. Door de mogelijkheid tot pi-backbonding van het metaalion naar de LUMO van het ligand ontstaan stabiele complexen met een hoge opsplitsingsenergie. Dergelijke complexen komen zelfs voor in de natuur, zoals de porfyrinering in de heemgroep (in hemoglobine en chlorofyl) of de corrinering in cobalamine. Tetrahydrofuraan wordt bijvoorbeeld gebruikt als oplosmiddel bij de synthese van Grignard-reagentia, omdat de zuurstofatomen de gevormde organomagnesiumverbinding stabiliseren door coördinatie met magnesium.
Synthese[bewerken | brontekst bewerken]
Er zijn in de loop der jaren talloze synthesemethoden voor heterocyclische verbindingen gepubliceerd.[20][21][22]
Johnson-Corey-Chaykovski-reactie[bewerken | brontekst bewerken]
De Johnson-Corey-Chaykovski-reactie is een algemene organische reactie waarbij een verzadigde driering met een heteroatoom wordt gevormd uit reactie van een zwavelylide met een geschikt substraat. Dit substraat bepaalt het uiteindelijke heteroatoom in de ring:
- Een carbonylverbinding levert een epoxide
- Een imine levert een aziridine
- Een thiocarbonylverbinding levert een thiiraan

In het geval van een alfa,bèta-onverzadigde carbonylverbinding wordt een cyclopropaanring gevormd, maar dit is geen heterocyclische verbinding. De reactie werd in 1961 ontdekt door A. William Johnson en significant verder ontwikkeld door Elias James Corey en Michael Chaykovski.[23][24] Bij de reactie wordt een grote mate van stereoselectiviteit waargenomen, waarbij het trans-derivaat wordt gevormd, ongeacht de stereochemie van het uitgangsproduct.
Stikstofhoudende heterocyclische verbindingen[bewerken | brontekst bewerken]
Azirines kunnen op fotochemische wijze bereid worden uit vinylaziden. De drijvende kracht van de reactie is de vorming van stikstofgas, dat uit het reactiemidden ontsnapt. Gesubstitueerde azirines kunnen ook op thermische wijze gesynthetiseerd worden uit een enamine met een ondermaat fenyljood(III)diactaat bij 0 °C.[25] De onverzadigde varianten, aziridines, kunnen bereid worden uit reactie van een amine, met in de β-positie een goede leaving group, en een base.
Pyrrool en derivaten ervan zijn eenvoudig te synthetiseren met de Paal-Knorr-synthese.[26] Hierbij worden 1,4-dicarbonylverbindingen met ammoniak of een primair amine in reactie gebracht:

De onverzadigde varianten (zoals pyrrolidine) kunnen bereid worden door partiële of gehele hydrogenering.
Pyridine en derivaten ervan kunnen bereid worden via de Hantzsch-pyridinesynthese, waarbij een aldehyde, ammoniak (of ammoniumacetaat) en een β-ketoester met elkaar reageren.[27] Hierbij ontstaat eerst het dihydropyridinederivaat, dat nog niet aromatisch is. Dit wordt vervolgens geoxideerd tot het pyridinederivaat, door gedurende enige uren te refluxen met ijzer(III)chloride (als alternatief oxidans wordt ook salpeterzuur gebruikt):

Andere methoden om pyridines te bereiden zijn de Tsjitsjibabin-pyridinesynthese en de Bohlmann-Rahtz-pyridinesynthese.
Zuurstofhoudende heterocyclische verbindingen[bewerken | brontekst bewerken]
Van de kleine ringen met zuurstof als heteroatoom zijn de epoxiden (formeel organische derivaten van oxiraan) de belangrijksten. Hiervoor zijn verschillende syntheseroutes voorhanden. Een belangrijke route is de oxidatie van een alkeen met ofwel een peroxycarbonzuur (de Prileschajew-reactie) of met een mengsel van natriumhydroxide en waterstofperoxide. De oxidatie met peroxycarbonzuren vindt plaats bij elektronenrijke alkenen, zoals in styreen:[28]

Als oxiderend reagens wordt meestal m-chloorperoxybenzoëzuur aangewend, omdat de meeste andere peroxycarbonzuren instabiel zijn. In het geval enantioselectiviteit vereist is, wordt de Sharpless-epoxidatie van allylische alcoholen toegepast.[29] De enantioselectiviteit komt voort uit het gebruik van titaniumtetra(isopropylaat) en di-ethyltartraat als katalysatoren. Voor deze bijdrage aan de asymmetrische synthese kreeg Karl Barry Sharpless in 2001 de Nobelprijs voor de Scheikunde.
Oxetanen kunnen middels de Paternò-Büchi-reactie bereid worden.[30] Dit is een fotochemische [2π+2π]-cycloadditie tussen een carbonylverbinding en een alkeen.
Furaan, een belangrijke organische verbinding, kan bereid worden door de reactie van ethyn en formaldehyde, waarna het ontstane diol in reactie met ammoniak wordt gebracht. De verzadigde vorm, tetrahydrofuraan, kan gesynthetiseerd worden door volledige hydrogenering van furaan.
Zwavelhoudende heterocyclische verbindingen[bewerken | brontekst bewerken]
Thiireen, de meest eenvoudige onverzadigde zwavelhoudende heterocyclische verbinding, is onstabiel door de ringspanning en komt ook in de praktijk zelden voor. Ze kunnen bereid worden uit thioaceetaldehyde door middel van een fotochemische reactie.[31] De overeenkomstige verzadigde verbindingen, thiiranen, kunnen gevormd worden uit een one-pot-reactie van een α-gehalogeneerd keton met O,O-di-ethylwaterstoffosforodithioaat en natriumboorhydride op een drager van aluminiumoxide.[32] Ze kunnen ook bereid worden uit de overeenkomstige oxiranen met kaliumthiocyanaat en thioureum.[33] Een alternatieve en meer toegankelijker methode is de substitutiereactie van sulfiden met α,β-dibroomalkanen.
De belangrijkste verbindingen zijn echter de thiofenen en de verzadigde varianten (tetrahydrothiofenen), die eenvoudigweg via een Paal-Knorr-synthese uit een 1,4-diketon kunnen bereid worden. Het zwavelatoom wordt ingevoerd door fosforpentasulfide of een mengsel van waterstofsulfide, waterstofchloride en water. Via de Gewald-reactie kunnen derivaten van 2-aminothiofeen bereid worden.
Reacties[bewerken | brontekst bewerken]
Elektrofiele aromatische substitutie[bewerken | brontekst bewerken]
Daar waar bij klassieke aromaten, zoals benzeen of naftaleen, de elektrofiele aromatische substitutie vlot doorgaat omwille van het elektronrijke karakter van de aromatische ring, is deze reactie bij heteroaromaten sterk afhankelijk van de ringgrootte en het type heteroatoom. Het heteroatoom bezit namelijk een andere elektronegativiteit dan koolstof, waardoor een formele polarisatie in de ring ontstaat die de elektronendensiteit wijzigt.[34] Er zal dus een regioselectiviteit ontstaan.
Bij heteroaromaten waarbij het vrij elektronenpaar van het heteroatoom geen deel uitmaakt van het gedelokaliseerde π-systeem (bij zesringen zoals pyridine) is de elektronendensiteit laag, waardoor elektrofielen veel minder de neiging hebben om te reageren. In het geval van pyridine zal een elektrofiel eerder met het vrij elektronenpaar op stikstof reageren, met vorming van pyridiniumverbindingen. Elektrofiele aromatische substitutie bij pyridine zal enkel optreden op de 3-plaats, omdat dit het elektronenrijkste koolstof is:

Substitutie op de 2- of 4-plaats leidt tot een onstabiele, zogenaamd σ-complex (met slechts 6 elektronen rond stikstof):


Wanneer het vrij elektronenpaar wel deel uitmaakt van het π-systeem, bij vijfringen zoals in furaan of thiofeen, treedt een verhoging op van elektronendensiteit in de ring, wat tot gevolg heeft dat elektrofielen gemakkelijker reageren.[19] Pyrrool, furaan en thiofeen zijn in de regel daardoor reactiever dan benzeen, waardoor de reactieomstandigheden minder krachtig hoeven te zijn. De α-plaats (het koolstofatoom naast het heteroatoom) is het reactiefst, omdat de positieve lading door resonantie wordt gestabiliseerd (onder andere op het heteroatoom, waardoor alle elementen hun octetconfiguratie bezitten). De Bischler-Napieralski-reactie is een voorbeeld waarbij elektrofiele aromatische substitutie plaatsgrijpt bij pyrrool:[35]

Zwakke elektrofielen reageren het slechtst met elektronenarme heteroaromaten.
Nucleofiele aromatische substitutie[bewerken | brontekst bewerken]
Ringen met een sterk verminderde elektronendensiteit, door bijvoorbeeld aanwezigheid van meerdere hetero-atomen of elektronenzuigende substituenten, reageren bijna niet in een elektrofiele aromatische substitutie. Daarentegen ondergaan zij zeer vlot een nucleofiele aromatische substitutie. Een bekend voorbeeld is de Tsjitsjibabin-reactie, waarbij met natriumamide in ammoniak een aminegroep op het α-koolstofatoom in pyridine wordt ingevoerd. De reactiviteit van pyridine kan verhoogd worden door aanwezigheid van elektronenzuigende substituenten.
Ringopening[bewerken | brontekst bewerken]
Met behulp van geschikte nucleofielen kunnen de meeste verzadigde heterocyclische verbindingen geopend worden. De reactiviteit neemt af naarmate de ring groter wordt, omdat de ringspanning dan gradueel afneemt. Een voorbeeld is de vlotte ringopening van thietaan met dibroom, waarbij het disulfide ontstaat:[36]

Epoxiden worden via een SN2-reactie vlot geopend met behulp van nucleofielen. Wanneer het ontstane alkoxide niet snel goed gestabiliseerd kan worden, treedt het zelf op als nucleofiel. Zodoende treedt polymerisatie tot polyethers op:

De opening kan ook met zuren gebeuren: dan wordt zuurstof eerst geprotoneerd en ontstaat een zeer reactief cyclisch hydroxonium als intermediair. Water treedt vervolgens als nucleofiel op en opent de driering (via een SN1-proces). Een daaropvolgende zuur-basereactie leidt tot vorming van het vicinaal diol.
Aziridines kunnen regioselectief geopend worden door reactie met natriumazide en kaliumperoxosulfaat in acetonitril.[37]
Naast verzadigde ringen kunnen ook heteroaromaten geopend worden. Een voorbeeld is de ringopening van stikstofhoudende heteroaromaten met behulp van metaalcomplexen van onder andere scandium, yttrium[38] en uranium.[39]
De Eschenmoser-fragmentering is een reactie waarbij een α,β-epoxyketon 1 (een epoxide afgeleid van een alfa,bèta-onverzadigde carbonylverbinding) met een arylsulfonzuurhydrazide (2) wordt omgezet tot een alkyn (3) en een keton (4):[40]

Dit soort reacties is van belang bij de synthese van macrocyclische verbindingen.[41]
Eliminatie van het heteroatoom[bewerken | brontekst bewerken]
In drieringen kan het heteroatoom via verschillende retro-pericyclische reacties geëlimineerd (verwijderd) worden. Een voorbeeld is de nitrosering van aziridines met nitrosylchloride in tetrachloormethaan. De drijvende kracht voor de reactie is de vorming van een gas (distikstofoxide) en een sterke dubbele binding:

Thiiranen kunnen van zwavel ontdaan worden door reactie met driewaardige fosforverbindingen, zoals tri-ethylfosfiet:

Bij de Ramberg-Bäcklund-reactie wordt een alkeen bereid uit een α-gehalogeneerde sulfonverbinding met een sterke base. Het intermediair is een cyclische sulfoxide, waarbij zwavel geëlimineerd wordt onder de vorm van zwaveldioxide:[42]

Bepaalde retro-cheletrope reacties leiden tot de extrusie van een gasvormige component. Een voorbeeld is de vrijzetting van 1,3-butadieen uit de heterocyclische verbinding sulfoleen:

Deze reactie wordt gebruikt om in situ 1,3-butadieen (dat gasvormig is bij kamertemperatuur) te genereren, dat kan aangewend worden bij het uitvoeren van diels-alderreacties. Sulfoleen is een vaste stof en is dus veel gemakkelijker hanteerbaar dan een gas.
Voorkomen[bewerken | brontekst bewerken]
Heterocyclische verbindingen, zowel alifatische als aromatische, vormen in de natuur een zeer wijdverbreide stofklasse. Ze zijn verantwoordelijk voor het kunnen uitvoeren van talrijke biologische functies, hoofdzakelijk gebaseerd op hun complexerend vermogen. Zeer giftige stoffen die bepaalde diersoorten tegen predatoren beschermen, zoals batrachotoxine op de huid van pijlgifkikkers of tetrodotoxine in de kogelvis, bezitten één of meerdere heterocyclische gedeelten in hun structuur. Daarnaast bezitten verschillende in de natuur voorkomende heterocyclische verbindingen farmaceutische eigenschappen en worden daarom als geneesmiddel gebruikt, al dan niet gemodificeerd.
DNA en RNA[bewerken | brontekst bewerken]
Nucleotiden vormen de bouwstenen van het DNA en RNA, de dragers en vertalers van genetische informatie. Een nucleotide bestaat uit drie componenten:
- een purine- of een pyrimidinebase (een zogenaamde nucleobase)
- een suiker met vijf koolstofatomen (een zogenaamd pentose)
- één tot drie fosfaatgroepen
De purine- en pyrimidinebasen betreffen in het DNA adenine, guanine, cytosine en thymine (in RNA is de thymine vervangen door uracil) en zijn heterocyclische verbindingen. Adenine vormt in het DNA steeds een basenpaar met thymine door middel van twee waterstofbruggen; cytosine en guanine vormen drie waterstofbruggen met elkaar.
 |  |
In het RNA vormt adenine een basenpaar met uracil. De waterstofbrugvorming, de aanwezigheid van een fosfaatruggengraat in DNA, en bovenal de stacking-interactions tussen de nucleobasen vormen de basis voor de dubbele helicoïdale structuur. Omdat een basenpaar altijd dezelfde geometrie heeft, is de driedimensionale structuur van DNA niet afhankelijk van de nucleotidevolgorde. Een genoom kan dus evolueren zonder dat de stabiele dubbele helix daarbij veranderd.[43]
Het belang van complexvorming door heterocyclische verbindingen in het DNA wordt geïllustreerd door de toepassing van bepaalde complexvormende cytostatica, zoals cisplatine, bij de bestrijding van kanker. In het geval van cisplatine ondergaat de coördinatieverbinding hydrolyse in de cel, waarbij een chloor-ligand wordt vervangen door water. Hierbij ontstaat een geladen reactief aqua-complex. Dit complex wordt met een specifiek stikstofatoom (N7) in guanine en adenine verbonden. Verdere hydrolyse vervangt ook het andere chlooratoom door water, waardoor cisplatine ook met een tweede stikstofatoom in een nucleotide kan complexeren. De ontstane adducten verstoren de helixstructuur van het DNA.[44] Hierdoor wordt de replicatie en verdere ontwikkeling van kankercellen afgeremd.
Cytochroom[bewerken | brontekst bewerken]
De cytochromen zijn een groep van gekleurde proteïnen, die zich kenmerken door hun ijzerbevattende heemverbinding. Ze spelen een rol in een aantal belangrijke stofwisselingsprocessen, zoals in de fotosynthese en de oxidatieve fosforylering. Cytochromen zijn gespecialiseerd in het snel opnemen en afstaan van elektronen, een functie die essentieel is in de elektronentransportketen. Een aparte familie van cytochromen, cytochroom P450-groep genaamd, zijn voornamelijk betrokken bij enzymatische afbraak van kleine lichaamsvreemde moleculen, zoals geneesmiddelen of toxines.
De heemgroepen zijn chemische gezien derivaten van porfyrine, dat een tetrapyrrool is. Door de aromaticiteit (18 gedelokaliseerde pi-elektronen) en de hoge mesomere energie, zijn deze verbindingen zeer stabiel. Het kan worden verhit zonder dat een noemenswaardige vorm van ontleding optreedt.[19] De stikstofatomen kunnen verschillende metaalionen complexeren: in heem wordt ijzer gebonden en in chlorofyl wordt magnesium gecoördineerd.
 |  |
IJzer en magnesium kunnen door middel van valentie- en coördinatiebindingen in totaal 6 groepen met een elektronenpaar binden. Daarom kunnen beide metalen in de porfyrinering naast twee normale covalente bindingen (de valentiebindingen) naar stikstof ook nog vier coördinatieverbindingen aangaan. Twee van deze coördinatieplaatsen worden reeds ingenomen door de overige twee stikstofatomen. In het geval van ijzer zijn er nog twee coördinatieplaatsen onder en boven het vlak van de porfyrinering over. Een van deze wordt gebruikt om te coördineren met het stikstofatoom uit de imidazoolring van histidine (een heteroaromatisch aminozuur), dat deel uitmaakt van het eiwit globine. De laatste coördinatieplaats wordt ingenomen door een vrij elektronenpaar van dizuurstof.
 |
Omdat zuurstof slechts een matige elektronenpaardonor is, kan het gemakkelijk worden overgedragen naar myoglobine, een eiwit dat in de spieren aanwezig is. Daar wordt zuurstof door opname van vier elektronen uit de oxidatieve fosforylering (de elektronentransportketen) omgezet tot water. Sterke elektronenpaardonoren, zoals koolstofmonoxide of cyanide, vormen bindingen met hemoglobine die zeer sterk zijn en door zuurstof niet kunnen verdrongen worden. In dat geval kan er geen zuurstof meer getransporteerd worden naar de verschillende weefsels en organen, met als gevolg dat er vergiftiging door zuurstoftekort optreedt (koolstofmonoxidevergiftiging).
Cobalamine[bewerken | brontekst bewerken]
De cobalamines zijn de enige voorbeelden van organische kobalthoudende verbindingen in de natuur, met als bekendste voorbeeld vitamine B12. Hun structuur is gelijkaardig aan die van de heemgroep, maar de porfyrinering is hier vervangen door een corrinering. Het enige verschil is dat er een koolstofatoom minder in de ring aanwezig is. De coördinatiestructuur rondom kobalt is vergelijkbaar met die van ijzer in hemoglobine. Een axiale coördinatieplaats wordt ingenomen door een dimethylbenzimidazolgroep (een heteroaromaat). De laatste ligand is variabel en geeft aanleiding tot verschillende mogelijk cobalamines: een cyanide tot cyanocobalamine, een hydroxylgroep tot hydroxocobalamine, een methylgroep tot methylcobalamine en adenine tot adenosylcobalamine.
Aminozuren[bewerken | brontekst bewerken]
Van de 20 natuurlijk voorkomende, proteïnogene aminozuren zijn er 3 die een heterocyclische structuur bezitten: histidine (imidazoolring), tryptofaan (indoolring) en proline (pyrrolidinering). De eerste twee bezitten ook een aromatisch karakter, proline is volledig verzadigd. Bovendien is het stikstofatoom in de pyrrolidinering gebonden aan de zijketen zelf. Bijgevolg is het een secundair aminozuur.
 |  |  |
Alkaloïden[bewerken | brontekst bewerken]
Talloze alkaloïden, met name de echte alkaloïden (met een stikstofatoom in een heterocyclische ring), zijn heterocyclisch van aard. Verbindingen als atropine, bufotenine, cafeïne, cocaïne, kinine, mescaline, morfine, nicotine, psilocine, psilocybine, reserpine, solanine, strychnine en tomatine, die voorkomen in planten, bezitten veelal neuroactieve dan wel psychoactieve eigenschappen. De biosynthese gaat uit van aminozuren: het merendeel van de alkaloïden wordt gesynthetiseerd uit fenylalanine, tyrosine en tryptofaan. Daarnaast worden – zij het in mindere mate – ook lysine, histidine en ornithine aangetroffen als precursors.
Bij de isolatie van alkaloïden uit planten wordt gebruikgemaakt van de basiciteit van het stikstofatoom. Het plantenmateriaal wordt meestal fijn gemalen in petroleumether, met als doel de apolaire verbindingen (zoals vetten, oliën, wassen en terpenen) te verwijderen. Daarna volgt een extractie met methanol of ethanol, waarin de meeste alkaloïden wel oplossen. Het indampen van deze alcoholische oplossing levert een alkaloïden bevattende stroperige vloeistof, die geschud wordt met een niet-mengbaar mengsel van ethylacetaat en verdund zuur. De zure en polaire natuurproducten (polyfenolen en polaire terpenen) lossen op in ethylacetaat. De alkaloïden worden geprotoneerd door het zuur en lossen als zout op in de waterfase. Nadat de waterfase is afgescheiden, wordt ze weer basisch gemaakt waardoor de alkaloïden uit hun zouten worden verdreven. Uitschudden van de basische oplossing met ethylacetaat geeft dan na indampen aan de rotavapor de vrije alkaloïden. Dit is echter een mengsel, maar het kan met chromatografische technieken gescheiden worden.[45]
Koolhydraten[bewerken | brontekst bewerken]
De monosachariden, zoals ribose, glucose en fructose, kunnen naast hun lineaire structuur ook als cyclische structuur voorkomen. Formeel betreft het een evenwicht tussen een aldehyde (of keton) en een alcohol enerzijds en een hemiacetaal anderzijds. In een monosacharide zijn zowel een hydroxylgroep als een carbonylgroep aanwezig, waardoor een cyclisatie kan plaatsgrijpen. Het evenwicht ligt hier aan de zijde van het hemiacetaal, dat tevens een heterocyclische verbinding is (met zuurstof als heteroatoom).
 |  |
In het geval dat er meerdere hydroxylgroepen aanwezig zijn, kunnen ringen van verschillende grootte gevormd worden. In de meeste gevallen worden enkel vijf- en zesringen gevormd, omdat deze het minste ringspanning bezitten.
Monosachariden kunnen zich verbinden tot polysachariden, die in de cellen van alle levende organismen worden aangetroffen. Ze dienen als constructiemateriaal en als reservevoedsel. Voorbeelden van deze polysachariden zijn cellulose, zetmeel, glycogeen, dextraan, chitine, inuline, levan, hyaluronzuur, heparine en pectine.
Geur- en kleurstoffen[bewerken | brontekst bewerken]
Indigo en derivaten[bewerken | brontekst bewerken]
Indigo is een plantaardige stof die reeds meer dan 4000 jaar als paarsblauwe kleurstof voor textiel wordt gebruikt. De stof wordt onrechtstreeks gewonnen uit planten als Indigofera arrecta, Indigofera tinctoria of Indigofera suffruticosa. Deze planten bevatten geen indigo, maar wel indicaan, een glycoside van indoxyl. Eerst wordt indicaan gehydrolyseerd, waardoor het gele indoxyl ontstaat. Vervolgens wordt indoxyl geoxideerd tot indigo. De basisstructuur van zowel indigo als indicaan is afgeleid van indool.
Het dibroomderivaat van indigo, purper, wordt gewonnen uit de schelp van de brandhoren (Haustellum brandaris). Het werd in het verleden gebruikt om gewaden van gezagsbekleders te kleuren vanwege de typisch paarse kleur. Purper, waarvan de structuur in 1909 werd opgehelderd, is een zeer dure stof en wordt commercieel niet geproduceerd.
 |  |  |
Daarnaast bestaan nog tal van andere derivaten van indigo, die variëren in het type substituent op de benzeenring. In indigokarmijn bijvoorbeeld zijn 2 sulfonzure groepen de substituenten. Deze verbinding wordt ook als pH-indicator gebruikt: de zure vorm is blauw en de basische is geel. Wanneer de secundaire amines worden vervangen door een thio-etherfunctie, ontstaat thio-indigo, dat een typisch rode kleur bezit.
Heden zijn er voor indigo syntheseroutes voorhanden, die vooral op industriële schaal worden aangewend. De eerste was de Baeyer-Drewson-indigosynthese uit 1882,[46] maar deze bleek praktisch gezien zeer moeilijk. De eerste praktische synthese staat op naam van Pfleger en werd gepubliceerd in 1901. Tijdens de reactie wordt N-fenylglycine behandeld met een gesmolten mengsel van natriumhydroxide, kaliumhydroxide en natriumamide, waardoor indoxyl wordt gevormd. Onder invloed van luchtzuurstof wordt deze verbinding geoxideerd tot indigo. Variaties op deze synthesemethode zijn nog steeds in gebruik.
Een alternatieve route betreft de verhitting van N-(2-carboxyfenyl)glycine met natriumhydroxide tot 200 °C onder inerte atmosfeer. Hierbij wordt het carbonzuur van indoxyl gevormd, dat gedecarboxyleerd en eveneens tot indigo geoxideerd wordt. Het proces, dat in 1897 werd ontwikkeld door Heumann, is eenvoudiger dan dat volgens Pfleger, maar het uitgangsproduct is duurder.
Fenylpropanoïden[bewerken | brontekst bewerken]
Coumarine is een heterocyclische zuurstofverbinding die in verdunde toestand naar hooi geurt. De verbinding komt voor in tal van planten: gewoon reukgras, veenreukgras, akkerhoningklaver, rolklaver, kaneel en tonkabonen. Coumarine is, samen met een aantal structureel verwante stoffen, verantwoordelijk voor de typische hooigeur van drogend en gedroogd gras. Bij het drogen van de planten komt de stof vrij uit de suikerketens waar het in de levende plant aan gebonden is. Hoewel de geur aangenaam is, zijn de planten waarin coumarine voorkomt bijna niet eetbaar door de bittere smaak. Dat is de reden dat grazende dieren deze planten vermijden. Bijgevolg treedt coumarine ook op als een soort beschermstof voor de plant.
Andere fenylpropanoïden met een heterocyclische structuur zijn safrol en umbelliferon. Safrol komt ook voor in sassafras, nootmuskaat, kaneel, foelie, anijs, zwarte peper en basilicum. Het heeft een typisch snoepwinkel-aroma, daarom werd het vroeger gebruikt in bieren, thee, zepen en parfums. Umbelliferon bezit een coumarinestructuur als basis, met op de 7-plaats een hydroxylgroep.
Scatool en heterocyclische thiolen[bewerken | brontekst bewerken]
Scatool is een methylderivaat van indool. Het bezit een zeer onaangename geur, daar het voorkomt in menselijke en dierlijke ontlasting. In zeer lage concentraties bezit het echter een bloemengeur en komt het voor in enkele planten, zoals bieten, sinaasappelbloesems, jasmijn en Ziziphus mauritiana. In die context wordt het verwerkt in onder andere parfums. Scatool bezit een zeer lage geurdrempel: een concentratie van 0,23 ppb (0,23 µg per kilogram) kan nog steeds door de mens worden waargenomen.
De anale geurklieren van stinkdieren produceren onder andere 2-quinolinemethaanthiol. De thiolen waarmee stinkdieren hun belagers besproeien hechten door adsorptie zeer goed en langdurig in de keratinevezels van de beharing en het huidoppervlak van hun belagers. Deze thiolen zijn goed waarneembaar bij concentraties vanaf 10 ppb, ze laten langzaam van de huid en de beharing van een belager los, maar ze lossen niet op in schoonmaakmiddelen.[47][48] De stank verdwijnt alleen doordat de geurstoffen tergend langzaam verdampen/sublimeren, waarna ze door diffusie uit de omgeving van de belager verdwijnen.
Fluorescerende stoffen[bewerken | brontekst bewerken]
Luciferines vormen een groep van organische verbindingen die worden aangetroffen in organismen die tot bioluminescentie in staat zijn, zoals glimwormen, bepaalde diepzeevissen (diepzeehengelvissen) en zeevonk. Het luciferine dat voorkomt in glimwormen (in het Engels firefly luciferin genoemd) bezit een basisstructuur van thiazoline en wordt door middel van zuurstof en ATP geoxideerd tot oxyluciferine. De reactie, die gekatalyseerd wordt met het enzym luciferase, produceert een karakteristiek geel licht.
Andere luciferines met een heterocyclische structuur zijn varguline, dat voorkomt in Vargula hilgendorfii (een mosselkreeftje) en coelenterazine, dat voorkomt in onder andere stralendiertjes, ribkwallen, bepaalde neteldieren (waaronder Aequorea victoria, Obelia geniculata en Renilla reniformis), pijlinktvissen, eenoogkreeftjes, pijlwormen en bepaalde stekelhuidigen.
Toepassingen[bewerken | brontekst bewerken]
Heterocyclische verbindingen zijn bijzonder veel voorkomende en toegepaste verbindingen, dit betreft aanwendingen in het dagelijks leven, de landbouw, de industrie alsook in een specifieke chemische context.
Geneesmiddelen[bewerken | brontekst bewerken]
Talloze geneesmiddelen bezitten minstens één heterocyclisch gedeelte in hun structuur. Bekende voorbeelden zijn atorvastatine (Lipitor), codeïne (in hoestdrank), diazepam (Valium), morfine (pijnstiller), povidonjodium (Isobetadine), sildenafil (Viagra) en xylometazoline (de werkzame stof in neusdruppels).
Chemische bestrijdingsmiddelen[bewerken | brontekst bewerken]
Bepaalde chemische bestrijdingsmiddelen (insecticiden, herbiciden, fungiciden en bactericiden), zoals clothianidine, endosulfan, imidacloprid en paraquat, zijn ook heterocyclisch van aard. Zij vormen, naast de groep van organofosfaat- en organothiofosfaatesters, een belangrijke groep. Hun nadeel is dat de toepassing beperkt is door de geringe natuurlijke afbreekbaarheid.
Basen[bewerken | brontekst bewerken]
In de synthetische chemie worden enkele heterocyclische verbindingen (voornamelijk de stikstofbevattende) aangewend als base. Ze worden onder meer ingezet om de deprotonering van alcoholen te faciliteren. Een veelgekozen verbinding hiervoor is pyridine. De verbindingen worden ook gebruikt bij het afvangen (capteren) van eventuele schadelijke zuren (zoals waterstofchloride), die vrijkomen tijdens een chemische reactie. Een voorbeeld hiervan betreft de omzetting van een carbonzuur naar een zuurchloride met thionylchloride. Andere toegepaste basen zijn tri-ethyleendiamine (DABCO) of de amidinebasen DBU en DBN.
 |  |
Hun voordeel betreft de zwakkere basiciteit in vergelijking tot bijvoorbeeld organolithiumverbindingen of hydriden. Zo wordt een hogere selectiviteit verkregen. Bovendien zijn ze veel zwakkere nucleofielen, zodat er geen additie aan de carbonylgroep optreedt. Dat maakt dat ze bij een groter scala aan verbindingen kunnen worden ingezet. Het nadeel is dat zij bepaalde complexerende eigenschappen bezitten en daarom niet kunnen worden gebruikt bij reacties waarin metalen voorkomen (bijvoorbeeld als katalysator).
Oplosmiddel[bewerken | brontekst bewerken]
Naast de meest gebruikelijke oplosmiddelen, zoals di-ethylether, n-pentaan of water, worden ook heterocyclische verbindingen wel voor dit doel ingezet. Een voorbeeld is tetrahydrofuraan (THF), dat bijvoorbeeld als een zwak-coördinerend ether bij Grignard-reacties wordt gebruikt. De coördinerende eigenschappen van zuurstof worden hier gebruikt om het organomagnesiumreagens te stabiliseren. Ook pyridine, pyrimidine, piperidine en morfoline worden aangewend als oplosmiddel. Onder de groene heterocyclische oplosmiddelen kunnen gerekend worden: propyleencarbonaat, 2-methyltetrahydrofuraan en dihydrolevoglucosenon.
Sulfolaan werd in de jaren 60 van de 20e eeuw door Royal Dutch Shell ontwikkeld als industrieel oplosmiddel. Het wordt gebruikt bij de vloeistof-vloeistofextractie en extractieve destillatie om aromatische verbindingen af te scheiden uit een mengsel van koolwaterstoffen. Het industrieel proces dat hiervoor nog steeds wordt gebruikt, wordt het sulfolaanproces genoemd.
Elektrotechniek[bewerken | brontekst bewerken]
Bepaalde heterocyclische verbindingen bezitten geleidende eigenschappen. Hierdoor kunnen deze als een alternatief voor metallische geleiders wordt gebruikt. Ze kunnen gebruikt worden als geleider, halfgeleider of supergeleider in bijvoorbeeld batterijen, transistoren en leds. Verbindingen die voor dergelijke doeleinden worden gebruikt, bezitten een uitgebreid geconjugeerd π-elektronensysteem. Polythiofenen en polypyrrolen komen hiervoor in aanmerking.[49][50] Ook eenkristallen van tetrathiafulvaleen en tetracyanochinodimethaan bezitten deze eigenschappen.[51][52]
Literatuur[bewerken | brontekst bewerken]
- (en) J.A. Joule & K. Mills (2010) - Heterocyclic Chemistry, John Wiley and Sons - ISBN 978-0-632-05453-4
- (en) J.J. Li (2005) - Name reactions in heterocyclic chemistry, John Wiley and Sons - ISBN 978-0-471-30215-5
- (en) M.F. Ansell & G. Pattenden (1978) - Saturated Heterocyclic Chemistry, Volume 5 - ISBN 978-0-851-86622-2
Externe links[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
| Dit artikel is op 10 november 2011 in deze versie opgenomen in de etalage. |


 French
French Deutsch
Deutsch