Naftaleen
| Naftaleen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
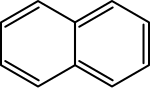 | |||||
Structuurformule van naftaleen | |||||
 | |||||
Molecuulmodel van naftaleen | |||||
| Algemeen | |||||
| Molecuulformule | C10H8 | ||||
| IUPAC-naam | naftaleen | ||||
| Molmassa | 128,17 g/mol | ||||
| SMILES | c1cccc2c1cccc2 | ||||
| CAS-nummer | 91-20-3 | ||||
| EG-nummer | 202-049-5 | ||||
| Wikidata | Q179724 | ||||
| Beschrijving | Witte vaste stof | ||||
| Vergelijkbaar met | benzeen, tolueen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H351 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 - P281 - P501 | ||||
| MAC-waarde | 50 mg/m³ | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | Wit | ||||
| Dichtheid | 1,0253 g/cm³ | ||||
| Smeltpunt | 80,55 °C | ||||
| Kookpunt | 218 °C | ||||
| Vlampunt | 79,8 °C | ||||
| Dampdruk | 6,6 Pa | ||||
| Oplosbaarheid in water | 0,03 g/L | ||||
| Goed oplosbaar in | benzeen, koolstofdisulfide, di-ethylether, tolueen, xyleen, chloroform | ||||
| Slecht oplosbaar in | water, ethanol | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Naftaleen (uit het Grieks voor aardolie: naphtha) is een witte, vaste stof met de brutoformule C10H8, die al bij kamertemperatuur sublimeert. Naftaleen is een bicyclische aromatische koolwaterstof met een karakteristieke, teerachtige geur. Naftaleen is gevaarlijk voor de gezondheid en het milieu.
Geschiedenis[bewerken | brontekst bewerken]
Naftaleen werd in 1819 door de Brits chemicus Alexander Garden uit steenkoolteer geïsoleerd. In 1866 werd door Emil Erlenmeyer de structuurformule voor naftaleen voor het eerst gepostuleerd. Hoewel het slechts uit twee geconjugeerde aromatische ringen bestaat, wordt het tot de polycyclische aromatische koolwaterstoffen (PAK) gerekend.
Eigenschappen[bewerken | brontekst bewerken]
In één liter water is slechts 30 milligram naftaleen oplosbaar en in ethanol is het slecht oplosbaar. In apolaire oplosmiddelen als benzeen, koolstofdisulfide, di-ethylether, tolueen, xyleen en chloroform lost naftaleen goed op. Naftaleen smelt bij 80°C en kookt bij 218°C. Aan de karakteristieke, teerachtige geur blijkt dat naftaleen reeds sublimeert bij kamertemperatuur. Naftaleen heeft een ontbrandingstemperatuur van 540°C.
Reactiviteit[bewerken | brontekst bewerken]
Naftaleen verbrandt met een roetende vlam en is een aromatische verbinding. Naftaleen heeft 10 π-elektronen en voldoet aan de regel van Hückel voor aromaticiteit. Naftaleen is een isomeer van azuleen, dat dezelfde molecuulformule heeft, maar azuleen bestaat uit een vijf- en een zevenring. Ten opzichte van benzeen is naftaleen reactiever, maar reageert vaak op een analoge manier. Reacties kenmerkend voor aromatische moleculen zoals sulfonering, nitrering en Friedel-Craftsacylering kunnen zonder problemen worden uitgevoerd met naftaleen. Anderzijds is naftaleen gevoeliger voor hydrogenatiereacties en kan een van beide ringen zonder veel problemen worden gereduceerd (bijvoorbeeld met waterstofgas en palladium op koolstof als katalysator). Het reageert met oxidatoren als chroom(VI)oxide en stikstofoxiden, maar onder katalytische omstandigheden met zuurstofgas, en kan op deze manier tot ftaalzuur worden geoxideerd. Vaak worden diazonaftaleenverbindingen gebruikt in kleurstoffen vanwege hun intense kleuren.
Van naftaleen zijn duizenden derivaten bekend.
Productie en toepassingen[bewerken | brontekst bewerken]
Naftaleen wordt gewonnen uit de middelste fracties van steenkoolteer, bruinkool, houtteer en kraakgas. In steenkoolteer is naftaleen verhoudingsmatig de grootste component. Naftaleen komt ook voor in aardolie en andere fossiele brandstoffen en ontstaat bij de verbranding van hout en tabak.
Naftaleen was vroeger het hoofdbestanddeel van mottenballen, maar vanwege de onaangename geur wordt het tegenwoordig door andere stoffen vervangen. In de vroege 20e eeuw werd het gebruikt voor stadsverlichting, ook al raakten de leidingen vaak verstopt door kristallisatie. Ondanks de gevaren werd naftaleen gebruikt tegen darminfectie.
Naftaleen wordt hoofdzakelijk gebruikt voor de synthese van ftaalzuuranhydride, dat gebruikt wordt voor de synthese van oplosmiddelen, kunststoffen en brandstoffen, bijvoorbeeld decaline en tetraline. Andere voorbeelden zijn kleurstoffen, 1-chloornaftaleen, 2-chloornaftaleen, (houtbeschermingsmiddelen), insecticiden, weekmakers en reinigingsmiddelen. Andere belangrijke industriële producten gebaseerd op naftaleen zijn 1-naftol, 2-naftol, 1-broomnaftaleen, 2-broomnaftaleen, 1-naftylamine, 1-nitronaftaleen en 2-nitronaftaleen. In 2016 bleek uit onderzoek dat Naftaleen ook in de kunstgras korrels van voetbalvelden zit.
In 1987 werd ongeveer 1 miljoen ton naftaleen geproduceerd. West-Europa is met een productie van ongeveer 250.000 ton de hoofdproducent van naftaleen, gevolgd door Oost-Europa (200.000 ton), Japan (200.000 ton) en de Verenigde Staten (125.000 ton).
Toxicologie en veiligheid[bewerken | brontekst bewerken]
De letale dosis voor een mens ligt op ongeveer 5 gram. Naftaleen geeft op de huid irritaties en kan in het lichaam de rode bloedcellen beschadigen. Bij inademing kan het tot irritatie van de slijmvliezen leiden en tot overgeven, verwardheid en misselijkheid leiden. Bij inname leidt naftaleen tot maag-darmklachten, ademhalingsproblemen en krampen. Ondanks de geringe wateroplosbaarheid kan naftaleen leiden tot beschadiging van de lever, nieren en de ogen. Van naftaleen wordt vermoed dat het kanker verwekt.
Indien het poeder of de korrels vermengd worden met lucht, kan er stofexplosie optreden. Naftaleen vormt bij verbranding irriterende en giftige gassen en reageert met sterke oxidatoren.
Externe links[bewerken | brontekst bewerken]
 naftaleen - International Chemical Safety Card
naftaleen - International Chemical Safety Card- (en) Gegevens van naftaleen in de GESTIS-stoffendatabank van het IFA


 French
French Deutsch
Deutsch

