Eschenmoser-fragmentering
De Eschenmoser-fragmentering (ook aangeduid als de Eschenmoser-Ohloff- of de Eschenmoser-Tanabe-fragmentering) is een organische reactie waarbij een α,β-epoxyketon (1) met een arylsulfonzuurhydrazide (2) wordt omgezet tot een alkyn (3) en een keton (4):[1]

De reactie werd vernoemd naar de Zwitserse scheikundige Albert Eschenmoser, die ze ontdekte bij zijn onderzoek naar de synthese van muskon en andere macrocyclische muskusverbindingen.
Reactiemechanisme[bewerken | brontekst bewerken]
De reactie start met de vorming van een sulfonylhydrazon (3) uit een α,β-epoxyketon (1) en een arylsulfonzuurhydrazide (2). Het epoxide is afgeleid van een alfa,bèta-onverzadigde carbonylverbinding en kan gevormd worden door reactie met een peroxycarbonzuur. Het sulfonylhydrazon kan een nu een fragmentering ondergaan, die gekatalyseerd kan worden door een zuur of een base. Bij gebruik van een zuur (typisch azijnzuur in dichloormethaan bij -18°C) wordt het epoxide geprotoneerd en volgt een ringopening. Bij gebruik van een base wordt het stikstofatoom in het sulfonylhydrazon gedeprotoneerd. In beide gevallen ontstaat een allylisch alcohol (4). Het alcohol is in staat om een carbonylgroep te vormen, waarbij een koolstof-koolstofbinding gebroken wordt, stikstofgas ontstaat en een arylsulfienzuur als leaving group de molecule verlaat. De drijvende kracht van de reactie is de vorming van het uiterst stabiele stikstofgas.

Toepassingen[bewerken | brontekst bewerken]
Dit soort reacties is van belang bij de synthese van macrocyclische verbindingen:[2]
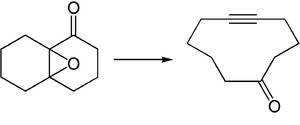
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|


 French
French Deutsch
Deutsch