Keton
Een keton is:
- een functionele groep, bestaande uit een carbonylgroep waaraan twee koolstofatomen zijn gebonden (ketogroep).
- een organische verbinding met zo'n groep (ook wel alkanonen genoemd).
- Figuur 1: Ketongroep
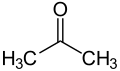
- Figuur 2: Aceton
- Figuur 3: 2-pentanon
- Figuur 4: 3-pentanon
De eenvoudigste keton-verbinding is aceton: (CH3-CO-CH3), een vloeistof die veel als oplosmiddel wordt gebruikt (bijvoorbeeld in nagellakverwijderaar en contactlijm). In het laboratorium wordt aceton veel gebruikt als schoonmaak- en droogmaakmiddel omdat het zowel voor andere organische stoffen een goed oplosmiddel is, als goed mengbaar met water.
Naamgeving[bewerken | brontekst bewerken]
Als de keton-groep de hoogste prioriteit heeft wordt de naam van de verbinding gevormd door de naam van de langste koolstofketen waar de keton-groep in voorkomt, gevolgd door -on. Als verwarring mogelijk is, wordt nog een cijfer toegevoegd om aan te geven aan welk koolstofatoom het zuurstofatoom gekoppeld is. De officiële naam voor aceton, zie figuur 2) is dan ook propanon. De nummers in 2- en 3-pentanon (resp. figuur 3 en 4) geven aan op welke positie het zuurstofatoom zich bevindt.
Is de keton-groep niet de groep met de hoogste prioriteit dan wordt voorvoegsel oxo-, in combinatie met een plaats-cijfer gebruikt. De groep die de hoogste prioriteit heeft krijgt daarbij een zo laag mogelijk nummer.
Speciale gevallen: methanon en ethanon[bewerken | brontekst bewerken]
| De opmerking in de eerste alinea dat propanon (of aceton) het eenvoudigste keton is zou de suggestie kunnen wekken dat namen afgeleid van methanon en ethanon niet voor kunnen komen. Hoewel deze namen niet vaak gebruikt worden, treden ze soms op als een gesubstitueerde verbinding het eenvoudigst als derivaat van een van beide beschreven kan worden. Twee voorbeelden staan hiernaast. | Benzofenon-3 IUPAC: (2-hydroxy-4-methoxyfenyl)-fenylmethanon | Adrenalon IUPAC: 1-(3,4-dihydroxyphenyl)-2-(methylamino)ethanon |
Eigenschappen[bewerken | brontekst bewerken]
- Alkanonen reageren met waterstof via een additiereactie tot een secundaire alkanol.
- Alkanonen kunnen op twee manieren met base reageren: 1) de base kan reageren met het relatief positief geladen koolstofatoom van de carbonylgroep of 2) de base kan reageren door een waterstofatoom van het koolstofatoom naast de carbonylgroep aan het keton te onttrekken, waardoor een enolaation ontstaat. Deze laatste ionen zijn intermediairen in bijvoorbeeld de aldol-condensatie en de haloformreactie.
- Alkanonen zijn, in tegenstelling tot aldehyden, stabiel ten opzichte van partiële oxidatie.
Synthese[bewerken | brontekst bewerken]
Ketonen kunnen worden gemaakt door:
- selectieve oxidatie van secundaire alcoholen.
- oxidatieve splitsing van alkenen.
- hydratatie van alkynen.
- arylketonen door Friedel-Craftsacylering van aromaten.
- reactie van een zuurchloride met een diorganokoperreagens.
- condensatie van carbonzuren op hoge temperatuur met een metaaloxide als katalysator.
Fysiologie[bewerken | brontekst bewerken]
Ketonen zijn een brandstof voor de hersenen. In normale omstandigheden wordt glucose gebruikt als brandstof voor de hersenen, maar indien er onvoldoende glucose beschikbaar is, dan worden vetten gebruikt als energiebron. Bij de verbranding van vetten worden ketonen gevormd. Te veel ketonen kunnen een ketoacidose veroorzaken. Mogelijke oorzaken voor te veel ketonen in urine of bloed zijn: een nieuw ontstane of een ontregelde suikerziekte, langdurig vasten, een slecht werkzame bijnier, zeldzame erfelijke metabole aandoeningen.
In 2019 kwamen ketonen als prestatiebevorderende stoffen bovendrijven in de wielersport.[1]
Diagnostiek[bewerken | brontekst bewerken]
De bepaling van de hoeveelheid aanwezige ketonen in urine (en soms in bloed) kan worden aangevraagd om de oorzaak van een zuur-basestoornis uit te zoeken. In de urine komen verschillende ketonen voor zoals aceton en acetoacetaat. Het zijn afbraakproducten uit de vetstofwisseling. In de praktijk worden hiervoor meestal teststrookjes gebruikt die in de afgestane urine worden gedoopt.
Opmerkingen[bewerken | brontekst bewerken]
De teststrookjes die worden gebruikt om ketonen aan te tonen in urine reageren op de aanwezigheid van acetoacetaat en niet of nauwelijks op andere ketonen. Een klinisch laboratorium kan zo nodig andere specifieke, in urine of bloed aanwezige, ketonen afzonderlijk bepalen.


 French
French Deutsch
Deutsch