Acylchloride

Acylchloriden of carbonzuurchloriden (vaak aangeduid als zuurchloriden) zijn een groep reactieve organische verbindingen die gebruikt worden voor het synthetiseren van onder andere esters en amiden.
Doordat het carbonylkoolstofatoom een binding heeft met het zeer elektronegatieve chloor is het een zeer sterk elektrofiel, wat betekent dat het zelfs met zwakke nucleofielen makkelijk reageert.
Synthese[bewerken | brontekst bewerken]
Thionylchloride[bewerken | brontekst bewerken]
Een acylchloride kan gesynthetiseerd worden door het overeenkomstige carbonzuur te laten reageren met thionylchloride (SOCl2):

Deze reactie wordt uitgevoerd in aanwezigheid van een tertiair amine (pyridine of tri-ethylamine) om het toxische waterstofchloride uit het reactiemengsel te verwijderen. De drijvende kracht van deze reactie is het ontstaan van het gas zwaveldioxide.
Oxalylchloride[bewerken | brontekst bewerken]
Een variant op de methode met thionylchloride is de reactie van het overeenkomstige carbonzuur met oxalylchloride (het diacylchloride van oxaalzuur). Hierbij ontstaan koolstofdioxide en koolstofmonoxide:
Ook hier dient de reactie te worden uitgevoerd met een amine om het ontstane waterstofchloride af te vangen. De reactie wordt uitgevoerd met dimethylformamide als katalysator. Dit reageert in de eerste stap met oxalylchloride tot een iminiumverbinding als intermediair:

De iminiumverbinding reageert met het carbonzuur tot het acylchloride:
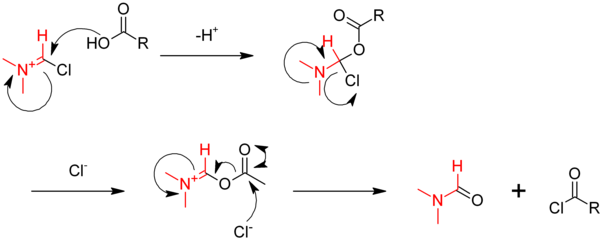
Toepassingen en reacties[bewerken | brontekst bewerken]
Synthese van esters en amiden[bewerken | brontekst bewerken]
Door het acylchloride te laten reageren met een alcohol ontstaat een carbonzure ester:
Bij deze reactie ontstaat ook waterstofchloride, dat met pyridine wordt afgevangen.
Volgens hetzelfde principe kunnen ook amiden gesynthetiseerd worden door een acylchloride te laten reageren met een primair of secundair amine.
Reactie met organometaalverbindingen[bewerken | brontekst bewerken]
Met Grignard-reagentia reageren acylchloriden in een eerste stap tot het overeenkomstig keton en vervolgs tot het tertiair alcohol. Een uitzondering hierop is het gebruik van bepaalde organocadmiumverbindingen, waarbij de reactie stopt bij het keton. De reactie met Gilman-reagentia levert eveneens ketonen, omdat zij een stuk minder reactief zijn ten opzichte van de gevormde ketonen dan ten opzichte van het acylchloride.
Elektrofiele reacties[bewerken | brontekst bewerken]
Acylchloriden worden in combinatie met geschikte lewiszuren (zoals aluminiumchloride of ijzer(III)chloride) aangewend bij de Friedel-Craftsacylering.
Omzetting in gehalogeneerde ketonen[bewerken | brontekst bewerken]
Met behulp van de Nierenstein-reactie kan een acylchloride met diazomethaan in een gehalogeneerd keton worden omgezet:



 French
French Deutsch
Deutsch
