Natriumboorhydride
| Natriumboorhydride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
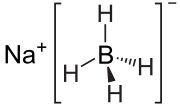 | |||||
Structuurformule van natriumboorhydride | |||||
| Algemeen | |||||
| Molecuulformule | NaBH4 | ||||
| IUPAC-naam | natriumtetrahydroboraat(I-) | ||||
| Molmassa | 37,83252928 g/mol | ||||
| CAS-nummer | 16940-66-2 | ||||
| PubChem | 22959485 | ||||
| Wikidata | Q407895 | ||||
| Beschrijving | Wit kristallijn poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H260 - H301 - H311 - H314 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P223 - P231+P232 - P280 - P301+P310 - P370+P378 - P422 | ||||
| Hygroscopisch? | ja | ||||
| Opslag | Gescheiden van sterke zuren, alcoholen, metalen in poedervorm, water en oxiderende stoffen. Koel en droog opslaan in een goed gesloten recipiënt. | ||||
| VN-nummer | 1426 | ||||
| ADR-klasse | Gevarenklasse 4.3 | ||||
| LD50 (ratten) | (oraal) 160 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 1,0740 g/cm³ | ||||
| Smeltpunt | 400 °C | ||||
| Kookpunt | 500 °C | ||||
| Vlampunt | 70 °C | ||||
| Zelfontbrandings- temperatuur | ca. 220 °C | ||||
| Oplosbaarheid in water | 550 g/L | ||||
| Goed oplosbaar in | water, methanol, vloeibare ammoniak, amines, pyridine | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Natriumboorhydride is een natriumzout, met als brutoformule NaBH4. De stof komt voor als een wit, hygroscopisch kristallijn poeder. Dit zout is een reductor en wordt hoofdzakelijk gebruikt om geneesmiddelen en andere organische en anorganische verbindingen te maken. Natriumboorhydride is goed oplosbaar in water en methanol, maar reageert hevig met deze stoffen onder zure omstandigheden.[1] In neutraal milieu is de reactie veel trager en kan het reagens in waterige oplosingen gebruikt worden. Deze anorganische verbinding werd in de jaren 40 van de 20ste eeuw ontdekt door de Amerikaanse scheikundige Hermann Irving Schlesinger.
Synthese[bewerken | brontekst bewerken]
Natriumboorhydride kan bereid worden uit een reactie van natriumhydride en trimethylboraat bij een temperatuur van 250 tot 270°C:
Het kan ook worden gesynthetiseerd uit een reactie van natriumhydride met verpulverd boriumsilicaatglas.[2]
Kristalstructuur[bewerken | brontekst bewerken]
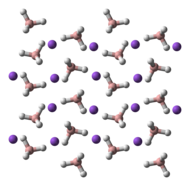
Natriumboorhydride kent 3 polymorfen: α, β en γ. α-NaBH4 is de meest stabiele structuur bij kamertemperatuur en atmosferische druk. Ze is analoog opgebouwd als natriumchloride (kubisch). Bij een druk van 6,3 GPa verandert de structuur ervan naar het tetragonale β-NaBH4; en bij een druk van 8,9 GPa naar het orthorombische γ-NaBH4.[3][4]
Hoax als energiedrager[bewerken | brontekst bewerken]
Natriumboorhydride wordt ook genoemd als energiedrager als waterstof in poedervorm. Natriumboorhydride reageert immers (exotherm) met zeer zuiver water tot waterstof en NaBO2 (borax). Het Havenbedrijf Amsterdam bouwt er een boot voor. [5]. Er bestaat echter nog geen bruikbare methode om het ontstane NaBO2 terug te vormen tot NaBH4 [6]. Alle NaBH4 wordt dan ook met fossiele energie geproduceerd. Natriumboorhydride als (groene) waterstofdrager is dan ook niets meer dan een hoax.
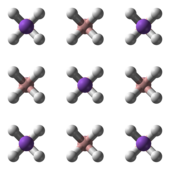 | 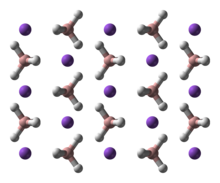 |  |
Toepassingen[bewerken | brontekst bewerken]
Natriumboorhydride reduceert aldehyden en ketonen tot alcoholen, alsook de meer reactieve acylchloriden en thio-esters. De stof slaagt er evenwel niet in, in tegenstelling tot het sterkere reductiemiddel lithiumaluminiumhydride, om esters, amiden of carbonzuren te reduceren.[1] Een andere toepassing is het uitvoeren van de demercurering in de oxymercurering-reductie.
In de analytische chemie wordt natriumboorhydride gebruikt om verbindingen van vluchtige metalen, zoals kwik, om te zetten in de vrije metalen. De vrije metalen kunnen vervolgens bijvoorbeeld met AAS bepaald worden.
Natriumboorhydride wordt ook gezien als mogelijke herbruikbare energiedrager in de vorm van (her)gebonden waterstof.[7] Het heeft een hoge energiedichtheid ten opzichte van andere opslagvormen van waterstof (27 megajoule per liter), het benadert daarmee de energiedichtheid van diesel (36 megajoule per liter). Het circulair maken van het proces wordt nog onderzocht.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Natriumboorhydride ontleedt bij verhitting of bij contact met zuren, metalen in poedervorm en water, waarbij onder andere het ontvlambare, explosieve waterstofgas wordt gevormd. Het is een sterke reductor en reageert hevig met oxiderende stoffen, waardoor brand- en explosiegevaar ontstaat.
De stof is corrosief voor de ogen, de huid en de luchtwegen.
Externe links[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|


 French
French Deutsch
Deutsch


