Cyanide
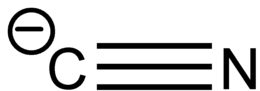
Een cyanide is een verbinding die het CN− ion of een -CN functionele groep bevat. Organische verbindingen met een cyanidefunctionaliteit worden nitrilen genoemd.
Toxiciteit[bewerken | brontekst bewerken]
Vooral bekend zijn de verbindingen waterstofcyanide (HCN, blauwzuur), het kaliumzout van blauwzuur (KCN, kaliumcyanide), ook wel cyaankali genoemd, en het calciumzout (Ca(CN)2, calciumcyanide), vanwege hun snelle werking als vergif.
Het cyanide-ion bindt aan een celenzym van de ademhalingsketen, cytochroom A3 waardoor het de dissimilatie blokkeert. Dat leidt in korte tijd (minuten) tot de dood. De dodelijke dosis KCN voor een volwassene wordt op ongeveer 10 mg/kg, voor HCN op 3,7 mg/kg geschat. (Dit zijn de LD50-waarden voor ratten.) Slechts sommige mensen zijn in staat om waterstofcyanide te ruiken, zij merken een vage amandelachtige geur op. Dit is genetisch bepaald, de meeste mensen zullen dus niets merken. Bij vergiftiging moet een slachtoffer snel een zogenaamde cyanokit (hydroxocobalamine) intraveneus worden toegediend. Hydroxocobalamine bindt direct met cyanide tot een andere vorm van vitamine B12, cyanocobalamine, die via de urineweg wordt uitgescheiden.[1]
Waterstofcyanide (blauwzuurgas), gemaakt door kaliumcyanide met een zuur te laten reageren, wordt in de Verenigde Staten officieel gebruikt om gevangenen in de gaskamer te executeren. De gaskamer werd echter door een Amerikaans gerechtshof als wrede en ongebruikelijke straf aangemerkt. De Amerikaanse grondwet verbiedt wrede en ongebruikelijke straffen. Mede hierdoor is de gaskamer in de meeste staten afgeschaft en wordt ook in de vijf staten Californië, Maryland, Wyoming, Missouri en Arizona, waar deze straf wel nog bestaat, de dodelijke injectie als een optie voor doodstraffen aangeboden. Het door de nazi's in hun gaskamers gebruikte gif, Zyklon B, was vloeibaar blauwzuur, opgezogen in een poreus materiaal, dat aan de lucht snel verdampte.
Entomologen gebruikten blauwzuurgas om gevangen insecten te doden in een stikpot, waarin wat KCN onder een laagje gips ligt ingebed; door langzame ontleding ontstaat hieruit steeds iets blauwzuurgas. Vanwege de voor de hand liggende risico's is deze methode nagenoeg in onbruik geraakt en wordt tegenwoordig meestal ethylacetaat voor dit doel gebruikt.
In de ongediertebestrijding wordt nog weleens gebruikgemaakt van blauwzuurgas, maar uitsluitend door daarin gespecialiseerde bedrijven die hiervoor de benodigde vergunningen en deskundigheid in huis hebben. Vroeger werd cyanide nog zeer veelvuldig gebruikt met alle risico's van dien: zo overleed dichter Dan Andersson in 1920 in Stockholm aan cyanidevergiftiging doordat zijn hotel waterstofcyanide had gebruikt om zijn kamer te reinigen van bedwantsen en verzuimd had de kamer nadien goed te luchten.
Cyaniden vinden voorts toepassing in de edelmetaalwinning en -zuivering, omdat fijn stofgoud, zoals dat in aanzienlijke hoeveelheden aanwezig blijft in het afgewerkte erts van een goudmijn, oplost in een oplossing van blauwzuur en daaruit kan worden neergeslagen door toevoeging van zinkpoeder. Cyanide wordt gebruikt in galvanisatiebaden voor depositie van koper en zilver en bij een aantal chemische synthesen van grondstoffen voor kunststoffen.
Cyanide zorgde in 1978 voor de verplichte zelfmoord van meer dan 900 leden van Peoples Temple in Guyana.
Abrikozenpitten en amandelpitten bevatten van nature cyanogene glycosiden. Analyse wijst uit dat abrikozenpitten gemiddeld 217 mg waterstofcyanide per 100 gram bevatten[2] en bittere amandelen ongeveer 4–9 mg waterstofcyanide per amandel.[3][4] Er zijn verschillende gevallen van cyanidevergiftiging door het eten van abrikozenpitten of bittere amandelen beschreven in de wetenschappelijke literatuur.[2][4][5]
Redox-eigenschappen[bewerken | brontekst bewerken]
Het cyanide-ion is een reductiemiddel en wordt geoxideerd door sterke oxidatiemiddelen zoals moleculair chloor (Cl2), hypochloriet (ClO–) en waterstofperoxide (H2O2). Deze oxidatiemiddelen worden gebruikt om cyaniden in afvalwater van goudwinning te vernietigen.[6][7][8]
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|


 French
French Deutsch
Deutsch