メモリーB細胞
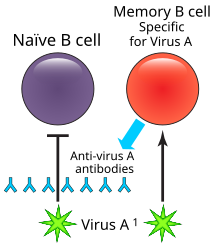
メモリーB細胞(めもりーびーさいぼう、英: Memory B cells)は、一次感染後に胚中心内で形成されるB細胞の亜型である。メモリーB細胞は何十年も生き残ることができ、再感染した場合には、加速された強固な抗体媒介免疫応答(二次免疫応答としても知られている)を繰り返し生成する[1][2]。
一次応答[編集]
T細胞依存性の発生経路において、ナイーブ濾胞B細胞(ろほうびーさいぼう)は、最初の感染、すなわち一次免疫応答中に抗原提示TFH細胞によって活性化される[2]。活性化後、B細胞は二次リンパ系器官(すなわち脾臓およびリンパ節)に移動する。二次リンパ系器官内では、B細胞の大部分がB細胞濾胞に入り、そこで胚中心が形成される。ほとんどのB細胞は、最終的に胚中心内で形質細胞またはメモリーB細胞に分化する[3]。
胚中心内に入ると、B細胞は増殖し、続いて表面受容体の遺伝子コーディング領域の突然変異が起こる。これは、体細胞超変異として知られているプロセスである[2]。変異は、特定の抗原に対する表面受容体の親和性を増加または減少させ、これは親和性成熟と呼ばれる進行である。これらの変異を獲得した後、B細胞の表面にある受容体(B細胞受容体)は、胚中心内で現在の抗原に対する親和性をテストされる[4]。表面受容体の親和性を高めた変異を持つB細胞クローンは、同族のTFH細胞との相互作用を介して生存シグナルを受け取る[1][5]。これらの生存シグナルを受け取るのに十分に高い親和性を持たないB細胞、および潜在的に自己反応性を持つB細胞は、アポトーシスによって死滅する[3]。体細胞突然変異に加えて、多くのB細胞は、分化前にクラススイッチも受け、これにより、将来の免疫応答でさまざまな種類の抗体を分泌することができる。
多くのB細胞は、エフェクターB細胞とも呼ばれる形質細胞に分化し、防御抗体の第一波を産生し、感染症の治癒を助ける[3][1]。B細胞の一部は、体内で長期的生存するメモリーB細胞に分化する[6]。 分化後、メモリーB細胞は、将来の曝露の際に抗原に遭遇しやすい体の周辺部に移動する[3][1][2]。循環するB細胞の多くは、パイエル板のような、抗原と接触する可能性の高い部位に集中するようになる。
メモリーB細胞への分化のメカニズムについて、抗原に対する親和性が比較的低いB細胞はメモリーB細胞となり、親和性が比較的高いB細胞は形質細胞になるという仮説があったが、2016年にIFReCの新中須亮助教、黒崎知博教授らの研究グループの研究で、親和性が低い胚中心B細胞が、メモリーB細胞に分化誘導されやすいという仮説を裏付け従来の概念を覆す研究結果が示された。なぜ親和性が低いB細胞が分化されやすいか、それは親和性が高いと特定の抗原に特化し強く反応するよりも、親和性が低い方が多少変異を起こした抗原へもある程度反応し対応できるからだと考えられる[7][8]。
また、一部の研究者は、メモリーB細胞への分化はランダムに起こるという仮説を提唱している[9]が、完全なランダムではなく、胚中心細胞から記憶細胞への分化のメカニズムとして、代謝活性の低くB細胞受容体からの生存シグナルを多く獲得した胚中心B細胞が記憶B細胞に効率的に分化しやすいことが分かった[10][11]。
また、転写因子NF-κBやサイトカインIL-24がメモリーB細胞への分化に関与しているという仮説もされている[12]が、転写因子Bach2遺伝子が胚中心 B 細胞の代謝制御に重要である事がわかった[10][11]。
しかし、胚中心内でメモリーB細胞に分化する過程はまだ完全には解明されていない[2]。
二次応答と記憶[編集]
一次免疫応答中に産生されるメモリーB細胞は、最初の曝露中に関与する抗原に特異的である。二次応答では、その抗原または類似の抗原に特異的なメモリーB細胞が応答する[2]。メモリーB細胞が特定の抗原に再遭遇すると、それらは増殖して形質細胞に分化し、形質細胞は抗原に反応して除去する。この時点で形質細胞に分化しなかったメモリーB細胞は、胚中心に再び侵入して、さらなる親和性成熟を起こすためのクラススイッチまたは体細胞突然変異を受けることができる。メモリーB細胞の形質細胞への分化は、ナイーブB細胞による分化よりもはるかに速く、メモリ-B細胞は、より効率的な二次免疫応答を生み出すことができる[9]。このメモリーB細胞応答の効率化と蓄積は、ワクチンおよびブースターショット(二度目のワクチン)の基盤となる。
寿命[編集]
メモリーB細胞は何十年も生き延びることができ、同じ抗原への複数回の曝露に反応する能力を与える[2]。長期間の生存は、他のB細胞の亜集団よりもメモリーB細胞でより高度に発現している特定の抗アポトーシス遺伝子の結果であると仮定されている[3]。さらに、メモリーB細胞は、長期的に生存するために、抗原またはT細胞との継続的な相互作用を必要としない[9]。
マーカー[編集]
いくつかの亜集団はCD27を発現しないが、メモリーB細胞は通常、細胞表面マーカーCD27によって区別される。CD27を欠くメモリーB細胞は、一般に、疲弊したB細胞またはHIV、全身性エリテマトーデス、または関節リウマチなどの特定の自己免疫疾患と関連している[1][2]。
B細胞は通常、クラススイッチを受けているので、さまざまな免疫グロブリン分子を発現させることができる。特定の免疫グロブリン分子のいくつかの特異的な属性を以下に説明する。
受容体CCR6は、一般に、最終的にメモリーB細胞に分化するB細胞のマーカーである。この受容体は、B細胞が体内を移動するための化学伝達物質であるケモカインを検出する。メモリーB細胞は、胚中心から、抗原に遭遇する確率が高い組織への移動を可能にするために、この受容体を持つことがある[3]。
亜集団[編集]
胚中心非依存性のメモリーB細胞[編集]
この細胞の亜集団は、胚中心に入る前に、活性化されたB細胞からメモリーB細胞に分化する。B細胞濾胞内でTFHとの相互作用が高いレベルにあるB細胞は、胚中心に入る傾向が高くなる。胚中心から独立してメモリーB細胞に発達するB細胞は、T細胞からのCD40およびサイトカインシグナル伝達を受ける可能性が高い[9]。クラススイッチは、胚中心との相互作用の前に起こる可能性があるが、体細胞突然変異は、胚中心との相互作用の後にしか起こらない。体細胞突然変異の欠如は有益であると仮定されている。親和性成熟のレベルが低いということは、これらのメモリーB細胞が特定の抗原にあまり特化しておらず、より広い範囲の抗原を認識できる可能性があることを意味している[12][13]。
T細胞非依存性メモリーB細胞
T細胞非依存性メモリーB細胞は、B1細胞と呼ばれる亜集合である。これらの細胞は、一般に腹膜腔内に存在する。抗原に再導入されると、これらのB1細胞の一部は、T細胞と相互作用することなくメモリーB細胞に分化する[9]。これらのB細胞は、感染症の治癒を助けるIgM抗体を産生する[14]。
T-betメモリーB細胞
T-bet B細胞は、転写因子T-betを発現していることがわかっている亜集合である。T-betはクラススイッチと関連している。T-bet B細胞は、細胞内細菌やウイルス感染に対する免疫応答において重要であると考えられている[15]。
脚注[編集]
- ^ a b c d e Weisel, Florian; Shlomchik, Mark (2017-04-26). “Memory B Cells of Mice and Humans”. Annual Review of Immunology 35 (1): 255–284. doi:10.1146/annurev-immunol-041015-055531. ISSN 0732-0582. PMID 28142324.
- ^ a b c d e f g h i j Seifert, M; Küppers, R (2016-08-08). “Human memory B cells”. Leukemia 30 (12): 2283–2292. doi:10.1038/leu.2016.226. ISSN 0887-6924. PMID 27499139.
- ^ a b c d e f Suan, Dan; Sundling, Christopher; Brink, Robert (2017-04-01). “Plasma cell and memory B cell differentiation from the germinal center” (英語). Current Opinion in Immunology 45: 97–102. doi:10.1016/j.coi.2017.03.006. ISSN 0952-7915. PMID 28319733.
- ^ Allman, David; Wilmore, Joel R.; Gaudette, Brian T. (March 2019). “The continuing story of T‐cell independent antibodies”. Immunological Reviews 288 (1): 128–135. doi:10.1111/imr.12754. ISSN 0105-2896. PMC 6653682. PMID 30874357.
- ^ Victora, Gabriel D.; Nussenzweig, Michel C. (2012-03-26). “Germinal Centers”. Annual Review of Immunology 30 (1): 429–457. doi:10.1146/annurev-immunol-020711-075032. ISSN 0732-0582. PMID 22224772.
- ^ Gatto, Dominique; Brink, Robert (2010-11-01). “The germinal center reaction” (英語). Journal of Allergy and Clinical Immunology 126 (5): 898–907. doi:10.1016/j.jaci.2010.09.007. ISSN 0091-6749. PMID 21050940.
- ^ Ryo Shinnakasu、Takeshi Inoue、Kohei Kometani、Saya Moriyama、Yu Adachi、Manabu Nakayama、Yoshimasa Takahashi、Hidehiro Fukuyama ほか「Regulated selection of germinal-center cells into the memory B cell compartment」『Nature Immunology』第17巻、2016年、861?869、doi:10.1038/ni.3460。
- ^ “メモリーB細胞の分化誘導メカニズムを解明(黒崎グループがNat Immunolに発表)解説”. 大阪大学免疫学フロンティア研究センター (WPI-IFReC). 2021年9月4日閲覧。
- ^ a b c d e f g h Kurosaki, Tomohiro; Kometani, Kohei; Ise, Wataru (March 2015). “Memory B cells” (英語). Nature Reviews Immunology 15 (3): 149–159. doi:10.1038/nri3802. ISSN 1474-1733. PMID 25677494.
- ^ a b Takeshi Inoue、Ryo Shinnakasu、Chie Kawai、Wataru Ise、Eiryo Kawakami、Nicolas Sax、Toshihiko Oki、Toshio Kitamura ほか「Exit from germinal center to become quiescent memory B cells depends on metabolic reprograming and provision of a survival signal」『Journal of Experimental Medicine (JEM)』第218巻第1号、2021年、doi:10.1084/jem.20200866。
- ^ a b “免疫記憶成立のメカニズムを解明 (井上&黒崎G が JEMに発表) 解説”. 大阪大学免疫学フロンティア研究センター (WPI-IFReC). 2021年9月4日閲覧。
- ^ a b Shinnakasu, Ryo; Kurosaki, Tomohiro (2017-04-01). “Regulation of memory B and plasma cell differentiation” (英語). Current Opinion in Immunology 45: 126?131. doi:10.1016/j.coi.2017.03.003. ISSN 0952-7915. PMID 28359033.
- ^ Pupovac, Aleta; Good-Jacobson, Kim L (2017-04-01). “An antigen to remember: regulation of B cell memory in health and disease” (英語). Current Opinion in Immunology 45: 89–96. doi:10.1016/j.coi.2017.03.004. ISSN 0952-7915. PMC 7126224. PMID 28319732.
- ^ Montecino-Rodriguez, Encarnacion; Dorshkind, Kenneth (2012-01-27). “B-1 B Cell Development in the Fetus and Adult” (英語). Immunity 36 (1): 13–21. doi:10.1016/j.immuni.2011.11.017. ISSN 1074-7613. PMC 3269035. PMID 22284417.
- ^ Knox, James J.; Myles, Arpita; Cancro, Michael P. (March 2019). “T‐bet + memory B cells: Generation, function, and fate” (英語). Immunological Reviews 288 (1): 149–160. doi:10.1111/imr.12736. ISSN 0105-2896. PMC 6626622. PMID 30874358.


 French
French Deutsch
Deutsch