中枢性免疫寛容
中枢性免疫寛容(ちゅうすうせいめんえきかんよう、英: central tolerance)は、自己に反応する発達中のTリンパ球やBリンパ球を排除するプロセスで、ネガティブセレクション(負の選択)とも呼ばれる[1]。寛容とは、自己反応性のリンパ球を排除することで、免疫系が自己ペプチドを攻撃しないよう保証することである[2]。リンパ球の成熟(および中枢性免疫寛容)は、骨髄や胸腺などの一次リンパ器官で起こる。哺乳類では、B細胞は骨髄で成熟し、T細胞は胸腺で成熟する[1]。
中枢性免疫寛容は完全ではないため、末梢性免疫寛容が、T細胞やB細胞が一次リンパ器官を離れた後に自己反応を起こさないようにするため、二次機構として存在する[3]。末梢性免疫寛容は、中枢性免疫寛容とは異なり、発達中の免疫細胞が一次リンパ系器官(胸腺や骨髄)から出て、末梢に運ばれる前に起こるものである[1]。
中枢性免疫寛容の機能[編集]
中枢性免疫寛容は、成熟したB細胞やT細胞が自己抗原を外来微生物として認識しないようにするため、免疫細胞が正常に機能するのに不可欠である[2]。より具体的には、T細胞受容体(TCR)やB細胞受容体(BCR)は、ランダムな体細胞組換えによって細胞内で作られるため、中枢性免疫寛容が必要となる[1]。V(D)J組換えと呼ばれるこのプロセスは、受容体の多様性を高め、B細胞やT細胞が新規抗原に対する受容体を持つ見込みを高めるために重要である[1]。接合部多様性は組換えの際に発生し、BCRやTCRの多様性をさらに高める役割を果たしている[1]。ランダムなTCRやBCRの生成は、その高い突然変異率から、微生物に対する重要な防御手段となっている[1]。このプロセスは、種の存続にも重要な役割を果たしている。なぜなら、種の中でさまざまな受容体の再編成が行われ、少なくとも1つの種のメンバーが新規抗原の受容体を持つ可能性が非常に高まるからである[1]。
体細胞組換えプロセスは、免疫防御を成功させるために不可欠であるが、これは自己反応性につながる可能性がある。たとえば、体細胞の組換えに必要な酵素である機能的なRAG1/2の欠如は、患者の血球に対して抗体が作られる免疫性血球減少症の発症に関連している[4]。ランダムな受容体組換えの性質により、自己抗原を外来性として認識するいくつかのBCRやTCRが生成される[2]。これらのB細胞やT細胞が活性化された場合、中枢性免疫寛容メカニズムによって死滅したり不活性化されたりしない限り、自己に対する免疫系攻撃を開始するために問題がある[2]。そのため、中枢性免疫寛容がなければ、免疫系が自己を攻撃してしまい、それは持続性を欠くもので自己免疫疾患を起こす可能性がある[2][3]。
中枢性免疫寛容の機構[編集]
寛容の最終結果は、自己抗原に反応しないが、ランダムに配置された受容体に基づいて外来の非自己抗原を認識できるような、リンパ球の集団の形成である[2]。重要なのは、リンパ球は骨髄(B細胞)と胸腺(T細胞)に存在する抗原に対してのみ寛容を獲得できることである。
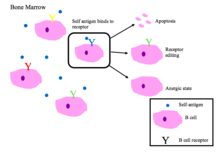
B細胞寛容[編集]
骨髄中の未成熟B細胞は、自己ペプチドと結合するとネガティブセレクションを受ける[2]。
正常に機能するB細胞受容体は、非自己抗原または病原体関連分子タンパク質(PAMP)を認識する[1]。
- アポトーシス(クローン欠失)
- 受容体編集:自己反応性B細胞は、遺伝子を再配列することで特異性を変化させ、自己に反応しない新しいBCRを発達させる。このプロセスにより、B細胞は、アポトーシスまたはアネルギーになるようシグナルを受ける前に、BCRを編集する機会を得られる。
- アネルギーの誘導(非反応性の状態)

T細胞寛容[編集]
T細胞の中枢性免疫寛容は胸腺で起こる[1]。T細胞はポジティブセレクション(正の選択)とネガティブセレクション(負の選択)を受ける[2]。
T細胞受容体は、非自己ペプチドが結合した自己主要組織適合遺伝子複合体(MHC)分子を認識する能力を備えている必要がある[1]。
- ポジティブセレクション中に、T細胞がペプチド-MHC複合体に親和性を持って結合する能力があるかチェックされる。T細胞がMHCクラスIやMHCクラスIIの複合体と結合できない場合、T細胞は生存シグナルを受け取らないため、アポトーシスを介して死滅する。ペプチド-MHC複合体に対して十分な親和性を持つT細胞受容体が生存のために選択される。
- ネガティブセレクションでは、T細胞の自己への親和性がテストされる。もし、それらが自己のペプチドと結合する場合は、それらはアポトーシスのシグナルが送られる(クローン欠失のプロセス)。
- 自己に結合しないが、抗原/MHC複合体を認識するCD4+またはCD8+のいずれかであるT細胞は、成熟したナイーブT細胞として二次リンパ系器官に移動する。
制御性T細胞(T reg)は、胸腺で成熟するもう一つのタイプのT細胞である。T reg細胞のセレクションは胸腺髄質で行われ、Foxp3の転写を伴う。T reg細胞は、免疫系が活動すべきでないときに免疫系を抑制することで、自己免疫を調整するために重要な役割を果たしている[6]。

中枢性免疫寛容の欠陥による遺伝性疾患[編集]
中枢性免疫寛容の遺伝的欠損は、自己免疫につながる可能性がある。
- 多腺性自己免疫症候群-I型は、ヒト遺伝子AIREの変異により発症する。これにより、胸腺における末梢抗原が発現しなくなり、インスリンなどの主要な末梢タンパク質に対するネガティブセレクションが行われなくなる[7][8]。複数の自己免疫症状が生じる。
中枢性免疫寛容の歴史[編集]
中枢性免疫寛容の最初の使用例は、1945年にRay Owenが、二卵性双生児の牛の一方に他方の血液を注射しても抗体ができないことに気付いたことである[9]。彼の発見は、HasekとBillinghamが後に行った実験によって確認された[9]。この結果は、バーネットのクローン選択仮説によって説明された[10]。バーネットとメダワーは、免疫寛容がどのように機能したかを説明した功績により、1960年にノーベル賞を受賞した[10][11]。
関連項目[編集]
脚注[編集]
- ^ a b c d e f g h i j k l Owen, Judith A; Punt, Jenni; Stranford, Sharon A; Jones, Patricia P; Kuby, Janis (2013). Kuby immunology (7th ed.). New York: W.H. Freeman. ISBN 978-1-4292-1919-8. OCLC 820117219
- ^ a b c d e f g h i j Romagnani S (2006). “Immunological tolerance and autoimmunity”. Internal and Emergency Medicine 1 (3): 187–96. doi:10.1007/bf02934736. PMID 17120464.
- ^ a b Janeway, Charles (2011). Immunobiology 5: The Immune System in Health and Disease (5th ed.). New York: Garland. ISBN 978-0-8153-3642-6. OCLC 45708106
- ^ Chen K, Wu W, Mathew D, Zhang Y, Browne SK, Rosen LB, McManus MP, Pulsipher MA, Yandell M, Bohnsack JF, Jorde LB, Notarangelo LD, Walter JE (March 2014). “Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations”. The Journal of Allergy and Clinical Immunology 133 (3): 880–2.e10. doi:10.1016/j.jaci.2013.11.038. PMC 4107635. PMID 24472623.
- ^ Sprent J, Kishimoto H (May 2001). “The thymus and central tolerance”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 356 (1409): 609–16. doi:10.1098/rstb.2001.0846. PMC 1088448. PMID 11375064.
- ^ Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo VK (May 2006). “Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells”. Nature 441 (7090): 235–8. doi:10.1038/nature04753. PMID 16648838.
- ^ Anderson MS, Venanzi ES, Klein L, Chen Z, Berzins SP, Turley SJ, von Boehmer H, Bronson R, Dierich A, Benoist C, Mathis D (November 2002). “Projection of an immunological self shadow within the thymus by the aire protein”. Science 298 (5597): 1395–401. doi:10.1126/science.1075958. PMID 12376594.
- ^ Liston A, Lesage S, Wilson J, Peltonen L, Goodnow CC (April 2003). “Aire regulates negative selection of organ-specific T cells”. Nature Immunology 4 (4): 350–4. doi:10.1038/ni906. PMID 12612579.
- ^ a b Schwartz RH (April 2012). “Historical overview of immunological tolerance”. Cold Spring Harbor Perspectives in Biology 4 (4): a006908. doi:10.1101/cshperspect.a006908. PMC 3312674. PMID 22395097.
- ^ a b Liston A (January 2011). “Immunological tolerance 50 years after the Burnet Nobel Prize”. Immunology and Cell Biology 89 (1): 14–5. doi:10.1038/icb.2010.138. PMID 21209621.
- ^ Silverstein AM (March 2016). “The curious case of the 1960 Nobel Prize to Burnet and Medawar”. Immunology 147 (3): 269–74. doi:10.1111/imm.12558. PMC 4754613. PMID 26790994.


 French
French Deutsch
Deutsch