Corey-Kim-oxidatie
De Corey-Kim-oxidatie is een organische reactie waarbij een primair of secundair alcohol met dimethylsulfide en N-chloorsuccinimide (NCS) wordt geoxideerd tot respectievelijk een aldehyde of keton.[1]
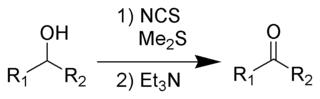
De reactie werd vernoemd naar de Amerikaanse scheikundige Elias James Corey en de Koreaans-Amerikaanse scheikundige Choung Un Kim. Ondanks het feit dat de reactie kan toegepast worden bij temperaturen boven -25°C, hetgeen een groot voordeel vormt ten opzichte van de verwante Swern-oxidatie, wordt ze weinig toegepast. De reden is dat dimethylsulfide een onwelriekend en giftig gas is, dat moeilijk hanteerbaar is in een laboratorium.
Reactiemechanisme[bewerken | brontekst bewerken]
In eerste instantie moet dimethylsulfide worden geactiveerd met N-chloorsuccinimide, waardoor een sulfoniumintermediair ontstaat. Hierop kan het alcohol als nucleofiel aanvallen, zodat een sulfoxoniumverbinding wordt gevormd. De additie van een organische base (doorgaans tri-ethylamine) leidt tot vorming van een sulfoxoniumylide, dat via een cyclische transitietoestand ontleedt tot dimethylsulfide en de uiteindelijke carbonylverbinding.
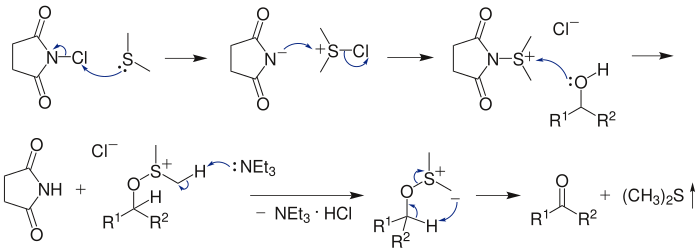
Allylische en benzylische alcoholen hebben de neiging om omgezet te worden in de corresponderende allyl- en benzylchloriden, tenzij de additie van het alcohol snel wordt gevolgd door toevoegen van de base.
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|


 French
French Deutsch
Deutsch