Ossido di renio(VII)
| Ossido di renio(VII) | |
|---|---|
 | |
| Nome IUPAC | |
| ossido di renio(VII) | |
| Nomi alternativi | |
| eptossido di renio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Re2O7 |
| Massa molecolare (u) | 484,41 |
| Aspetto | solido giallo |
| Numero CAS | |
| Numero EINECS | 215-241-9 |
| PubChem | 123106 |
| SMILES | O=[Re](=O)(=O)O[Re](=O)(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 6,10[1] |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | 300 °C (573 K)[2] |
| Temperatura di ebollizione | 360 °C (633 K)[2] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -1240,1[1] |
| ΔfG0 (kJ·mol−1) | -1066,0[1] |
| S0m(J·K−1mol−1) | 207,1[1] |
| C0p,m(J·K−1mol−1) | 166,1[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| pericolo | |
| Frasi H | 314 [3] |
| Consigli P | 280 - 305+351+338 - 310 [3] |
L'ossido di renio(VII) o eptossido di direnio è il composto binario di renio eptavalente con formula Re2O7. In condizioni normali è un solido giallo molto igroscopico. È l'ossido più stabile del renio, che in questo composto raggiunge il suo massimo stato di ossidazione, +7. Re2O7 è il principale composto di partenza per la sintesi di tutti i composti di renio.[2][4]
Sintesi[modifica | modifica wikitesto]
Re2O7 fu descritto per la prima volta nel 1929 da Ida Noddack e Walter Noddack.[5] Il composto si forma per arrostimento all'aria di polvere di renio o di altri ossidi di renio.[4]
Struttura[modifica | modifica wikitesto]
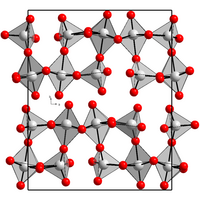
Re2O7 solido cristallizza nel sistema ortorombico, gruppo spaziale P212121, con costanti di reticolo a = 1251 pm b = 1520 pm e c = 545 pm, otto unità di formula per cella elementare.[6] Questa struttura è costituita da doppie catene di ottaedri ReO6 e tetraedri ReO4 alternati. Nella fase gassosa si formano singole molecole Re2O7 costituite da due tetraedri ReO4 con un vertice di ossigeno comune.[2] È isoelettronico di valenza con Mn2O7 e Tc2O7, oltre che con l'anidride perclorica Cl2O7.
Proprietà[modifica | modifica wikitesto]
Re2O7 è fortemente igroscopico. In acqua si scioglie formando acido perrenico (del quale costituisce l'anidride), che è incolore in soluzione diluita e diviene giallo chiaro in soluzione concentrata.[4] Re2O7 è solubile anche in alcool etilico, etere dietilico, diossano e piridina.[1]
Usi[modifica | modifica wikitesto]
L'ossido di renio(VII) è un intermedio importante nell'isolamento e purificazione del renio metallico.[7] Viene usato come catalizzatore in varie reazioni di chimica organica, tra cui la riduzione di carbonili e ammidi.[8] È il materiale di partenza per sintetizzare il catalizzatore metiltriossorenio, CH3ReO3:[9]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) W. A. Herrmann, R. M. Kratzer e R. W. Fischer, Alkylrhenium Oxides from Perrhenates: A New, Economical Access to Organometallic Oxide Catalysts, in Angew. Chem. Int. Ed. Engl., vol. 36, n. 23, 1997, pp. 2652–2654, DOI:10.1002/anie.199726521.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) B. Krebs, A. Mueller e H. H. Beyer, Crystal structure of rhenium(VII) oxide, in Inorg. Chem., vol. 8, n. 3, 1969, pp. 436–443, DOI:10.1021/ic50073a006.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (EN) H. G. Nadler e H. C. Starck, Rhenium and Rhenium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a23_199.
- (EN) S. Nishimura, Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis, Wiley, 2001, ISBN 9780471396987.
- (DE) J. Noddack e W. Noddack, Die Sauerstoffverbindungen des Rheniums, in Z. Anorg. Allg. Chem., vol. 181, n. 1, 1929, pp. 1–37, DOI:10.1002/zaac.19291810102.
- Sigma-Aldrich, Scheda di dati di sicurezza dell'ossido di renio(VII), su sigmaaldrich.com, 2012. URL consultato il 25 gennaio 2018.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su ossido di renio(VII)
Wikimedia Commons contiene immagini o altri file su ossido di renio(VII)


 French
French Deutsch
Deutsch