Контаминант — Википедия


Контаминáнт (от лат. contaminant — примесь, также загрязняющий агент) — нежелательный биологический агент (микроорганизмы, включая и вирусы) либо химическое соединение, смесь соединений, обладающие высокой биологической активностью (аллерген, иммуносупрессор, канцероген, мутаген, тератоген, токсин или в общем случае ксенобиотик) либо радиоактивное вещество (радионуклид), присутствие которых в сырье и пищевых продуктах[3] несвойственно и, несомненно, может оказывать негативное воздействие на организм и, как следствие, нести угрозу для здоровья и жизни человека. Процесс, в результате которого происходит загрязнение пищевых продуктов и сырья контаминантами называется контаминацией.
Термин контаминант употребляется в основном в микробиологии (синоним термина обсеменение), в производстве фармацевтической продукции и в производстве пищевых продуктов[4][5][6]. В большинстве случаев загрязнение пищевого продукта контаминантами является причиной алиментарных расстройств желудочно-кишечного тракта человека (пищевые интоксикации).
Контаминанты обладают высокой подвижностью и скоростью миграции и, тем самым довольно легко проникают в организм человека из внешней среды[7].
Не следует путать термины контаминант и ксенобиотик. Первый означает любой загрязняющий агент продуктов питания и попадает в организм исключительно алиментарным путём (то есть с пищей), в то время как второй термин более широкий по определению и означает любое чужеродное вещество, попавшее в организм человека не обязательно алиментарным путём, а, например, воздушным (респираторным), сублингвальным (подъязычным) или через кожу (трансдермально). Любой контаминант — это ксенобиотик, но не каждый ксенобиотик — это контаминант.
Биологические контаминанты[править | править код]


Биологические, также природные или естественные контаминанты — нежелательные микроорганизмы (вирусы, патогенные и условно-патогенные бактерии, микроскопические грибы, простейшие, споры микромицетов итд.), а также их продукты метаболизма (например, ботулотоксин, продуцируемый Clostridium botulinum или охратоксины — группа микотоксинов, вырабатываемые некоторыми видами микроскопических плесневых грибов рода Аспергилл и Пеницилл), присутствующие в пищевых продуктах. Большое количество биологических контаминантов приходится на бактерии и их метаболитов (токсинов, антибиотиков). К этой группе можно отнести токсины морских животных, употребляемых в пищу (например, тетродотоксин из собаки-рыбы или фугу), а также токсины растений или фитотоксины (например, рицин, из ядер клещевины или амигдалин из косточек горького миндаля, абрикоса — ядовитый гликозид) и грибов (аматоксины, фаллотоксины и др.).
- Некоторые биологические контаминанты
- Дезоксиниваленол или вомитоксин (от англ. Vomiting — рвота), наиболее распространённый трихотецен, продуцируется микроскопическими плесневыми грибами рода Fusarium (Fusarium culmorum, Fusarium graminearum). Высокотоксичен, обладает иммуносупрессивным эффектом, вызывает сильнейшее отравление сопровождаемое упорной рвотой, поражением ЖКТ и агранулоцитозом[8][9].
- Афлатоксин B1 — один из представителей афлатоксинов, смертельно опасный токсин, а также сильнейший гепатоканцероген[10]. Продуцируется микроскопическими плесневыми грибами рода Аспергилл (Aspergillus flavus, Aspergillus parasiticus).
- Соланин — стероидный гликозид, фитотоксин вырабатываемый некоторыми видами растений семейства паслёновых или Solanaceae (ягоды чёрного паслёна, клубни картофеля итд.)[11].
- Модель вируса SARS-CoV-2, одного из представителей семейства коронавирусов. Данный вирус высококонтагиозный и может контаминировать воду и пищевые продукты, тем самым увеличивается риск распространения коронавирусной инфекции (COVID-19)[12].
- Сигуатоксин 1В — полициклический полиэфир, очень ядовит, продуцируется некоторыми видами динофлагеллятов (Gambierdiscus toxicus). Вместе с планктоном поедается токсин, который накапливается в жировой ткани, внутренностях и коже многих видов морских рыб, тем самым он представляет огромную опасность. Интоксикация сигуатоксином проявляется в виде сигуатеры[13].
- Сакситоксин (STX), накапливается в съедобных морских моллюсках (мидии, морское ушко, устрицы, итд.), которые в свою очередь питаются продуцентами — динофлагеллятами (Gonyaulax catenella, Alexandrium sp., Gymnodinium sp., Pyrodinium sp.) и цианобактериями (Anabaena sp., Aphanizomenon spp., Cylindrospermopsis sp., Lyngbya sp., Planktothrix sp.). Сильнейший яд небелковой природы с ярко выраженным нервно-паралитическим воздейстием, ЛД50 ~5,7 мкг/кг перорально для человека (так, одна мелкая мидия может содержать сакситоксин в дозе, достаточной чтобы убить 50 человек[14]). Селективный блокатор потенциал-зависимых натриевых каналов[15] (сходный по действию с тетродотоксином), тем самым поражает ЦНС.
- Структура конваллятоксина, гликозида, который встречается во всех частях майского ландыша (Convallaria majаlis), но особенно его много в ягодах. Обладает сильнейшим кардиотоксическим воздействием (ингибирует Na+/K+-АТФазу), даже в небольших количествах (2-3 мг) может вызывать фибрилляцию желудочков[16][17][18], повышение давления и остановку сердца, однако, в очень низких концентрациях — терапевтических дозах (0,3 мг/мл) применяется для лечения пароксизмальной тахикардии.
- Аманин — один из представителей аматоксинов, встречается в плодовых телах грибов рода Аманита (Мухомор), Лепиота и Галерина, чрезвычайно токсичен и смертельно опасен, сильнейший гепатотоксин, вызывает лизис и некрозы клеток паренхимы печени, помимо этого он разрушает клетки кишечника и почек (вызывает острую почечную недостаточность)[19].
- Веротоксин или Шига-подобный токсин (SLT-II) — токсин Коли, вызывает сильнейшее пищевое отравление, сопровождаемое геморрагической лихорадкой, повреждением сосудов внутренних органов, гемолитической анемией. Продуцируется некоторыми штаммами E. coli и Shigella.
Бактериальные токсины[править | править код]
Бактериальные токсины загрязняют пищевые продукты и являются причиной острых пищевых интоксикаций. Рассмотрим наиболее часто регистрируемые интоксикации, связанные с поражением пищевых продуктов некоторыми бактериальными токсинами.
Энтеротоксины S.aureus[править | править код]
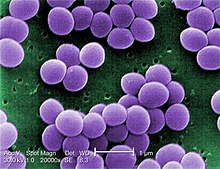
Staphylococcus aureus — грамположительные бактерии, сферической формы, которые являются причиной стафилококкового пищевого отравления. Продуцируют следующие энтеротоксины: А, В, С1, С2, D, E, которые представляют собой полипептиды с молекулярной массой 26 360-28 500 дальтон. Энтеротоксины S. aureus термостабильны и инактивируются лишь после 2-3-часового кипячения. Бактерицидным действием по отношению к стафилококкам обладают уксусная, лимонная, фосфорная, молочная кислоты при рН до 4,5. Кроме того, жизнедеятельность бактерий прекращается при концентрации соли (NaCl) — 12 %, сахара — 60-70 %, вакуумная упаковка также ингибирует рост бактерий. Всё это необходимо учитывать в различных технологиях консервирования, как в промышленном масштабе, так и в домашних условиях.
Наиболее благоприятной средой для роста и развития стафилококков являются молоко, мясо и продукты их переработки, а также кондитерские кремовые изделия, в которых концентрация сахара составляет менее 50 %. Стафилококковые энтеротоксины являются причиной 27-45 % всех пищевых токсикоинфекций.
Стафилококковые гастроэнтериты вызываются при приёме внутрь пищи, содержащей один или несколько энтеротоксинов, выделяемых некоторыми видами и штаммами стафилококков[20]. Хотя и считается, что выделение энтеротоксинов обычно связано со штаммами S. aureus, продуцирующих коагулазу и термонуклеазу, многие штаммы, не продуцирующие ни коагулазу, ни термонуклеазу, тем не менее выделяют энтеротоксины.
Симптомы стафилококкового пищевого отравления обычно развиваются в течение четырёх часов после приема внутрь заражённых пищевых продуктов, хотя этот интервал, по разным сообщениям, может различаться в пределах от одного до шести часов[21]. Среди симптомов обычно отмечаются такие, как тошнота, рвота, спазмы живота (которые, как правило, бывают очень сильными), диарея, выпотевание, головная боль, упадок сил, истощение, иногда снижение температуры тела — которые обычно продолжаются от 24 до 48 ч. Смертельные исходы достаточно редки или полностью отсутствуют. Как правило, для здоровых людей лечение ограничивается постельным режимом и поддержанием баланса жидкости в организме. После прекращения симптомов у переболевших не сохраняется выраженного иммунитета к повторным заражениям, хотя при неоднократном пероральном введении доз у животных появляется устойчивость к энтеротоксину[22]. Поскольку симптомы были вызваны приёмом внутрь уже сформированного энтеротоксина, понятно, что культуры из фекальных масс не содержат стафилококков, хотя это и случается редко.
Токсины C.perfringens[править | править код]
Clostridium perfringens (ранее известная как C. welchii или Bacillus welchii) представляет собой грамположительную, палочковидную, облигатно (строго) анаэробную, спорообразующую патогенную бактерию рода Клостридиум[23][24]. Является одним из возбудителей газовой гангрены и клостридиальной кишечной токсоинфекции.
Штаммы Clostridium perfringens, вызывающие пищевые отравления, обнаруживаются в почве, воде, пыли, продуктах питания, пряностях и в пищеварительных трактах человека и животных. Многие исследователи сообщали, что распространённость термоустойчивых, негемолитических штаммов в общей популяции оценивается в пределах от 2 до 6 %. В экскрементах от 20 до 30 % здорового персонала больниц и членов их семей были обнаружены эти организмы, а среди заболевших процент носителей этих токсигенных клостридий через две недели равнялся 50 %, а иногда достигал и 88 %. Термочувствительные штаммы являются обычными представителями микрофлоры желудочно-кишечного тракта у всех людей. Бактерии C. perfringens попадают в мясо либо непосредственно после забоя животных, либо в результате последующего заражения мяса животных руками людей или пылью. Поскольку клостридии являются спорообразующими бактериями, они могут противостоять неблагоприятным условиям среды, высушиванию, нагреванию и воздействию различных токсических веществ.

Энтеротоксин является фактором, определяющим пищевые отравления при попадании бактерий C.perfringens в организмы человека и животных. Он имеет молекулярную массу 35,3 кДа и отвечает за распад плотных контактов, образованных между эпителиальными клетками в кишечнике[25]. Необычным является то, что этот белок является споро-специфическим; его выделение происходит параллельно с процессом споруляции. Причиной всех известных случаев пищевых отравлений, вызванных этим видом бактерий, были штаммы, относящиеся к типу A. Другое заболевание, некротический энтерит, вызывается бета-токсином, производимым штаммами типа С. Это заболевание характерно для Новой Гвинеи, и весьма редки сообщения о таком отравлении за её пределами. Несмотря на то что некротический энтерит, вызываемый клостридиями типа С, связан с уровнем смертности в 35-40 %, пищевые отравления, вызываемые клостридиями типа A, являются фатальными только для пожилых и ослабленных людей. Показано, что некоторые штаммы клостридий типа С продуцируют энтеротоксин, но его значение и роль в заболеваниях пока не ясны.
Ботулинистические токсины[править | править код]

В отличие от отравления пищей, содержащей бактерии C. perfringens, при котором большое количество жизнеспособных клеток должны попасть в желудочно-кишечный тракт, симптомы ботулизма вызываются попаданием в организм чрезвычайно токсичного, растворимого энтеротоксина — ботулинистического, продуцируемого бактериями, растущими в продуктах питания.
Ботулизм вызывается некоторыми штаммами бактерий C. botulinum, которые являются грамположительными анаэробными спорообразующими палочками, имеющими форму от овальной до цилиндрической, со спорами, расположенными на конце или почти на конце палочковидной клетки. На основании серологической спецификации их токсинов определены семь типов: A, B, C, D, E, F и G[26][27]. Токсины A, B, E, F и G вызывают заболевания у человека; тип С вызывает ботулизм у домашней птицы и дичи, рогатого скота, норки и других животных; тип D связан с отравлением скота фуражом, в особенности в Южной Африке. Дифференциация типов штаммов осуществляется также на основании их протеолитической активности. Типы A и G являются протеолитическими, также как и некоторые из штаммов, принадлежащих к типам B и F. Тип E непротеолитический, так же как и некоторые из штаммов, принадлежащих к типам B и F. Протеолитическая активность штаммов типа G слабее, чем у штаммов типа A, и для действия их токсина необходимо участие трипсина. Все штаммы, продуцирующие токсин типа G, объединены внутри вида C. argentinense. Штаммы этого вида были выделены из почв Аргентины, Швейцарии и США.
Ботулотоксины, образующиеся в бактериях С.botulinum, высвобождаются в результате аутолиза. Они продуцируются клетками, растущими в оптимальных условиях, хотя были сообщения о том, что покоящиеся клетки также образуют токсины. Ботулотоксины являются наиболее токсичными из всех известных природных ядов нервно-паралитического действия. Летальные дозы некоторых типов достигают нескольких десятков пикограмм на килограмм живого веса.
Токсины Сальмонелл и Шигелл[править | править код]

Сальмонеллы являются грамотрицательными, неспорообразующими палочковидными бактериями[28], которые практически ничем не отличаются внешне от кишечной палочки под микроскопом или при выращивании на обычных питательных средах. Эти бактерии широко распространены в природе. При этом человек и животные являются их главными резервуарами. Основным механизмом пищевых отравлений сальмонеллами является заглатывание пищевых продуктов, содержащих патогенные штаммы этого рода бактерий в значительных количествах.
Сальмонеллы в воде открытых водоёмов, в почве и в комнатной пыли сохраняются до 3 месяцев. Они хорошо переносят низкие температуры, способны размножаться при температуре 40 °С. В колбасных изделиях сохраняются до 6 месяцев, в замороженном мясе и яйцах — до 1 года, на овощах и фруктах — 5-10 дней, в молоке — до 20 дней, в сливочном масле — до 120 дней, на яичной скорлупе — до 24 дней. В молоке и мясе даже при низкой положительной температуре сальмонеллы способны размножаться. Соление и копчение продуктов оказывает на сальмонеллы слабое действие. При нагревании до 56 °С сальмонеллы погибают через 45-60 минут, при температуре 70 °С они погибают через 5-10 минут, при кипячении — мгновенно. Уф-излучение губительно для этих бактерий. Растворы дезинфицирующих веществ (5 % фенол, 3 % хлорамин, 3 % лизол, этиловый спирт) убивают сальмонеллы в течение 2-3 минут. К большинству антибиотиков сальмонеллы чувствительные. Однако в настоящее время отмечается неуклонный рост штаммов, обладающих резистентностью к антибиотикам.
Сальмонеллы разных видов и подвидов обладают разным набором токсинов. Эндотоксин выделяется при разрушении бактериальной клетки. Он вызывает развитие лихорадки в случае бактериемии, вызванной сальмонеллами. Некоторые сальмонеллы, особенно сальмонеллы животного происхождения, образуют белковые термостабильный и термолабильный энтеротоксины, которые схожи с холерным энтеротоксином и LТ-токсином энтеротоксигенных кишечных палочек. Цитотоксины (шига-подобные токсины) угнетают синтез белка на рибосомах энтероцитов.
Разные серовары сальмонелл обладают свойственным только им набором факторов патогенности, что обусловливает различия в клинической картине вызываемых заболеваний. В зависимости от источника инфекции, путей передачи возбудителя, особенностей патогенеза и форм проявления инфекционного процесса выделяют следующие нозологические формы сальмонеллёзной этиологии:
- брюшной тиф;
- паратифы А, В и С;
- сальмонеллёзы, возбудителями которых являются сальмонеллы животного происхождения;
- госпитальный (нозокомиальный) сальмонеллёз.
Шигеллы[править | править код]
Род Shigella принадлежит к семейству энтеробактерий Enterobacteriaceae так же, как Salmonella и Escherichia. В этом роду определены только четыре вида: S.dysenteriae, S.flexneri, S.boydii и S.sonnei. Среди них S.dysenteriae является основным патогеном, вызывающим бациллярную форму дизентерии. Шигеллы представляют собой прямые палочки с закруглёнными концами размером 0,5-0,7 × 2-3 мкм. Шигеллы грамотрицательные — окрашиваются в красный цвет при использовании метода Грама. Неподвижные (отсутствуют жгутики). Имеют пили. Спор и капсул не образуют. Могут формировать микрокапсулу. Они являются факультативными анаэробами.
Благоприятной средой для шигелл являются пищевые продукты. На фруктах и овощах шигеллы выживают до 2 недель. Наиболее устойчивыми к воздействию неблагоприятных факторов являются клетки S. sonnei. Они выживают в воде до 2 месяцев, а в почве — до 3 месяцев. В молоке и молочных продуктах S. sonnei способна не только длительно выживать, но и размножаться. Дезинфицирующие средства (гипохлориты, хлорамин, лизол и др.) в обычных концентрациях обладают бактерицидным действием. К большинству антибиотиков шигеллы чувствительны. Однако шигеллы способны приобретать R-плазмиды от других энтеробактерий и становиться устойчивыми к антимикробным препаратам. У отдельных штаммов шигелл формируется при этом множественная лекарственная устойчивость. Такие возбудители дизентерии вызывают крупные вспышки с тяжёлым течением болезни. Установлено, что для возникновения инфекции у чувствительных индивидуумов достаточно попадания в организм всего лишь 10 КОЕ.
Токсины шигелл[править | править код]
Шигеллы продуцируют разнообразные токсины, которые являются факторами вирулентности и способствуют процессам защиты и инвазии бактерий.
Эндотоксин шигелл представляет собой липополисахарид клеточной стенки (LPC). Он выделяется при разрушении микробных клеток, обусловливает развитие интоксикационного синдрома. В свою очередь, ЛПС защищает бактерии от действия кислой среды желудка и желчи. Экзотоксины шигелл представлены цитотоксином (Шига-токсина и шига-подобным токсином) и энтеротоксинами.
Цитотоксин повреждает мембраны эпителиальных клеток кишечника. S. dysenteriae серовара 1 продуцирует белковый Шига-токсин (SLT-I), остальные шигеллы продуцируют шига-подобные токсины (SLT-II). Шига-токсин кодируется хромосомным геном stx. Эти токсины состоят из субъединиц А и В. Субъединица В вначале связывается с гликолипидом Gb3 мембраны клетки, а затем субъединица А проникает внутрь клетки и блокирует синтез белка на рибосомах (цитотоксическое действие). Шига-токсин попадает в кровь и оказывает энтеротоксическое, нейротоксическое и нефротоксическое действие, что проявляется нарушением водно-солевого обмена, деятельности ЦНС, гибелью эпителиальных клеток толстого кишечника и поражением почечных канальцев.
Энтеротоксины ShET-1 и ShET-2 усиливают секрецию жидкости и солей в просвет кишечника, обусловливая диарею. Синтез токсина ShET-1 кодируется хромосомными генами. Его продуцирует только S. flexneri серотипа 2а. Синтез токсина ShET-2 и инвазинов кодируют плазмидные гены.
Токсины Иерсиний[править | править код]

Иерсинии относятся семейству Yersiniaceae, роду Yersinia. Название рода происходит от фамилии А. Йерсена, который совместно с Ш. Китазато открыл возбудителя чумы. Род Yersinia включает 18 видов. Медицинское значение имеют 3 вида: Y. pestis (возбудитель чумы), Y. pseudotuberculosis (возбудитель псевдотуберкулёза) и Y. enterocolitica (возбудитель кишечного иерсиниоза). Y. pseudotuberculosis и Y. enterocolitica относятся к энтеропатогенным иерсиниям. Одной из особенностей иерсиний является психрофильность — способность бактерий размножаться при температуре 4-8 °С.
Бактерии Yersinia enterocolitica вырабатывают термостабильный энтеротоксин (ST), который может выдерживать температуру 100 °С в течение 20 мин, оставаясь активным. Он не подвергается воздействию протеаз и липаз и обладает молекулярной массой, равной 9000–9700 дальтон. Токсин теряет биологическую активность при обработке 2-меркаптоэтанолом. ST Yersinia enterocolitica растворим в метаноле и стимулирует гуанилатциклазу и циклический аденозинмонофосфат (цАМФ) в кишечнике, но в то же время не стимулирует аденилатциклазу. Токсин ST продуцируется при температуре, равной или ниже 30 °С, и его продукции способствуют рН в пределах от 7 до 8. Из 46 изолятов, выделенных из молока, только 3 продуцировали термостабильный токсин (ST) в молоке при 25 °С, в то время как при 4 °С выделения ST не отмечалось.
Что же касается продукции термостабильного энтеротоксина (ST) другими видами иерсиний, отличающихся от Yersinia enterocolitica, то ни один из 21, 8 и 1 штаммов соответственно Yersinia intermedia, Yersinia frederiksenii и Yersinia aldovae не показывали соответствующей положительной реакции в одном из исследований образцов сырого молока, в то время как 62,5 % изолятов Yersinia enterocolitica были положительными по термостабильному энтеротоксину. С другой стороны, в двух других исследованиях было показано, что около одной трети видов иерсиний, не относящихся к Yersinia enterocolitica, включая Yersinia intermedia и Yersinia kristensenii, были положительными по термоста-бильному энтеротоксину (ST). Бактерии Yersinia bercovieri продуцируют собственный термостабильный энтеротоксин (YbST). Хорошо определяемый уровень продуцирования этого энтеротоксина регистрируется в условиях культивирования при 4 °С в течение периода 144–168 часов.
Эшерихиальные токсины[править | править код]

Эшерихии относятся к семейству энтеробактерий Enterobacteriaceae роду Escherichia. Основным видом рода Escherichia, имеющим санитарно-гигиеническое значение, является Escherichia coli (кишечная палочка). По антигенным свойствам эшерихии подразделяются на серогруппы. Эшерихии были выделены в 1885 г. немецким педиатром, профессором клиники детских болезней Т. Эшерихом из кала ребенка, больного “детской холерой”. Первоначально название кишечной палочки — Bacterium coli communis.
Эшерихии представляют собой неспорообразующие полиморфные прямые или слегка изогнутые грамотрицательные палочки[29] с закруглёнными концами средних размеров (длина 2-6 мкм и ширина 0,4-0,6 мкм). Палочки располагаются одиночно, реже — попарно. Клетки E. coli имеют пили (фимбрии) и обладают подвижностью благодаря перитрихиально расположенным жгутикам[30]. По отношению к кислороду это факультативные анаэробы. Эшерхии имеют как непатогенные (резидентные, часть естественного микробиома кишечника человека), так и условно-патогенные и патогенные штаммы, попадаемые в организм человека извне с пищевыми продуктами, которые могут вызывать разнообразные заболевания эшерихиозы, которые затрагивают органы ЖКТ (массовые кишечные отравления, гастроэнтериты, болезнь Крона итд.), крови (гемолитическую анемию, сепсис), урогенитальной системы. Источником инфекции при эшерихиозе является больной человек или бактерионоситель, хотя здоровое носительство выявляется редко — в 2-3 % случаев. В некоторых случаях источником инфекции является крупный рогатый скот и овцы (при инфицировании энтерогеморрагическими эшерихиями). Механизм передачи инфекции — фекально-оральный. Пути передачи — водный, алиментарный (пищевой), бытовой. По данным ВОЗ, заражение энтеротоксигенными и энтероинвазивными эшерихиями чаще происходит пищевым путём, а энтеропатогенными эшерихиями — контактно-бытовым путём. Нередко заболевания связаны с инфицированным молоком и молочными продуктами. Заболевания, вызванные патогенными эшерихиями, чаще всего встречается у путешественников (так называемая диарея путешественников), посещающих страны с жарким климатом. Предполагается, что распространению инфекций способствует загрязнение объектов внешней среды сточными водами, нарушение санитарно-гигиенических условий, контаминация эшерихиями продуктов питания (мясных, молочных и овощных продуктов). По данным ВОЗ, эшерихиозы занимают первое место среди диарейных заболеваний у новорождённых и детей раннего возраста.
Патогенные штаммы E. coli.[править | править код]

На основании симптомов заболеваний, их характеристик, а также воздействия определённых клеточных культур и их принадлежности к серологическим группам, распознаются следующие вирулентные группы Escherichia coli:
- энтероагрегативная (EAggEC),
- энтерогеморрагическая (EHEC),
- энтероинвазивная (EIEC),
- энтеропатогенная (EPEC),
- энтеротоксигенная (ETEC),
- диффузно-адгерентная, диффузно-агрегативная или диффузно-агрегирующая (DAEC).
Передача патогенных штаммов E. coli происходит в основном фекально-оральным путём[31], например, при контаминации ими пищевых продуктов или воды и, последующим их употреблением, а также не соблюдении правил гигиены и санитарно-гигиенических правил и норм мест общественного питания.
Энтероагрегативная E. coli (EAggEC)[править | править код]
Эта группа (обозначаемая также как энтероадгерентная) тесно связана с энтеропатогенной (EPEC) группой E. coli, но агрегативная адгерентность, проявляемая этими штаммами, характерна только для них. Некоторые штаммы, относящиеся к EAggEC, продуцируют термостабильный энтеротоксин (ST), получивший обозначение EAST1. Ген плазмидного происхождения, названный astA, кодирует состоящую из 38 аминокислотных остатков белковую молекулу, в отличие от гена estA, кодирующего энтеротоксин STa, состоящего из 72 аминокислотных остатков. Бактерии EAggEC-штаммов продуцируют также энтеротоксин/цитотоксин, имеющий молекулярную массу 108 кДа, гены которого локализованы в большой плазмиде вирулентности. Отличительными клиническими признаками бактерий EAggEC-штаммов являются неослабевающая диарея, длящаяся более 14 дней, в особенности у детей. Эти штаммы не являются первичной причиной диареи путешественников.
До сих пор неясно, являются ли члены этой группы пищевыми патогенами.
Энтерогеморрагическая E. coli (EHEC)[править | править код]
Эти штаммы с одной стороны напоминают, а с другой стороны отличаются от EPEC-штаммов. Схожесть с EPEC-штаммами определяется тем, что они обладают хромосомным геном eaeA (или аналогичным ему геном), а также в том, что они вызывают повреждения типа прикрепление-сглаживание. В отличие от EPEC-штаммов EHEC-бактерии воздействуют только на толстый кишечник (у модели поросят) и выделяют в больших количествах токсин, аналогичный шига-токсину (SLT, Stx, подробнее описан ниже). Бактерии EHEC обладают плазмидой весом 60 МДа, которая кодирует фимбрии, опосредующие прикрепление к культуре клеток. Эти бактерии не способны внедряться в клетки, относящиеся к линиям Hep-2 или INT407, однако некоторые штаммы обладают способностью проникать в клетки некоторых линий эпителия человека. Некоторые из штаммов EHEC образуют сильно скрученные фимбрии, которые осуществляют прикрепление клеток бактерий к поверхностям.
Токсины[править | править код]

Токсины, продуцируемые бактериями E. coli, относящихся к EHEC-штаммам, называют шига-подобными токсинами (веротоксин, вероцитотоксин). Сюда же относят два таких токсина-прототипа, как SLT-I и SLT-II. В последнее время, однако, используется новая терминология, и то, что раньше называли SLT-I, теперь называют Stx1, а SLT-II теперь носит название Stx2.
Все токсины Stx состоят из одной ферментативно активной субъединицы А (32 кДа) и нескольких субъединиц В (7,7 кДа)[32][33]. Чувствительные к этим токсинам клетки обладают рецептором глоботриаозилцерамида (Gb3), и кроме того, бутират натрия, по-видимому, также играет роль при сенситизации клеток к Stx токсинам. Как только токсины оказываются связанными с рецептором Gb3, далее следует интернализация (посредством экзоцитоза) и транспорт по каналам сети аппарата Гольджи. После того, как токсин оказывается внутри клетки-хозяина, субъединица А связывается с 28S-рРНК, входящей в состав 60S-субъединицы рибосом, освобождая при этом аминокислотный остаток аденина и, таким образом, ингибируя синтез белка[34]. В-субъединицы образуют пентамеры в ассоциации с одной субъединицей А (AB5), и, таким образом, они являются ответственными за связывание токсина с нейтральными гликолипидными рецепторами.
Энтероинвазивные E. coli (EIEC)[править | править код]
Эти штаммы обычно не продуцируют энтеротоксины, как это характерно для штаммов ETEC, но, тем не менее, эти бактерии проникают в клетки эпителия толстого кишечника и затем распределяются по непосредственно примыкающим клеткам тем же способом, что и шигеллы.
Энтеропатогенные E. coli (EPEC)[править | править код]
Эти штаммы, как правило, не продуцируют энтеротоксинов, хотя они могут вызывать диарею. Бактерии данных штаммов способны прикрепляться к клеткам культуры ткани и способны к агглютинации в средах для выращивания культуры тканей. Они обладают плазмидами, кодирующими факторы адгезивности, что позволяет им прикрепляться к мукозному слою кишечника. После колонизации мукозного слоя кишечника происходят его деградативные изменения, обозначаемые термином «прикрепления-разрушения» (“attachment-effacement”, сокр. A/E).
Энтеротоксигенные E. coli (ETEC)[править | править код]
Бактерии этих штаммов прикрепляются к стенкам тонкого кишечника и колонизируют его при помощи находящихся на фимбриях антигенных факторов колонизации (CFA). Существует 4 типа факторов колонизации — I, II, III и IV. Все они были клонированы и секвенированы. CFA кодируются плазмидами и, главным образом, той же плазмидой, которая кодирует термостабильный энтеротоксин. Эти факторы не выделяются при температуре ниже 20 °С. Будучи уже прикреплёнными, эти бактерии продуцируют один или сразу два энтеротоксина.
Энтеротоксины[править | править код]
Один из энтеротоксинов Escherichia coli является термолабильным (LT), другой — термостабильным (STа или ST-1 и STb или ST-2). Термолабильный энтеротоксин разрушается при 60 °С в течение приблизительно 30 мин, в то время как термостабильный энтеротоксин может выдерживать температуру 100 °С в течение 15 мин.
Термолабильный энтеротоксин представляет собой белок с молекулярным весом около 91 кДа и обладает ферментативной активностью, аналогичной активности холерного токсина (СТ).
Термолабильный энтеротоксин (LT) состоит из двух протомеров (субъединиц): А, с молекулярным весом около 25,5 кДа, который при обработке трипсином становится активным и состоит из полипептидной цепи А1, связанной дисульфидной связью с А2-подобной цепью, и протомера В, обладающего молекулярным весом около 59 кДа и состоящего из 5 нековалентно связанных отдельных полипептидных цепей. Протомер В термолабильного энтеротоксина (LTB) обладает иммунологическими свойствами, похожими на те, которые характерны для субъединиц А и В токсина Vibrio cholerae.
Термостабильный энтеротоксин STa обладает хорошей растворимостью в метаноле и вызывает секреторный ответ у детёнышей мышей. В его состав входит состоящий из 18–19 аминокислотных остатков кислый пептид, который содержит три дисульфидных связи и имеет молекулярную массу в 1972 Да. Этот энтеротоксин стимулирует специфическую гуанилатциклазу в кишечнике. STa был химически синтезирован.
STb нерастворим в метиловом спирте и первоначально был выделен из организма свиньи. Этот токсин является наиболее распространённым при выделении различных токсинов из диарейных фекалий свиней. Он воздействует на тонкий кишечник и связанный с ним илеум у молочных поросят, а также на кишечную петлю мышей при добавлении ингибитора протеаз. Ген этого энтеротоксина (estB) был секвенирован и клонирован. Трипсин-чувствительный STb энтеротоксин синтезируется в виде полипептида, состоящего из 71 аминокислотного остатка, которые затем расщепляются, и в результате остается молекула из 48 аминокислот, содержащая 4 цистеиновых остатка, которая и проходит в периплазматическое пространство клеток бактерий. Механизм действия этого энтеротоксина остается пока невыясненным, но показано, что он стимулирует синтез простагландина Е2. Клеточным рецептором этого энтеротоксина в клетках кишечника мыши является белок, обладающий молекулярной массой 25 кДа.
Механизм действия энтеротоксинов[править | править код]
Гастроэнтериты, которые определяются действием ETEC-штаммов, вызываются при поглощении 106–1010 жизнеспособных клеток бактерий на грамм, которые должны колонизировать тонкий кишечник и начать продуцировать энтеротоксины. Факторами колонизации являются обычно фимбрии или пили. Синдром определяется, прежде всего, некровавым поносом без воспалительных экссудатов в стуле. Испражнения имеют водянистую консистенцию и напоминают по структуре испражнения, характерные при заражении холерным вибрионом. Диарея происходит вследствие активации энтеротоксином аденилатциклазы кишечника, в результате действия которой происходит накопление циклического 3',5'-аденозинмонофосфата (цАМФ). Из кишечника человека выделяют кишечные палочки, синтезирующие преимущественно ST-1. Энтеротоксин ST-1 связывается с рецептором энтероцитов и увеличивает внутриклеточную концентрацию циклического гуанозинмонофосфата (цГМФ). В результате этого стимулируется секреция хлорид ионов Cl- и ингибируется всасывание ионов натрия Na+, что приводит к потере жидкости кишечником. Рецепторы к этому токсину в большей степени имеются на энтероцитах тонкой кишки, поэтому тонкая кишка преимущественно и вовлекается в патологический процесс при инфицировании такими штаммами.
Диффузно-адгерентные E. coli (DAEC)[править | править код]
Диффузно-адгерентные E. coli (англ. Diffusely Adherent E. coli, сокр. DAEC), также диффузно-агрегативные, диффузноагрегирующие (сокр. ДАКП) — характеризуются образованием диффузных агрегатов на эпителиальных клетках HeLa или Hep-2[35]. ДАКП имеют как фимбриальные, так и афимбриальные адгезины (семейства Afa/Dr). После того, как адгезины связываются с энтероцитами, происходит „демонтаж“ (разборка) молекул актина, приводящий к удлинению микроворсинок и перераспределению белков цитоскелета. Перераспределение белков цитоскелета клеток кишечника происходит непосредственно, под участием системы секреции III типа (T3SS). Некоторые исследователи считают, что из-за трудностей классификации и идентификации DAEC роль этого возбудителя при острых кишечных инфекциях требует дополнительных эпидемиологических исследований[36].
Токсины Вибрионов[править | править код]

Вибрионы составляют род Vibrio, относящийся к семейству Vibrionaceae. В состав этого рода входит большое количество видов. Среди них особое значение имеет V. cholerae — возбудитель холеры, опасного инфекционного заболевания, способного не только к эпидемическому, но и пандемическому распространению. Холера является типичной антропонозной инфекцией. Природный резервуар — загрязнённая вода; источник инфекции — больной человек с первых дней заболевания и бактерионоситель. Основные механизмы передачи — фекально-оральный и контактный. Факторы передачи — вода, пищевые продукты, объекты окружающей среды. В воде открытых водоёмов холерный вибрион часто находится в ассоциациях с зоопланктоном (в частности, с веслоногими рачками) и водными растениями[37]. Пути заражения холерой — водный (через воду, используемую для питья, купания и хозяйственно-бытовых нужд), алиментарный (пищевой) и контактно-бытовой. Определённую роль могут играть мухи, способные переносить возбудителя с испражнений больного человека на пищевые продукты.
Все крупные эпидемии и пандемии холеры связаны с водой. Больной холерой человек выделяет во внешнюю среду в 1 мл испражнений от 10 млн. до 1 млрд. вибрионов, а бактерионоситель — до 100 тыс. микробных клеток. Переболевшие лица выделяют холерный вибрион в течение 7-10 дней после клинического выздоровления. Примерно у 4-5% переболевших формируется хроническое носительство, при котором холерный вибрион сохраняется в жёлчном пузыре. Инфицирующая доза составляет около 1 млн. микробных клеток. Заражение человека от человека не происходит.
Вид V. cholerae включает 206 серогрупп, которые различаются по структуре соматического О-антигена. Их разделяют на агглютинирующиеся типовой холерной О1-сывороткой (V. cholerae O1) и на неагглютинирующиеся типовой холерной О1-сывороткой (V. cholerae non O1). Вибрионы, неагглютинирующиеся О1-сывороткой, называются неагглютинирующимися (НАГ) вибрионами.
“Классическая” холера вызывается холерным вибрионом серогруппы О1 (V. cholerae O1). К этой серогруппе относятся 2 биовара: классический (V. cholerae 267 биовар cholerae или V. cholerae биовар asiaticae) и Эль-Тор (V. cholerae биовар eltor). Биовары V. cholerae cholerae и V. cholerae eltor включают по 3 биотипа: Инаба (Inaba), Огава (Ogawa) и Хикосима (Hikojima). Кроме представителей серогруппы О1 холеру вызывает вибрион серогруппы О139 (V. cholerae bengal). Вибрионы, относящиеся к другим серологическим группам (О2-О138, О140-О206), могут вызывать у людей спорадические или групповые случаи диарейных заболеваний, не склонных к эпидемическому распространению.
Холерный вибрион представляет собой изогнутые короткие подвижные грамотрицательные палочки[38]. Размеры клеток холерного вибриона составляют 1,5-4,0 × 0,2-0,6 мкм. Для холерных вибрионов характерен полиморфизм — в клиническом материале обнаруживаются типичные изогнутые формы (в виде запятой), а в препаратах с питательных сред преобладают прямые палочковидные формы.

Жгутик снабжён чехликом и продольным выростом, напоминающим ундулирующую мембрану. Жгутики хорошо выявляются при окраске препаратов по методу Лейфсона. Подвижность холерных вибрионов является одним из диагностических признаков возбудителя. Пили (фимбрии) представляют собой тонкие гибкие нитевидные образования на поверхности бактериальной клетки. Не образует капсул и спор. По отношению к кислороду является факультативным анаэробом.
Холерный вибрион во внешней среде чувствителен к высушиванию и действию прямых солнечных лучей, но хорошо сохраняется и размножается при температуре выше 10-12 °С в открытых водоёмах и сточных водах, богатых органическими веществами. В частности, в водоёмах возбудитель сохраняется в течение 2-3 недель. Холерные вибрионы хорошо сохраняются при низкой температуре: во льду — до 1 месяца; в морской воде — до 47 суток, в речной воде — от 3-5 дней до нескольких недель, в почве — от 8 дней до 3 месяцев. В свежих испражнениях больного возбудитель холеры сохраняется до 3 суток, на белье, загрязнённом испражнениями больных, сохраняется до 2 суток, а на влажном материале — неделю. На вареных продуктах (рис, лапша, мясо, каши и др.) холерные вибрионы выживают в течение 2-5 дней, на сырых овощах — 2-4 дней, на фруктах - 1-2 дней, в молоке и молочных продуктах — 5 дней. При хранении продуктов в холодильнике срок выживания возбудителя увеличивается на 1-3 дня. Холерные вибрионы при 50 °С погибают через 30 минут, при 80 °С — через 5 минут, при 100 °С — через несколько секунд. Холерные вибрионы очень чувствительны к действию дезинфектантов, особенно с кислым значением рН. В растворе сулемы (1:100000) они погибают через 5 минут. Под влиянием хлорамина и других дезинфектантов погибают через 5-15 минут. Возбудитель высокочувствителен к хлору: доза активного хлора 0,3-0,4 мг/л за 30 минут вызывает надёжное обеззараживание предметов.
Токсины[править | править код]

V. cholerae продуцирует т.н. холерогенный экзотоксин (СТ). Он секретируется в окружающую среду системой секреции II типа. СТ состоит из компонентов А и В — два белковых домена. Домен, отвечающий за связывание с энтероцитами человека, является пентамером субъединицы В с молекулярной массой 12 кДа. Каталитический домен, осуществляющий АДФ-рибозилирование Gs α-субъединицы (Gαs) состоит из субъединицы А, с молекулярной массой 28 кДа. Структурно холерный токсин представляет собой гетерогексамер (AB5).
Компонент В через 1-3 минуты после выделения токсина из микробной клетки распознает на поверхности энтероцита специфический рецептор (ганглиозид Gm1), связывается с ним и формирует внутримембранный канал для прохождения компонента А внутрь клетки. Если в клетке отсутствует Gm1, токсин, скорее всего, связывается с другими типами гликанов, такими как Lewis Y и Lewis X, которые прикреплены к белкам, а не к липидам[39][40][41]. Внутри клетки белок А1 взаимодействует с Gs α-субъединицей, располагающейся на внутренней стороне мембраны энтероцита. Образующаяся АДФ-рибоза связывается с регуляторной субъединицей аденилатциклазы, в результате чего внутри клетки происходит повышение концентрации циклического аденозинмонофосфата (цАМФ). Эти изменения происходят в течение 30 минут после контакта токсина с клеточным рецептором.

Гиперпродукция молекул цАМФ приводит к выходу из энтероцитов в просвет кишечника внутриклеточной жидкости с низким содержанием белка и высокой концентрацией катионов и анионов (Na+, НСО3-, K+, Сl-)[42]. Всё это приводит к развитию сильнейшей диареи, обезвоживанию и обессоливанию организма. Кроме того, в результате нарушения водно-солевого баланса в просвете кишечника создается идеальная щелочная среда для размножения возбудителя[43].
Помимо холерогенного токсина, V. cholerae продуцируют и эндотоксины. Эндотоксин V. cholerae представляет собой термостабильный липополисахарид (LPC). Он отвечает за общую интоксикацию организма и рвоту. Эндотоксин холерного вибриона воздействует на арахидоновую кислоту, входящую в состав фосфолипидов клеточных мембран. В результате этого происходит синтез простагландинов, которые вызывают сокращение гладкой мускулатуры тонкого кишечника и обусловливают тенезмы. Антитела, образующиеся против эндотоксина, обладают выраженным вибриоцидным действием (растворяют вибрионы в присутствии системы комплемента) и являются важным компонентом постинфекционного и поствакцинального иммунитета.
Токсины Листерий[править | править код]

Листерии являются грамположительными, неспорообразующими и не кислотоустойчивыми палочковидными бактериями, являются факультативными анаэробами[44], которые были изначально названы «Listerella». В 1940 г. родовое наименование было изменено на Listeria. Во многих отношениях они похожи на представителей рода Brochothrix. Бактерии обоих родов являются положительными по каталазе и имеют тенденцию к взаимосвязям в природных условиях наряду с бактериями рода Lactobacillus, однако, в отличие от Listeria и Brochothrix, лактобациллы являются отрицательными по каталазе.
Листерии широко распространены в природе и могут быть обнаружены на гниющей растительности в почве, испражнениях животных, канализационных водах, силосной массе и в воде. Как правило, можно ожидать обнаружение листерий в тех средах обитания, где существуют также молочнокислые бактерии, Brochothrix, а также некоторые из коринеформных бактерий. Связь бактерий этой группы с молочными продуктами и силосом хорошо известна, так же как и связь с этими продуктами некоторых других продуцентов молочной кислоты.
Достаточно хорошо установлено, что любые свежие продукты питания животного и растительного происхождения могут содержать бактерии L. monocytogenes в тех или иных количествах. Эти организмы, как правило, выявляются в сыром молоке, мягких сырах, в свежем и замороженном мясе, в мясе птиц, морепродуктах и фруктовых и овощных продуктах. Преимущественное нахождение этих бактерий в молоке и молочных продуктах вызывает повышенное внимание к ним из-за частых вспышек массовых заражений. L. innocua обычно обнаруживают в мясе, молоке, замороженных морепродуктах, полумягком сыре, образцах яиц и овощах. Как правило, этот вид листерий превалирует в молочных продуктах.
Из всех видов листерий Listeria monocytogenes является патогеном, который в наибольшей степени затрагивает человека. Несмотря на то что бактерии L. ivanovii, например, могут активно размножаться на модельных мышах, их пролиферация осуществляется в гораздо меньшей степени, чем у L. monocytogenes, и их присутствие в концентрации до 106 клеток не вызывает инфекции у мышей. Такие виды, как L. innocua, L. welshimeri и L. seeligeri, не являются патогенными, хотя последний из них продуцирует гемолизин. Наиболее значительным фактором вирулентности, связанным с бактериями L. monocytogenes, является листериолизин О (LLO).
Вирусы как биологические контаминанты[править | править код]
По ряду причин о случаях обнаружения в продуктах вирусов известно намного меньше, чем о бактериях и грибах. Во-первых, вирусы — облигатные паразиты, которые не растут на культуральных питательных средах как бактерии и грибы. Обычно для культивирования вирусов применяют культуру ткани или методики, использующие куриный эмбрион. Во-вторых, вирусы не размножаются в продуктах, их число, как предполагают, ниже по сравнению с бактериальным числом, и для их выделения необходимы методы экстракции и концентрирования. Хотя этой методологии было посвящено много исследований, трудно получить больше 50%-го выделения вирусных частиц из таких продуктов, как говядина. В-третьих, лабораторные вирусологические методики неосуществимы во многих микробиологических лабораториях, исследующих пищевые продукты.
Ротавирусы[править | править код]

Впервые ротавирусы были обнаружены в 1973 году в Австралии, в первый раз их удалось культивировать в лаборатории в 1981 г. Были идентифицированы девять видов (обозначаются буквами A-J)[45][46], три из них (А, В и С) являются контагиозными для людей. Группа A встречается обычно среди младенцев и маленьких детей во всём мире. Группа B вызывает диарею у взрослых и отмечена только в Китае. Ротавирусы принадлежат семейству Reoviridae; в диаметре они приблизительно 70 нм, безоболочечные (без суперкапсида) и содержат двухцепочечную РНК (дцРНК), частицы вирусов морфологически напоминают колесо (от лат. rota — «колесо»), откуда и получили своё название. Фекально-оральный путь — первичный способ передачи, при контакте через загрязнённые руки, поверхности и предметы быта (вещи, столовые приборы итд.)[47]. Вирусная диарея, вызванная инфицированием очень контагиозна.
Ротавирусы стабильны в окружающей среде и были обнаружены в пробах воды из устьев рек в количестве до 1-5 инфекционных частиц на галлон США (~ 1 частица на литр). Средняя выживаемость вирусов вне клеток составляет от 9 до 19 дней[48].
Вирус гепатита A[править | править код]
До 1990-х гг. вспышек гепатита А обнаруживаемого в продуктах, было зарегистрировано больше, чем любой другой вирусной инфекции. Вирус гепатита A принадлежит семейству Picornaviridae так же, как и полиомиелит, ЕСНО-вирус и вирусы Коксаки, все они имеют геномы из односпиральной РНК (ssРНК). Инкубационный период при гепатите длится от 15 до 45 дней с пожизненным иммунитетом к повторному заражению. Способ передачи — фекально-оральный, самое обычное средство передачи — сырой или частично приготовленный моллюск из загрязнённых вод.
Прионы как контаминанты[править | править код]

Прионы (англ. prion от protein «белок» + infection «инфекция»; слово было предложено в 1982 году Стенли Прузинером[49]) представляют собой особый класс инфекционных агентов, который не содержит нуклеиновых кислот. Прионы это белки, имеющие аномальную третичную структуру, способные к катализу конформационных превращений гомологичных молекул белка в себе подобные. При этом процесс инфицирования протекает без участия передачи информации, осуществляемых посредством нуклеиновых кислот. Благодаря патологическому фолдингу в здоровых клетках растёт число молекул прионов, происходит замещение нормальных белков на последние, которые способны к образованию плотно упакованных фибриллярных белков — бета-амилоидов. Вызванные патологические процессы являются необратимыми. Прионные заболевания носят нейродегенеративный характер (прионы поражают клетки головного мозга). Несмотря на длительный инкубационный (латентный) период (от 5 до 20 лет), при появлении симптомов, прионные заболевания быстро прогрессируют, приводя к повреждению головного мозга и смерти[50]. Все прионные заболевания неизлечимы и имеют 100%-ую летальность.
Прионы очень устойчивые к агрессивным воздействиям, они не чувствительны к термической обработке (выдерживают кипячение более 1 часа), ионизирующему излучению, УФ-излучению, химическим веществам: к растворителям (ацетон, этанол, бензол, аммиак (1М), мочевина (7-8М)), формалину, протеолизу (ферментами и в кислой среде), к воздействию некоторых окислителей (перекись водорода, перманганат калия, спиртовой раствор йода, фенолы). Деградация и полная инактивация прионов возможна только агрессивными агентами, такими, как концентрированные растворы щелочей, которые невозможно использовать в производстве пищевых продуктов.
Передача прионов к человеку возможна алиментарным путём через инфицированное мясо и мясные продукты, больных животных — овец, коров.
Микотоксины и токсины грибов[править | править код]
Микотоксины (от греч. μύκης, mykes, mukos — «гриб» и τοξικόν, toxikon — «яд») — это вторичные метаболиты микроскопических плесневых грибов, обладающие выраженными токсическими свойствами[51]. Они не являются эссенциальными для роста и развития продуцирующих их микроорганизмов.
С гигиенических позиций — это особо опасные токсические вещества, загрязняющие корма и пищевые продукты. Высокая опасность микотоксинов выражается в том, что они обладают токсическим эффектом в чрезвычайно малых количествах и способны весьма интенсивно диффундировать вглубь продукта.
Афлатоксины[править | править код]

Афлатоксины (AF, сокр. от Aspergillus flavus toxins) — органические соединения, из группы поликетид, представляют собой одну из наиболее опасных групп микотоксинов, обладающих чрезвычайной высокой токсичностью и гепатоканцерогенностью[52].
Афлатоксины, несомненно, наиболее изученные из всех микотоксинов. Первые данные об их существовании относятся к 1960 году, когда внезапно и почти одновременно 100 000 индюшат погибли в Англии (так называемая «болезнь-Х») после употребления арахисовой муки, импортируемой из Африки и Южной Америки[53].
В настоящее время семейство афлатоксинов включает четыре основных представителя (афлатоксины B1, B2, G1, G2)[54] и ещё более 10 соединений, являющихся производными или метаболитами основной группы (M1, M2, B2a, G2a, GM1, афлатоксикол, P1, Q1 и др.)[55].
Продуцентами афлатоксинов являются некоторые штаммы двух видов микроскопических грибов: Aspergillus flavus (Link.) и Aspergillus parasiticus (Speare)[56].
 |  |  |
 |  |  |

В природных условиях чаще и в наибольших количествах афлатоксины обнаруживаются в арахисе, кукурузе, семенах хлопчатника. Кроме того, в значительных количествах они могут накапливаться в различных орехах (грецкий орех, миндаль, фундук, кешью и др.), семенах масличных культур, пшенице, ячмене, зёрнах какао и кофе[57].
В кормах, предназначенных для сельскохозяйственных животных, афлатоксины также обнаруживаются достаточно часто и в значительных количествах. Во многих странах с этим связано и обнаружение афлатоксинов в продуктах животного происхождения. Например, в молоке и тканях сельскохозяйственных животных, получавших корма, загрязнённые микотоксинами, обнаружен афлатоксин М1. Причём афлатоксин М1 обнаружен как в цельном, так и в сухом молоке и даже в молочных продуктах, подвергшихся технологической обработке (пастеризация, стерилизация, приготовление творога, йогурта, сыров и т. п.).
Термическая обработка, используемая в кулинарии не способствует уменьшению концентрации афлатоксинов, ввиду того, что они устойчивы к нагреванию, даже в автоклавах при довольно высоких температурах и продолжительности процесса (t > 120 °C, более 40 минут). Для разрушения афлатоксинов необходимы дополнительные мероприятия, например, использование окислителей, экстракция с полярными органическими растворителями (хлороформ, ацетон) или азеотропными смесями (оптимальный вариант — смесь воды и метоксиметана), использование раствора или газообразного аммиака, который наиболее эффективно уничтожает организмы продуценты аспергиллы и разрушает до 98 % афлатоксинов.
Токсическое воздействие афлатоксинов[править | править код]
Действие афлатоксинов на организм животных и человека может быть охарактеризовано с двух позиций. Во-первых, с точки зрения острого токсического действия и, во-вторых, с точки зрения оценки опасности отдалённых последствий.
Острое токсическое действие афлатоксинов связано с тем, что они являются одними из наиболее сильных гепатропных ядов, органом-мишенью которых является печень. Отдалённые последствия действия афлатоксинов проявляются в виде канцерогенного, мутагенного и тератогенного и иммунодепрессивного эффектов. Наиболее изучен афлатоксин B1.
| Животные | Способ введения | Токсичность (LD50) в мг/кг |
|---|---|---|
| Утка | п/о | 0,5-2,0 |
| Крысы | п/о, вб | 1,2-17,9 (в зависимости от пола и возраста) |
| Хомяки | п/о | 9,0-10,2 |
| Мыши | п/о | 6,0-9,0 |
| Кролики | п/о | ~0,5 |
| Морские свинки | вб | ~1,0 |
| Собака | п/о | 0,45-0,5 |
| Речная форель | п/о | <0,5 |
Механизм воздействия на гепатоциты имеет сходства с механизмом воздействия ПАУ. Однако продукты гидроксилирования имеют более высокие окислительные свойства и повреждают клетки посредством нарушения структуры целостности биомембран и алкирования нуклеиновых кислот.

В молекулах афлатоксинов содержится большое количество атомов кислорода, вследствие этого, попадая в клетку печени и подвергаясь эпоксидированию (окислению), посредством цитохрома P450 микросомальной системы молекулы приобретают чрезвычайно реакционноспособные свойства. Молекулы образовавшегося эпоксида легко проникает в ядро, с помощью белка AHR. В ядре они немедленно начинают алкилировать цепи ДНК, образуя с ними прочные аддукты. Происходит торможение и полное подавление синтеза молекул тРНК. В ядре появляются морфологические изменения. Алкилирование ДНК приводит к повреждениям гена-онкосупрессора p53, вплоть до утраты к экспрессии белка[58]. Тем самым лишая гепатоцит апоптоза. Дальнейшее продолжение процесса приводит к трансформации клеток, посредством активации некоторых онкогенов, например, K-ras, вызывая гепатоцеллюлярную карциному[59].
Скорость алкилирования лимитируется концентрацией продуктов гидроксилирования, однако, даже минимальное количество причиняет серьёзные повреждения гепатоцитам. Помимо этого они обладают сильнейшей гепатотоксичностью (в особенности афлатоксин B1 — наиболее токсичный, СДЯВ, минимальная летальная доза для человека составляет менее 2 мг/кг).
Афлатоксины способны вызывать у человека острые и хронические микотоксикозы, названные афлатоксикозами. Возникновению афлатоксикозов способствует отсутствие надлежащего санитарно-эпидемиологического контроля за продуктами питания, особенно в странах с жарким и влажным климатом (страны тропической Африки, Юго-восточной Азии и Индия), где среди местного населения наблюдаются высокие показатели цирроза печени и гепатоцеллюлярной карциномы.
Помимо гепатотропного и канцерогенного эффектов, афлатоксины способны снижать иммунитет, посредством влияния на митохондрии и клеточные мембраны лимфоцитов. Нарушают синтез цитокинов макрофагов и Т-лимфоцитов.
Отравление афлатоксинами требует безотлагательных мер медицинской помощи.
Согласно данным ВОЗ, человек при благоприятной гигиенической ситуации потребляет с суточным рационом до 0,19 мкг афлатоксинов. В России приняты следующие санитарно-гигиенические нормативы по афлатоксинам: № 015/2011 о безопасности зерна и № 021/2011 о безопасности пищевой продукции ПДК афлатоксина В1 для всех пищевых продуктов, кроме молока, составляет 5 мкг/кг, для молока и молочных продуктов — 1 мкг/кг (для афлатоксина М1 — 0,5 мкг/кг). Допустимая суточная доза (ДСД) — 0,005-0,01 мкг/кг массы тела. В ферментных молокосвертывающих препаратах грибного происхождения, продуктах для детей, беременных и кормящих женщин наличие афлатоксина B1 не допускается.
Трихотецены[править | править код]

Трихотеценовые микотоксины или просто трихотецены (сокр. ТТМТ) — органические соединения из так называемого семейства сесквитерпеноидов, их отличительной чертой служит трихотеценовое кольцо (трихотекан), которое содержит двойную связь при С-9 и эпоксидную группу в области С-12,13[60]. В настоящее время идентифицировано более 150 трихотеценов[61], большинство из них являются слаботоксичными, лишь немногие — смертельно опасны. Трихотеценовые микотоксины — вторичные метаболиты, которые продуцируются в основном микроскопическими плесневыми грибами (микромицетами) рода Fusarium, а также в меньшей степени Stahybotrys, Trichoderma, Cephalosporium, Trichothecium и Mizothecium. Биологические контаминанты, являются сильными иммунодепрессантами, поражают органы кроветворения, желудочно-кишечного тракта, повышают риск возникновения геморрагий (кровоизлияний) внутренних органов человека[62].
В зависимости от структуры трихотеценового ядра эти микотоксины подразделяются на 4 группы: А, В, С и D. Структура различных типов трихотеценовых микотоксинов очень сложна и имеет свои характерные особенности.
В качестве природных загрязнителей (контаминантов) пищевых продуктов и кормов к настоящему времени выявлены только четыре: Т-2 токсин и диацетоксискирпенол, относящиеся к типу А, а также ниваленол и дезоксиниваленол (вомитоксин), относящиеся к типу B. В Европе (включая и территорию РФ) наиболее распространённым трихотеценом является дезоксиниваленол (вомитоксин)[63].
- Дезоксиниваленол или вомитоксин
Токсическое воздействие трихотеценов[править | править код]
Алиментарные токсикозы, вызванные потреблением в пищу продуктов и кормов, поражённых микроскопическими грибами, продуцирующими ТТМТ, можно отнести к наиболее распространённым микотоксикозам человека и сельскохозяйственных животных. Первые сведения о такого рода заболеваниях появились более ста лет тому назад.
Хорошо известен, так называемый токсикоз «пьяного хлеба» — заболевание человека и животных, причиной которого послужило употребление зерновых продуктов (главным образом хлеба), приготовленных из зерна, поражённого грибами Fusarium graminearum (F. roseum). Кроме того, описан целый ряд тяжёлых токсикозов, таких как акабаби-токсикоз (впервые описан в Японии, вызывается красной плесенью и связан с поражением зерна грибами F. nivale и F. graminearum)[64], алиментарная токсическая алейкия — АТА (микотоксикоз, связанный с употреблением в пищу продуктов из зерновых культур, перезимовавших в поле под снегом и пораженных микроскопическими грибами F. sporotrichiella и F. poae) и многие другие, приводящие к серьёзному нарушению здоровья людей и протекающие по типу эпидемий, то есть характеризующиеся определённой очаговостью, сезонностью, неравномерностью вспышек в разные годы и употреблением продуктов из зерна, поражённого микроскопическими грибами.
Многочисленными исследованиями in vitro и in vivo было показано, что трихотецены являются ингибиторами синтеза белков (на всех этапах синтеза), и нуклеиновых кислот (в частности тРНК). Трихотецены также обладают способностью влиять на общую функцию клеточных ферментов из-за тенденции тиоловых групп активного центра атаковать 12,13-углеродное эпоксидное кольцо[65]. Данные ингибирующие эффекты наиболее ярко проявляются в активно делящихся клетках тканей, таких как желудочно-кишечного тракта или красного костного мозга (миелоидной). Кроме этого, вызывают нарушения стабильности лизосомных мембран и активацию ферментов лизосом, что в конечном счёте приводит к гибели клетки.
Охратоксины[править | править код]
Охратоксины — органические соединения, группа микотоксинов, производные кумарина, продуцируемые некоторыми видами микроскопических плесневых грибов рода Аспергилл (страны с преимущественно субтропическим и тропическим климатом) и Пеницилл (страны с умеренным климатом). Основной продуцент охратоксинов среди грибов рода Пеницилл — Penicillium verrucosum, среди аспергиллов — Aspergillus ochraceus и некоторые другие виды аспергиллов, включая A.carbonarius и A.niger. Являются биологическими контаминантами. Источниками охратоксинов служат растительные продукты, в особенности зерновые культуры (пшеница, ячмень, кукуруза итд.). По обобщённым статистическим данным, в европейских странах, Канаде, США частота контаминации зерна охратоксином А составляет 5 % и характеризуется диапазоном содержаний токсина от 5 до 360 мкг/кг[66].
Из культуры гриба А. ochraceus выделено четыре охратоксина — А, В, С и D (ТА). Все охратоксины проявляют сильную нефротоксичность. В крови они быстро связываются с белками. Наиболее распространённым и токсичным является охратоксин А. Охратоксины незначительно различаются между собой (имеют сходную структуру молекул). Так, например, охратоксин В отличие от типа А не содержит атома хлора; охратоксин С — это этилохратоксин А[67].
- Охратоксин B
- Охратоксин C
- Охратоксин TA
Токсичность охратоксинов[править | править код]
Охратоксины входят в группу микотоксинов, преимущественно поражающих почки (нефротоксины). Охратоксин А нефротоксичен для всех изученных до сих пор видов животных даже при воздействии в наименьших из исследованных концентрациях (200 мкг/кг корма у крыс и свиней). Поражение включает атрофию канальцев, интерстициальный фиброз и, в поздних стадиях, гиалинизацию клубочков. При остром токсикозе, вызванном охратоксинами, патологические изменения выявляются и в печени, и в лимфоидной ткани, и в желудочно-кишечном тракте. В настоящее время уже доказано, что охратоксин А обладает сильным тератогенным действием. Вопрос о канцерогенности охратоксинов для человека остается нерешёнными.
Биохимические, молекулярные, клеточные механизмы действия охратоксинов изучены недостаточно. В исследованиях in vitro показано, что они активно связываются с различными белками: альбуминами сыворотки крови, тромбином, альдолазой, каталазой, аргиназой, карбоксипептидазой А. Некоторые моменты подтверждены и в исследованиях in vivo. Результаты изучения влияния охратоксинов на синтез макромолекул свидетельствуют о том, что охратоксин А ингибирует синтез белка и матричной РНК (токсин действует как конкурентный ингибитор), но не действует на синтез ДНК.
Для охратоксина А период полураспада в организме человека определён в 840 часов.
Фумонизины[править | править код]

Фумонизины — органические соединения, микотоксины, вторичные метаболиты, продуцируемые некоторыми видами микроскопических плесневых грибов (микромицетами) рода Fusarium (в частности, Fusarium verticillioides[68]), Lesiola[69]. Характерной особенностью этих микотоксинов является необычайное структурное сходство с молекулой жирного спирта — сфинганина, предшественника сфингозина и сфинголипидов[70]. Существует большое количество различных видов фумонизинов (более 100), однако, наиболее опасными контаминантами сырья и продуктов из них являются только 4: фумонизин B1 (самый распространённый и токсичный), В2, В3 и В4.
- Фумонизин B1
- Фумонизин B2
Впервые фумонизины (ФB1 и ФB2) были обнаружены и идентифицированы в 1970 году, в поражённой микромицетом F. verticillioides кукурузе, которая при употреблении вызвала вспышку лейкоэнцефаломаляции у лошадей. Однако, впоследствии они были найдены и в других злаковых культурах: пшенице, сорго, рисе. Фумонизин В2 методом ВЭЖХ и тандемной масс-спектроскопии был обнаружен в зёрнах кофе[71].
Токсичность фумонизинов[править | править код]
Токсичность фумонизинов невелика, но несмотря на это, они способны к серьёзным провреждениям клеточных мембран, вызывая апоптоз (вследствие нарушения целостности) гепатоцитов и клеток почек. Структурная аналогия фумонизинов приводит к тому, что они способны блокировать синтез сфинголипидов, посредством ингибирования ферментов 3-кетосфинганин редуктазы (шифр КФ 1.1.1.102) и N-ацетилсфингозин трансферазы (церамидсинтазы, шифр КФ 2.3.1.24). В клетках накапливаются субстраты данных ферментов, молекулы сфинганина, сфингозина и их 1-фосфатных метаболитов и снижаются концентрации сложных сфинголипидов. Накопление сфинганина и сфингозина является основной причиной токсичности фумонизина В1. Сфинганин и сфингозин в больших количествах цитотоксичны и ингибируют рост. Фумонизин В2 более цитотоксичен, чем фумонизин B1.
Считается, что существует связь между интоксикацией F. verticillioides и раком пищевода человека. Низкий социально-экономический статус и менее разнообразное питание, в основном состоящее из кукурузы и пшеницы, связаны с возникновением рака пищевода. Данная связь основана на эпидемиологических исследованиях в различных странах. Другие исследования показывают, что более высокие концентрации ФB1, ФB2 и F. verticillioides присутствуют в кукурузе, выращиваемой в регионах с высоким процентом рака пищевода.
Острый фумонизинотоксикоз (микотоксикоз) — пищевое отравление при употреблении продуктов, заражённых микромицетами, продуцирующие фумонизины. В 1995 году в 27 деревнях Индии произошла вспышка заболевания, характеризоваваяся диареей и болями в животе. Это произошло в результате употребления заплесневелого сорго и кукурузы, образовавшиеся в результате повышенной влажности (сезон дождей). Данная вспышка была изучена, и микотоксикоз был связан с употреблением пресного хлеба. Образцы кукурузы и сорго были собраны в домохозяйствах и исследованы. Кукуруза и сорго были заражены Fusarium и Aspergillus и содержали высокие уровни ФВ1 по сравнению с выборками незатронутых интоксикацией домохозяйств[72].
Патулин[править | править код]

Патулин — особо опасное вещество, обладающее канцерогенными и мутагенными свойствами, производное пирана (4-гидроксифуропиранон), трикетид, вторичный метаболит и микотоксин, продуцируемый некоторыми видами микроскопических плесневых грибов рода Aspergillus, Penicillium и реже Byssochlamys. Широко распространён. Является биологическим контаминантом. Высокотоксичен (при пероральном приёме, LD50 ≈ 17-20 мг/кг), поражает органы ЖКТ, обладает канцерогенным и генотоксическим воздействием, сообщалось, что он является иммуносупрессором для животных[73]. Помимо этого он проявляет свойства антибиотика, действуя на некоторые виды микроорганизмов[74]. Термостабилен, не разрушается при продолжительном нагревании и пастеризации.
Основными продуцентами патулина являются микроскопические грибы Penicillium patulum и Penicillium expansu. Но и другие виды этого рода микроскопических грибов, а также Byssochlamys fulva и B. nivea способны синтезировать патулин. Максимальное токсинообразование отмечается при температуре 21-30 °С.
Биологическое действие патулина проявляется как в виде острых токсикозов, так и в виде ярко выраженных канцерогенных и мутагенных эффектов. Биохимические механизмы действия патулина изучены недостаточно. Предполагают, что патулин блокирует синтез ДНК, РНК и белков, причём блокирование инициации транскрипции осуществляется за счёт ингибирования ДНК-зависимой РНК-полимеразы. Кроме этого, микотоксин активно взаимодействует с SH-группами белков и подавляет активность тиоловых ферментов.
Продуценты патулина поражают в основном фрукты и некоторые овощи, вызывая их гниение[75]. Патулин обнаружен в яблоках, грушах, абрикосах, персиках, вишне, винограде, бананах, клубнике, голубике, бруснике, облепихе, айве, томатах. Наиболее часто патулином поражаются яблоки[76], где содержание токсина может доходить до 17,5 мг/кг. Патулин концентрируется в основном в подгнившей части яблока, в отличие от томатов, где он распределяется равномерно по всей ткани.
Патулин в высоких концентрациях обнаруживается и в продуктах переработки фруктов и овощей: соках, компотах, пюре и джемах. Особенно часто его находят в яблочном соке (0,02-0,4 мг/л). Содержание патулина в других видах соков: грушевом, айвовом, виноградном, сливовом, манго — колеблется от 0,005 до 4,5 мг/л. В России приняты санитарно-гигиенические нормативы, допускающие уровень содержания патулина в плодово-овощной продукции не более 0,05 мг/кг[75]. Интересным представляется тот факт, что цитрусовые и некоторые овощные культуры, такие как картофель, лук, редис, редька, баклажаны, цветная капуста, тыква и хрен обладают естественной устойчивостью к заражению грибами-продуцентами патулина.
Цитринин[править | править код]
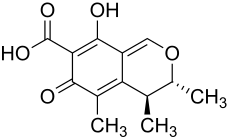
Микотоксин цитринин является поликетидом, продуцируется Penicillium citrinum, P. veridicatum и в меньшей степени другими микромицетами (Aspergillus). Он был выделен из полированного риса, плесневелого хлеба, очищенной ветчины, пшеницы, овсяных зёрен, ржи и других продуктов. Под ультрафиолетовым излучением он флуоресцирует лимонно-жёлтым цветом.
Хотя цитринин-продуцирующие организмы были обнаружены на бобах какао и кофе, эти микотоксины, как и другие, не найдены на этих продуктах в процессе их роста. Очевидная причина — ингибирование синтеза цитринина кофеином. Ингибирование цитринина является, вероятнее всего, специфичным, поскольку отмечается лишь небольшое уменьшение в росте продуцирующих его организмов.
Известен как канцероген. Высокотоксичен (LD50 = 19,0 мг/кг). Обладает также антибиотическим действием, но использовать его в качестве антибиотика нельзя, так как цитринин проявляет сильную нефротоксичность.
Контроль за загрязнением микотоксинами[править | править код]
В настоящее время вопросы контроля за загрязнением продовольственного сырья, пищевых продуктов и кормов микотоксинами решаются не только в рамках отдельных государств, но и на международном уровне под эгидой ВОЗ и ФАО.
В системе организации контроля за загрязнением продовольственного сырья и пищевых продуктов можно выделить два уровня: инспектирование и мониторинг, которые включают регулярные количественные анализы продовольственного сырья и пищевых продуктов.
Мониторинг позволяет установить уровень загрязнения, оценить степень реальной нагрузки и опасности, выявить пищевые продукты, являющиеся наиболее благоприятным субстратом для микроскопических грибов — продуцентов микотоксинов, а также подтвердить эффективность проводимых мероприятий по снижению загрязнения микотоксинами.
Особое значение имеет контроль за загрязнением микотоксинами при характеристике качества сырья и продуктов, импортируемых из других стран. С целью профилактики алиментарных микотоксикозов основное внимание следует уделять зерновым культурам. В связи с этим необходимо соблюдать следующие меры по предупреждению загрязнения зерновых культур и зернопродуктов:
- Своевременная уборка урожая с полей, его правильная агротехническая обработка и хранение.
- Санитарно-гигиеническая обработка помещений и ёмкостей для хранения.
- Закладка на хранение только кондиционного сырья.
- Определение степени загрязнения сырья и готовых продуктов.
- Выбор способа технологической обработки в зависимости от вида и степени загрязнения сырья.
Токсины грибов[править | править код]
В эту группу включены токсины, продуцируемые высшими грибами, которые могут вызвать отравления и/или смерть при употреблении в пищу. Отравления токсинами грибов — мицетизмы — нередко являются тяжёлыми.
Аматоксины[править | править код]

Аматоксины, также аманитотоксины — группа органических соединений, представляют собой циклические пептиды (октапептиды), состоящие из восьми аминокислотных остатков. Все токсины аманита содержат γ-гидроксилированные аминокислоты, что является условием их токсичности[77]. Чрезвычайно токсичны, сильнейшие гепатотоксины, поражают клетки печени (гепатоциты), вызывая их некроз, и тем самым представляют большую угрозу здоровью и жизни человека при интоксикации.

Всего известно десять видов аматоксинов, представленных в виде таблицы[78]:
| Название | R1 | R2 | R3 | R4 | R5 |
|---|---|---|---|---|---|
| α-Аманитин | OH | OH | NH2 | OH | OH |
| β-Аманитин | OH | OH | OH | OH | OH |
| γ-Аманитин | H | OH | NH2 | OH | OH |
| ε-Аманитин | H | OH | OH | OH | OH |
| Амануллин | H | H | NH2 | OH | OH |
| Амануллиновая кислота | H | H | OH | OH | OH |
| Аманинамид | OH | OH | NH2 | H | OH |
| Аманин | OH | OH | OH | H | OH |
| Проамануллин | H | H | NH2 | OH | H |
Источниками аматоксинов являются некоторые виды грибов рода Аманита (бледная поганка, белая поганка, весенняя поганка и др.), Галерина (галерина окаймлённая и др.) и Лепиота или Чешуйница (лепиота коричнево-красная, лепиота каштановая, лепиота розоватая и др.). Наиболее распространённые и смертельно опасные грибы, содержащие аматоксины:
- Лепиота коричнево-красная (Lepiota brunneoincarnata) — один из наиболее смертельно опасных грибов своего рода.
- Галерина окаймлённая (Galerína margináta), смертельно ядовитый гриб.
- Белая поганка или белый мухомор — один из смертельно опасных видов грибов рода Аманита.
- Лепиота каштановая, ещё один смертельно опасный гриб, содержащий большое количество аматоксинов.
- Бледная поганка (Amanita phalloides), самый распространённый на Земле смертельно ядовитый гриб рода Аманита (Мухомор)[79] (недоступная ссылка)[80]. Впервые аматоксины были обнаружены именно в этом грибе, откуда и получили своё название. Один гриб способен накапливать до 10 мг аматоксинов — смертельную дозу для взрослого человека[81] (недоступная ссылка).
- Лепиота розоватая (Lepiota subincarnata) смертельно ядовитый гриб[82].
Все аматоксины — СДЯВ, с ярко выраженным цитотоксическим воздействием. Вызывают деструкции (разрушения) клеток желудка и особенно энтероцитов кишечника. Наиболее чувствительными к воздействию аматоксинов являются клетки печени и почек. Однако воздействие происходит медленно. Минимальная летальная доза колеблется от 0,1 мг (α-аманитин) до 7 мг/кг тела человека.
Фаллотоксины[править | править код]

Фаллотоксины, также фаллоидины — группа органических соединений, представляют собой циклические гептапептиды, состоящие из 7-ми аминокислотных остатков, соединённые мостиками боковых цепей остатков триптофана и цистеина. За исключением указанных остатков все аминокислоты имеют L-конфигурацию[83]. Фаллотоксины относятся к ингибиторам цитоскелета и блокируют его ремоделирование. Все фаллоидины это чрезвычайно токсичные вещества, которые проявляют гепатотоксическое воздействие, посредством поражения клеток паренхимы печени (некрозы). Отличаются более быстрым периодом токсического воздействия на неё и латентным периодом, а также меньшей токсичностью (ЛД50 фаллоидина ~ 1,9 мг/кг, остальные 9-12 мг/кг), нежели аматоксины. Встречаются вместе с аматоксинами в плодовых телах грибов рода Аманита (Мухомор).

Известные виды фаллотоксинов представлены в виде таблицы:
| Название | R1 | R2 | R3 | R4 |
|---|---|---|---|---|
| Фаллацин | CH2CH(OH)(CH3)2 | CH(CH3)2 | CH(OH)COOH | OH |
| Фаллацидин | CH2C(OH)(CH3)CH2OH | CH(CH3)2 | CH(OH)COOH | OH |
| Фаллизацин | CH2C(OH)(CH2OH)2 | CH(CH3)2 | CH(OH)COOH | OH |
| Фаллизин | CH2C(OH)(CH2OH)2 | CH3 | CH(OH)CH3 | OH |
| Фаллоидин | CH2C(OH)(CH3)CH2OH | CH3 | CH(OH)CH3 | OH |
| Фаллоин | CH2CH(OH)(CH3)2 | CH3 | CH(OH)CH3 | OH |
| Профаллоин | CH2CH(OH)(CH3)2 | CH3 | CH(OH)CH3 | H |
Болесатин[править | править код]


Болесатин представляет собой гликопротеин, с молекулярной массой ~ 63 кДа, обнаруженный и выделенный из плодовых тел сатанинского гриба (Boletus satanas). Является термолабильным (неустойчивым к нагреванию) ингибитором белкового синтеза[84][85]. Относится к группе рибосомо-инактивирующих белков, токсинов, встречающихся в бактериях и растениях.
Чрезвычайно токсичен, ингибирует синтез белков и ДНК посредством гидролиза нуклеотидов, поражает органы ЖКТ, сильнейший гематический токсин, вызывает обширные тромбозы и гемостаз в печени и почках млекопитающих[86]. ЛД50 = 3,3 мг/кг (мыши, перорально).
Отравление болесатином возникает при употреблении сырых плодовых тел сатанинского гриба. Симптомы отравления наступают в среднем после 6 часов лантентного периода и включают в себя: диспепсию, тошноту, сильную рвоту, повышение температуры, абдоминальную боль, острый гастроэнтерит, геморрагический синдром, понос с кровью, возможно возникновение гепатита с тромботическим поражением сосудов печени и почечной недостаточностью[87][88][89][90].
Гиромитрин[править | править код]


Гиромитрин (N'-этилиден-N-метилформогидразид) — азотсодержащее органическое вещество, производное гидразина, обладает высокой токсичностью и канцерогенностью. Найден в плодовых телах сумчатых грибов рода Строчок (Gyromitra). Гиромитрин нестабилен и легко гидролизуется до чрезвычайно токсичного соединения монометилгидразина. Монометилгидразин (ММН) действует на центральную нервную систему, вызывает гемолиз эритроцитов и нарушает обмен витамина В6. Отравление приводит к тошноте, спазмам желудка и диарее, в то время как тяжёлое отравление может привести к судорогам, желтухе или даже коме или смерти. Было показано, что воздействие монометилгидразина является канцерогенным для мелких млекопитающих. Токсичность гиромитрина сильно варьируется в зависимости от исследуемых видов животных. Средняя летальная доза (LD50) составляет 244 мг/кг для мышей, 50-70 мг/кг для кроликов и 30-50 мг/кг для людей[93]. Токсичность в значительной степени обусловлена образующихся в результате гидролиза молекул ММН; около 35 % проглоченного гиромитрина превращается в MMH. На основании этого преобразования было оценено, что ЛД50 ММН для человека составляет 1,6-4,8 мг/кг (дети) и 4,8-8 мг/кг (взрослые)[93].
Меры предосторожности[править | править код]

Отравления грибами часто возникают ввиду неправильного сбора смертельно ядовитых грибов, приняв последние за съедобные. Наибольшую опасность представляет бледная поганка, её плодовые тела могут накапливать высокие дозы смеси чрезвычайно токсичных соединений (аматоксины и фаллотоксины), которые не разрушаются при термической обработке, интересной особенностью плодовых тел этого гриба является приятный вкус. Помимо этого манифестация отравления (первые симптомы) наступает после продолжительного латентного периода, что приводит к серьёзным последствиям с высокой долей вероятности летального исхода, особенно опасно данное отравление для детей.
Во избежание интоксикаций ядовитыми грибами ни в коем случае не рекомендуется сбор плодовых тел неизвестных видов грибов, осуществление сбора проводить только с опытными грибниками.
Фитотоксины[править | править код]

Фитотоксины (от др.-греч. φυτόν — «растение» и τοξικός — «яд», «ядовитый») — токсины, которые образуются и продуцируются растениями. Обычно такие растения принято называть ядовитыми[95]. Являясь продуктами метаболизма растений, фитотоксины порой выполняют защитные функции, отпугивая от них потенциальных консументов (защищают от поедания). Фитотоксины включают большую группу разнообразных органических соединений, как низко-, так и высокомолекулярные: непротеиногенные аминокислоты, гликозиды, алкалоиды, стероиды, изопреноиды, фенольные соединения, лектины, и т. д. Но наиболее встречаемыми и разнообразными по структуре считают алкалоиды.
Фитотоксины проявляют свойства биологических контаминантов.
Все фитотоксины в какой-то степени представляют опасность для здоровья и жизни человека.
Алкалоиды[править | править код]
Алкалоиды — весьма обширный класс азотсодержащих органических соединений, оказывающих самое различное действие на организм человека. Это и сильнейшие яды, и полезные лекарственные средства (обладают сильными физиологическими воздействиями)[96].
- Некоторые алкалоиды
- Атропин — алкалоид тропанового ряда, впервые обнаружен в ягодах Красавки обыкновенной или белладонны (от лат. Atrópa belladónna), также встречается в разных частях белены (Hyoscyamus niger) и некоторых видах дурмана (Datura stramonium). Является неселективным мускариновым холиноблокатором (холинолитик), блокирует м-холинорецепторы постганглионарных парасимпатических нервов, делая их нечувствительными к ацетилхолину. Такое воздействие приводит к мидриазу (расширение зрачка), атропин снижает слюновыделение (сухость во рту), происходит ослабление тонуса гладких мышц внутренних органов, например — броноходилатация (расширение просвета бронхов). Он усиливает сердцебиение (тахикардия) и вентиляцию лёгких, вызывает покраснение кожи лица (т.н. румянец), возбуждает ЦНС (возможны бред, галлюцинации, при сильном отравлении возможны психозы), данные свойства белладоны широко использовали богатые итальянские дамы. Опасным проявлением отравления является паралич дыхания, следствием которого является летальный исход. Отравление происходит при поедании или втирании ягод белладоны. ЛД50 = 300-400 мг/кг.
- Структурная формула кониина — алкалоида, производного пиперидина. Встречается в листьях, плодах и корнях растения рода болиголов (Conīum). Очень токсичен, LD50 = 1 мг/кг (перорально). Отравление наступает быстро, так как он легко проникает через органы ЖКТ в кровь. Кониин обладает сильным нейротропным воздействием, сначала поражает двигательные и чувствительные нервные окончания, далее, затрагивая нервы и органы ЦНС, вызывает так называемый «восходящий паралич». Отравление кониином возможно при ошибочном сборе ядовитых частей болиголова, приняв их за съедобные (например, корни сходны с корневищем хрена, листья очень похожи на листья петрушки, а плоды могут быть неправильно применены как плоды аниса).
- Стрихнин — алкалоид индолового ряда, впервые обнаружен и выделен из рвотных орешков — семян растения чилибу́хи (Strychnos nux-vomica). Чрезвычайно токсичное вещество, нейротоксичной природы, является антагонистом глициновых рецепторов ЦНС. При отравлении симптоматическая картина напоминает столбняк: происходит возбуждение ЦНС, risus sardonicus, возможны генерализованные судороги мышц — тетания, дыхательный паралич и смерть от остановки дыхания или асфиксии[97]. LD50 ~ 1 мг/кг.
Гликозиды[править | править код]
Гликозиды — представляют собой органические соединения, состоящих из двух компонентов — одного или более углеводного остатка (молекул пиранозного или фуранозного цикла) и неуглеводного компонента или агликона. Гликозиды разнообразны по строению и образуют довольно обширную группу производных углеводов. Многие растительные гликозиды ядовиты, обладают высокой биологической активностью, особенно на миокард сердца, поэтому некоторые из них, например, ландыша, наперстянки или строфанта (Strophanthus kombe) используют в качестве лекарственных препаратов в очень низких концентрациях (так называемая группа сердечных гликозидов)[98].
Цианогенные гликозиды[править | править код]

Цианогенные гликозиды — это гликозиды некоторых цианогенных альдегидов и кетонов, которые при ферментативном или кислотном гидролизе выделяют очень ядовитую синильную кислоту HCN, вызывающую общетоксическое и поражение нервной системы.
Из представителей цианогенных гликозидов целесообразно отметить линамарин, содержащийся в белой фасоли, льне и маниоке, и амигдалин, который обнаружен в косточках некоторых растений семейства розовых (Rosaceae) — миндаля (до 8 %), персиков, слив, абрикос (от 4 до 6 %).
Амигдалин представляет собой сочетание дисахарида генциобиозы и агликона, включающего остаток синильной кислоты и бензальдегида.
Линамарин является гликозидом ацетонциангидрина, в качестве углеводной части выступает молекула глюкозы.
Лектины[править | править код]

Лектины — группа веществ гликопротеидной природы с молекулярной массой от 60 до 120 тысяч дальтон. Они широко распространены в семенах и других частях растений. Лектины обнаружены в бобовых, арахисе, проростках растений, а также в икре рыб.
Лектины обладают способностью: повышать проницаемость стенок кишечника для чужеродных веществ; нарушать всасывание нутриентов; вызывать агглютинацию (склеивание) эритроцитов крови. С этим связано их негативное действие при высоких концентрациях. Некоторые лектины чрезвычайно токсичны, например, лектин из семян клещевины (Ricinus communis) — рицин[100], а также лектины некоторых животных и микроорганизмов, в частности холерный токсин.
Непротеиногенные аминокислоты[править | править код]
Некоторые непротеиногенные аминокислоты являются токсичными, из-за их способности к имитации структур протеиногенных аминокислот, такие, как тиализин. Другие же подобны структурам аминокислотам-нейромедиаторам, они обладают нейротоксичностью, например, квискваловая кислота, канаванин и азетидин-2-карбоновая кислота[101].
- Азетидин-2-карбоновая кислота (сокр. Aze) — непротеиногенная аминокислота, структурный аналог и антагонист пролина. Обладает токсичностью, ошибочно встраивается в белки организма. Неправильное включение Aze в человеческие белки может изменить структуру коллагена, кератина, гемоглобина и фолдинг белков[102]. Обнаружен в ландыше майском (Convallaria majalis) и спарже, также встречается во многих растениях семейства бобовых (Fabaceae), в небольших количествах обнаруживается в столовой и сахарной свекле[103].
- Гипоглицин A — непротеиногенная аминокислота, фитотоксин, содержится в незрелых плодах и семенах Аки (Blighia sapida) и личи (Litchi chinensis)[104]. Высокотоксичен, вызывает специфическое заболевание «Ямайскую рвотную болезнь», сопровождаемое сильнейшей интоксикацией и гипогликемией[105].
Канаванин[править | править код]
Канаванин — непротеиногенная аминокислота, структурный аналог аргинина. Обнаружен в некоторых растениях семейства бобовых (например, в семенах и ростках люцерны), при употреблении в больших количествах у человека может вызвать симптомы системной красной волчанки[106].
Механизм токсичности канаванина заключается в том, что организмы, потребляющие его, обычно по ошибке включают его в свои собственные белки вместо L-аргинина (у животных и человека аминоацил-тРНК-синтетазы не обладают высокой специфичностью к L-аргинину, в отличие от растений), тем самым синтезируются структурно аберрантные («неправильные») белки, которые не могут функционировать должным образом.
Меры предосторожности[править | править код]

Ядовитые растения часто путают с неядовитыми, ввиду морфологических сходств некоторых частей. Особенно часто сходства наблюдаются в строении побегов, цветков или плодов. Неопытные сборщики могут легко перепутать несъедобные и ядовитые растения с лекарственными и используемых в пищу, и тем самым подвергнут своё или здоровье близких риску отравления или даже смерти. Например, ягоды очень ядовитого и смертельно опасного вороньего глаза имеют большое сходство с ягодами черники. Часто плоды ядовитых растений имеют прекрасный запах и вполне съедобный вид, однако, такая обманчивость может быть очень опасной, как, например, с плодами манцинеллового дерева[107] или ягодами клещевины. Поэтому не следует собирать ягоды, плоды, семена или другие части растений, для использования в гастрономических целях, если они неизвестны и встречаются впервые.
Некоторые ядовитые растения[править | править код]
В галереи представлены те растения или их части, которые могут быть ошибочно использованы в гастрономических целях.
- Ядовитые растения
- Иллюстрация Нарцисса поэтического (Narcissus poeticus), ядовитого растения из семейства амариллисовых. Особенно ядовитыми частями растения являются луковицы, содержащие фитотоксин — алкалоид нарциссин. Луковицы нарцисса имеют большое сходство с луком-пореем случайное употребление приводит к нарушениям со стороны ЖКТ (диспепсию, рвоту, абдоминальную боль диарею), неврологические симптомы, включая тетанию, судороги и паралич, при употреблении большего количества луковиц возможен летальный исход.
- Вороний глаз четырёхлистный (Pāris quadrifōlia) — смертельно ядовитое растение из семейства Мелантиевые. Опасность растения представляют плоды (содержат сильно ядовитый гликозид паридин и сапонин паристифин), похожие на ягоды черники или голубики, приняв их за съедобные происходит сильнейшее отравление, особенно им подвержены дети. Паридин обладает ярко выраженной кардиотоксичностью, подобно конваллятоксину действует на миокард сердца. Симптомы отравления: боли в животе, диарея, рвота, приступы головокружения, судороги, нарушение работы сердца вплоть до его остановки.
- Болиголов пятнистый (Conīum maculātum) очень ядовитое растение из семейства Зонтичных. Болиголов содержит в листьях, корнях и плодах чрезвычайно токсичное вещество, нейротоксин — кониин. Отравление болиголовом происходит при неправильном сборе его частей, приняв последние за съедобные, например, листья похожи на листья петрушки, а плоды на анисовые семена. Картина отравления сходна с воздействием яда кураре или никотина. Основные симптомы отравления: тошнота, слюнотечение, головокружение, нарушение глотания, речи, побледнение кожи. Начальное возбуждение сопровождается судорогами и переходит в угнетение ЦНС. Характерным является так называемый восходящий паралич, начинающийся с нижних конечностей, сопровождающийся потерей кожной чувствительности. Зрачки расширены, на свет не реагируют. Нарастающее удушье может привести к остановке дыхания.
- Зрелые ягоды волчеягодника обыкновенного (Dáphne mezéreum) содержат в себе большое количество фитотоксинов, включая гликозид дафнин (является антивитамином К, вызывает геморрагии и снижает свёртываемость крови) и мезереин (ирритант, сильно раздражает кожу и слизистые оболочки)[108]. Поедание ягод волчеягодника в количестве более 3 г (в среднем 6-10 ягод) смертельно опасно.
- Нераскрывшийся плод Аки (Blighia sapida) содержит непротеиногенную аминокислоту гипоглицин[109] — высокотоксичное вещество, которое может привести к сильному отравлению, сопровождаемой упорной рвотой и гипогликемией, к так называемой «Ямайской рвотной болезни».
- Клещевина обыкновенная (Ricinus communis), красивое декоративное растение, однако, её семена содержат сильнейший белковый фитотоксин — рицин. При поедании семян возникает сильнейшая интоксикация с гемолитическим и геморрагическим синдромом, поражается кишечник и сосуды (нарушается целостность стенок, образуются тромбы, снижается кровоток итд.), как следствие гемолитическая анемия, угнетается деятельность ЦНС, возникает тотальное падение артериального давления, летальный исход происходит почти в 100% случаев интоксикаций. Сырьё или жмых, контаминированный рицином также смертельно опасен и для домашних животных (крупный и мелкий рогатый скот, лошади).
Зоотоксины и токсины морских беспозвоночных[править | править код]
Зоотоксины от (др.-греч. ζῷον — «животное», «живое существо» и τοξικός — «ядовитый») — токсины, продуцируемые животными, в частности позвоночными (рыбы, земноводные, рептилии, птицы, млекопитающие), такие животные являются ядовитыми по аналогии с растениями. Токсины морских беспозвоночных рассматриваются обычно отдельно. Среди зоотоксинов, наиболее часто встречаемые контаминанты это токсины рыб.
Нейротоксины моллюсков[править | править код]

Отравление нейротоксичными моллюсками связано с употреблением в пищу мидий, устриц, морских гребешков или сердцевидок. Двустворчатые моллюски становятся ядовитыми после питания определёнными динофлагеллятами или цианобактериями. Парализующим токсином моллюска (PSP) является сакситоксин.
Действие сакситоксина проявляется у людей в виде сердечно-сосудистого коллапса и паралича дыхания. Он блокирует распространение нервных импульсов без деполяризации, и нет никакого известного противоядия. Он устойчив к высокой температуре, растворим в воде, не разрушается при варке. Он может быть разрушен кипячением в течение 3-4 ч при pH 3,0.
Признаки синдрома PSP развиваются в течение 2 ч после приема пищи ядовитых моллюсков, они характеризуются парестезией (покалывание, нечувствительность или жжение), которая начинается со рта, губ и языка, которая позднее распространяется по лицу, голове и шее к кончикам пальцев руки ног. Смертность по разным данным колеблется от 1 до 22 %.
Тетродотоксин[править | править код]

Тетродотоксин представляет собой органическое вещество, небелковый токсин с сильнейшим нервно-паралитическим действием, плохо растворим в воде, хорошо в неполярных органических растворителях. Впервые был обнаружен и выделен в 1909 году японским химиком Ёшизуми Тахара[110] из печени бурой собаки-рыбы (Takifugu rubripes), входящей в отряд четырёхзубообразные (Tetraodontiformes), откуда и происходит название токсина. Смертельная доза для человека составляет менее чем 0,1 мг. Токсин накапливается главным образом в печени, яичниках и икре рыб семейства иглобрюхие, включая и смертоносную собаку-рыбу. Исследования показали, что иглобрюхи не способны вырабатывать нейротоксин, а лишь аккумулируют его в своём организме. Изначально тетродотоксин вырабатывается морскими бактериями, которые затем поедаются разнообразными живыми организмами.
Токсическое воздействие[править | править код]

Тетродотоксин относится к сильнейшим природным нейротоксинам. Его действие обусловлено воздействием на натриевые каналы нейронов, ингибируя их путём изменения структуры (не позволяет проникать ионам натрия внутрь клеток), токсин делает процесс передачи нервного импульса по нервным волокнам невозможным, что приводит к параличу мышц[111]. Токсин легко всасывается в кишечнике в кровь, проникает через практически любые тканевые барьеры, во все внутренние органы, включая головной мозг, может накапливаться в сердце и почках.
Картина отравления сходна с сакситоксином. Сначала развивается онемение, зуд языка, нёба, губ, возникают боли в животе, тошнота, рвота, понос, затем происходит тремор и угнетение мышечного движения, дисфагия, афония и потеря сознания, смерть возникает в результате дыхательной недостаточности, вызванной параличом мышц участвующих в дыхании и поражении блуждающего нерва (n.vagus). Противоядия не существует. Активный антагонист более токсичный батрахотоксин, использовать которого не является целесообразным (минимальная летальная составляет порядка 20 мкг). Лечение при отравлении только симптоматическое, единственная возможность спасти отравившегося человека состоит в искусственном поддержании работы дыхательной и кровеносной систем до тех пор, пока не закончится действие яда. Минимальные концентрации токсина, вызывающие токсические эффекты составляют порядка 0,01-0,02 мг.
Меры предосторожности[править | править код]

Мясо иглобрюхов в Японии и странах Юго-Восточной Азии считается деликатесным, знаменитое блюдо фугу, приготавливают именно из них, особенно вкусным получается из мяса бурого скалозуба. Но несмотря на все необходимые меры безопасности приготовления этого экзотического блюда с эффектом онемения губ и языка, каждый год в Японии регистрируют несколько десятков отравлений. В странах Юго-Восточной Азии (особенно в Таиланде) количество отравлений намного больше (до нескольких сотен) учитывая, что в большинстве случаев рыбы вылавливаются и приготавливаются без должных мер безопасности, имеется высокий риск смертельного отравления. Вследствие этого не рекомендуется приобретать мясо фугу на рыбных рынках.
- Тарелка с fugu sashimi
- Fugu no Shirako
- Fugu no ransou nukazuke, Яичники иглобрюха, маринованные в пасте из рисовых отрубей.
Сигуатоксин и сигуатера[править | править код]

Сигуатера (или чигуатера) — является острым отравлением, которое вызывается самыми различными тропическими морскими рифовыми или прибрежными рыбами, в телах которых накапливается токсин, выделяемый динофлагеллятами вида Gambierdiscus toxicus (сигуатоксин). Установлено, что это заболевание могут вызывать рыбы более 300 видов. Очевидно, любая морская рыба при соответствующих обстоятельствах может содержать такой яд, так как обычно рыб всех этих видов едят и считают вполне съедобными. Полагают, что эти рыбы становятся ядовитыми, когда поедают ядовитую пищу, как говорилось выше[112].
Сигуатера является серьёзной проблемой в некоторых районах, вроде центральной и южной частей Тихого океана и Вест-Индии. К сожалению, её нельзя предвидеть, и потому с ней чрезвычайно трудно бороться. Известно, что рыбы внезапно становились несъедобными[112].
Механизм токсического воздействия и клинические проявления[править | править код]

Сигуатоксин — сложное органическое вещество, относится к так называемым полициклическим полиэфирам, является сильным нейротоксином, обладает липофильностью, проходит через ГЭБ, тем самым, легко воздействует на органы ЦНС и процессы передачи нервных импульсов. Попавший в организм токсин селективно нарушает функцию натриевых каналов в мембранах нервных и мышечных клеток, влияет на передачу сигнала в синапсах. К сигуатоксину наиболее чувствительны теплокровные животные и человек. Существует несколько представителей сигуатоксина. ЛД50 для сигуатоксина CTX1B составляет 0,25 мкг/кг (мыши, внутрибрюшинно)[113].
Манифестация сигуатеры происходит в течение 1-6 часов. При отравлении рыбой, содержащий сигуатоксин наблюдаются следующие симптомы: со стороны желудочно-кишечного тракта, такие как боли в животе, рвота, диарея, но могут быть и неврологические расстройства, в том числе онемение языка и губ, зуд, светобоязнь, металлический вкус во рту, замена ощущений тепла и холода на противоположные. Однако в редких случаях могут иметь место нарушения со стороны дыхательной и сердечно-сосудистой систем, которые могут привести к смерти.
Лечение только симптоматическое, антидота нет. Несмотря на отсутствие антитода, летальность при таких отравлениях рыбой относительно низка, умирает ~ 7 % отравившихся. Если пострадавший выживет, выздоровление идёт чрезвычайно медленно. При сильном отравлении для полного выздоровления может потребоваться много месяцев или даже лет[112].
Меры предосторожности[править | править код]

Ядовитую рыбу нельзя распознать по внешнему виду. Кроме того, нет простого химического способа обнаружения яда[112]. Наиболее надёжный метод — приготовление тканевых вытяжек, которые впрыскивают в брюшную полость мышам, или скармливание внутренностей и мяса кошкам и собакам; потом следят, не появятся ли у этих животных симптомы интоксикации. Никогда не следует есть внутренностей (печень и кишечник) тропических морских рыб. Икра и молоки большинства морских рыб тоже потенциально опасны, и в некоторых случаях могут стать причиной быстрой смерти. Рыб, которые необычно толсты для своих размеров, надо есть с осторожностью. Это особенно относится к барракуде (Sphyraena), каранксам (Caranx) и груперам (Epinephelus) в период их размножения. Если человек голодает и вынужден есть рыбу, в доброкачественности которой не уверен, рекомендуется нарезать рыбу тонкими ломтиками и вымачивать в пресной или солёной воде не менее 30 минут, несколько раз меняя воду. Не варите рыбу в той воде, в которой её промывали. Яд немного растворим в воде и при промывке отчасти вымывается. Если сомнительную рыбу варят, воду следует вылить. Надо подчеркнуть, что при обычных способах приготовления пищи сигуатоксин не разрушается (термостабилен)[114], а лишь незначительно ослабляется. Мнение местных жителей о съедобности тропических морских рыб часто бывает противоречивым и ошибочным, особенно если они живут в этой местности недавно. Не забывайте, что рыба, съедобная в одном районе, может оказаться смертельно ядовитой в другом[112].
Скумбриевое отравление или отравление, вызванное гистамином[править | править код]

Данная интоксикация, вызванная потреблением рыбы или рыбопродуктов семейства скумбриевых, содержащих высокие уровни гистамина, часто упоминается как «скумбриевое отравление» или «скомброид»[13]. Среди скумбриевых рыб — тунец, макрель, скумбрия и другие. В одном сообщении гистаминовое отравление было связано с рыбой парусником, не относящейся к скумбриевым рыбам. В отличие от многих видов пищевых отравлений, скумбриевое отравление не вызывается попаданием в организм возбудителя[115].
Гистамин образуется в результате бактериального декарбоксилирования (ферментативный процесс) большого количества аминокислоты гистидина в мышцах этой группы рыб.

Достаточные уровни гистамина могут быть образованы в продукте с хорошей органолептикой, так что в итоге «скумбриевое отравление» может быть вызвано как свежей, так и испорченной рыбой.

Бактериями, чаще всего связанными с этим синдромом, являются Morganella spp., особенно M. morganii, у которых все штаммы образуют гистамин в количествах > 5000 ppm. Среди других бактерий, у которых обнаружены гистидиндекарбоксилазы (шифр КФ 4.1.1.22), Raoulella planticola и R. ornithinolytica, Hafnia alvei, Citrobacter freundii, Clostridium perfringens, Enterobacter aerogenes, Vibrio alginolyicus и Proteus spp. Выделенный штамм Morganella morganii из альбакора, хранившегося с нарушением температурного режима, образовал 5253 ppm гистамина в вытяжке из тунца при 25 °C и 2769 ppm при 15 °C. Роста микроорганизма и образования гистамина не наблюдалось при 4 °C. P. phosphoreum образует гистамин при температурах ниже 10 °C.
Образованию гистамина способствует низкий показатель pH, но чаще это происходит, когда продукты хранятся при температуре, превышающей температуры холодильника. Самая низкая температура для образования существенных уровней была 30 °C для H. alvei, C. freundii и E. coli и 15 °C для двух штаммов M. morganii. Синдром связали с употреблением свежей или приготовленной рыбы определённого типа; симптомы проявляются от нескольких минут до 3 ч после приёма токсичной пищи, в большинстве случаев они проявляются в течение 1 ч. Типичные симптомы заключаются в приливе крови к лицу и шее, сопровождаемом интенсивным повышением температуры, общим дискомфортом и диареей. Часто за ними появляется сыпь на лице и шее. Прилив крови сопровождается интенсивной пульсирующей головной болью, приводящей к непрерывной тупой боли. Другие симптомы включают головокружение, зуд, слабость, жжение рта и горла и неспособность глотать. Минимальный уровень гистамина, способный вызвать эти симптомы, равен 100 мг/дл. Большое число M. morganii в рыбе, относящейся к видам, способным вызывать этот синдром и содержащей гистамин на уровне больше, чем 10 мг/дл, считают существенными в зависимости от качества продукта.
Первые 50 инцидентов в Великобритании произошли между 1976 и 1979 гг., 19 произошли в 1979 г. Консервированная и копчёная макрель были самыми распространёнными рыбами, вызвавшими интоксикацию, наряду с бонитой, килькой и сардинами. Самым частым симптомом среди 196 случаев была диарея.
Меры предосторожности[править | править код]

Чтобы избежать отравления высокими концентрациями гистамина скумбриевых рыб, их необходимо хранить при температурах ниже 0 °C. Свежепойманную рыбу лучше употреблять сразу[112]. В большинстве случаев скумбриевые отравления возникают, если рыба хранилась при температурах выше 5 °С, замороженная рыба с соблюдением всех требований пищевой безопасности, пригодна к употреблению в течение нескольких недель после отлова. Если рыба имеет неприятный запах, после долгого хранения (более месяца) и процесса разморозки, то лучше отказаться от её употребления, однако, даже при отсутствии запахов не исключается интоксикация. Термическая обработка не уменьшает количества гистамина в контаминированной рыбе[13]. Лица, с непереносимостью, бронхиальной астмой и/или аллергией на скумбриевых рыб и рыбную продукцию, имеют высокие риски к возникновению тяжёлой формы интоксикации.
Самостоятельное лечение скумбриевоего отравления проводится только при лёгкой форме, сопровождаемой симптомами схожих с аллергической реакцией (жжением, зудом, покраснением лица, ангионевротическим отёком). При более тяжёлом протекании отравления, когда наблюдаются гипертермия, тахикардия, падение артериального давления (гипотония), бронхоспазм и анафилаксия — немедленно обратиться за медицинской помощью!
Простейшие как контаминанты пищевых продуктов[править | править код]
Токсоплазма и токсоплазмоз[править | править код]
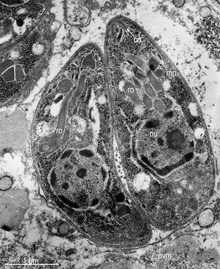
Токсоплазмоз. Эта болезнь вызывается токсоплазмой Toxoplasma gondii, кокцидиозным простейшим, которое является облигатным внутриклеточным паразитом. Родовое название основывается на характерной форме амёбной стадии простейшего (от греч. τόξο — токсо, «дуга»). Впервые он был выделен в 1908 г. от африканского грызуна гонди, откуда и пошло его видовое название. В большинстве случаев попадание ооцист T. gondii в организм человека алиментарным путём не вызывает характерных симптомов, или инфекция является самоизлечивающейся. В этих случаях простейшее инцистируется и становится латентным. Однако когда иммунокомпетентный статус ослаблен, опасный для жизни токсоплазмоз проявляется в результате обострения латентной инфекции. Домашние и дикие кошки — единственные окончательные хозяева (носители) кишечной или половой фазы этого организма, что делает их первичными источниками токсоплазмоза человека. Обычно болезнь передается от кошки к кошке, но фактически все позвоночные животные восприимчивы к ооцистам, распространяющимся кошками. Доза в 100 ооцист может вызвать клинический токсоплазмоз у человека, и ооцисты могут оставаться жизнеспособными более года в тёплой сырой окружающей среде[117]. Свиньи — главный источник токсоплазмоза среди животной пищи для человека.
Токсоплазмоз у людей может быть предотвращён, если избегать экологического загрязнения кошачьими фекалиями из окружающей среды (из кошачьих туалетов, например) и потреблять мясо и мясные продукты, которые не содержат жизнеспособных цист. Цисты T. gondii могут быть разрушены термообработкой мяса выше 60 °C или облучением на уровне 300 Гр или выше. Паразит может быть инактивирован замораживанием, но так как результаты являются переменными, замораживание не гарантирует инактивации ооцисты.
Дизентерийная амёба и амёбиаз[править | править код]

Entamoeba histolytica внедряется внутрь при проглатывании цист, которые передаются в основном фекально-оральным путём[118] через контаминированную пищу и воду. Резервуара среди животных не существует. Проглоченные внутрь цисты дифференцируются в трофозоиты (бесполая вегетативная стадия и/или форма) в подвздошной кишке, но, как правило, колонизируют слепую и толстую кишки. Организм необычен тем, что является анаэробным, и трофозоиты не имеют митохондрий. Это — аэротолерантный анаэроб, которому необходима глюкоза или галактоза в качестве главного дыхательного субстрата[119]. Трофозоиты E. histolytica имеют размер в диапазоне от 10 до 60 мкм, тогда как размеры шаровидных цист обычно составляют от 10 до 20 мкм. Трофозоиты подвижны, а цисты — нет. Хотя трофозоиты не выживают в условиях окружающей среды, инцистированные формы могут сохранить жизнеспособность целых 3 месяца в осадке сточных вод[120].
Трофозоиты внедряются в эпителий толстой кишки и выделяют ферменты, вызывающие локальный некроз. В этом участке развивается небольшой очаг воспаления. Когда поражение достигает мышечного слоя, образуются типичные колбообразные язвы, которые могут разрушать кишечный эпителий на большом протяжении. Поражение подслизистого слоя приводит к инвазии трофозоитов в кровь через систему портальной вены. Наиболее часто поражается печень, где в абсцессах обнаруживают трофозоитные формы. Миграция трофозоитов в другие органы (наиболее часто в брюшную полость, лёгкие или головной мозг) и ткани нередко вызывают перитонит[121], плеврит и энцефалиты. Особенно опасны энцефалиты, которые могут привести к летальному исходу.
Острый кишечный амёбиаз протекает как дизентерия[121](то есть диарея с примесями крови и слизи). Сопровождается дискомфортом в нижней части живота (абдоминальная боль), метеоризмом и болезненными позывами на дефекацию. При хроническом амёбиазе симптомы слабо выражены. Наблюдаются редкие случаи диареи, потеря веса и утомляемость. Примерно у 90 % пациентов инфекции проходят бессимптомно[118] , но они могут быть носителями, в фекалиях содержатся цисты, которые могут быть переданы другим людям. Человек с этой болезнью может передавать до 4,5 × 107 цист каждый день. У некоторых пациентов в слепой кишке или ректосигмоидной области толстой кишки образуются гранулематозные поражения, называемые амёбной гранулёмой. Эти поражения могут напоминать аденокарциному толстой кишки, но их необходимо чётко различать. Считается, что 10 % населения в мире заражены E. histolytica и что каждый год происходят до 100 млн случаев амёбного колита или абсцессов печени.
С целью профилактики необходимо избегать употребления загрязнённых фекальными массами воды и пищи и соблюдать правила личной гигиены, в первую очередь мыть руки. Очистка муниципального водоснабжения, как правило, достаточно эффективна, но, тем не менее, вспышки амёбиаза у городских жителей всё ещё происходят в случаях сильного загрязнения. Использование нечистот (человеческих фекалий) в качестве удобрения почвы должно быть запрещено. В районах эндемичных инфекций овощи необходимо подвергать термической обработке.
Химические контаминанты[править | править код]


К химическим или антропогенным контаминантам относят разнообразные химические соединения или их смеси, чужеродного происхождения (являются результатом деятельности человека — ксенобиотиками), обладающие высокой биологической активностью, присутствие которых в пищевых продуктах может серьёзно ухудшить здоровье или даже привести к смерти людей. Подразделяются на две группы: неорганические и органические (составляют большую часть). Примером таких соединений являются метанол, аммиак, формальдегид, неорганические соединения мышьяка, соединения бериллия, некоторые соединения тяжёлых металлов (бария, кадмия, сурьмы, меди, свинца, таллия, ртути итд.), поверхностно-активные вещества (моющие средства или детергенты), пестициды (например, хлорорганические: группы альдрина, гексахлоран, ДДТ; паракват; фосфорорганические: фосдрин, ДФФ, тиофос и др.) и минеральные удобрения (основу, которых составляют нитраты), нефтепродукты (топливо, синтетические масла, бензол и ряд его производных, и другие ароматические соединения), органические растворители, фенолы и их производные (в частности, фенолформальдегидные смолы), эпоксид этилена, пластмассы и некоторые полимеры (ПВХ, поливинилиденхлорид и т. д.), искусственные пищевые и непищевые красители, лаки и краски, продукты сгорания биомассы, диоксины и диоксинподобные соединения, канцерогены антропогенного происхождения (полициклические ароматические углеводороды — бензпирен, бензантрацен, ДМБА, ароматические амины и др.) и многие другие.
- Некоторые химические контаминанты
- Бензпирен, широко распространённый полициклический ароматический углеводород, канцероген, мутаген. Образуется в результате процессов риформинга, происходящих при сжигании бытовых отходов, нефтепродуктов, табачного дыма, выхлопных газов, а также при термической обработке мяса[122][123].
- Диметилртуть — ртутьорганическое соединение, чрезвычайно токсична[124], обладает биоаккумуляцией в морских животных, но особенно в рыбе, вызывает тяжёлое поражение ЦНС — болезнь Минамата.
- Ацетат свинца (II), также известный, как «свинцовый сахар» (сладкий свинец). Кристаллическое вещество, напоминающее по виду кристаллы сахарозы, сладкое на вкус, с металлическим привкусом (сладость достигает 1,2 по относительной шкале сладости), хорошо растворяется в воде. Известен с древнейших времён, использовался в качестве подсластителя (так называемый дефрутум) в древнем Риме. В средние века использовался в качестве отравляющего вещества (из-за своего вкуса). Высокотоксичен, обладает нейротропным воздействием, смертельная доза для человека составляет менее 3500 мг (в пересчёте на свинец).
- Пентахлорфенол — гербицид и десикант. Высокотоксичный. Обладает политропным воздействием на организм человека, в первую очередь поражает нервную систему и клетки миелоидной ткани. Сильный ирритант, при попадании на открытые участки кожи вызывает ожоги и поражения кожи, сходные с хлоракне. ЛД100 для человека составляет 1,5-1,7 г.
- Эндрин — хлорорганическое соединение с необычайно сильным инсектицидным действием, а также чрезвычайно токсичное вещество, вызывает сильнейшую интоксикацию, поражение печени и в особенности ЦНС[125].
- Бензол — простейший ароматический углеводород, один из самых распространённых ксенобиотиков. Токсичен, сильный канцероген, обладает мутагенными свойствами, миелотоксичен (поражает красный костный мозг)[126][127].
- Метанол — одноатомный спирт, сильный яд, вызывающий поражение зрения (дегенерацию зрительного нерва) в небольших дозах (5-15 мл), в больших кому и летальный исход (30-50 мл)[128][129].
- Нитрат натрия, вместе с нитратами калия и аммония, являются наиболее используемыми азотными удобрениями в сельском хозяйстве. Поступают в организм человека с овощами и в меньшей степени с фруктами и ягодами, которые накапливают нитраты в своих плодах. Овощи (особенно корнеплоды), содержащие большие количества нитрата натрия или других нитратов, вследствие окисления в организме человека, которое происходит под действием фермента бактерий кишечной микрофлоры — нитратредуктазы, до более токсичных нитритов, вызывают серьёзные расстройства и нарушения работы со стороны органов ЖКТ, а также метгемоглобинемию со стороны системы крови[130].
- 2,3,7,8-Тетрахлородибензодиоксин, сокр. ТХДД — органическое бифункциональное соединение (хлорорганический циклический эфир), представитель полихлорированных дибензодиоксинов (ПХДД), чрезвычайно токсичен, одно из самых токсичных веществ антропогенного происхождения (ЛД50 = 0,5 мкг/кг морская свинка (перорально)). Сильный мутаген, доказанный канцероген[131][страница не указана 224 дня], обладает ярко выраженным тератогенным воздействием, снижает деятельность эндокринной и репродуктивной системы.
Тяжёлые металлы, мышьяк и их соединения[править | править код]
В так называемую группу тяжёлых металлов входят металлы с плотностью более 8 г/см3 (в некоторых источниках более 5 г/см3 или 3,5 г/см3[132][133]) и атомной массой более 40 а. е. м.. Однако с точки зрения медицины и экотоксикологии тяжёлыми металлами считаются те металлы, которые обладают высокой биологической активностью, в частности, токсичностью и способностью внедрения в пищевые цепи. К таким металлам относятся:
- Свинец
- Кадмий
- Ртуть
- Таллий
- Сурьма
- Барий
- Медь
- Хром
- Никель
- Цинк и их соединения.
Помимо данных элементов в группу входят: Мышьяк, Бериллий и Алюминий. Два последних элемента по плотности и атомной массе нельзя отнести к тяжёлым металлам, однако, бериллий является сильным канцерогеном (категория 1 по списку МАИР[134]), помимо этого, он и особенно его растворимые соединения обладают высокой токсичностью. Алюминий, несмотря на низкую токсичность способен к накоплению в организме до токсичных концентраций (более 0,1 г/кг), образуя нерастворимые и плохо выводимые соединения, например, фосфатные конкременты (камни) в почках. Барий имеет невысокое значение плотности (3,7 г/см3), но имеет высокотоксичные растворимые соединения, которые при контаминации пищевых продуктов вызывают серьёзные интоксикации организма человека.
- Свинец — наиболее распространённый тяжёлый металл.[источник не указан 313 дней] Свинец ядовит[135], а его растворимые (ацетат II) и летучие (тетраэтилсвинец) соединения высокотоксичны и смертельно опасны[136]. Избыток свинца (сатурнизм) даже в небольших дозах, опасен для здоровья и негативно влияет на органы ЖКТ, ЦНС, в частности на кору головного мозга, а также нарушает обмен кальция. Особенно чувствительны к токсичному воздействию дети.
- Ртуть — единственный жидкий тяжёлый металл. Ртуть сильно ядовита, особенно опасны её пары. Все соединения ртути (в большей степени органические) сильные нейротропные яды, некоторые из них до сих пор используются в качестве инсектицидов в сельском хозяйстве (этилмеркурхлорид). При остром отравлении или меркурализме возникает поражение слизистых, глаз, рта, наблюдается высокая температура, тошнота, рвота и так называемая ртутная кайма. Хроническое отравление ртутью или её соединениями приводит к болезни Минамата, которое сопровождается глубоким поражением органов ЦНС, часто заканчивается летально.
- Кадмий и его соединения (особенно растворимые в воде) высокотоксичны. Кадмий нефротоксичен, он отрицательно влияет на обмен кальция[137], цинка, меди и железа в организме человека, избыток кадмия повышает риск возникновения заболеваний со стороны сердечно-сосудистой системы, злокачественных опухолей (канцероген) и остеопороза. Хроническое отравление кадмием приводит к болезни итай-итай.
Ртуть и её соединения[править | править код]

Ртуть — один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в растениях и в организме животных и человека, то есть являющийся ядом кумулятивного действия.
В организм человека ртуть поступает в наибольшей степени с рыбопродуктами, в которых её содержание может многократно превышать ПДК.
Токсичность ртути зависит от вида её соединений, которые по-разному всасываются, метаболизируются и выводятся из организма. Наиболее токсичны алкилртутные соединения с короткой углеродной цепью — метилртуть, этилртуть, диметилртуть. Механизм токсического действия ртути связан с её взаимодействием с сульфгидрильными группами белков (SH-группы). Блокируя их, ртуть изменяет свойства или инактивирует ряд жизненно важных ферментов. Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена, а органические — обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена. Защитным эффектом при воздействии ртути на организм человека обладают цинк и особенно селен. Предполагают, что защитное действие селена обусловлено деметилированием ртути и образованием нетоксичного соединения — селено-ртутного комплекса. Человек получает с суточным рационом около 0,05 мг ртути, что соответствует рекомендациям ФАО/ВОЗ.
Мясо рыбы отличается наибольшей концентрацией ртути и её соединений, поскольку активно аккумулирует их из воды и корма, в который входят различные гидробионты, богатые ртутью. Например, хищные пресноводные рыбы могут содержать от 107 до 509 мкг/кг, нехищные пресноводные рыбы — от 78 до 200 мкг/кг, а океанские нехищные рыбы — от 300 до 600 мкг/кг Hg. Организм рыб способен синтезировать метилртуть, которая накапливается в печени. У некоторых видов рыб в мышцах содержится белок — металлотионеин, который с различными металлами, в том числе и с ртутью, образует комплексные соединения, способствуя тем самым накапливанию ртути в организме и передаче её по пищевым цепям. У таких рыб содержание ртути достигает очень высоких концентраций: рыба-сабля содержит её от 500 до 20 000 мкг/кг, а тихоокеанский марлин — от 5000 до 14 000 мкг/кг. Для других продуктов характерно следующее содержание ртути (в мкг/кг) — в продуктах животноводства: мясо — 6-20, печень — 20-35, почки — 20-70, молоко — 2-12, сливочное масло — 2-5, яйца — 2-15; в съедобных частях сельскохозяйственных растений: овощи — 3-59, фрукты — 10-124, бобовые — 8-16, зерновые — 10-103; в шляпочных грибах — 6-447, в перезрелых — до 2000 мкг/кг, причём, в отличие от растений, в грибах может синтезироваться метилртуть. При варке рыбы и мяса концентрация ртути в них снижается, при аналогичной обработке грибов — остается неизменной. Это различие объясняется тем, что в грибах ртуть связана с аминогруппами азотсодержащих соединений, в рыбе и мясе — с серосодержащими аминокислотами.
Болезнь Минамата[править | править код]
Наиболее печально известные примеры массового отравления ртутью были вызваны именно метилртутью CH3Hg+. В 1953 году в Японии у 121 жителя побережья в бухте Минамата было зафиксировано заболевание, сопровождавшееся ломотой в суставах, нарушением слуха и зрения. Это заболевание, вошедшее в литературу под названием «болезнь Минамата», закончилась смертью для почти трети больных.
В дальнейшем в 1959 году удалось установить, что эта болезнь вызывается употреблением в пищу рыбы, отравленной ртутью в форме хлорида CH3HgCl, сбрасываемого химическим предприятием (Chicco corp.) прямо в воды залива. Концентрация ртути была настолько велика, что рыба погибала; поедавшие эту рыбу птицы падали прямо в море, а отведавшие отравленной пищи кошки передвигались, «кружась и подпрыгивая, зигзагами и коллапсируя». К 1954 году популяция кошек в этих местах заметно снизилась. Однако до 1959 года никаких замеров ртутного загрязнения вод залива в этом районе не проводилось (мониторинг отсутствовал).
Интенсивное расследование позволило установить, что на заводе по производству ацетальдегида и уксусной кислоты из ацетилена (по реакции Кучерова) ртутные отходы (в виде отработанного сульфата ртути HgSO4) сбрасывались в реку, впадающую в бухту Минамата. При этом ртуть, о чём первоначально и не подозревали, микробиологическим путём превращалась в метилртуть, которая через планктон, моллюсков и рыб в конце концов попадала в пищу. В этом цикле ртуть постепенно концентрировалась и в конце пищевой цепи, дойдя до человека, достигала токсической концентрации. Загрязнение в устье канала сточными водами было настолько сильным, что измеренные значения концентраций составили 2 кг ртути на тонну отложений.
Свинец и его соединения[править | править код]


Свинец — один из самых распространённых и опасных экотоксикантов. История его применения очень древняя, что связано с относительной простотой его получения и большой распространённостью в земной коре (1,6·10−3 %). Соединения свинца — Pb3O4 и PbSO4 — основа широко применяемых пигментов: сурика и свинцовых белил. Глазури, которые используются для покрытия керамической посуды, также содержат соединения Pb. Металлический свинец со времён Древнего Рима применяют при прокладке водопроводов. В настоящее время перечень областей его применения очень широк: производство аккумуляторов, электрических кабелей, химическое машиностроение, атомная промышленность, производство эмалей, замазок, лаков, хрусталя, пиротехнических изделий, спичек, пластмасс и т. п. Мировое производство свинца составляет более 11,2 млн тонн в год. В результате производственной деятельности человека в природные воды ежегодно попадает более 1 млн тонн, а в атмосферу в переработанном и мелкодисперсном состоянии выбрасывается около 700 тыс. тонн, подавляющее большинство которого оседает на поверхности Земли.
Токсичность свинца[править | править код]

Механизм токсического действия свинца имеет двойную направленность. Во-первых, блокада функциональных SH-групп белков и, как следствие, инактивация ферментов, во-вторых, проникновение свинца в нервные и мышечные клетки, образование лактата свинца, затем фосфата свинца, которые создают клеточный барьер для проникновения ионов Са2+.
Свинцовая интоксикация может приводить к серьёзным нарушениям здоровья, проявляющимся в частых головных болях, головокружениях, повышенной утомляемости, раздражительности, ухудшении сна, мышечной гипотонии, а в наиболее тяжёлых случаях к параличам и парезам, умственной отсталости. Неполноценное питание, дефицит в рационе кальция, фосфора, железа, пектинов, белков (или повышенное поступление кальциферола) увеличивают усвоение свинца, а следовательно, его токсичность. Среднесмертельная доза свинца составляет 500 мг для взрослого человека, и менее 150 мг для детей.
Свинец в пищевых продуктах[править | править код]
Свинец обнаруживается в питьевой воде и некоторых пищевых продуктах.
Ежедневное поступление свинца в организм человека колеблется от 70 до 400 мкг. Основной источник поступления соединений свинца в организм — пища, преимущественно растительная. Поступление свинца в организм человека с питьевой водой составляет лишь несколько процентов от того количества свинца, которое вводится с пищей и воздухом. Основной источник свинца в воде — сплавы, используемые при соединении водопроводных труб. Имеются доказательства того, что содержание свинца в хлорированной водопроводной воде больше, чем в нехлорированной.
Отравления свинцом иногда носит массовый характер, например, в 2019 году в Бангладеш соединения свинца были добавлены в куркуму, чтобы сделать её более жёлтой[141]. Считается, что это началось в 1980-х и продолжается до сих пор.
Кадмий и его соединения[править | править код]

Кадмий — высокотоксичный металл и микроэлемент, является одним из основных загрязнителей окружающей среды[142]. Кадмий широко применяется в различных отраслях промышленности. Широко используется в ядерной энергетике, электронной и радиотехнической промышленности; а также при производстве аккумуляторов, различных сплавов и красок; кадмий добавляют в пластик (основа ПВХ) в качестве стабилизатора.
В воздух кадмий поступает вместе со свинцом при сжигании топлива на ТЭЦ, с газовыми выбросами предприятий, производящих или использующих кадмий. Загрязнение почвы кадмием происходит при оседании аэрозолей из воздуха и дополняется внесением минеральных удобрений: суперфосфата (7,2 мг/кг), фосфата калия (4,7 мг/кг), селитры (0,7 мг/г). Заметно содержание кадмия и в навозе, где он обнаруживается в результате следующей цепи переходов: воздух — почва — растения — травоядные животные — навоз. В некоторых странах соли кадмия применяют в качестве антисептических и антгельминтных препаратов в ветеринарии. В медицинских целях сульфат кадмия используют при проведении исследований свертываемости крови. Всё это определяет основные пути загрязнения кадмием окружающей среды, а следовательно, продовольственного сырья и пищевых продуктов.
Токсичность кадмия и его соединений[править | править код]
В организм взрослого человека в течение суток поступает 10-20 мкг кадмия. Однако считается, что оптимальная интенсивность поступления кадмия должна составлять 1-5 мкг. Пищевыми источниками кадмия являются морепродукты (особенно мидии и устрицы), злаки (зерновые) и листовые овощи. Содержание кадмия (в мкг/кг) в различных продуктах выглядит следующим образом — растительные продукты: зерновые — 28-95, горох — 15-19, фасоль — 5-12, картофель — 12-50, капуста — 2-26, помидоры — 10-30, салат — 17-23, фрукты — 9-42, растительное масло — 10-50, сахар — 5-31, грибы — 100—500; продукты животноводства: молоко — 2,4, творог — 6,0, яйца — 23-250. Установлено, что примерно 80 % кадмия поступает в организм человека с пищей. Дефицит кадмия в организме может развиться при недостаточном поступлении этого элемента (0,5 мкг/сутки и менее), а порог токсичности равен 30 мкг/сутки. В тонком кишечнике адсорбируется менее 5 % поступившего с пищей кадмия. На всасывание кадмия существенно влияет присутствие других биоэлементов и пищевых веществ, таких как Ca, Zn, Cu, пищевые волокна и др. Кадмий, поступающий в организм с вдыхаемым воздухом, усваивается значительно лучше (10-50 %). В организме человека кадмий аккумулируется в основном в почках, печени и двенадцатиперстной кишке. С возрастом содержание кадмия в организме увеличивается, особенно у мужчин. Средняя концентрация кадмия у мужчин и женщин составляет соответственно в почках 44 и 29 мкг/г, печени — 4,2 и 3,4 мкг/г. Содержание кадмия в рёбрах составляет 0,4-0,5 мкг/г. Кадмий выводится из организма преимущественно через кишечник. Среднесуточная скорость выведения этого элемента очень незначительна и составляет, по некоторым данным, не более 0,01 % от общего количества кадмия содержащегося в организме. Эстрогены усиливают выведение кадмия, что может быть связано с активизацией обмена меди. Физиологическая роль кадмия изучена недостаточно. Кадмий обнаруживается в составе так называемого «металлотионеина» — белка, для которого характерно высокое содержание сульфгидрильных групп и тяжёлых металлов. Функция тионеина заключается в связывании и транспортировке тяжёлых металлов и их детоксикации. In vitro кадмий активирует несколько цинкзависимых ферментов: триптофан оксигеназу, ДАЛК-дегидратазу, карбоксипептидазу. Однако ферментов, которые бы активировались только кадмием, не обнаружено. Помимо ярко выраженной токсичности, кадмий проявляет канцерогенные свойства, вызывает риск возникновения кардиоваскулярных заболеваний и остеопороза[143][144][145][146].
Токсическая доза для человека: 3-330 мг. Летальная доза для человека: от 350 до 3500 мг. Растворимые соли кадмия — нитрат и хлорид, имеют летальные дозы в пределах от 50 до 150 мг. Сульфид кадмия наиболее токсичный из солей, наименьшая смертельная концентрация составляет менее 30 мг.
По рекомендациям ВОЗ допустимая суточная доза (ДСД) кадмия — 1 мкг.
Большое значение в профилактике интоксикации кадмием имеет правильное питание (включение в рацион белков, богатых серосодержащими аминокислотами, аскорбиновой кислоты, железа, цинка, селена, кальция), контроль за содержанием кадмия (полярографический, атомно-абсорбционный анализы) и исключение из рациона продуктов, богатых кадмием.
Токсичность алюминия[править | править код]

Алюминий — самый распространённый металл на Земле, он, как элемент занимает 3-место по распространёности и запасам, после кислорода и кремния. Алюминий занимает одно из ведущих мест среди важнейших металлов по уровню использования человеком. Из алюминия и его сплавов производят большое количество различных предметов, широко применяемых в быту: в первую очередь посуду и столовые приборы. Но несмотря


 French
French Deutsch
Deutsch![Дезоксиниваленол или вомитоксин (от англ. Vomiting — рвота), наиболее распространённый трихотецен, продуцируется микроскопическими плесневыми грибами рода Fusarium (Fusarium culmorum, Fusarium graminearum). Высокотоксичен, обладает иммуносупрессивным эффектом, вызывает сильнейшее отравление сопровождаемое упорной рвотой, поражением ЖКТ и агранулоцитозом[8][9].](http://upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Vomitoxin2DCSD.svg/177px-Vomitoxin2DCSD.svg.png)
![Афлатоксин B1 — один из представителей афлатоксинов, смертельно опасный токсин, а также сильнейший гепатоканцероген[10]. Продуцируется микроскопическими плесневыми грибами рода Аспергилл (Aspergillus flavus, Aspergillus parasiticus).](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/%28%E2%80%93%29-Aflatoxin_B1_Structural_Formulae_V.1.svg/167px-%28%E2%80%93%29-Aflatoxin_B1_Structural_Formulae_V.1.svg.png)
![Соланин — стероидный гликозид, фитотоксин вырабатываемый некоторыми видами растений семейства паслёновых или Solanaceae (ягоды чёрного паслёна, клубни картофеля итд.)[11].](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/Solanine.svg/180px-Solanine.svg.png)
![Модель вируса SARS-CoV-2, одного из представителей семейства коронавирусов. Данный вирус высококонтагиозный и может контаминировать воду и пищевые продукты, тем самым увеличивается риск распространения коронавирусной инфекции (COVID-19)[12].](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/SARS-CoV-2_%28CDC-23312%29.png/126px-SARS-CoV-2_%28CDC-23312%29.png)
![Сигуатоксин 1В — полициклический полиэфир, очень ядовит, продуцируется некоторыми видами динофлагеллятов (Gambierdiscus toxicus). Вместе с планктоном поедается токсин, который накапливается в жировой ткани, внутренностях и коже многих видов морских рыб, тем самым он представляет огромную опасность. Интоксикация сигуатоксином проявляется в виде сигуатеры[13].](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Ciguatoxin.svg/180px-Ciguatoxin.svg.png)
![Сакситоксин (STX), накапливается в съедобных морских моллюсках (мидии, морское ушко, устрицы, итд.), которые в свою очередь питаются продуцентами — динофлагеллятами (Gonyaulax catenella, Alexandrium sp., Gymnodinium sp., Pyrodinium sp.) и цианобактериями (Anabaena sp., Aphanizomenon spp., Cylindrospermopsis sp., Lyngbya sp., Planktothrix sp.). Сильнейший яд небелковой природы с ярко выраженным нервно-паралитическим воздейстием, ЛД50 ~5,7 мкг/кг перорально для человека (так, одна мелкая мидия может содержать сакситоксин в дозе, достаточной чтобы убить 50 человек[14]). Селективный блокатор потенциал-зависимых натриевых каналов[15] (сходный по действию с тетродотоксином), тем самым поражает ЦНС.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c1/Saxitoxin_neutral.svg/122px-Saxitoxin_neutral.svg.png)
![Структура конваллятоксина, гликозида, который встречается во всех частях майского ландыша (Convallaria majаlis), но особенно его много в ягодах. Обладает сильнейшим кардиотоксическим воздействием (ингибирует Na+/K+-АТФазу), даже в небольших количествах (2-3 мг) может вызывать фибрилляцию желудочков[16][17][18], повышение давления и остановку сердца, однако, в очень низких концентрациях — терапевтических дозах (0,3 мг/мл) применяется для лечения пароксизмальной тахикардии.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Convallatoxin.svg/157px-Convallatoxin.svg.png)
![Аманин — один из представителей аматоксинов, встречается в плодовых телах грибов рода Аманита (Мухомор), Лепиота и Галерина, чрезвычайно токсичен и смертельно опасен, сильнейший гепатотоксин, вызывает лизис и некрозы клеток паренхимы печени, помимо этого он разрушает клетки кишечника и почек (вызывает острую почечную недостаточность)[19].](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Amanin.png/151px-Amanin.png)











![Бледная поганка (Amanita phalloides), самый распространённый на Земле смертельно ядовитый гриб рода Аманита (Мухомор)[79] (недоступная ссылка)[80]. Впервые аматоксины были обнаружены именно в этом грибе, откуда и получили своё название. Один гриб способен накапливать до 10 мг аматоксинов — смертельную дозу для взрослого человека[81] (недоступная ссылка).](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a6/2009-05_Amanita_phalloides_crop.jpg/101px-2009-05_Amanita_phalloides_crop.jpg)
![Лепиота розоватая (Lepiota subincarnata) смертельно ядовитый гриб[82].](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0d/Lepiota_subincarnata_117620.jpg/120px-Lepiota_subincarnata_117620.jpg)



![Стрихнин — алкалоид индолового ряда, впервые обнаружен и выделен из рвотных орешков — семян растения чилибу́хи (Strychnos nux-vomica). Чрезвычайно токсичное вещество, нейротоксичной природы, является антагонистом глициновых рецепторов ЦНС. При отравлении симптоматическая картина напоминает столбняк: происходит возбуждение ЦНС, risus sardonicus, возможны генерализованные судороги мышц — тетания, дыхательный паралич и смерть от остановки дыхания или асфиксии[97]. LD50 ~ 1 мг/кг.](http://upload.wikimedia.org/wikipedia/commons/thumb/4/41/Strychnine2.svg/140px-Strychnine2.svg.png)
![Азетидин-2-карбоновая кислота (сокр. Aze) — непротеиногенная аминокислота, структурный аналог и антагонист пролина. Обладает токсичностью, ошибочно встраивается в белки организма. Неправильное включение Aze в человеческие белки может изменить структуру коллагена, кератина, гемоглобина и фолдинг белков[102]. Обнаружен в ландыше майском (Convallaria majalis) и спарже, также встречается во многих растениях семейства бобовых (Fabaceae), в небольших количествах обнаруживается в столовой и сахарной свекле[103].](http://upload.wikimedia.org/wikipedia/commons/thumb/2/24/%28S%29-Azetidine-2-carboxylic_acid-Structural_formula_V1.svg/120px-%28S%29-Azetidine-2-carboxylic_acid-Structural_formula_V1.svg.png)
![Гипоглицин A — непротеиногенная аминокислота, фитотоксин, содержится в незрелых плодах и семенах Аки (Blighia sapida) и личи (Litchi chinensis)[104]. Высокотоксичен, вызывает специфическое заболевание «Ямайскую рвотную болезнь», сопровождаемое сильнейшей интоксикацией и гипогликемией[105].](http://upload.wikimedia.org/wikipedia/commons/thumb/3/34/Hypoglycin_A.svg/120px-Hypoglycin_A.svg.png)



![Зрелые ягоды волчеягодника обыкновенного (Dáphne mezéreum) содержат в себе большое количество фитотоксинов, включая гликозид дафнин (является антивитамином К, вызывает геморрагии и снижает свёртываемость крови) и мезереин (ирритант, сильно раздражает кожу и слизистые оболочки)[108]. Поедание ягод волчеягодника в количестве более 3 г (в среднем 6-10 ягод) смертельно опасно.](http://upload.wikimedia.org/wikipedia/commons/thumb/0/00/Daphne_mezereum_Berries2.jpg/160px-Daphne_mezereum_Berries2.jpg)
![Нераскрывшийся плод Аки (Blighia sapida) содержит непротеиногенную аминокислоту гипоглицин[109] — высокотоксичное вещество, которое может привести к сильному отравлению, сопровождаемой упорной рвотой и гипогликемией, к так называемой «Ямайской рвотной болезни».](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cf/Ackee_001.jpg/160px-Ackee_001.jpg)




![Бензпирен, широко распространённый полициклический ароматический углеводород, канцероген, мутаген. Образуется в результате процессов риформинга, происходящих при сжигании бытовых отходов, нефтепродуктов, табачного дыма, выхлопных газов, а также при термической обработке мяса[122][123].](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fa/Benzo-a-pyrene.svg/180px-Benzo-a-pyrene.svg.png)
![Диметилртуть — ртутьорганическое соединение, чрезвычайно токсична[124], обладает биоаккумуляцией в морских животных, но особенно в рыбе, вызывает тяжёлое поражение ЦНС — болезнь Минамата.](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a2/Dimethylmercury3.png/180px-Dimethylmercury3.png)


![Эндрин — хлорорганическое соединение с необычайно сильным инсектицидным действием, а также чрезвычайно токсичное вещество, вызывает сильнейшую интоксикацию, поражение печени и в особенности ЦНС[125].](http://upload.wikimedia.org/wikipedia/commons/thumb/e/eb/Endrin.svg/132px-Endrin.svg.png)
![Бензол — простейший ароматический углеводород, один из самых распространённых ксенобиотиков. Токсичен, сильный канцероген, обладает мутагенными свойствами, миелотоксичен (поражает красный костный мозг)[126][127].](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Benzol.svg/105px-Benzol.svg.png)
![Метанол — одноатомный спирт, сильный яд, вызывающий поражение зрения (дегенерацию зрительного нерва) в небольших дозах (5-15 мл), в больших кому и летальный исход (30-50 мл)[128][129].](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a2/Methanol-2D.png/141px-Methanol-2D.png)
![Нитрат натрия, вместе с нитратами калия и аммония, являются наиболее используемыми азотными удобрениями в сельском хозяйстве. Поступают в организм человека с овощами и в меньшей степени с фруктами и ягодами, которые накапливают нитраты в своих плодах. Овощи (особенно корнеплоды), содержащие большие количества нитрата натрия или других нитратов, вследствие окисления в организме человека, которое происходит под действием фермента бактерий кишечной микрофлоры — нитратредуктазы, до более токсичных нитритов, вызывают серьёзные расстройства и нарушения работы со стороны органов ЖКТ, а также метгемоглобинемию со стороны системы крови[130].](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/NaNitrate.png/180px-NaNitrate.png)
![2,3,7,8-Тетрахлородибензодиоксин, сокр. ТХДД — органическое бифункциональное соединение (хлорорганический циклический эфир), представитель полихлорированных дибензодиоксинов (ПХДД), чрезвычайно токсичен, одно из самых токсичных веществ антропогенного происхождения (ЛД50 = 0,5 мкг/кг морская свинка (перорально)). Сильный мутаген, доказанный канцероген[131][страница не указана 224 дня], обладает ярко выраженным тератогенным воздействием, снижает деятельность эндокринной и репродуктивной системы.](http://upload.wikimedia.org/wikipedia/commons/thumb/0/06/2%2C3%2C7%2C8-tetrachlorodibenzo%28b%2Ce%29%281%2C4%29dioxine_200.svg/180px-2%2C3%2C7%2C8-tetrachlorodibenzo%28b%2Ce%29%281%2C4%29dioxine_200.svg.png)
![Свинец — наиболее распространённый тяжёлый металл.[источник не указан 313 дней] Свинец ядовит[135], а его растворимые (ацетат II) и летучие (тетраэтилсвинец) соединения высокотоксичны и смертельно опасны[136]. Избыток свинца (сатурнизм) даже в небольших дозах, опасен для здоровья и негативно влияет на органы ЖКТ, ЦНС, в частности на кору головного мозга, а также нарушает обмен кальция. Особенно чувствительны к токсичному воздействию дети.](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e6/Lead_electrolytic_and_1cm3_cube.jpg/165px-Lead_electrolytic_and_1cm3_cube.jpg)

