| Fermiony |
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Bozony |
| ||||||||
| Inne | |||||||||
| Hipotetyczne |
|
| Hadrony |
| ||||
|---|---|---|---|---|---|
| Inne | |||||
| Hipotetyczne |
|
| Elektrony i dziury | |
|---|---|
| Fonony i pokrewne | |
| Separacja spinowo-ładunkowa | |
| Odpowiedniki cz. elementarnych | |
| Inne |

Atom – podstawowy składnik materii. Składa się z małego dodatnio naładowanego jądra o dużej gęstości i otaczającej go chmury elektronowej o ujemnym ładunku elektrycznym[c].
Słowo atom pochodzi z greckiego ἄτομος – átomos (od α-, „nie-” + τέμνω – temno, „ciąć”[1]), oznaczającego coś, czego nie da się przeciąć ani podzielić[2]. Idea istnienia niepodzielnych składników materii pojawiła się już w pismach starożytnych filozofów indyjskich i greckich. W XVII i XVIII wieku chemicy potwierdzili te przypuszczenia, identyfikując pierwiastki chemiczne i pokazując, że reagują one ze sobą w ściśle określonych proporcjach. W XIX wieku odkryto ruchy Browna, będące pośrednim dowodem ziarnistości materii. Na początku XX wieku fizycy zbadali wewnętrzną strukturę atomów, pokazując tym samym, że są one podzielne. Teorie mechaniki kwantowej pozwoliły stworzyć matematyczne modele wnętrza atomu[3][4].
Atomy mają rozmiary rzędu 10−10 m i masę rzędu 10−26 – 10−25 kg. Można je obserwować przez skaningowy mikroskop tunelowy. Ponad 99,9% masy atomu jest zawarte w jego jądrze. Jądro atomowe zbudowane jest z nukleonów: protonów o dodatnim ładunku elektrycznym i elektrycznie obojętnych neutronów[c]. Chmurę elektronową tworzą elektrony związane z jądrem przez oddziaływanie elektromagnetyczne[c]. Podobne oddziaływanie pozwala atomom łączyć się w cząsteczki. Atom jest elektrycznie obojętny, gdy liczba elektronów jest równa liczbie protonów. W przeciwnym przypadku ma ładunek i nazywany jest jonem.
Główne właściwości chemiczne atomów określa liczba protonów w jądrze (liczba atomowa), gdyż determinuje ona strukturę chmury elektronowej oraz liczbę elektronów koniecznych do tego, aby atom był elektrycznie obojętny. Elektrony związane w atomach rozłożone są na powłokach, między którymi mogą przechodzić emitując bądź absorbując fotony o określonej energii. Struktura chmury elektronowej wpływa na chemiczne właściwości atomów i większość ich właściwości magnetycznych. Zbiory atomów o tej samej liczbie atomowej stanowią pierwiastki chemiczne. Atomy mające tę samą liczbę protonów, ale różniące się liczbą neutronów w jądrze to izotopy[5]. Suma protonów i neutronów w jądrze atomu określana jest jako liczba masowa.
Wszystkie pierwiastki mają niestabilne izotopy. Ich jądra ulegają spontanicznemu rozpadowi, co zazwyczaj prowadzi do powstania atomów innych pierwiastków. Rozpadowi temu towarzyszy emisja promieniowania jonizującego. Zjawisko to jest nazywane naturalną radioaktywnością[6].
Pomysł, że materia składa się z mikroskopijnych składników, których nie da się w nieskończoność dzielić na mniejsze części, był znany już w starożytności. Nie opierał się jednak na żadnych danych empirycznych, a jedynie stanowił jedną z filozoficznych koncepcji natury rzeczywistości. Cechy tych mikroskopijnych składników były odmiennie opisywane przez różne szkoły filozoficzne, często uwzględniając ich duchowe właściwości. Istnienie atomów zostało powszechnie zaakceptowane w XVIII wieku, gdy okazało się, że pozwala w elegancki sposób opisać prawa chemii[7].
Najstarsze odniesienia do atomów można znaleźć w pismach poświęconych dźinizmowi napisanych w VI wieku p.n.e. w Indiach[8][9]. Szkoły filozoficzne Njaja i Waiśeszika opracowały zawiłe teorie, opisujące łączenie się atomów w bardziej złożone obiekty[10]. W cywilizacji zachodniej odniesienia do atomów pojawiły się około sto lat później w pismach Leukipposa i zostały usystematyzowane przez jego ucznia Demokryta. Około 450 roku p.n.e. Demokryt wprowadził słowo átomos (niepodzielny). W latach 50 p.n.e. Lukrecjusz twierdził, iż świat składa się jedynie z atomów i pustki[11]. Choć te koncepcje były czysto filozoficzne, współczesna nauka zaadaptowała tę nazwę[7].
W XIII wieku w alchemii pojawiła się koncepcja korpuskularyzmu. Za jej autora uważa się alchemika podpisującego się Geber[12]. Według tej koncepcji wszystkie fizyczne obiekty posiadają wewnętrzną i zewnętrzną warstwę z mikroskopijnych cząstek[13]. Przypominało to teorię atomizmu, z wyjątkiem odrzucenia koncepcji, że te cząsteczki są niepodzielne. Przykładowo spekulowano, że rtęć może wnikać do wnętrza metali i zmieniać ich wewnętrzną strukturę, co miało umożliwić wytwarzanie złota[14]. Koncepcja ta zdominowała alchemię na następnych kilkaset lat.
W 1624 poglądy atomistyczne odnowił Pierre Gassendi w dziele Exercitationes paradoxicae adversus Aristoteleos.
W 1661 roku Robert Boyle opublikował traktat The Sceptical Chymist, w którym przekonywał, że materia zbudowana jest z kombinacji wielu różnych korpuskuł zamiast z klasycznych czterech żywiołów (powietrza, ziemi, wody i ognia)[15]. Koncepcji tej użył dziesięć lat później Izaak Newton do opracowania korpuskularnej teorii światła[13][16].
W 1758 atomizm był postulowany również przez Rogera Boscovicha[17][18].

Jakob Hermann w 1716 roku w dziele Phoronomia opisał gaz jako składający się z cząsteczek poruszających się z różnymi prędkościami. Powiązał on ciepło gazu z kwadratem średniej prędkości jego cząsteczek[20]. Daniel Bernoulli w 1738 roku opublikował Hydrodynamica, w której m.in. wyłożył podstawy kinetyczno-molekularnej teorii gazów. Wyjaśnił on transportowanie ciepła przez gazy oraz istnienie ciśnienia gazu poprzez oddziaływanie jego cząsteczek z otoczeniem[21][22].
Wraz z przekształcaniem się chemii w naukę ścisłą nastąpił dalszy rozwój teorii atomów. W 1789 roku Antoine Lavoisier odkrył prawo zachowania masy i zdefiniował pierwiastek chemiczny jako podstawową substancję, która nie może już być rozdzielona metodami chemicznymi[23]. W 1803 roku John Dalton skorzystał z koncepcji atomów do wytłumaczenia, czemu pierwiastki wchodzą w reakcje w stosunkach ilościowych dających się przedstawić w postaci niewielkich liczb naturalnych (prawo stosunków wielokrotnych) i czemu jedne gazy łatwiej się rozpuszczają w wodzie niż inne. Postulował, że każdy pierwiastek składa się z atomów jednego, unikalnego typu i że te atomy mogą się łączyć, tworząc związki chemiczne[24][19]. Postawienie tych hipotez uczyniło Daltona twórcą współczesnej teorii atomów[25][26].
Fakty doświadczalne mające w przyszłości stanowić dodatkowe potwierdzenie teorii atomów pojawiły się w 1827 roku, gdy botanik Robert Brown odkrył zjawisko spontanicznego chaotycznego ruchu pyłków kwiatowych zawieszonych w wodzie. Zjawisko to zostało potem nazwane ruchami Browna. Jego wyjaśnienie przez termiczne ruchy cząsteczek wody zasugerował w 1877 roku Joseph Delsaulx[27][28], a w 1905 roku Albert Einstein przedstawił jego pełną matematyczną analizę[29][30][31]. Fundamentalny wkład do teorii ruchów Browna wniósł w latach 1906–1917 Marian Smoluchowski (tworząc przy okazji nową gałąź fizyki statystycznej określanej obecnie jako procesy stochastyczne)[28][32]. Analiza Einsteina została potwierdzona eksperymentalnie po raz pierwszy już w 1906 roku przez Theodora Svedberga[28], a Jean Baptiste Perrin wykorzystał teoretyczne prace Einsteina i Smoluchowskiego do eksperymentalnego wyznaczenia mas i „rozmiarów” atomów (1908) potwierdzając ostatecznie teorię Daltona[28][33][34][35].

W 1869 Dmitrij Mendelejew opublikował swój układ okresowy pierwiastków[36]. Układ przedstawiał wizualnie prawo okresowości głoszące, że właściwości chemiczne pierwiastków powtarzają się okresowo, gdy uporządkuje się te pierwiastki zgodnie z ich masami atomowymi[37].
W 1897 roku J.J. Thomson, badając promienie katodowe, odkrył elektrony i doszedł do wniosku, że znajdują się one w każdym atomie. Tym samym obalił tezę, że atomy są ostatecznymi, niepodzielnymi elementami materii[38]. Stworzył pierwszy model struktury atomu, w którym ujemnie naładowane elektrony unoszą się w jednorodnej, dodatnio naładowanej kuli. Model ten obalili w 1909 roku Hans Geiger, Ernest Marsden i Ernest Rutherford, gdy bombardując złotą folię cząstkami alfa odkryli, że niewielka część cząstek alfa jest odbijana, co było sprzeczne z przewidywaniami w modelu Thomsona. Na podstawie tych wyników Rutherford stworzył nowy model atomu, w którym dodatni ładunek i większość masy atomu są skupione w niewielkim jądrze w jego centrum, a ujemnie naładowane elektrony krążą wokół jądra[39].
W 1913 roku Frederick Soddy, badając produkty rozpadu promieniotwórczego, odkrył, że atomy każdego pierwiastka mogą występować w kilku odmianach różniących się nieco masą atomową[40]. Określenie izotop (z gr. isos topos – „w tym samym miejscu”) zasugerowała mu szkocka pisarka i lekarz, Margaret Todd (1859–1918)[41]. J.J. Thomson opracował technikę segregowania atomów ze względu na ich stosunek masy do ładunku w zjonizowanych gazach, co umożliwiło odkrycie stabilnych izotopów[42].
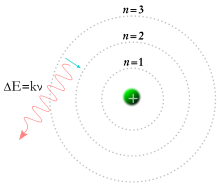
Jednocześnie w 1913 roku fizyk Niels Bohr zaproponował wyjaśnienie występowania linii spektralnych w widmach emisyjnych pierwiastków przez wprowadzenie hipotezy istnienia zestawu dopuszczalnych orbit, na których mogą krążyć elektrony wokół jądra atomowego[26]. W jego modelu każdy elektron musiał zaabsorbować lub wyemitować foton o określonej energii, żeby przeskoczyć między orbitami[43].
Korzystając z tego modelu, Gilbert Newton Lewis zaproponował w 1916 roku wyjaśnienie istoty wiązań chemicznych jako wymianę i współdzielenie elektronów na najwyższych orbitach atomowych[44]. W 1919 roku Irving Langmuir zaproponował wytłumaczenie okresowości właściwości pierwiastków jako efekt grupowania się elektronów na pewnych orbitach tworzących powłoki elektronowe[37][45].
W 1922 roku doświadczenie Sterna-Gerlacha pokazało, że kierunek wektora magnetycznego momentu dipolowego atomów jest skwantowany. Specjalnie ukształtowane pole magnetyczne dzieliło strumień przelatujących przez nie atomów srebra na dwie rozdzielone wiązki. Zgodnie z mechaniką klasyczną takie zjawisko nie powinno mieć miejsca, ponieważ moment magnetyczny każdego atomu powinien móc być skierowany w dowolnym kierunku i oddziaływanie z zewnętrznym polem magnetycznym mogło jedynie rozciągnąć strumień atomów w jakimś kierunku. Zamiast tego atomy zostały rozdzielone na dwie grupy, w których wektor momentu magnetycznego skierowany był w górę lub w dół[46].
W 1924 roku Louis de Broglie zaproponował, że wszystkie cząstki mogą zachowywać się jak fale. W 1926 roku Erwin Schrödinger rozwinął tę ideę, przedstawiając matematyczny model atomu, w którym ruch elektronów został opisany funkcjami fal stojących. Konsekwencją opisywania cząstek jako fali było to, że matematycznie niemożliwe stało się jednoczesne określenie ich położenia i pędu, co zostało sformułowane jako zasada nieoznaczoności przez Wernera Heisenberga w 1926 roku. Zgodnie z nią, zwiększając precyzję pomiaru położenia, zmniejsza się jednocześnie precyzję pomiaru pędu i vice versa. Model Schrödingera umożliwił rozwiązanie problemów, które napotykały wcześniejsze modele przy wyjaśnianiu linii spektralnych atomów cięższych od wodoru. Obecnie przyjmuje się go za obowiązujący[47][48].

Wynalezienie spektrometru mas umożliwiło dokładne zmierzenie bezwzględnych mas atomowych. Urządzenie to wykorzystuje pole magnetyczne do odchylenia trajektorii jonów, a stopień odchylenia zależy od stosunku ładunku jonu do jego masy. Francis William Aston jako pierwszy udowodnił przy jego użyciu, że izotopy mają różne masy i że różnice w ich masach są wielokrotnościami tej samej masy. W 1932 roku fizyk James Chadwick wyjaśnił te różnice odkrywając neutron – elektrycznie obojętną cząstkę podobną do protonu. Izotopy okazały się atomami o tej samej liczbie protonów, ale różniącymi się liczbą neutronów w jądrze[49].
W 1938 roku niemiecki chemik Otto Hahn skierował strumień neutronów na atomy uranu próbując uzyskać cięższe pierwiastki. Produktem okazał się lżejszy pierwiastek bar[50]. Rok później Lise Meitner i Otto Frisch potwierdzili, że ten eksperyment był pierwszym sztucznie wywołanym rozbiciem jądra atomowego[51][52]. Po 1950 roku budowa akceleratorów cząstek i detektorów cząstek pozwoliła fizykom badać wyniki zderzeń atomów poruszających się z dużymi prędkościami[53]. Odkryto w ten sposób dziesiątki, a później setki nowych cząstek. Ich strukturę wyjaśnili niezależnie od siebie Gell-Mann i G. Zweig w 1964 roku, wprowadzając pojęcie kwarków. Neutrony i protony okazały się być hadronami – cząsteczkami zbudowanymi z kwarków. Na bazie tego stworzono model standardowy, wyjaśniający strukturę jądra atomowego w oparciu o kwarki i siły, jakim podlegają[54].
Mimo że słowo atom pierwotnie oznaczało cząstkę, której nie da się podzielić na mniejsze, współcześnie nazywa się nim strukturę zbudowaną z mniejszych cząstek: elektronów, protonów i neutronów. Jedynie wodór 1H nie zawiera żadnych neutronów, a jego dodatnio naładowany jon nie zawiera też elektronów.
Elektron jest najmniej masywną z tych trzech cząstek, z masą 9,11×10−31 kg. Posiada ujemny ładunek i rozmiary zbyt małe, aby dało się je określić przy użyciu współczesnych metod[55]. Protony posiadają dodatni ładunek i masę około 1836 razy większą od elektronów: 1,6726×10−27 kg. Neutrony nie posiadają ładunku elektrycznego i są około 1839 razy cięższe od elektronu[56], z masą 1,6929×10−27 kg. Masa protonów i neutronów wewnątrz jądra jest pomniejszona o energię wiązania. Neutrony i protony mają podobne średnice, rzędu 2,5×10−15 m – jednak z powodu ich wewnętrznej struktury trudno zdefiniować, co jest ich „powierzchnią”[57].
Według modelu standardowego protony i neutrony są zbudowane z kwarków. Kwarki stanowią jedną z podstawowych grup cząstek tworzących materię (drugą są leptony, których przykładem jest elektron). Istnieje sześć typów kwarków, każdy posiadający ułamkowy ładunek elektryczny wynoszący albo +2/3 albo −1/3. Protony są zbudowane z dwóch kwarków górnych (o ładunku +2/3) i jednego kwarku dolnego (o ładunku −1/3). Neutrony są zbudowane z jednego kwarka górnego i dwóch dolnych. Ta różnica odpowiada za różnicę w masach i ładunku tych dwóch cząstek. Kwarki są powiązane ze sobą silnym oddziaływaniem jądrowym, którego nośnikiem są gluony. Gluony są bozonami cechowania – podstawowymi cząstkami przenoszącymi oddziaływania fizyczne[58][59].

Wszystkie protony i neutrony w atomie (nazywane wspólnie nukleonami) skupiają się w jądro atomowe. Średnica jądra atomowego wynosi około fm, gdzie A oznacza liczbę nukleonów[60]. Jest to około 1/100 000 średnicy całego atomu. Nukleony są związane ze sobą przez siły jądrowe, będące resztkowym przejawem oddziaływania silnego. Na odległościach mniejszych niż 2,5 fm te siły są wielokrotnie silniejsze od odpychania elektrostatycznego pomiędzy dodatnio naładowanymi protonami[61].
Atomy tego samego pierwiastka mają tę samą liczbę protonów, nazywaną liczbą atomową. Liczba neutronów może być różna, w zależności od izotopu tego pierwiastka. Łączna liczba protonów i neutronów określana jest jako liczba masowa. Stabilność jądra zależy od liczby protonów, jak i neutronów w jądrze. Jądra niestabilne ulegają rozpadowi promieniotwórczemu[62].
Zarówno protony, jak i neutrony są fermionami. Reguła Pauliego zabrania identycznym fermionom zajmowania jednocześnie tego samego stanu kwantowego. Dlatego każdy proton w jądrze musi znajdować się w innym stanie kwantowym, podobnie jak każdy neutron. Reguła ta nie zabrania protonowi i neutronowi znajdować się w tym samym stanie, ponieważ są innym typem cząstek.
W atomach z małą liczbą protonów (poniżej 20) najstabilniejsze są izotopy, w których liczba protonów i neutronów jest w przybliżeniu równa. Jądro atomu z tej grupy, zawierające znacząco różną liczbę neutronów i protonów, może obniżyć swoją energię przez rozpad radioaktywny prowadzący do zmniejszenia tej różnicy. W miarę wzrostu liczby protonów w jądrze ich odpychanie elektrostatyczne sprawia, że stabilniejsze stają się jądra z nieco większą liczbą neutronów. Jądra wszystkich atomów cięższych od wapnia (20 protonów), których liczba neutronów jest równa liczbie protonów, są niestabilne. Z dalszym wzrostem liczby protonów optymalny stosunek liczby neutronów do protonów rośnie, osiągając około 1,5 dla najcięższych jąder[63]. Najcięższym trwałym atomem jest ołów, którego izotop 208Pb zawiera 82 protony i 126 neutronów. Do roku 2003 za najcięższy trwały atom uważano bizmut (izotop 209Bi), który jednak, zgodnie z przewidywaniami teoretycznymi, ostatecznie okazał się niestabilny[64].
W wyniku zderzeń jąder atomowych może dojść do utworzenia nowych jąder, ale doprowadzenie do takiej reakcji wymaga często bardzo wysokich energii. Fuzja jądrowa zachodzi, gdy lżejsze jądra łączą się w cięższe. Przykładowo protony muszą zderzyć się z energią 3–10 keV, aby przezwyciężyć wzajemne odpychanie i zbliżyć się na tyle, żeby połączyć się w jądro deuteru[65]. Rozszczepienie jądra atomowego to odwrotny proces, w którym ciężkie jądro rozpada się na dwa lżejsze. Jądro może też zostać zmodyfikowane w wyniku zderzenia z wysokoenergetyczną cząstką lub fotonem – które zmieni proton w neutron lub na odwrót[66][67].
Jeśli masa powstałego jądra i emitowanych cząstek jest mniejsza niż masa substratów, różnica zostanie wyemitowana w postaci promieniowania gamma lub energii kinetycznej produktów, zgodnie ze wzorem na równoważność masy i energii E = mc2. Różnica mas wynika z energii wiązania w jądrze i jej utrata sprawia, że powstałe jądro jest stabilne – aby się rozpaść, musi otrzymać tę energię z otoczenia[68].
Fuzja, w której powstaje jądro lżejsze od żelaza – o liczbie nukleonów mniejszej niż 60 – powoduje zwykle wyemitowanie większej ilości energii niż jest potrzebna do jej wywołania[69]. Ta energia napędza reakcję termojądrową we wnętrzu gwiazd. Dla jąder cięższych od jądra żelaza energia wiązania w przeliczeniu na nukleon zaczyna spadać. Oznacza to, że fuzja takich jąder zużywa energię i nie może podtrzymać równowagi hydrostatycznej w gwiazdach[70].

Elektrony w atomie są przyciągane siłami elektrycznymi przez protony w jądrze. To oddziaływanie tworzy studnię potencjału wokół jądra, z której uwolnienie wymaga dostarczenia elektronom energii z zewnątrz. Im bliżej jądra znajduje się elektron, tym silniej jest przyciągany i wzrasta energia konieczna do jego oderwania od atomu. Zgodnie z mechaniką kwantową, elektrony (tak jak wszystkie cząstki) są jednocześnie cząstkami i falami. Każdy elektron można opisać funkcją matematyczną określającą prawdopodobieństwo znalezienia elektronu w określonym obszarze. Dla elektronu w studni potencjału, funkcja ta jest funkcją fali stojącej i jest nazywana orbitalem[71]. Zbiór orbitali posiadających podobny poziom energetyczny nazywany jest powłoką elektronową, a łącznie wszystkie powłoki – chmurą elektronową. Istnieje określony, niewielki zbiór stabilnych orbitali wokół jądra a wszystkie pozostałe, które są teoretycznie możliwe, szybko rozpadałyby się na orbitale z tego zbioru[72]. Te stabilne orbitale różnią się między sobą kształtami oraz wielkością i orientacją obszaru, który określają[73].

Każdemu orbitalowi przypisany jest jego poziom energetyczny. Elektron może znaleźć się na wyższym poziomie energetycznym pochłaniając foton o odpowiedniej energii lub otrzymując tę energię ze zderzenia z innym atomem lub cząstką. Odwrotnie – elektron z wyższego poziomu może przenieść się na niższy. Powstający w ten sposób nadmiar energii jest unoszony przez emitowany foton (zjawisko to nazywamy emisją spontaniczną) lub przejmowany przez inny atom (przejście bezpromieniste). Charakterystyczne wartości tych energii, będące różnicami energii poszczególnych orbitali, odpowiadają za występowanie linii spektralnych w widmach liniowych poszczególnych pierwiastków[72].
Energia potrzebna na oderwanie bądź przyłączenie elektronu – energia wiązania elektronu – jest o wiele mniejsza niż energia wiązania nukleonów. Potrzeba około 13,6 eV, aby oddzielić elektron w stanie podstawowym od jądra atomu wodoru[74], podczas gdy wyrwanie nukleonu z jądra deuteru wymaga 2,23 milionów eV[75].
Jeśli atom ma tę samą liczbę protonów i elektronów, jest elektrycznie obojętny. Atomy mające nadmiar lub niedomiar elektronów nazywane są jonami. Elektrony na orbitalach najdalszych od jądra mogą przenosić się na inne atomy bądź tworzyć orbitale wokół dwóch i więcej atomów jednocześnie. W ten sposób atomy tworzą wiązania chemiczne między sobą, łącząc się w związki chemiczne[76].
Z definicji dwa atomy o identycznej liczbie protonów w jądrze są atomami tego samego pierwiastka. Jeśli różnią się liczbą neutronów, stanowią różne izotopy tego pierwiastka. Przykładowo atomy wodoru posiadają zawsze jeden proton, ale mogą nie posiadać żadnego neutronu (prot), posiadać jeden (deuter), dwa (tryt) lub nawet więcej neutronów. 99,98% atomów wodoru w przyrodzie należy do pierwszego izotopu (bez neutronów)[77]. Lista znanych obecnie pierwiastków obejmuje liczby atomowe od 1 (wodór) do 118 (oganeson)[78]. Jądra o określonej liczbie protonów i neutronów określane są jako nuklidy. Wszystkie znane nuklidy mające więcej niż 82 protony w jądrze są radioaktywne[79][80].
Na Ziemi naturalnie występuje około 339 różnych nuklidów[81], z czego 227 (około 67%) jest stabilnych i nie ulega radioaktywnemu rozpadowi. Jednak jedynie 90 z nich nie ma teoretycznej możliwości rozpadu, pozostałe 137 taką możliwość wedle współczesnej wiedzy posiadają, ale nigdy takiego rozpadu nie zaobserwowano. Oprócz tych 227 stabilnych nuklidów u kolejnych 30 potwierdzono radioaktywny rozpad, ale czas tego rozpadu jest zbyt duży, aby dało się go wyznaczyć eksperymentalnie. Kolejnych 31 ma czas połowicznego rozpadu przekraczający 80 milionów lat, dzięki czemu ich resztki dotrwały do dzisiejszych czasów od początków istnienia Układu Słonecznego. Daje to w sumie 288 tzw. pierwotnych nuklidów, istniejących na Ziemi od jej początków. Ostatnie 51 istniejących na Ziemi naturalnie nuklidów to produkty rozpadu cięższych nuklidów (jak np. rad powstający z rozpadu uranu) i produkty naturalnych reakcji jądrowych (jak 14C produkowany w górnych warstwach atmosfery pod wpływem promieniowania kosmicznego)[82][83].
80 pierwiastków chemicznych posiada stabilne izotopy. Nie mają ich pierwiastki o liczbie atomowej 43 (technet), 61 (promet) i wszystkie o liczbach atomowych większych od 82 (ołów). Pozostałe posiadają średnio po około 3 stabilne izotopy. 27 pierwiastków ma tylko jeden stabilny izotop. Największą liczbę stabilnych izotopów (10) ma cyna[84].
Stabilność izotopów zależy od proporcji protonów i neutronów oraz od tego czy ich liczba jest równa jednej z tzw. liczb magicznych. W modelu powłokowym struktury jądra atomowego, liczby magiczne odpowiadają maksymalnej pojemności kolejnych jego poziomów energetycznych. Część liczb magicznych dotyczy obu nukleonów, a część odnosi się tylko do jednego z ich rodzajów. Przykładowo, jądro cyny zawiera 50 protonów, która jest liczbą magiczną dla obu nukleonów, dlatego cyna posiada wyjątkowo dużo trwałych izotopów. Wśród znanych 256 stabilnych nuklidów tylko 4 mają nieparzyste liczby zarówno protonów, jak i neutronów: wodór-2, lit-6, bor-10 i azot-14. Większość jąder o nieparzystej liczbie protonów i neutronów w bardzo krótkim czasie ulega rozpadowi beta, tworząc jądro o parzystej liczbie protonów i neutronów, zwykle znacznie stabilniejsze (patrz model kroplowy)[84].
Protony i neutrony odpowiadają za ponad 99,9% masy atomu, a ich masa jest w przybliżeniu taka sama. Dlatego sumaryczna liczba protonów i neutronów nazywana jest liczbą masową. Masa spoczynkowa atomów wyrażana jest często w jednostkach atomowych (u), zdefiniowanych jako 1/12 masy atomu 12C, czyli około 1,66×10−27 kg[85]. W tych jednostkach masa każdego atomu jest w przybliżeniu równa jego liczbie masowej. Przykładowo masa atomu 1H wynosi 1,007825 u[86][87]. Najcięższy stabilny atom to 208Pb[79], którego masa wynosi 207,976652481 u[88].
Ponieważ w chemii używa się makroskopowych ilości atomów, chemicy używają dodatkowej jednostki: mola. Jeden mol to około 6,022×1023 cząstek. Liczba ta została dobrana w ten sposób, żeby mol atomów o liczbie masowej 1 miał masę zbliżoną do 1 grama. Ze względu na to, że dokładny pomiar liczby atomów w 1 gramie wodoru-1 jest problematyczny, za podstawę skali względnej masy atomowej przyjęto założenie, że 1 mol to taka liczba atomów, jaka znajduje się w 12 gramach izotopu węgla-12[85].
Powiązanie definicji mola i standardowej jednostki atomowej (u) poprzez odniesienie do izotopu węgla-12 nie jest przypadkowe, lecz wynika z wieloletnich konsultacji i dyskusji w ramach IUPAC, IUPAP i Międzynarodowego Komitetu Miar i Wag[89].
Atomy nie mają dokładnie określonych granic, ich rozmiary są określane w sposób umowny, na podstawie odległości pomiędzy sąsiednimi jądrami atomów (promień kowalencyjny), z którymi tworzą wiązania chemiczne. Odpowiada to zwykle średniej odległości, na jakiej znajdują się elektrony na najdalszej powłoce. Tak zdefiniowane rozmiary zależą jednak od rodzaju wiązań chemicznych, liczby sąsiadów i od ich spinu[90]. W układzie okresowym średnice atomów wewnątrz każdej grupy rosną wraz z liczbą obsadzonych powłok, jednak maleją wewnątrz okresu wraz ze zwiększeniem liczby protonów (ponieważ jądro przyciąga elektrony mocniej i rozmiary powłok maleją)[91]. Dlatego najmniejszą średnicę ma hel – około 62 pm, a największą cez – około 520 pm[92].
Przyjmuje się, że w pustej przestrzeni atomy w stanie podstawowym mają kształt kuli. Pod wpływem pól elektrycznych te kształty mogą się jednak zmieniać. Stopień odkształcenia zależy od siły pola i typu zewnętrznej powłoki elektronowej atomu. W szczególności atomy tworzące kryształy mogą mieć kształty znacznie odbiegające od sfery z powodu silnych pól wytwarzanych przez atomy rozłożone wokół nich[93][94].
Ponieważ rozmiary atomów są tysiące razy mniejsze od długości fali światła widzialnego (400–700 nm), nie można dostrzec pojedynczych atomów za pomocą mikroskopu optycznego. Pierwszym urządzeniem, które umożliwiło wizualizację pojedynczych atomów i ich rozmieszczenia, był polowy mikroskop jonowy, jednak jego użyteczność była ograniczona[95]. Później uzyskano możliwość obrazowania atomów za pomocą skaningowej mikroskopii elektronowej i wysokonapięciowej mikroskopii elektronowej, natomiast skaningowy mikroskop tunelowy umożliwił również manipulację pojedynczymi atomami[96].
Wielkość atomów można opisać obrazowo na przykładach makroskopowych: ludzki włos ma średnicę około miliona atomów węgla, kropla wody zawiera około 2 tryliardy (2×1021) atomów tlenu i dwa razy więcej atomów wodoru[97]. Gdyby powiększyć jabłko do rozmiarów Ziemi, to atomy jabłka miałyby rozmiary mniej więcej jabłka[98].

Każdy pierwiastek ma nietrwałe izotopy, które ulegają rozpadowi radioaktywnemu. W trakcie takiego rozpadu jądro emituje cząstki, czemu może towarzyszyć promieniowanie elektromagnetyczne. Szczególnie podatne na taki rozpad są jądra o dużej wielkości w stosunku do zasięgu oddziaływania silnego – około 1 fm[99].

Najbardziej powszechne typy rozpadów radioaktywnych to[100][101]:
Rozpady α i β− kolejnych izotopów promieniotwórczych grupują się w 4 szeregi promieniotwórcze, kończące się trwałymi izotopami ołowiu (szeregi 1–3) lub praktycznie trwałym izotopem bizmutu-209 (szereg 4).
Rzadziej występujące typy rozpadów radioaktywnych to m.in. emisja neutronu, emisja protonu albo ich grupy z jądra, emisja wysokoenergetycznego elektronu w wyniku konwersji wewnętrznej i emisja promieniowania elektromagnetycznego nie będącego promieniami gamma.
Rozpad radioaktywny jest procesem, którego wystąpienie jest losowe, i nie da się przewidzieć, w jakim momencie dany atom ulegnie rozpadowi. Można natomiast określić prawdopodobieństwo rozpadu w określonym czasie. Jest ono niemal niezależne od czynników zewnętrznych, w tym i od wielkości próbki, dlatego dla każdego nietrwałego jądra można określić charakterystyczny czas połowicznego rozpadu – czas, po jakim połowa jąder z próbki ulegnie rozpadowi[99]. Rozpad jest wykładniczy, co oznacza, że po upływie dwukrotności tego czasu pozostaje 1/4 jąder, po trzykrotności 1/8 itd.
Cząstki elementarne mają kwantową cechę nazywaną spinem. Ma ona podobne cechy jak moment pędu obiektu wirującego wokół swojego środka masy, choć cząstki elementarne wedle współczesnej wiedzy nie obracają się. Spin wyraża się w jednostkach stałej Diraca (ħ). Elektrony, protony i neutrony mają spin ½ ħ. W atomie elektrony mają także moment pędu wynikający z ich ruchu wokół jądra, a nukleony wynikający z ich krążenia w jądrze[103].
Pole magnetyczne wytwarzane przez atom – jego moment magnetyczny – wynika z sumy momentów pędu. Główną rolę odgrywa jednak spin. Ponieważ reguła Pauliego zabrania dwóm cząstkom znajdować się w identycznym stanie kwantowym, na każdym poziomie energetycznym znajdują się zwykle dwie cząstki o przeciwnie skierowanych spinach. W ten sposób, jeśli liczba atomowa jest parzysta, wszystkie spiny w atomie mogą się nawzajem znosić, tworząc atom o zerowym momencie magnetycznym.
W ferromagnetykach takich jak żelazo nieparzysta liczba elektronów oznacza, że w każdym atomie jeden elektron pozostaje niesparowany. Ponieważ orbitale tych elektronów w sąsiednich atomach nakładają się na siebie, energetycznie niższy stan jest osiągany, gdy te niesparowane elektrony mają tak samo skierowane spiny. W ten sposób wszystkie niesparowane elektrony mogą uzyskać tak samo skierowany spin, co wytwarza makroskopowe pole magnetyczne. W paramagnetykach spiny sąsiednich atomów nie układają się same w jednym kierunku, ale zewnętrzne pole magnetyczne może wymusić przyjęcie jednej orientacji, co również prowadzi do wytworzenia makroskopowego pola[104]. Właściwości atomów zawierających niesparowane elektrony można badać za pomocą spektroskopii elektronowego rezonansu paramagnetycznego (EPR).
Jądra atomowe również mogą zawierać niesparowane nukleony i w efekcie niezerowy spin (np. 1H i 2H, 13C, 15N, 17O, 19F, 23Na i 31P). Zwykle takie spiny są skierowane w losowych kierunkach i nie wytwarzają efektów makroskopowych. W zewnętrznym polu magnetycznym jądra atomów o niezerowym spinie ulegają jednak polaryzacji magnetycznej, a przejścia między dozwolonymi poziomami energetycznymi da się rejestrować, co jest podstawą spektroskopii magnetycznego rezonansu jądrowego (NMR), obrazowania rezonansem magnetycznym (MRI)[105][106] i innych technik magnetycznego rezonansu jądrowego.
Energia potencjalna elektronów związanych w atomie jest odwrotnie proporcjonalna do ich odległości od jądra. Można ją zmierzyć przez określenie energii, jaka jest potrzebna do oderwania tych elektronów od atomu. Zwykle wyraża się ją w elektronowoltach (eV). Zgodnie z mechaniką kwantową, elektron związany w atomie musi znajdować się w jednym z określonych z góry stanów, którym odpowiadają określone poziomy energetyczne. Najniższy poziom energetyczny nazywany jest stanem podstawowym, a pozostałe stanami wzbudzonymi.
Aby przejść pomiędzy stanami, elektron musi pochłonąć lub wyemitować foton o energii odpowiadającej różnicy pomiędzy energią potencjalną tych stanów. Energia fotonu określa jego częstotliwość, dlatego te energie mają wyznaczone miejsca w widmie elektromagnetycznym[107]. Każdy pierwiastek ma charakterystyczne widmo, określone przez ładunek jądra, wypełnienie poszczególnych powłok elektronami i oddziaływania pomiędzy elektronami[108].

Gdy światło o ciągłym widmie przechodzi przez gaz lub plazmę, niektóre fotony zostają pochłonięte przez atomy, wywołując przejścia elektronów między poziomami energetycznymi. Wzbudzone tak elektrony po jakimś czasie wracają do swojego poprzedniego stanu, emitując fotony w losowych kierunkach. W ten sposób atomy działają jak filtry, tworząc ciemne linie absorpcyjne w widmie przechodzącego przez nie światła. Z kolei obserwując te same atomy z innego kierunku i nie widząc przechodzącego przez nie światła, można zobaczyć tylko światło wyemitowane przez atomy – tzw. linie emisyjne. Spektroskopia wykorzystuje te zjawiska do badania składu chemicznego różnych substancji[109].
Wysokorozdzielcza analiza linii widmowych ujawnia, że niektóre z nich w rzeczywistości składają się z kilku blisko położonych linii. Wynika to z oddziaływania spinowych i orbitalnych momentów magnetycznych elektronów[110]. Zewnętrzne pole magnetyczne może spowodować dalsze rozdzielenie linii widmowych – znane jest to jako efekt Zeemana. Wynika on z tego, że orbitale, które w przypadku braku zewnętrznego pola mają takie same poziomy energetyczne, mogą się różnić energiami, gdy pojawi się takie pole[111]. Podobnie przyłożenie zewnętrznego pola elektrycznego może zmienić poziomy energetyczne orbitali i wywołać rozszczepienie linii widmowych. Zjawisko to nazywane jest efektem Starka[112].
Jeśli elektron jest w stanie wzbudzonym, oddziaływanie z fotonem o odpowiedniej energii może wymusić na nim przejście do niższego stanu i emisję fotonu, który będzie miał kierunek i fazę identyczną jak foton wymuszający. Zjawisko to umożliwia stworzenie laserów, tworzących spójną wiązkę światła o wąskim przedziale częstotliwości[113].
Elektrony znajdujące się na najdalszej powłoce w atomie nazywane są walencyjnymi, a ich powłoka – walencyjną. Liczba takich elektronów determinuje właściwości chemiczne atomów. Atomy, w których powłoka walencyjna nie jest w pełni wypełniona, łatwo oddziałują z innymi atomami, tak aby uzupełnić (lub opróżnić) tę powłokę[114]. Odbywa się to poprzez reakcje chemiczne, czyli procesy tworzenia i zrywania wiązań chemicznych.
Wiązania powstają w efekcie uwspólniania elektronów przez dwa lub więcej atomów (wiązanie kowalencyjne) albo na skutek przeniesienia elektronów z jednego atomu na drugi (wiązanie jonowe). W pierwszym przypadku współdzielone elektrony tworzą jedną, wspólną chmurę wokół połączonych atomów, a w drugim atomy łączą się w pary jonowe, przyciągane do siebie oddziaływaniem elektrostatycznym. O typie wiązania decyduje różnica elektroujemności atomów[115][116].
Pierwiastki chemiczne zwykle przedstawia się w układzie okresowym, podkreślającym podobieństwo właściwości chemicznych pierwiastków o tej samej liczbie elektronów walencyjnych (znajdujących się w jednej grupie). Ostatnia grupa zawiera pierwiastki, w których powłoka walencyjna jest całkowicie zapełniona elektronami. Są one niemal całkowicie niereaktywne chemicznie i nazywa się je gazami szlachetnymi[117][118].

Grupy atomów mogą znajdować się w różnych stanach skupienia, w zależności od warunków takich jak temperatura i ciśnienie. Zmieniając te warunki, można wywoływać przejścia między stanem stałym, ciekłym, gazowym i plazmą[119]. W jednym stanie skupienia mogą istnieć różne stany fazowe. Przykładowo węgiel w postaci stałej ma kilka odmian alotropowych, jak np. grafit czy diament[120].
W temperaturach bliskich zera bezwzględnego niektóre atomy mogą tworzyć kondensat Bosego-Einsteina, w którym wszystkie zachowują się jak jeden superatom. Ich kwantowe własności mogą być wtedy obserwowane w skali makroskopowej[121][122][123].

Skaningowy mikroskop tunelowy umożliwia oglądanie powierzchni w skali atomowej. Wykorzystuje on zjawisko tunelowe, pozwalające elektronom na pokonywanie próżni pomiędzy badaną próbką a elektrodą. Powstaje w ten sposób mierzalny prąd elektryczny. Przesuwając elektrodę nad próbką i kontrolując jej odległość od próbki tak, aby natężenie prądu było stałe, uzyskuje się trójwymiarowy obraz powierzchni. Obraz ten w przybliżeniu odpowiada wielkości orbitali elektronowych na zapełnionych powłokach w atomach próbki[124][125].
Innym rodzajem mikroskopii na poziomie atomowym jest mikroskopia sił atomowych, która działa na zasadzie przemiatania ostrza nad lub pod powierzchnią próbki i pomiarze sił działających na to ostrze. W odpowiednich warunkach technika ta pozwala na rejestrację pojedynczych atomów na powierzchni próbki[126].
Atomy mogą ulegać jonizacji, tracąc lub przyłączając elektrony. Uzyskują wtedy ładunek elektryczny i można nimi sterować za pomocą pola elektrycznego i magnetycznego. W polu magnetycznym jony poruszają się po okręgach o promieniu zależnym od ich masy i ładunku, ale niezależnym od prędkości. Spektrometria mas wykorzystuje to do identyfikacji izotopów i składów pierwiastkowych cząsteczek. Jeśli badana próbka zawiera atomy różnych izotopów, spektrometr pozwala na rozdzielenie ich i określenie procentowej ich zawartości. Metoda ta umożliwia jedynie określenie ilości poszczególnych atomów w próbce, bez możliwości określenia miejsca atomu w cząsteczce[127].
Do uzyskiwania informacji o położeniu różnych atomów w jakiejś strukturze służy spektroskopia strat energii elektronów (EELS). W technice tej wykorzystuje się elektronowy mikroskop transmisyjny do przepuszczania elektronów przez próbkę. Następnie mierzy się straty energii tych elektronów, wynikające z wybijania elektronów i wzbudzania drgań sieci krystalicznej próbki. Metoda ta pozwala na uzyskiwanie nanometrowej rozdzielczości i na trójwymiarowe obrazowanie przemieszczeń atomów w czasie femtosekund[128]. Ułożenie atomów w sieci krystalicznej można określić poprzez analizę dyfrakcji promieniowania rentgenowskiego za pomocą technik rentgenografii strukturalnej. Uzyskane trójwymiarowe mapy gęstości elektronowych pozwalają m.in. na ustalenie struktur badanych cząsteczek, długości wiązań chemicznych i kątów między nimi[129].
Widma stanów wzbudzonych umożliwiają analizę składu chemicznego odległych gwiazd. Zestaw częstotliwości występujący w tych widmach można porównywać z częstotliwościami wytwarzanymi przez odpowiednią mieszaninę gazów w lampach wyładowczych[130]. W ten sposób pierwiastek hel został odkryty w Słońcu 23 lata przed zaobserwowaniem go na Ziemi[131].
Drgania atomów w cząsteczkach chemicznych można analizować za pomocą spektroskopii w podczerwieni i spektroskopii Ramana, a przejścia elektronowe między dozwolonymi poziomami energetycznymi za pomocą spektroskopii w ultrafiolecie i świetle widzialnym. Do badania właściwości magnetycznych atomów stosowane są: spektroskopia elektronowego rezonansu paramagnetycznego (EPR), spektroskopia magnetycznego rezonansu jądrowego (NMR) i spektroskopia jądrowego rezonansu kwadrupolowego (NQR).
Atomy stanowią około 4% całkowitej masy-energii obserwowanego Wszechświata, występując ze średnią gęstością około 0,25 atomu/m³[132]. Wewnątrz galaktyk, takich jak Droga Mleczna, atomy występują o wiele gęściej, od 105 do 109 atomów/m³ w ośrodku międzygwiazdowym[133].
Słońce znajduje się wewnątrz Bąbla Lokalnego – pustki w ośrodku międzygwiazdowym, stworzonej przez supernową, która wybuchła 2–4 miliony lat temu. Wewnątrz tego bąbla gęstość wynosi około 10³ atomów/m³[134]. Gęstsze obszary w ośrodku międzygwiazdowym mogą grawitacyjnie zapadać się, tworząc gwiazdy. Procesy zachodzące w gwiazdach z upływem czasu zwiększają ilość pierwiastków cięższych od wodoru i helu. Około 95% atomów w Drodze Mlecznej znajduje się wewnątrz gwiazd, a ich całkowita masa odpowiada za około 10% masy galaktyki[135] (za resztę odpowiada ciemna materia[136]).
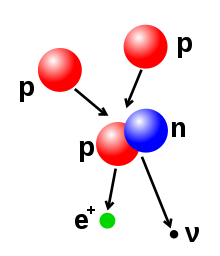
Zgodnie z teorią Wielkiego Wybuchu protony i neutrony uformowały się około jednej sekundy po powstaniu Wszechświata. W ciągu kolejnych trzech minut w wyniku pierwotnej nukleosyntezy powstała większość helu, litu i deuteru we Wszechświecie oraz prawdopodobnie część berylu i boru[137][138][139].
Pierwsze atomy (ze związanymi elektronami) pojawiły się około 380 tysięcy lat później, w epoce rekombinacji, gdy energia promieniowania wypełniającego przestrzeń zmalała poniżej energii jonizacji atomów[140]. Cięższe jądra atomowe (do żelaza) zaczęły powstawać w wyniku fuzji jądrowej we wnętrzu gwiazd kilkaset milionów lat później[141]. Niektóre izotopy, takie jak lit-6, powstawały później w wyniku spalacji wywoływanej przez promieniowanie kosmiczne[142]. Pierwiastki cięższe od żelaza powstawały w wyniku eksplozji supernowych poprzez proces r oraz we wnętrzu gwiazd AGB poprzez proces s. Oba te procesy polegają na wychwytywaniu neutronów przez jądra atomowe[143]. Pierwiastki takie jak ołów powstały głównie w wyniku radioaktywnego rozpadu cięższych pierwiastków[144].
Większość atomów, z których składa się Ziemia i jej mieszkańcy, nie zmieniła swych jąder od czasu ich powstania, czyli wcześniej niż mgławica, z której powstał Układ Słoneczny, zaczęła się zapadać. Niewielka liczba nowych atomów powstała w wyniku rozpadów radioaktywnych, a stosunek ich zawartości obecnie pozwala określić wiek Ziemi na podstawie datowania izotopowego[145][146]. Większość helu w skorupie Ziemi (około 99% znajdowanego w złożach gazów, jak wynika z niskiej zawartości 3He) powstała jako cząstki alfa w rozpadzie alfa[147].
Istnieje kilka pierwiastków śladowych, które nie były obecne na Ziemi na jej początku, ani nie są produktami rozpadów cięższych pierwiastków. Przykładowo 14C powstaje w sposób ciągły w górnych warstwach atmosfery w wyniku zderzeń niskoenergetycznych neutronów z jądrami azotu[148]. Pewna liczba nowych atomów została wytworzona sztucznie w reaktorach i wybuchach jądrowych[149][150]. Wśród transuranowców (pierwiastków o liczbie atomowej powyżej 92) tylko pluton i neptun występują naturalnie na Ziemi[151][152]. Mają one czasy połowicznego rozpadu wielokrotnie mniejsze od czasu istnienia Ziemi[153], dlatego nieokreślone ich ilości mogły się w przeszłości rozpaść na lżejsze pierwiastki. Naturalnie występujące jądra plutonu i neptunu powstały w wyniku wychwytu neutronu przez jądra uranu[154].
Ziemia zbudowana jest z około 1,33×1050 atomów[155], głównie z atomów żelaza (35% masy), tlenu (30%), krzemu (15%) i magnezu (12%)[155]. Atmosfera ziemska składa się głównie z azotu (N2), tlenu (O2), pary wodnej (H2O), argonu (Ar) i dwutlenku węgla (CO2). Na powierzchni Ziemi atomy tworzą wiele cząsteczek chemicznych, począwszy od prostych, jak woda, sole i tlenki, do bardzo złożonych, takich jak białka. Atomy tworzą też substancje nie zbudowane z sumy oddzielnych cząsteczek chemicznych, lecz tworzące struktury ciągłe, w których nie da się wydzielić poszczególnych cząsteczek – metale, niektóre kryształy nieorganiczne, szkła i wiele innych[156][157][158].
Choć wszystkie nuklidy o liczbie atomowej większej niż 82 (ołów) są radioaktywne, teoretyczne modele przewidują istnienie „wyspy stabilności” – zbioru pierwiastków o liczbach atomowych powyżej 103, które miałyby stosunkowo stabilne izotopy[159]. Najbardziej stabilnym pierwiastkiem w tym zbiorze miałby być niezsyntetyzowany dotychczas unbiheks, o 126 protonach i 184 neutronach w jądrze[160].
Sztucznie wytworzono też pewne egzotyczne atomy, w których proton, neutron albo elektron zastąpiono inną cząstką o takim samym ładunku. Przykładowo zastępując w atomie wodoru elektron przez mion uzyskuje się atom mionowy[161][162][163], zaś zastępując proton przez antymion (mion dodatni) uzyskuje się mionium[164].
Atom, w którym zwykłe jądro atomowe zostało zastąpione przez hiperjądro, nazywa się hiperatomem. Hiperjądra zawierają oprócz protonów i neutronów także cięższe bariony, zwane hiperonami. Takie jądra mają zwykle czas życia rzędu 10−10 s i mniejszy, jednak wystarczająco długi, aby można je było obserwować. Znane są jądra zawierające hiperon Λ0 i Σ−.
Jeszcze innym rodzajem cząstki jest pozytonium (oznaczane symbolem Ps), układ związany złożony z pozytonu i elektronu. Posiada ono szereg stanów energetycznych podobnych do atomu wodoru, ale ze względu na znacznie niższą masę częstości przejść między stanami energetycznymi są o ponad połowę mniejsze (stan podstawowy ma energię −6,8 eV)[165]. Pozytonium ulega anihilacji, ale w 2007 roku dowiedziono eksperymentalnie, że jest zdolne utworzyć molekułę „dwuatomową” Ps2[166].
Każdy fermion posiada odpowiadającą jej antycząstkę o przeciwnym ładunku. Ponieważ takie antycząstki anihilują w zetknięciu ze zwykłą materią, nie obserwuje się ich w przyrodzie[167][168]. Jednak w 1996 roku udało się sztucznie wytworzyć kilka atomów antywodoru w laboratorium CERN[169][170]. Dopiero w 2010 roku spułapkowano wytworzone atomy antywodoru[171], w 2012 roku zaproponowano metodę chłodzenia atomów antywodoru do temperatur rzędu milikelwinów[172].