抗生物質

抗生物質(こうせいぶっしつ、英語: antibiotic)は、微生物が産生する、他の微生物や細胞に作用してその発育などを抑制する作用を持つ物質のことである。これまでに200種類以上の抗生物質が細菌感染症の治療と予防に広く使用されている[1][2]。また、抗生物質の抗菌作用を利用した薬剤の総称として抗生剤と呼ばれこともある。抗生物質は細菌に対して作用する抗菌薬として使用されるのみならず、真菌や寄生虫、腫瘍に対して用いられることもある。
抗生物質は古来より使用されてきた。複数の文明がカビなどを感染症の治療に使用しており、古代エジプト、ヌビア、ギリシャなどでその記録が残されている。20世紀の初頭にポール・エーリッヒらが合成抗菌薬を開発したことで、選択毒性に基づく感染症の化学療法という概念がもたらされる。そして1928年にはアレクサンダー・フレミングが世界初の抗生物質であるペニシリンを発見し、ハワード・フローリーとエルンスト・ボリス・チェーンの研究により大量生産が可能になったことで普及が進んだ。その後、抗生物質の開発は1950年代から1970年代に黄金期を迎え、グリコペプチド系、ホスホマイシン、マクロライド系など、様々なクラスの抗生物質が発見されていった。
抗生物質を合成の観点から捉えると、抗生物質は放線菌などの微生物が、生存に必須な一次代謝産物を基に合成する二次代謝産物である。これまでに臨床的に使用されてきた抗生物質の約60%は放線菌に由来し、抗生物質は土壌から抗生物質を産生する放線菌のような微生物を分離することで発見されてきた。ほとんどの抗生物質は化学的に合成することが困難な構造を持つため、その生産は発酵によって成し遂げられる。また、発酵により産生した抗生物質はさらに化学的な修飾を加えることで、半合成の抗生物質として用いられることもある。このように生産された抗生物質はヒトの医療用途で治療・予防に使用されるほか、動物や植物に対して使用されることもある。
しかし、抗生物質の有効性と入手のしやすさから、不適正な使用につながり[3]、一部の細菌は抗生物質に対する耐性を進化させた[1][4][5][6]。 複数の抗生物質に対し耐性を示す多剤耐性菌の出現を受けて、世界保健機関は抗生物質が効かなくなるポスト抗生物質時代の到来を危惧している。このような背景を受けて、近年は土壌以外の環境から抗生物質の探索を行う試みが進められているほか、抗生物質に依存しない代替製剤の開発も進められている。
名称と定義
[編集]細菌や真菌などの微生物がある環境に2種類存在する場合に、一方の生育が阻害されることがある。共生 (symbiosis) と対義的なこの拮抗的な作用を抗生(antibiosis; 抗生現象・抗生作用とも[7])と呼び[8][9]、例としてアオカビによる細菌の発育抑制が知られる[10]。抗生物質 (antibiotic) は、微生物が産生する物質で抗生作用を持つものを指す用語であり[11]、前述したアオカビによる細菌の発育阻害は、アレクサンダー・フレミングがアオカビから発見した抗生物質であるペニシリンによるものである[12]。抗生物質の単語を初めて定義したのは、抗生物質の一種ストレプトマイシンを発見してノーベル賞を受賞したセルマン・ワクスマンである。彼は1940年代[注 1]に「微生物が産生し、他の微生物の発育を阻害する物質」の名称として抗生物質の単語を定義した[16]。ただし、この定義は抗生物質のヒトによる利用を前提としたものであり、自然界に存在する抗生物質は薬効の得られる濃度よりも低く、産生微生物と周囲の微生物の間に抗生作用が生じないとも言われる[11][16]。一方で、細菌の代謝系を選択的に阻害して宿主の代謝系を阻害しない抗生物質は、細菌感染症の治療薬として使用される[17]。2012年の推定によると、これまでに6~8万種類の微生物に由来する天然化合物が知られているが、その40%は抗生物質としての機能を有するとされ、その内、200~220種程度の物質が微生物に直接由来する抗生物質として治療に用いられてきた[18]。また、「細菌に対して作用して感染症の治療、予防に使用されている薬剤」の総称として「抗菌薬」 (antibacterial agents) が用いられる他、「抗生物質の抗菌作用を利用した薬剤」を指す通称として「抗生剤」という用語が使用される。ただし、抗菌薬、抗生物質、抗生剤の3つは細菌に対する作用を示す薬剤の総称として厳密には区別されずに使用されている[19]。抗生物質の中には抗菌薬以外の用途で使用されるものもあり、ポリエンマクロライド系のように細菌ではなく真菌に毒性を示して真菌感染症の治療に用いられる物質や、イベルメクチンの基となった物質で抗寄生虫作用を持つアベルメクチン、「ほかの微生物」のみならず抗腫瘍活性を持つアクチノマイシン、ラパマイシンのように免疫抑制効果や抗炎症作用を示す物質も微生物に由来する薬剤として利用されている[20]。
近年では化学合成で生産されるものや、天然の誘導体から半合成されるものもある[21]。ワクスマンは微生物によって産生される物質を抗生物質と定義したが、多くのβラクタム系抗菌薬やマクロライド系抗菌薬に代表される、天然物へ人工的に修飾を加えた半合成の抗菌薬も抗生物質と呼ばれる[14]。また、ピリドンカルボン酸系(キノロン系、ニューキノロン系)やサルファ剤など、完全に人工的に合成された抗菌性物質は、厳密には抗生物質には含まず「合成抗菌薬」と呼ぶが、抗生物質として扱われることもある[14][16][22]。
なお、エタノールやグルタルアルデヒドなどの消毒薬 (disinfectant) も微生物を死滅・不活化させる働きを持つが、一般に強い細胞毒性を示し、選択毒性を持たないために服用はできず、抗生物質を含めた抗菌薬とは区別される[23][24][25]。
歴史
[編集]近代以前の感染症治療
[編集]20世紀以前の世界において、感染症の治療は専ら伝統医学によって行われるものであった。抗菌性を持つ物質を利用した治療の記録は紀元前から既に存在している[26]。古代エジプトや古代ギリシャなどの古代文明社会では、特定のカビや植物を感染症の治療に利用した[27][28]。また、ヌビアのミイラからは大量のテトラサイクリンが検出されている。これは当時生産されていた発酵食品などに由来するテトラサイクリンが蓄積したものであると推測されており[29]、彼らが食事を通じたテトラサイクリンの摂取により感染症から守られていた可能性が指摘されている[30]。古くから行われていた治療法には有効性を検証されているものもあり、1000年前のレシピに従って野菜、ワイン、胆汁を混ぜて作った薬がメチシリン耐性黄色ブドウ球菌に対して有効性を示したとする報告が2015年になされている[31][32]。抗生物質への耐性の歴史も非常に古く、抗生物質が発見されるはるか昔、数十億年前からある種の耐性遺伝子は存在していたと推定されている[30][33]。
合成抗菌薬の開発
[編集]抗生物質の発見の前に、微生物が他の微生物の増殖を抑制する現象は知られていた。例えば1887年にはルイ・パスツールらが、炭疽菌を他の好気性細菌と一緒に培養すると増殖が抑制される現象を発見している。また1889年にはジャン・ポール・ヴュイルマンが、「ある生物が生存のために他の生物を殺す関係性」を抗生と定義している[34]。1890年代には緑膿菌の抽出物が多くの患者に対して使用した報告がなされており、抗生物質の臨床応用に関するおそらく世界初の報告とも言われる[31]。

近代的な抗菌薬の歴史はサルバルサンを開発したポール・エーリッヒと、ペニシリンを発見したアレクサンダー・フレミングの2人と結びつけられることが多く[30]、まずはエーリッヒらが色素に由来する合成抗菌薬を発見し[35][36][37]、選択毒性に基づく感染症の化学療法という概念を初めてもたらした[22][38]。エーリッヒらは当時重大な副作用の代償にわずかな効果しか得られない無機水銀塩によって治療されていた梅毒の治療薬を開発するため、秦佐八郎らと共に今日でいうところの化合物スクリーニングを1904年に開始した。彼らが1909年に試験した606番目の化合物は、梅毒に罹患したウサギに有効性を示し、後にヘキスト社によってサルバルサンとして販売される。エーリッヒはサルバルサンの開発で成功を収め、改良版であるネオサルバルサンは1940年代まで最も多く処方される治療薬だった[30][39]。彼らのスクリーニングを用いた治療薬開発の手法は他の合成抗菌薬の開発にも応用され、色素として開発されたプロントジルが感染症治療薬としても有用であることがゲルハルト・ドーマクらによって明らかにされるなど、サルファ剤をはじめとした様々な抗菌薬が発見されていった[30]。プロントジルの抗菌性を見出したドーマクは、1939年にノーベル生理学・医学賞を受賞している[注 2][40]。
発見と研究の黄金期
[編集]1928年9月3日のフレミングによるペニシリンの発見は一つの失敗を機に成されたものであり、セレンディピティとしても知られる[12][30]。フレミングは休日を終えて当時の職場であるセント・メアリーズ病院に出勤し、実験台で培養していたペトリ皿のブドウ球菌にカビがコンタミしていることに気づく。この時、フレミングはコンタミしたカビが周囲の細菌の増殖を抑制している様子を観察し、この増殖抑制がアオカビの産生する物質によるものであることと、その物質をペニシリンと名付けたことを論文として投稿した[12][41]。その後オックスフォード大学のハワード・フローリーとエルンスト・ボリス・チェーンらの研究により大量生産が可能になると、フローリーらはペニシリンの臨床試験を1941年から1942年にかけて実施する。この臨床試験でペニシリンは何ら副作用を示さずに絶大な効果を発揮した。ペニシリンは第二次世界大戦後には広く使われるようになり、1945年にはフレミング、フローリー、チェーンの3名が、ペニシリンの発見とその後の研究によってノーベル生理学・医学賞を受賞している[12]。

サルバルサン、プロントジル、ペニシリンの3つの抗菌薬の発見はその後の抗菌薬の開発研究に大きな影響を与え、1950年代から1970年代にかけて抗生物質研究は黄金期を迎える[30]。1930年代の終わりにはセルマン・ワクスマンが抗生物質の探索を開始する[31]。1940年代に抗生物質を定義したワクスマンは[13][14]、結核に有効なネオマイシンやストレプトマイシンなど多数の抗生物質を発見し[31]、その貢献に対して1952年にはノーベル生理学・医学賞が授与された[42]。
この時代の抗生物質の発見は土壌のスクリーニングを行って有用な微生物を発見することによって成し遂げられた。そのため、この時代の製薬会社は世界中から土壌試料を集めて回っている。例えばエリスロマイシンを産生する放線菌は、イーライリリー・アンド・カンパニーが雇っていたフィリピンの医師が1949年に庭で発見したものである[43]。放線菌は抗生物質を産生する主要な微生物として知られ、1945年から1978年までの間に発見された抗生物質のうち55%は放線菌に由来するものである[31]。この時代に発見・開発された新しい系統の抗生物質・合成抗菌剤としてアミノ配糖体、セファロスポリン、クロラムフェニコール、テトラサイクリン、マクロマイド、キノロン、トリメトプリムなどが挙げられる。抗生物質開発の黄金期を迎えた研究者の中には感染症の克服を期待した者もいたが、それ以降、新しい系統の抗生物質の発見はほとんど無く、一方で1990年代頃から新興感染症や薬物耐性の問題は大きくなっていった[44]。
耐性菌の出現と新たなアプローチ
[編集]上述の通り、抗生物質への耐性は抗生物質を人類が使用する前から存在していた。例えば、イギリスの標準菌株として初めて登録された細菌は1915年に登録された赤痢菌だが、この菌株はペニシリンとエリスロマイシンに対する耐性遺伝子を持つことが2014年に明らかにされた。一方で人類の農業と医療における抗生物質の利用は、環境中における耐性菌を増加させ、抗生物質の効果を減じてきたことが知られる[45]。
現在においては耐性菌の出現は不可避であり、時間の問題でしかないと考えられており、抗生物質が使用されるようになると数ヶ月から数年後には耐性菌が出現する[14]。サルファ剤の耐性は1930年代に知られる様になり、1928年に発見されたペニシリンも、本格的に使用される様になる前の1940年にはペニシリンを分解する酵素の存在がペニシリンの開発者によって発見されている[16]。サルファ剤やペニシリン以外にも、例えばストレプトマイシンは1944年に発見の翌年には耐性菌が発見されている。バンコマイシンは例外的で、耐性菌の出現は導入からおよそ30年が経過した1987年のことであった。バンコマイシンの耐性出現が遅れた背景にはその限定的な利用があったと考えられる。これは1950年代から1960年代にかけての間は、バンコマイシンよりも優れた抗生物質が利用可能であったためである[14]。
1970年代からは新しい抗生物質がほとんど発見されなくなる[30]。例えば、グラクソ・スミスクラインやアストラゼネカは大規模なスクリーニングによる新規製剤開発研究を行ったが、目的とする抗生物質の実用には至っていない[31]。一方で耐性菌の出現により、既存の抗生物質は効果を失っていく。そこで、既存の抗生物質に対し、活性を高めたり、ヒトへの毒性を弱めたりするような改変を施すことで新しい抗菌薬を開発されるようになる。しかし改変された抗生物質に対しても細菌は耐性を獲得するため、ヒトと細菌の間で「いたちごっこ」は続いている[30]。近年では海洋やヒトのマイクロバイオームなどの土壌以外の環境から抗生物質を探索する試みもなされている[31]。
抗生物質に対する耐性菌の出現や、新規に開発される抗生物質の減少を受けて、抗生物質の代替が研究されている。この文脈における代替とは抗菌薬の様な化合物で細菌を制御するものではなく、細菌が感染する宿主の体を標的とした化合物や、細菌を標的とする従来の抗生物質とは異なる物質のことをいう。代表的な例として、細菌を標的とする抗体、宿主に健康上の利点をもたらす微生物と定義されるプロバイオティクス、ファージが産生して細菌を溶解する働きを持つライシンやファージ自体、自然免疫系を活性化する免疫賦活剤、感染を防ぐためのワクチンなどが挙げられる[46]。
分類
[編集]
抗生物質の分類は、化学構造からの分類と作用による分類の2つがある[21]。前者は新しい抗生物質の分類ができず、後者では作用機序が厳密に調べられていない抗生物質が分類できないことがある。従って両者を考慮した分類が理想的とされる[47]。
化学構造からの分類では、β-ラクタム系、アミノグリコシド系、マクロライド系、テトラサイクリン系、ペプチド系、核酸系、ポリエン系などに大別されるが、さらに細かくペニシリン系、セフェム系、モノバクタム系を加える場合もある[21]。
作用からの分類では、抗細菌性、抗カビ(真菌)性、抗腫瘍性などに分けられる。用途を重視する場合は、医療用、動物用、農業用などで分類される。作用域から、広範囲・狭域で区分される事もある[21]。作用機序から、細胞壁作用性などの呼称もある[21]。
抗菌薬
[編集]細菌に対する作用機序による抗菌薬の分類の一例としては、細胞壁合成阻害薬、タンパク質合成阻害薬、核酸合成阻害薬の3つに大きく分けるものがある[48]。また、葉酸代謝阻害薬を加えて4つに分類することもある[14]。
細胞壁合成阻害薬
[編集]細胞壁合成阻害薬に分類される抗生物質としてβラクタム系、ホスホマイシン、バンコマイシンがある。
細胞壁の合成経路
[編集]ほとんどの細菌は細胞膜の外側に細胞壁と呼ばれる構造を持つが[注 3]、動物細胞はこれを持たない。細菌は一般にグラム染色の染色像によりグラム陽性菌とグラム陰性菌に分類され、両者は細胞壁の構造の違いから区別されるが、いずれの細胞壁も共通してペプチドグリカンという高分子を構成成分として持つ。細菌の細胞は高い内部浸透圧を持ち、ペプチドグリカンはこの浸透圧から細菌を保護する働きを持つ。従ってペプチドグリカンを欠く細菌は細胞膜が破裂して死んでしまう[51]。
細菌の細胞壁はムレインとも呼ばれ、2つのアミノ糖と10個のアミノ酸から構成されるムレインモノマーがレンガのように組み立てられることで細胞壁が構成される。ムレインモノマーは細胞内で合成された後に細胞外へ輸送され、グリコシルトランスフェラーゼ (GT) と呼ばれる酵素とペニシリン結合タンパク質 (PBP) と呼ばれる酵素の両者の働きによって既存の細胞壁へ架橋され、細胞壁の合成が進められる。この2つの酵素は必ずしも別の酵素であるとは限らず、大腸菌の場合はPBPが2つの酵素の働きを兼ねる。細胞壁合成阻害薬のうち、β-ラクタム系とバンコマイシンはPBPの作用を阻害するが、ホスホマイシンは細胞内におけるムレインモノマーの合成を阻害する[52]。
β-ラクタム系
[編集]

β-ラクタム系の抗生物質は最も普及した抗生物質で、アメリカ合衆国で処方される抗菌薬の65%はこの系統に属する[53]。1920年代に世界で初めて発見されたβラクタム系抗生物質でPenicillium notatumなどが産生するペニシリン、 1940年代にカビの一種Acremonium chrysogenumから初めて発見されたセフェム系の他、カルバペネム系、モノバクタム系など、様々な類似化合物が知られる[54]。β-ラクタム系の中でもセフェム系は特に処方されることが多く、β-ラクタム系の処方のうちおよそ半分はセフェム系の抗生物質である[53]。
β-ラクタム系はPBPの作用を阻害することでその薬理効果を発揮する。PBPは、ムレインモノマーの分子中に存在するD-アラニル-D-アラニンを認識して架橋を形成し細胞壁の合成を進めるため、D-アラニル-D-アラニンは細胞壁合成において重要な役割を果たす。ペニシリンに代表されるβ-ラクタム系の抗菌薬はこのD-アラニル-D-アラニンに類似した構造をしているため、PBPに結合し、PBPはムレインモノマーに結合できなくなってしまう。結果的に細胞壁の架橋が不十分になり、細菌は破裂死する。これがβ-ラクタム系の作用機序である[52][48]。
β-ラクタム系はその名の通り、β-ラクタム環と呼ばれる構造を持っている。β-ラクタム系ではこれに付随する側鎖の構造を変えることで抗菌スペクトルが異なる様々な抗菌薬が派生して開発されている[52]。
グリコペプチド系
[編集]
グリコペプチド系の抗生物質の代表例が1953年に土壌中の放線菌の一種 Amycolatopsis orientalisから発見されたバンコマイシンである。他にもテイコプラニンなどがこの系統に含まれる[55]。β-ラクタム系がPBPと結合して細胞壁の合成を阻害するのに対し、バンコマイシンはムレインモノマーの一部であるD-アラニル-D-アラニンと結合し、GTによるムレインモノマーの重合を阻害することで作用するとされる。分子が大きいため細胞外膜を通過しにくいという難点や副作用から「最後の手段」と呼ばれることもあるが、β-ラクタム系と作用機序が異なるため、メチシリン耐性黄色ブドウ球菌の様にβ-ラクタム系の抗菌薬に対し耐性を示す細菌の感染に対し、治療薬として使用される[56][57]。
ホスホマイシン
[編集]ホスホマイシンは1969年に発見された、Streptomyces fradiaeなどの放線菌が産生する、ホスホエノールピルビン酸のアナログである。上記2系統の細胞壁合成阻害薬と異なり、ホスホマイシンはムレインモノマーの部品となるN-アセチルムラミン酸の産生を阻害する。β-ラクタム系と併用することで相乗効果を示す[56][58]。
タンパク質合成阻害薬
[編集]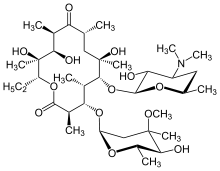
生物のDNAに保存された情報は転写によりmRNAに変換され、mRNAは翻訳されてタンパク質の合成に用いられる。リボソームはタンパク質合成の場であり、細菌の場合70Sリボソームが30Sサブユニットと50Sサブユニットの組み合わせによって構成される[48]。細菌のリボソームはヒトのリボソームとは部分的に異なった構造を持ち、タンパク質合成阻害薬は細菌のリボソームに高い親和性を持って作用する[59]。タンパク質合成阻害薬はヒトのタンパク質合成系には作用しないが、ミトコンドリアのリボソームには作用するため、投与量によってはヒトの細胞にも障害を与える。そのため、量的選択毒性を持つとも言われる。これは、動物細胞に存在しない細胞壁の合成を阻害するためにヒトに対して安全性が高く、質的選択毒性を示す細胞壁合成阻害薬と対照的である[60]。
タンパク質合成阻害薬はその阻害対象によって30Sサブユニットを対象とするものと、50Sサブユニットを対象とするものの2つに大きく分類できる。前者にはアミノ配糖体とテトラサイクリン系が、後者にはクロラムフェニコール、マクロライド系が含まれる[48]。アミノ配糖体(アミノグリコシド系)は1943年にStreptomyces griseusから分離されたストレプトマイシンに代表される抗生物質で、グラム陽性菌及びグラム陰性菌両者に対する広い抗菌スペクトルを持つ[61]。一方、アミノ配糖体の細胞内への取り込みには好気呼吸が必要であり、嫌気性菌に対しては有効性を欠く[62][63]。マクロライド系は、12個から16個の原子によって構成される大環状ラクトンと呼ばれる構造を持つ大きな分子で[64]、毒性が低く[65]、ブドウ球菌などのグラム陽性菌に優れた抗菌力を示す[66]。代表例として1952年に放線菌Saccharopolyspora erythreaから発見されたエリスロマイシンなどが知られる[64][67]。 テトラサイクリン系も極めて抗菌スペクトルの広い抗生物質で、4つの連なった環状構造を核として持つ。テトラサイクリンの他、テトラサイクリンの側鎖を変更して脂溶性を高めたドキシサイクリン、ミノサイクリンが知られる。テトラサイクリン系抗生物質はリボソームと結合し、アミノアシル-tRNAとリボソームの結合を阻害することでタンパク質合成を阻害する[68]。 クロラムフェニコールは極めて広い抗菌スペクトルを持つ抗生物質である。しかしながら、骨髄毒性を示すなど毒性が強く、治療目的で使用されることは多くない[59][69]。
核酸合成阻害薬
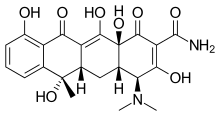
[編集]核酸合成阻害薬はRNA合成阻害薬とDNA合成阻害薬に分類され、いずれも量的な選択毒性を示す。前者はRNAポリメラーゼを阻害してmRNAの合成を抑制する[70]。1957年に分離されたノカルジア属菌、Nocardia mediterraneiはリファマイシンと呼ばれる抗生物質を産生する。リファンピシンはリファマイシンを化学的に修飾する事で得られたRNAポリメラーゼ阻害薬で、結核の治療における第一選択薬として使用される[71][72]。
抗真菌薬
[編集]ポリエンマクロライド系はエルゴステロールと呼ばれる真菌の細胞膜に特徴的なステロールに結合する。この結合によりエルゴステロールが細胞膜から奪われ、機能を阻害することで真菌に対する毒性を示す[73][74]。代表例として放線菌の一種Streptomyces nodususが産生するアムホテリシンBが知られ[75]、重篤な全身性の真菌感染症の治療に使用される[73]。
他にも真菌の細胞壁の成分である1,3-β-グルカンの合成を阻害するキャンディン系が知られる。キャンディン系抗生物質のミカファンギンは、福島県いわき市の土壌から分離された真菌の一種、Coleophoma empetri F-11899が産生する前駆物質を修飾して得られる抗真菌薬で、他の抗真菌薬に耐性を示す真菌にも使用される[76][77]。
抗腫瘍薬
[編集]マイトマイシンは細胞内で還元されて活性化するとDNAを架橋する働きを持つ抗生物質である。マイトマイシンを活性化する酵素は全身に分布するが、酸素が豊富な環境では還元が抑制される。従って相対的に低酸素状態にある固形がんに対し選択的に毒性を示すため、特にマイトマイシンCは抗がん剤として利用される[78][79]。
他にもDNAを切断する作用を持ち扁平上皮癌や悪性リンパ腫の治療に使用されるブレオマイシンや、二重結合によって隔たられた二つの三重結合炭素を持つことで構造的に特徴的なエンジインなどが抗腫瘍活性を持つ抗生物質として知られる[80]。
その他
[編集]アベルメクチンはノーベル生理学・医学賞を受賞した大村智らが放線菌Streptomyces avermitilisから分離した抗寄生虫抗生物質で、無脊椎動物のイオンチャネル阻害剤として機能する。これを改変したイベルメクチンはヒトや動物の寄生虫症の治療に用いられる[81][82]。
一般に抗生物質はウイルスに効果を示さないが[19]、抗生物質の中には抗ウイルス作用が報告されているものもある[83][84][85]。例えば、動物実験でネオマイシンは単純ヘルペスウイルスなどのウイルスに対して抗ウイルス作用を示した。この抗ウイルス作用を岩崎明子らの研究グループはTLR3を介したインターフェロン誘導遺伝子の活性化によって説明している。もっとも、この結果はネオマイシンのような抗生物質をウイルス感染症の治療に使うことを推奨するものではない[84]。
探索と生産
[編集]抗生物質は放線菌などの二次代謝経路を利用して生産される二次代謝産物である[86]<[87]。二次代謝産物は生物の生存に必須ではない物質をいい、アミノ酸、糖、ビタミン、核酸、タンパク質、脂質などの生存に必須な一次代謝産物から生合成される[87][82]。感染症治療に用いられる抗生物質をはじめ、様々な有用物質がこれまでに生物の二次代謝産物から発見されており、これはスクリーニングと呼ばれる手法によって探索されてきた。スクリーニングとは多数の化合物ライブラリの中から目的とする生理活性を有する物質を探索することをいい、特に微生物二次代謝産物は多種多様な化合物を含むことから現在においても有用な資源とされる[88]。
生合成
[編集]
抗生物質のような二次代謝産物は、一次代謝産物やその類似化合物を前駆物質として生合成される[87]。ペニシリンやセファロスポリンなどのβラクタム系抗生物質を一例に挙げる。これらの物質はPenicillum属などに含まれる一部の菌類とStreptomyces属などに含まれる一部の細菌によって合成されるが、産生する微生物を問わずβラクタム系の抗生物質は共通してイソペニシリンNと呼ばれる中間体を経由して合成される。このイソペニシリンNはトリペプチドをイソペニシリンNシンターゼによって修飾することで合成されるものであり、さらにこのトリペプチドはα-アミノアジピン酸、システイン、バリンの3アミノ酸で構成される。なお、このトリペプチドは通常のペプチド合成と異なりリボソームが関与しないで合成されるものであり、非リボソームペプチドとも呼ばれる[89]。このようにβラクタム系の抗生物質はアミノ酸を前駆物質として生合成される。同様に、ストレプトマイシンはアミノグリコシド系に分類される抗生物質だが、アミノグリコシド系の抗生物質は一次代謝産物であるグルコースを前駆物質として生成される。マクロライドは酢酸やプロピオン酸などの短鎖脂肪酸を前駆物質として生合成される。また、二次代謝経路は前駆物質のみならず合成に必要なエネルギーや補酵素も一次代謝で得られるものを利用している[13][82]。
探索
[編集]
1928年にフレミングがペニシリンを発見して以来、抗生物質を含めて数万種類の及ぶ微生物由来の天然化合物が発見されてきたが[18]、臨床的に使用される抗生物質の60%が放線菌に由来する。放線菌はカビのように菌糸状に発育する細菌で、一般的に土壌に生息する。通常1gの土壌には1億個の細菌、1,000万個の放線菌、100万個のカビが生息すると言われ、この中から抗生物質を入手する。もっとも、人体に対する毒性が少ない、耐性菌にも十分な効果を示す、低価格かつ安定的に供給できるなどの条件を満たす抗生物質はわずかであり、発見された抗生物質のうち実用化されるのは10%に満たない[90]。
土壌からの抗生物質の探索は次のような方法により行われる。まず、土壌を採取する。これを殺菌水に懸濁後、懸濁水を寒天培地の表面に塗る。数日後、培地状にコロニーが出現したらこれを分離し、各種微生物を収集する。次に収集した微生物が抗生物質を生産するか調べるために、収集した微生物を液体培地で培養し、培養液を得る。収集した微生物が抗生物質を産生する微生物であれば、培養液中に抗生物質が含まれることが期待されるため、遠心分離などで菌体を除き、菌体を除いた培養液を検定試料とする。次に、細菌に対する有効性を評価するため、グラム陰性菌やグラム陽性菌を被検菌として寒天培地に塗り、その上に検定試料を染み込ませた濾紙を置く。一晩の間培養し、濾紙の周りに被検菌の発育阻害を意味する阻止円が形成された場合は元の収集した微生物が抗生物質生産菌であると考えられるため、この微生物が産生する物質の化学構造や作用機序の調査が行われる[90][91][92]。
構造的にも新規の抗生物質であることが確認された場合、非臨床試験と臨床試験による安全性試験が行われ、さらに審査を受けて合格すると製造に至る。これらの工程を経て、一つの抗生物質が承認されて使用されるまでには10年から15年近くの期間が必要となる[90][93]。さらに平均的に言えば臨床試験が開始された抗菌薬のうち実用に至るのは16分の1ともされる[93]。抗菌薬の開発は製薬会社にとっても費用がかかるなどリスクが大きく、大手の製薬会社は抗菌薬の開発よりも生活習慣病や慢性疾患などの利益が出やすい治療薬の開発に重点を置くようになっている[18]。
一方、ゲノム配列の解読の結果、放線菌は20-30種類に及ぶ二次代謝産物の生合成遺伝子群を持つことが明らかになったが、ほとんどの二次代謝産物生合成遺伝子群は休眠状態にあって、二次代謝産物が生産されないか生産量が極めて少ないことが知られる。休眠遺伝子は培養条件の工夫などで顕在化させることも可能であり、新規の遺伝資源として活用が可能である。このような手法はゲノムマイニングとも呼ばれ、新たな抗生物質資源探索の手法として期待されている[18][94]。
生産
[編集]抗生物質の工業生産は発酵によって成し遂げられる。ほとんどの抗生物質は構造が複雑で不斉中心を多く持つために、天然型の抗生物質を化学的な全合成により商業生産することは難しい。例えばアミノグリコシド系のテイコプラニンは全合成の手法が報告されているが、費用の高さから実用には至っていない。ただし、発酵による生産も品質管理は困難である。これは発酵に用いる菌株の種類によって不純物が異なったり、発酵の条件がまちまちであったりするためであり、一部の抗生物質は類似の化合物の混合物として生産されている[95]。
多くの抗生物質の生産は発酵学的に生産されており、生産方法は第二次世界大戦直後から60年の間でほとんど変わっていない[95]。ここではβラクタム系の抗生物質の生産法を例に挙げる。まずはペニシリン産生菌を、抗生物質を産生しない条件の下、フラスコの中で培養し、増殖させる。徐々にスケールを大きくして増殖させ、最終的に培地を抗生物質産生用のものに変えて半回分培養などによって抗生物質を生産させる[95][96]。培養槽の容積は20,000−60,000ガロンにも及び、培養には120時間から200時間の時間をかける。発酵の間は酸素の他、炭素源としてグルコースやスクロースなどの糖が連続的に供給される。ペニシリンは培養液中に排出されるため、発酵の最終段階で培養液を回収し、培養液から溶媒抽出によりペニシリンを精製する。不純物は活性炭によって除去され、最終的にカリウム塩として結晶化される。1990年代の時点におけるペニシリンの製造コストはkgあたり10ドルから20ドルとされる。生産されたペニシリンの75%はさらに修飾されて半合成のβラクタム系抗生物質として使用される[96]。
βラクタム系抗生物質のセファロスポリンCもペニシリンと同様に発酵によって生産される。セファロスポリンCは菌類の半回分培養によって生産されるが、抗生物質産生の段階でエネルギー源が糖から大豆油やピーナッツ油のような油脂に置換される。これにより分節胞子の形成が促進され、分節胞子によるセファロスポリンの産生が促進される。他にもメチオニン、酸素、窒素などが分節胞子形成やセファロスポリンC産生量に影響する。もっとも、セファロスポリンCのほとんどは化学的な手法か酵素化学的な手法により分解されて7-アミノセファロスポラン酸に変換され、他の半合成抗生物質の合成のために使用される[96][97]。
また、全ての抗生物質が発酵により生産されるわけではない。同じβラクタム系の抗生物質でも、カルバペネム系の抗生物質は最初に放線菌から得られたチエナマイシンが不安定であり、加えて半合成に有用な中間体が発酵により得られないことから、アミノ酸などの安価な材料を原料とした全合成によって生産される[95][98]。
医療における利用
[編集]抗生物質の大部分は抗菌薬として使用される。抗菌薬の投与方法は臨床薬理学の考え方が適用されている。細菌感染症に対する抗生物質の投与は、抗生物質は化学療法剤とは異なるものの、臨床医学的にはまとめて化学療法と呼ばれている。
その他、ポリエンマクロライド系抗生物質は真菌の治療に使用される。また、癌治療にはマイトマイシンCやブレオマイシン、アドリアマイシン、ドキソルビシンなどの抗生物質が使用される。またシクロスポリン、タクロリムス、エベロリムスも抗生物質であり、免疫抑制剤として膠原病、自己免疫疾患、移植医療の現場で活躍している。
治療
[編集]ある症状が感染に起因することが疑われ、かつそれを起因する病原体が明らかでない場合は経験的治療を行うことがある[99]。経験的治療においては結果が出るのに数日かかる培養検査の結果を待たずに、症状に基づいて広域スペクトル抗生物質が投与される[99][100]。厳密に感染起因菌を特定するためには培養などによる検査が必要だが、症状から病原体の推定が可能なこともある。例えば、蜂巣炎の病原体はレンサ球菌やブドウ球菌が尤もらしいと推定できるため、培養で陽性が得られなくとも抗菌薬による治療を開始できる[99]。一方、病原微生物が予めわかっていたり、検査により特定された場合には、抗菌スペクトルの狭い抗生物質が投与される。抗生物質投与の費用と毒性を抑え、かつ耐性菌の出現を抑制するためには、病原体の特定が重要となる[99]。
培養によって病原体が特定された場合、次に薬剤感受性試験を行い、病原体が特定の抗菌薬の存在下で発育可能か試験する。薬剤感受性試験で得られた最小発育阻止濃度の値を基に、病原体が各薬剤に対し、感受性か、耐性か、あるいは中間かを決定する。感受性の場合は通常投与される抗菌薬の量で感染を治療できることを意味する。通常、この過程を経ることで有効な抗菌薬を絞り込むことが可能となる[99]。
抗生物質が予防的に用いられることもあるが、予防的な投与は免疫抑制薬を服薬中の者、がん患者、手術を受けた患者のような免疫系の弱った者への投与に限定され、特にヒト免疫不全ウイルス感染者における肺炎の防止のために投与される[100]。外科手術における抗生物質の投与は切開部位の感染を防止する。予防的な抗生物質の投与は口腔外科的な手術で重要な役割を担い、菌血症やそれに続く感染性心内膜炎を防止する。また、好中球減少症における感染防止にも使用され、これは特に化学療法によるがん治療を受けるものに対して行われる[101][102][103]。ただし、薬剤耐性菌の問題が大きくなってからは、それ以前に比べて予防投与の効果が低減している可能性もある[104]。
投与経路
[編集]
抗生物質は様々な投与経路を持つ。通常は経口投与されることが多いが、全身感染症の場合などで点滴や注射によって投与されることもある[99]。感染部位が露出しているような場合は抗生物質が局所投与されることもあり、例えば結膜炎の際には結膜に対して目薬として、急性の外耳炎の場合には点耳薬として投与される。また、ニキビや蜂巣炎のような皮膚疾患の治療には外用薬として抗生物質が用いられることがある[105]。局所投与の利点は抗生物質の投与部位における濃度を高く、長く保つことができる点などにある。これにより全身的な吸収や毒性を抑え、抗生物質の投与量を減少し、それゆえに乱用の恐れを減ずることができる[106]。手術創に対する抗生物質の局所投与は、術創感染のリスクを軽減すると報告されてきた[107]。しかしながら、抗生物質の局所投与に対しては一般的に懸念材料が存在する。抗生物質が吸収されて全身へ移行する可能性もあり、その場合には抗生物質の投与量の正確な調節が困難となる。また、局所性の過敏反応や、接触性皮膚炎を生じる可能性もある[106]。
併用療法
[編集]結核などの感染症の治療においては数種類の抗生物質を同時に使用する併用療法が行われることがある[108]。併用療法は経験的治療における抗菌スペクトラムの拡大、相乗効果による治療効果の増大、耐性菌出現の抑制などを目的として行われる[109]。急性の細菌感染においては、治療効果の向上のために、単剤よりも効果の大きい複数の抗生物質の組み合わせが相乗効果を狙って投与され[110][111]、メチシリン耐性黄色ブドウ球菌の感染ではフシジン酸とリファンピシンの併用により治療が行われる[110]。グラム陰性菌感染に対して併用療法による治療を行う場合はβラクタム系にアミノ配糖体かフルオロキノロンが組み合わされる[109]。また、抗生物質の組み合わせが単剤投与の場合よりも低下する場合もあり、これを拮抗作用と呼ぶ[110]。一般的には静菌作用を持つ抗生物質と殺菌作用を持つ抗生物質の組み合わせは拮抗的である[110][111]。ただし、併用療法の有効性は実験的条件下においてのみ実証されている場合があり、例えばグラム陰性菌に対する併用療法の臨床における効果については疑問視する意見もある[109]。
抗生物質と他の抗生物質の組み合わせに加え、抗生物質が抗生物質への耐性を抑える薬剤と共に用いられることもある。例えば、ベータラクタム系抗生物質を分解する酵素であるβ-ラクタマーゼを持つ細菌に感染した患者に対しては、βラクタム系の抗生物質がクラブラン酸やスルバクタムのようなβ-ラクタマーゼ阻害薬と併用されることがある[112]。
動植物への使用
[編集]抗生物質はヒトの医療においてのみならず、動物や植物に対しても使用される[113][114]。中にはヒトのみに使用されるもの、動物に対してのみ使用されるものも存在するが、多くの抗生物質はヒトとその他の動物の両者に使用される。抗生物質が投与され得る動物としてヒト以外の哺乳類、鳥類、魚類、昆虫などが例示される。また、テトラサイクリン系やストレプトマイシンなど一部の抗生物質は果樹に対しても使用される[113][115]。1997年の統計によると、ヨーロッパではヒトの医療用途で5,460,000 kgの抗生物質が使用された一方、動物への使用量も5,040,000 kgに上り、世界的に見ておよそ50%の抗生物質が動物に対して使用されると推定される[114]。また、アメリカ食品医薬品局によると、2019年の一年間でアメリカ合衆国内において動物用に販売された、医療用にも使用される抗菌薬の量は6,189,260 kgに上り、その内67%をテトラサイクリン系抗生物質が占めていた。なお、動物に対する抗菌薬の使用量は2015年の9,702,943 kgが最大となっており、それと比べると36%減少している。また、動物の種別では牛と豚に対する抗菌薬の使用がそれぞれ2,529,281 kgと2,582,399 kgに及び、これは動物に対する抗菌薬の使用量のそれぞれ41%と42%を占めている[116]。
動物への使用
[編集]
上述の通り、ヒトに対して抗菌薬を用いる場合、抗菌薬の投与は原則的に治療を目的とする。一方、ヒト以外の動物に対して用いる場合は事情が異なる。動物の中でも犬や猫のようなペットに対して抗菌薬を用いる場合、使用方針はヒトと同様であり、原則的に感染の治療を目的として個々の動物に対して抗菌薬が用いられる。例外的に予防的投与が行われることもあるが、これは手術後など特定の条件に限られる。一方、食肉を目的として飼育される動物の場合、群の一部の個体が症状を示していて、大多数の個体が無症状でも、餌や水を通して抗菌薬が群全体に投与されることがある。このような集団単位での抗菌薬の使用がヒトに対して行われるのは稀であり、その場合も濃厚接触がある個人など特定の個人にしか用いられない[113]。
最も議論を招いているのは成長促進を目的とした経済動物に対する長期の低容量の抗菌薬の使用である。これは動物の治療を目指すものではなく、経済的利点から抗生物質が使用される。畜産における抗生物質の使用は1950年代から始まり、アメリカ合衆国の農家で薬用量に満たない低用量の抗菌薬の家畜への投与が、家畜の体重増加を大幅に早めるために利用されてきた。肥育目的で用いられた抗生物質に分類される抗菌薬としては、例えば、ペニシリン、オキシテトラサイクリン、エリスロマイシン、スピラマイシン、タイロシンなど多岐にわたる[117]。実験動物のマウスへの抗生物質の低用量投与でも体重増加を示した。生後6か月のヒトの幼児でも抗生物質の投与と体重増加が関連を示していた[118]。低容量の抗生物質が成長促進に有効なことは再現性が示されているが、その機序は明らかでない。また、そのような効果は衛生的環境では生じないことが知られている。腸内の微生物叢へ影響を与えることによるという説もあるが、なぜ最小発育阻止濃度に満たない抗生物質が効果を示すのが不明である。そのため、免疫系におけるサイトカインの放出を抑制することで炎症細胞を阻害し、結果として食欲不振から動物を守るという機序も提唱されている[119][120]。
低容量の抗菌薬の長期にわたる使用は耐性菌を生じやすく、また耐性菌は動物の間のみならず食事や環境を通してヒトにも伝播しうる[113]。例えば、バンコマイシンに類似した構造を持ってグラム陽性菌に効果を示す抗生物質であるアボパルシンは、家禽やブタの成長促進用途で使用されるが、アボパルシンを使用した農場ではバンコマイシン耐性腸球菌が検出されやすくなる。バンコマイシン耐性腸球菌はイギリス、ドイツ、デンマークの家畜から検出されており、この耐性菌が欧米の医療施設で急速に拡散したと考えられている[121]。加えて抗菌薬の使用による経済的な利得もないか、あっても耐性の出現に比して小さいものである[113]。一方、ヨーロッパでは2006年から成長促進を目的とした抗菌薬の使用を全面的に禁止している[122]。デンマークでの研究では家畜の成長促進を目的としたアボパルシンの使用禁止のみではバンコマイシン耐性腸球菌の検出率は下がらなかったが、さらにマクロライド系抗菌薬の使用も禁止したところ、バンコマイシン耐性腸球菌の検出率が減少した。これはバンコマイシン耐性遺伝子vanAとマクロライド耐性遺伝子ermBが連鎖して伝播することによって説明されている[121]。
植物への使用
[編集]
畜産における抗生物質の使用は1950年代から始まっているが、植物に対してもペニシリン、ストレプトマイシン、クロルテトラサイクリン、クロラムフェニコール、オキシテトラサイクリンなどが病気から植物を守るために使用できないか1940年代後半から検討されてきた。しかしながら低容量では効果がない、高容量では薬害が問題となる[注 4]、他の防除法と比して費用がかかるといった点から、実際にはストレプトマイシンとオキシテトラサイクリンが特定の病気に使用される様になったのみである[115]。植物に対して使用する場合、水に溶かして散布することにより使用される。費用の問題から、実際に使用されるのは生産品が高価な果樹や野菜と観葉植物などのようにコストの回収が容易な植物に対してのみである[124]。また、アメリカ合衆国の場合、植物に対して使用される抗生物質はアメリカ合衆国内の抗生物質使用量の0.1%以下と言われる[125]。ストレプトマイシンは植物の疾患制御に使われる主要な抗生物質で、リンゴやナシの火傷病を引き起こすErwinia amylovoraや、リンゴやナシの花弁・果実に感染するPseudomonas syringae、トマトなどの斑点細菌病の原因菌であるXanthomonas campestrisなどの病原体に対して使用される。またモモなどの斑点細菌病に対してはオキシテトラサイクリンが用いられる[115]。他に日本ではカビによって生じるイネの病気であるイネいもち病の防除に、ブラストサイジンSやカスガマイシンなどの抗生物質が利用されている[126][127]。
また、植物の根と微生物は共生関係にあることがあり、特に菌類と植物の根の相互作用が行われる場は菌根圏と呼ばれることもある。菌根圏に存在する微生物には放線菌のように抗生物質を産生するものもおり、これが植物に対する有害微生物の増殖を抑制するとも考えられている[128]。
耐性と乱用
[編集]薬剤耐性
[編集]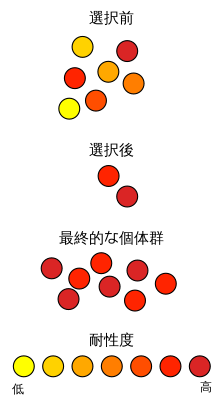
細菌学において抗菌薬が効かないことを耐性といい、耐性を持つ細菌のことを耐性菌と呼ぶ。2009年現在において使用されてきた全ての抗生物質のいずれに対しても耐性菌が報告されており、これは合成抗菌薬についても同様である[129]。例えば1940年代には事実上、全てのグラム陽性菌がペニシリンに感受性だったが[130]、1991年までに病院で検査される黄色ブドウ球菌の38%がペニシリンより強力なβラクタム系抗生物質であるメチシリンに対して耐性を示すようになった[130][131]。後述の通り、細菌は様々な機構で抗生物質に対する耐性を持つが、特に複数の抗生物質に耐性を示す多剤耐性菌が問題化している。
耐性獲得機構
[編集]
細菌の持つ抗生物質への耐性は、その細菌が生来持つものと、新たに獲得されるものとがある。前者の例としては緑膿菌の、細胞外膜の透過性が低いことによる、多くの抗生物質への自然発生的な耐性があげられる。後者の耐性獲得に関わる機構としては、プラスミドやトランスポゾンといった外来性遺伝子の取り込むによるものに加え、染色体上の変異によって発生することもある[14]。
外来遺伝子の取り込みは遺伝子の水平伝播とも呼ばれ、細菌の進化に重要な役割を果たすが、これによってしばしば耐性遺伝子が伝達される。抗生物質は土壌などの環境中に存在する微生物に由来するが、抗生物質を産生する微生物は当然にその抗生物質に対して耐性を持つ[45][132]。生態学的ニッチを共有する微生物もその抗生物質に対する耐性遺伝子を持っており、その様な遺伝子が医療現場で検出される病原体の耐性遺伝子の元となる可能性が高い[132]。現代においては土壌のような環境が耐性遺伝子の主要な発生源と考えられており、院内、ヒトや動物のマイクロバイオームなどを含む環境中の耐性遺伝子の集合のことをレジストームと呼ぶ[45]。
変異により耐性を獲得する場合、感受性を持つ細菌集団の中から抗生物質の活性に影響を及ぼす遺伝子変異を起こす細胞が出現し、その細胞が抗生物質に耐えて生き残る。生き残った細胞は抗生物質の存在下では選択圧により感受性を持つ細菌を駆逐して優先となる[132]。
一方、抗生物質は一般に細胞壁合成のように細菌の生存に重要な機能を標的としており、耐性の獲得はこれに変化を生じさせるため、ある環境における生存しやすさを意味する適応度が低下する。これは、変異による耐性の獲得のみならず、外来遺伝子の取り込みの場合でも同様である。例えば、プラスミドの獲得は一般に細菌の増殖効率を低下させて適応度を低下させる[133][134]。このように、耐性遺伝子は一般にコストが大きいため、抗生物質が存在しないと維持されない[132]。しかし、細菌が耐性の獲得による適応度の低下を補う変異を起こすことで適応度の低下を代償することもある。また、適応に必要なコストが低い、あるいは存在しない場合もある。そのため、抗生物質の使用量の減少により選択圧を低下させることで耐性菌の出現率を低下させることは、現実的ではないかもしれない[133]。
耐性のメカニズム
[編集]薬剤耐性のメカニズムは大きく(1)抗菌薬の取り込み低下や排出促進による抗菌薬の蓄積防止、(2)抗菌薬の分解や修飾による不活化、(3)抗菌薬の標的分子の変異や修飾による親和性の低下や過剰生産による抗菌薬の量的無効化に分類される[14][48]。
抗菌薬の取り込み低下や排出促進による抗菌薬の蓄積防止による耐性機構の一例として緑膿菌の自然耐性がある。全ての抗生物質は細菌の外膜を通過し、菌体内で蓄積することで機能を発揮するが、緑膿菌の外膜は抗生物質の透過性が低く、一般に抗生物質が効きにくい。また、細胞内へ透過したβラクタム系抗生物質やキノロン系抗菌薬を排出することでも耐性を持つ[14][135]。
抗菌薬の分解や修飾による不活化は、βラクタム系のような天然の抗生物質に対する耐性の主要なメカニズムである。典型的な例としてβラクタマーゼによるβラクタム系抗生物質に対する耐性機構が知られており、βラクタマーゼはベータラクタム環構造を加水分解することで、ペニシリンをはじめとしたβラクタム系抗生物質とPBPの結合を阻害し、細菌に耐性をもたらす[14]。これまでに数百種類のラクタマーゼが発見されており、一般的にはA、B、C、Dの4種類のクラスに分類される[129][48][136]。特にニューデリー・メタロβラクタマーゼ-1 (NDM-1) と呼ばれるβラクタマーゼは他のラクタマーゼと異なり特定の菌種のみならず多数の菌種に共有される、NDM-1の遺伝子を持つプラスミドが他の系統の耐性遺伝子も持つためにプラスミドを保持する細菌が多剤耐性となる、子どもの下痢の原因となる大腸菌にも伝播しうるために環境中に広がりやすいといった特徴を持ち、世界的に保健衛生上の脅威として認識されている[137][138]。
天然物に由来する抗生物質と異なり、サルファ剤やキノロン系などの合成抗菌薬を分解・修飾する酵素は発見されていない。このような抗菌薬に対する耐性は、抗菌薬の標的分子の変異や修飾による親和性の低下や過剰生産による抗菌薬の量的無効化によって獲得される[14]。例えばキノロン系抗菌薬への耐性はDNAジャイレースやDNAトポイソメラーゼのような酵素をコードする遺伝子に変異が生じることで発生する[48]。合成抗菌薬のみならず、天然物に由来する抗生物質に対する耐性も同様の機構で獲得されることがある。例えばテトラサイクリンは16SリボソームRNAと結合することでタンパク質合成を阻害する抗生物質であるが、アクネ菌やヘリコバクター・ピロリで16SリボソームRNA遺伝子の変異による耐性獲得が報告されている[136]。
多剤耐性菌
[編集]近年においてはメチシリン耐性黄色ブドウ球菌や多剤耐性結核菌のように、複数の抗菌薬に対し耐性を示す細菌が出現している。複数の抗菌薬に対し耐性を示すことを多剤耐性 (multidrug-resistant; MDR) と呼び、また多剤耐性を持つ細菌を多剤耐性菌と呼ぶ。加えて多剤耐性菌よりもさらに耐性の多い細菌を超多剤耐性 (extensively drug-resistant; XDR) 菌、全ての抗生物質に対し耐性を示す細菌を汎耐性 (pandrug-resistant; PDR) 菌と呼び、公衆衛生上の脅威となっている[139][140]。例えば、アメリカ疾病予防管理センターはアメリカ合衆国内で年間23,000人以上が多剤耐性を示す細菌の感染によって死亡していると推定している[132]。結核菌をはじめとした多数の細菌において多剤耐性の菌株が出現しており、治療用の抗生物質への耐性のために罹患率と死亡率の増加した微生物はスーパーバグと呼ばれることもある[16]。メチシリン耐性黄色ブドウ球菌や頭文字を取ってESKAPEと呼ばれる一群の細菌種(Enterococcus faecium、Staphylococcus aureus、Klebsiella pneumoniae、Acinetobacter baumannii、Pseudomonas aeruginosa、およびエンテロバクター属菌)がこれに含まれ、多剤耐性を示す院内感染起因菌として問題視される[138][141]。
乱用
[編集]
抗生物質の使用は耐性の出現に直結する。例えば、スウェーデンの調査では、抗生物質の使用量とペニシリン耐性肺炎球菌の小児感染者数の間に正の相関が認められた[142][143]。逆にイギリスの調査ではβラクタム系抗生物質の使用量の減少に伴ってペニシリン耐性肺炎球菌の割合が減少している。ただし、抗生物質の使用量の減少に伴う耐性の低下はマクロライドでは観察されていない[144][145]。いずれにしても、抗生物質の使用による選択圧の増加は耐性の増加につながると考えられており、抗生物質の使用は適正に行われる必要があると考えられている[19][145]。それにも拘らず、不適切な抗生物質の使用は未だに行われている[19][143]。例えば、2010~2011年にはアメリカ合衆国で1000人当たり505人に抗生物質が処方されたと推定されるが、その内、適正な処方は353件で、少なくとも約30%が不適正と推測されている[19][146]。
抗生物質の不適正な使用は、医師による抗生物質の効かないウイルス感染症に対しての処方や抗生物質がなくても治癒する感染症への処方、あるいは患者による自己判断の投薬によって生じる。また、患者は抗生物質を欲しがっていると考える医師の認識や、ウイルス性の上気道感染症に抗生物質が効くという患者の誤解が不適正な抗生物質使用の背景にある[143]。例えば、2010年のイギリスの調査によると、同国では48%の人が「抗生物質はウイルスを殺す」と考えていた[147]。一方、急性上気道感染症の9割は抗生物質が有効ではないウイルスによって生じるものであり、A群β溶血性連鎖球菌が検出された急性咽頭炎などの例外を除いて抗生物質の投与は推奨されない[19]。このような背景から、アメリカ合衆国で1995年から[148]、フランスでは2001年から[149]、抗生物質の適正使用を訴えるキャンペーンが開始されるなど各国で抗生物質の適正使用が啓発されている。日本でも2015年に世界保健機関で採択された「薬剤耐性(AMR)に 関するグローバル・アクション・プラン」を受けて、「薬剤耐性(AMR)対策アクションプラン」が2016年に取りまとめられた[150]。
ポスト抗生物質時代と新規薬剤の開発
[編集]抗生物質は数多くの命を救ってきたが、耐性菌の出現により既存の抗生物質が効かない事例も上述の通り生じており、WHOは抗生物質による感染症の治療ができなくなる「ポスト抗生物質時代」の到来を危惧している[151][152]。そのため、耐性菌にも有効な新たな薬剤の開発が今後も継続的に必要と予想される[46]。海洋やヒトのマイクロバイオームなどの土壌以外の環境から抗生物質を探索する試みもなされているが[31]、他にもゲノムマイニングが新たな抗生物質資源探索の手法として期待されている[18][94]。例えば、2014年に公表された研究では、ヒトマイクロバイオームから得られたメタゲノムを探索することで、ラクトバシラス属菌が産生するラクトシリンと呼ばれる未知の抗生物質を分離することに成功している[153]。同様に、2016年には、ヒトの鼻腔においてStaphylococcus lugdunensisの産生するルグドゥニンと呼ばれる環状ペプチドが抗生物質として作用することが明らかにされた。ルグドゥニンは黄色ブドウ球菌に代表されるグラム陽性菌の発育を抑制する作用を持ち、ルグドゥニン産生性のS. lugdunensisの存在下では黄色ブドウ球菌のラット鼻腔における増殖が抑制された[154][155]。一方、抗体製剤、プロバイオティクス、ファージ療法のように、抗生物質に依存しない代替製剤の開発も進められている[46]。
2020年現在、こうした細菌感染症に対する新規薬剤の研究は中小企業が中心的な役割を担っており、2020年に発表された総説[156] において分析された314の事業の内、中小企業の事業は81%を占めていた。この総説では新規抗生物質・抗生物質代替製剤の開発事業を次のように分類している。第1の分類は古典的抗生物質を含めた細菌の細胞に直接作用するものであり、187 (46%) の事業がこれに属する。33の事業はファージに関連するもので、細菌に直接作用する。次の分類は抗病原性剤を用いるもので、これも33の事業が該当する。例えば細菌の菌密度に応じて遺伝子発現を調節する仕組みであるクオラムセンシングを阻害する薬剤などがこれに含まれる。29の事業は抗体に関連したもので、毒素の中和抗体などが該当する。27の事業はワクチンであり、32の事業は他の薬剤、典型的には他の抗生物質を強化するもので、βラクタマーゼ阻害薬のような薬剤がこれに該当する。21の事業は微生物叢の操作を目指すもので、特に腸内微生物叢の調整を目的とする。プロバイオティクスがこれに該当する他、便微生物移植によるClostridium difficile感染症の治療が試験されている。他に、免疫賦活剤や既存薬の転用、ナノ粒子を用いた製剤なども開発が進められている[156]。
ファージ療法
[編集]
1910年代に発見されたファージ、あるいはバクテリオファージと呼ばれるウイルスは、細菌に感染してこれを殺してしまう。ファージ療法はこのファージを利用して病原性細菌を殺す手法である[151]。ファージの細菌感染症治療における可能性は1930年代から1940年代頃には認識されていたが、西側諸国では当時発見された抗生物質にとって変わられてしまい、その後は旧ソ連など東側諸国でのみ研究と実用が進んだ。しかしながら60年以上が経過した近年、抗生物質に対して耐性を示す病原性細菌の出現により、再び脚光を浴びている[157]。ファージ自体の利用のみならず、ファージが産生するエンドライシンと呼ばれる細菌を溶かす酵素も研究が進められている。ファージは細菌種に対し特異性を示すため、個々のファージ療法は特定の細菌種のみを対象とする。多くの研究事業が緑膿菌や黄色ブドウ球菌を対象とするが、Clostridium difficileの様なその他の細菌種、あるいは複数の細菌種を標的とする治療法も開発が進められている[156][158]。
抗病原性剤
[編集]抗病原性剤を用いる手法は細菌の産生する病原因子の産生や活性を抑制することを目的としており、細菌の発育自体には影響しない。例えば、大腸菌の尿路感染には細菌が尿路の上皮細胞に付着する、細胞接着が重要な役割を果たす。そのため、細胞接着に関わる分子の機能を阻害する薬剤は、尿路感染を防ぐことができるかもしれない[158]。また、クオラムセンシングは細菌が周囲の菌体と特定の遺伝子の発現量を同期したりするために用いられる情報伝達の手段である。このクオラムセンシングに関与する分子も新規製剤の標的として研究が進められている[158][159]。
病原性因子を標的とする戦略も種特異性が高く、緑膿菌、黄色ブドウ球菌、Clostridium difficileが標的とされている[156]。細菌を殺すことのない抗病原性剤は抗生物質にとって代わることを期待されているわけではなく、抗生物質のような他の薬剤を補完することを期待されている。それでもなお、実用には長い時間が必要とされる[158]。
微生物叢の操作
[編集]ある環境から採取された微生物の遺伝情報を分離培養なしに調査する技術であるメタゲノミクス技術の発展に伴い、ヒトマイクロバイオームと人の健康の関連性が知られる様になった。このヒトマイクロバイオームを操作する事でも感染を予防・治療することが可能であると考えられている。この場合、操作の標的となるのは腸内微生物叢であり、特にClostridium difficile感染が対象とされる[156][158]。
プロバイオティクス
[編集]プロバイオティクス (probiotics) は抗生物質の対義語として提唱されてきた用語で、「宿主の健康に良い影響をもたらす生きた微生物」と定義される。古典的には健常者の腸内に多く存在する細菌種が調査されてきており、BifidobacteriumやLactobacillusに属する乳酸菌が代表的である。プロバイオティクスの効果は抗生物質関連下痢症で示されている一方、Clostridium difficile感染においては効果が認められなかった。また、プロバイオティクスとしての摂取を止めても糞便からこれらの細菌が排出される人はごく一部にすぎないとする報告も複数なされている[160][161]。プロバイオティクスの効果は、場合によっては同じ種でも株ごとに異なり、さらに摂取する被験者の年齢や個人差にも影響を受けることが知られている。この様な背景から、異なる研究を横断的に分析するメタアナリシスやシステマティックレビューを行ってもなお効果の有無について矛盾した結果が得られることがあり、プロバイオティクスの効果については議論が続いている[162]。また、疾患・患者ごとに効果のあるプロバイオティクスが異なる可能性が指摘されることから、特定の個人に有効な菌を選択的に使用する、より個別化された使用法の開発も提唱されている[161][162][163]。
畜産業においては飼料添加物としての抗生物質の使用が耐性菌の出現を防ぐ目的で禁じられてきており、抗生物質の代わりの成長促進剤としてプロバイオティクスが注目されている。例えば日本では2014年現在、飼料の安全性の確保及び品質の改善に関する法律に基づき、11品目(28菌株)がプロバイオティクスとして指定されている[163][164]。
便微生物移植
[編集]
便微生物移植は健常者の糞便、または糞便に由来する腸内微生物を、腸内微生物叢の恒常性が破綻した患者の腸に移植することで、患者の腸内微生物叢の正常化する治療法である[165]。欧米で導入が進められており、再発性のClostridium difficile感染症における治療時の選択肢として使用される他、日本でも臨床研究が進められている[165][166]。一方で、移植便に耐性菌が含まれていたために患者が敗血症で死に至った事例が報告されており、移植便の適切なスクリーニングが重要と考えられている[166][167]。
脚注
[編集]注釈
[編集]- ^ ワクスマンはBiological Abstractsの編集長の問いかけに対し答える形で抗生物質 (antibiotic) という名詞を定義したが、その年については曖昧であり、1941年[13] とする場合と1942年[14] とする場合がある[15]。他に1945年に提唱したとする文献もある[11]。また、抗生 (antibiosis) の形容詞形としてのantibioticはワクスマンがantibioticを名詞として使用する前から利用されていた[15]。
- ^ ただし、ドーマクはナチスの圧力を受けて一度受賞を辞退し、1947年に改めて受賞した[40]。
- ^ 細胞壁は動物細胞以外の細胞、すなわち植物、真菌、細菌の細胞に存在するが、細胞壁を構成する成分は各々異なる。植物にはセルロース、ヘミセルロース、ペクチンが、菌類にはキチンが、細菌にはペプチドグリカンが含まれる[49]。逆にマイコプラズマのように細胞壁を持たない細菌も存在する[50]。
- ^ 例えばブラストサイジンSは高濃度でイネに薬斑と呼ばれる淡黄色の斑紋を生じる[123]。
出典
[編集]- ^ a b “Antibiotics”. NHS (5 June 2014). 17 January 2015閲覧。
- ^ “Factsheet for experts”. European Centre for Disease Prevention and Control. 21 December 2014時点のオリジナルよりアーカイブ。21 December 2014閲覧。
- ^ Laxminarayan Ramanan, Duse Adriano, Wattal Chand, Zaidi Anita KM, Wertheim Heiman FL, Sumpradit Nithima, Vlieghe Erika, Hara Gabriel Levy, Gould Ian M, Goossens Herman, others (December 2013). “Antibiotic resistance-the need for global solutions”. The Lancet. Infectious Diseases 13 (12): 1057-1098. doi:10.1016/S1473-3099(13)70318-9. PMID 242524836
- ^ “Public Confused About Antibiotic Resistance, WHO Says”. Medscape Multispeciality (16 November 2015). 21 November 2015閲覧。
- ^ “Antibiotics: from prehistory to the present day”. The Journal of Antimicrobial Chemotherapy 71 (3): 572-575. (March 2016). doi:10.1093/jac/dkv484. PMID 26851273.
- ^ Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons. (4 December 2013). p. 1. ISBN 978-3-527-33305-9
- ^ 吉川昌之介「抗生物質耐性菌の生態学 抗生物質と抗生物質耐性に関する生態学的考察; 変異 ・伝達 ・転移 ・選択」『Bulletin of Japanese Society of Microbial Ecology(日本微生物生態学会報)』第10巻第3号、日本微生物生態学会・日本土壌微生物学会、1995年、141-148頁、doi:10.1264/microbes1986.10.137、ISSN 0911-7830。
- ^ Kong, Kok-Fai; Schneper, Lisa; Mathee, Kalai (2010-01). “Beta-lactam antibiotics: from antibiosis to resistance and bacteriology: BETA-LACTAM RESISTANCE” (英語). APMIS 118 (1): 1-36. doi:10.1111/j.1600-0463.2009.02563.x. PMC 2894812. PMID 20041868.
- ^ 「抗生」『岩波生物学辞典』(第5版)岩波書店、2013年。ISBN 9784000803144。OCLC 1111577008。
- ^ Foster, W.; Raoult, A. (1974-12). “Early descriptions of antibiosis”. The Journal of the Royal College of General Practitioners 24 (149): 889-894. ISSN 0035-8797. PMC 2157443. PMID 4618289.
- ^ a b c Davies, Julian (2006-07). “Are antibiotics naturally antibiotics?” (英語). Journal of Industrial Microbiology & Biotechnology 33 (7): 496-499. doi:10.1007/s10295-006-0112-5. ISSN 1367-5435.
- ^ a b c d Lobanovska, Mariya; Pilla, Giulia (2017-03). “Penicillin's Discovery and Antibiotic Resistance: Lessons for the Future?”. The Yale Journal of Biology and Medicine 90 (1): 135-145. ISSN 1551-4056. PMC 5369031. PMID 28356901.
- ^ a b c Clardy, Jon; Fischbach, Michael A.; Currie, Cameron R. (2009-06). “The natural history of antibiotics” (英語). Current Biology 19 (11): R437-R441. doi:10.1016/j.cub.2009.04.001. PMC 2731226. PMID 19515346.
- ^ a b c d e f g h i j k l Yoneyama, Hiroshi; Katsumata, Ryoichi (2006-05-23). “Antibiotic Resistance in Bacteria and Its Future for Novel Antibiotic Development” (英語). Bioscience, Biotechnology, and Biochemistry 70 (5): 1060-1075. doi:10.1271/bbb.70.1060. ISSN 0916-8451.
- ^ a b Bentley, Ronald; Bennett, J. W. (2003). “What is an antibiotic? Revisited”. Advances in Applied Microbiology 52: 303-331. doi:10.1016/s0065-2164(03)01012-8. ISSN 0065-2164. PMID 12964249.
- ^ a b c d e Davies, Julian; Davies, Dorothy (2010-09). “Origins and Evolution of Antibiotic Resistance” (英語). Microbiology and Molecular Biology Reviews 74 (3): 417-433. doi:10.1128/MMBR.00016-10. ISSN 1092-2172. PMC 2937522. PMID 20805405.
- ^ Alberts, Bruce (2015). “Chapter 23: Pathogens and Infection”. Molecular biology of the cell (Sixth edition ed.). New York, NY. ISBN 978-0-8153-4432-2. OCLC 887605755
- ^ a b c d e Bérdy, János (2012-08). “Thoughts and facts about antibiotics: Where we are now and where we are heading” (英語). The Journal of Antibiotics 65 (8): 385-395. doi:10.1038/ja.2012.27. ISSN 0021-8820.
- ^ a b c d e f 厚生労働省健康局結核感染症課『抗微生物薬適正使用の手引き 第一版』(pdf)(レポート)厚生労働省、2017年6月。2017年12月10日閲覧。
- ^ Pham, Janette V.; Yilma, Mariamawit A.; Feliz, Adriana; Majid, Murtadha T.; Maffetone, Nicholas; Walker, Jorge R.; Kim, Eunji; Cho, Hyo Je et al. (2019-06-20). “A Review of the Microbial Production of Bioactive Natural Products and Biologics”. Frontiers in Microbiology 10: 1404. doi:10.3389/fmicb.2019.01404. ISSN 1664-302X. PMC 6596283. PMID 31281299.
- ^ a b c d e 生化学辞典第2版、p.471【抗生物質】
- ^ a b 標準微生物学(第10版), p. 142-143.
- ^ 標準微生物学(第10版), p. 54.
- ^ 辻明良『消毒薬 今昔(ヘッドライン:インフルエンザと化学)』公益社団法人 日本化学会、2010年。doi:10.20665/kakyoshi.58.11_514。2021年10月4日閲覧。
- ^ 仲川義人『感染症専門薬剤師の役割について』公益社団法人 日本薬剤学会、2005年。doi:10.14843/jpstj.65.258。2021年10月4日閲覧。
- ^ Lindblad, William J. (2008-06). “Review Paper: Considerations for Determining if a Natural Product Is an Effective Wound-Healing Agent” (英語). The International Journal of Lower Extremity Wounds 7 (2): 75-81. doi:10.1177/1534734608316028. ISSN 1534-7346.
- ^ Forrest, R. D. (1982-03). “Early history of wound treatment”. Journal of the Royal Society of Medicine 75 (3): 198-205. ISSN 0141-0768. PMC 1437561. PMID 7040656.
- ^ Wainwright, Milton (1989-01). “Moulds in ancient and more recent medicine” (英語). Mycologist 3 (1): 21-23. doi:10.1016/S0269-915X(89)80010-2.
- ^ Nelson, Mark L.; Dinardo, Andrew; Hochberg, Jeffery; Armelagos, George J. (2010-09). “Brief communication: Mass spectroscopic characterization of tetracycline in the skeletal remains of an ancient population from Sudanese Nubia 350-550 CE” (英語). American Journal of Physical Anthropology 143 (1): 151-154. doi:10.1002/ajpa.21340.
- ^ a b c d e f g h i Aminov, Rustam I. (2010). “A Brief History of the Antibiotic Era: Lessons Learned and Challenges for the Future”. Frontiers in Microbiology 1. doi:10.3389/fmicb.2010.00134. ISSN 1664-302X. PMC 3109405. PMID 21687759.
- ^ a b c d e f g h Hutchings, Matthew I; Truman, Andrew W; Wilkinson, Barrie (2019-10). “Antibiotics: past, present and future” (英語). Current Opinion in Microbiology 51: 72-80. doi:10.1016/j.mib.2019.10.008.
- ^ Harrison, Freya; Roberts, Aled E. L.; Gabrilska, Rebecca; Rumbaugh, Kendra P.; Lee, Christina; Diggle, Stephen P. (2015-09). Newman, Dianne K.. ed. “A 1,000-Year-Old Antimicrobial Remedy with Antistaphylococcal Activity” (英語). mBio 6 (4). doi:10.1128/mBio.01129-15. ISSN 2161-2129. PMC 4542191. PMID 26265721.
- ^ Garau, Gianpiero; Di Guilmi, Anne Marie; Hall, Barry G. (2005-07). “Structure-based phylogeny of the metallo-beta-lactamases”. Antimicrobial Agents and Chemotherapy 49 (7): 2778-2784. doi:10.1128/AAC.49.7.2778-2784.2005. ISSN 0066-4804. PMC 1168685. PMID 15980349.
- ^ Durand, Guillaume André; Raoult, Didier; Dubourg, Grégory (2019-04). “Antibiotic discovery: history, methods and perspectives” (英語). International Journal of Antimicrobial Agents 53 (4): 371-382. doi:10.1016/j.ijantimicag.2018.11.010.
- ^ Limbird, L. E. (2004-12-01). “The Receptor Concept: A Continuing Evolution” (英語). Molecular Interventions 4 (6): 326-336. doi:10.1124/mi.4.6.6. ISSN 1534-0384.
- ^ Williams, K. J. (2009-08). “The introduction of 'chemotherapy' using arsphenamine - the first magic bullet”. Journal of the Royal Society of Medicine 102 (8): 343-348. doi:10.1258/jrsm.2009.09k036. ISSN 1758-1095. PMC 2726818. PMID 19679737.
- ^ Bosch, Fèlix; Rosich, Laia (2008). “The Contributions of Paul Ehrlich to Pharmacology: A Tribute on the Occasion of the Centenary of His Nobel Prize” (english). Pharmacology 82 (3): 171-179. doi:10.1159/000149583. ISSN 0031-7012. PMC 2790789. PMID 18679046.
- ^ Aminov, Rustam (2017-06). “History of antimicrobial drug discovery: Major classes and health impact” (英語). Biochemical Pharmacology 133: 4-19. doi:10.1016/j.bcp.2016.10.001.
- ^ Singh, Ameeta E.; Romanowski, Barbara (1999-04). “Syphilis: Review with Emphasis on Clinical, Epidemiologic, and Some Biologic Features” (英語). Clinical Microbiology Reviews 12 (2): 187-209. doi:10.1128/CMR.12.2.187. ISSN 0893-8512.
- ^ a b “Gerhard Domagk, 1895-1964” (英語). Biographical Memoirs of Fellows of the Royal Society 10: 39-50. (1964-11). doi:10.1098/rsbm.1964.0003. ISSN 0080-4606.
- ^ Fleming, Alexander (1929-06). “On the Antibacterial Action of Cultures of a Penicillium, with Special Reference to their Use in the Isolation of B. influenzæ”. British journal of experimental pathology 10 (3): 226-236. ISSN 0007-1021. PMC 2048009.
- ^ Kresge, Nicole; Simoni, Robert D.; Hill, Robert L. (2004-11). “Selman Waksman: the Father of Antibiotics” (英語). Journal of Biological Chemistry 279 (48): e7-e8. doi:10.1016/S0021-9258(20)67861-9.
- ^ Katz, Leonard; Baltz, Richard H (2016-03-01). “Natural product discovery: past, present, and future” (英語). Journal of Industrial Microbiology and Biotechnology 43 (2-3): 155-176. doi:10.1007/s10295-015-1723-5. ISSN 1476-5535.
- ^ Conly, Jm; Johnston, Bl (2005). “Where are all the new antibiotics? The new antibiotic paradox” (英語). Canadian Journal of Infectious Diseases and Medical Microbiology 16 (3): 159-160. doi:10.1155/2005/892058. ISSN 1712-9532. PMC 2095020. PMID 18159536.
- ^ a b c Perry, Julie; Waglechner, Nicholas; Wright, Gerard (2016-06-01). “The Prehistory of Antibiotic Resistance”. Cold Spring Harbor Perspectives in Medicine 6 (6): a025197. doi:10.1101/cshperspect.a025197. ISSN 2157-1422. PMC 4888810. PMID 27252395.
- ^ a b c Czaplewski, Lloyd; Bax, Richard; Clokie, Martha; Dawson, Mike; Fairhead, Heather; Fischetti, Vincent A; Foster, Simon; Gilmore, Brendan F et al. (2016-02). “Alternatives to antibiotics—a pipeline portfolio review” (英語). The Lancet Infectious Diseases 16 (2): 239-251. doi:10.1016/S1473-3099(15)00466-1.
- ^ Jenkins, Amanda J.; Valentine, Jimmie L. (2012). Mozayani, Ashraf; Raymon, Lionel. eds (英語). Antimicrobial Drugs. Totowa, NJ: Humana Press. pp. 385-411. doi:10.1007/978-1-61779-222-9_10. ISBN 978-1-61779-221-2
- ^ a b c d e f g Kapoor, Garima; Saigal, Saurabh; Elongavan, Ashok (2017). “Action and resistance mechanisms of antibiotics: A guide for clinicians” (英語). Journal of Anaesthesiology Clinical Pharmacology 33 (3): 300. doi:10.4103/joacp.JOACP_349_15. ISSN 0970-9185. PMC 5672523. PMID 29109626.
- ^ 西沢 隆「細胞壁多糖類」『日本食品科学工学会誌』第55巻第10号、日本食品科学工学会、2008年、515-515頁、doi:10.3136/nskkk.55.515、ISSN 1341-027X。
- ^ Gautier-Bouchardon, Anne V. (2018-07-27). Aarestrup, Frank Møller; Schwarz, Stefan; Shen, Jianzhong et al.. eds. “Antimicrobial Resistance in Mycoplasma spp” (英語). Microbiology Spectrum 6 (4). doi:10.1128/microbiolspec.ARBA-0030-2018. ISSN 2165-0497.
- ^ 標準微生物学(第10版), p. 64-67.
- ^ a b c 標準微生物学(第10版), p. 144-148.
- ^ a b Bush, Karen; Bradford, Patricia A. (2016-08). “β-Lactams and β-Lactamase Inhibitors: An Overview” (英語). Cold Spring Harbor Perspectives in Medicine 6 (8): a025247. doi:10.1101/cshperspect.a025247. ISSN 2157-1422. PMC 4968164. PMID 27329032.
- ^ Brakhage, Axel A. (1998-09). “Molecular Regulation of β-Lactam Biosynthesis in Filamentous Fungi” (英語). Microbiology and Molecular Biology Reviews 62 (3): 547-585. doi:10.1128/MMBR.62.3.547-585.1998. ISSN 1092-2172.
- ^ Yim, Grace; Thaker, Maulik N; Koteva, Kalinka; Wright, Gerard (2014-01). “Glycopeptide antibiotic biosynthesis” (英語). The Journal of Antibiotics 67 (1): 31-41. doi:10.1038/ja.2013.117. ISSN 0021-8820.
- ^ a b 標準微生物学(第10版), p. 149-152.
- ^ Butler, Mark S; Hansford, Karl A; Blaskovich, Mark A T; Halai, Reena; Cooper, Matthew A (2014-09). “Glycopeptide antibiotics: Back to the future” (英語). The Journal of Antibiotics 67 (9): 631-644. doi:10.1038/ja.2014.111. ISSN 0021-8820.
- ^ Falagas, Matthew E.; Vouloumanou, Evridiki K.; Samonis, George; Vardakas, Konstantinos Z. (2016-04). “Fosfomycin” (英語). Clinical Microbiology Reviews 29 (2): 321-347. doi:10.1128/CMR.00068-15. ISSN 0893-8512. PMC 4786888. PMID 26960938.
- ^ a b 標準微生物学(第10版), p. 153-156.
- ^ 松本 慶蔵, 岩垣 明隆「4.最近の抗菌薬・抗生物質と使い方」『日本内科学会雑誌』第80巻第5号、日本内科学会、1991年、675-680頁、doi:10.2169/naika.80.675、ISSN 0021-5384。
- ^ Jospe-Kaufman, Moriah; Siomin, Liza; Fridman, Micha (2020-07-01). “The relationship between the structure and toxicity of aminoglycoside antibiotics”. Bioorganic & Medicinal Chemistry Letters 30 (13): 127218. doi:10.1016/j.bmcl.2020.127218. ISSN 1464-3405. PMC 7194799. PMID 32360102.
- ^ Ramirez, Maria S.; Tolmasky, Marcelo E. (2010-12). “Aminoglycoside modifying enzymes”. Drug Resistance Updates: Reviews and Commentaries in Antimicrobial and Anticancer Chemotherapy 13 (6): 151-171. doi:10.1016/j.drup.2010.08.003. ISSN 1532-2084. PMC 2992599. PMID 20833577.
- ^ Krause, Kevin M.; Serio, Alisa W.; Kane, Timothy R.; Connolly, Lynn E. (2016-06). “Aminoglycosides: An Overview” (英語). Cold Spring Harbor Perspectives in Medicine 6 (6): a027029. doi:10.1101/cshperspect.a027029. ISSN 2157-1422. PMC 4888811. PMID 27252397.
- ^ a b Vázquez-Laslop, Nora; Mankin, Alexander S. (2018-09). “How Macrolide Antibiotics Work”. Trends in Biochemical Sciences 43 (9): 668-684. doi:10.1016/j.tibs.2018.06.011. ISSN 0968-0004. PMC 6108949. PMID 30054232.
- ^ Brook, Itzhak; Wexler, Hannah M.; Goldstein, Ellie J. C. (2013-07). “Antianaerobic antimicrobials: spectrum and susceptibility testing”. Clinical Microbiology Reviews 26 (3): 526-546. doi:10.1128/CMR.00086-12. ISSN 1098-6618. PMC 3719496. PMID 23824372.
- ^ 西野 武志「薬剤耐性菌の耐性機構に関する研究―とくに自然耐性機構の解明―」『日本化学療法学会雑誌』第62巻第2号、2014年、177-191頁。
- ^ 「治療薬シリーズ(19)抗細菌薬 マクロライド系抗菌薬を中心に」『日本薬理学雑誌』第130巻第4号、2007年、294-298頁、doi:10.1254/fpj.130.294、ISSN 0015-5691。
- ^ Griffin, Michael O.; Fricovsky, Eduardo; Ceballos, Guillermo; Villarreal, Francisco (2010-09). “Tetracyclines: a pleitropic family of compounds with promising therapeutic properties. Review of the literature” (英語). American Journal of Physiology-Cell Physiology 299 (3): C539-C548. doi:10.1152/ajpcell.00047.2010. ISSN 0363-6143. PMC 2944325. PMID 20592239.
- ^ Oong, Ginny C.; Tadi, Prasanna (2021). Chloramphenicol. Treasure Island (FL): StatPearls Publishing. PMID 32310426
- ^ 標準微生物学(第10版), p. 157.
- ^ Sensi, P. (1983-07-01). “History of the Development of Rifampin” (英語). Clinical Infectious Diseases 5 (Supplement_3): S402-S406. doi:10.1093/clinids/5.Supplement_3.S402. ISSN 1537-6591.
- ^ Organization, World Health (2009). The Treatment of Tuberculosis. (4th ed ed.). Geneva: World Health Organization. ISBN 978-92-4-068535-2. OCLC 662259096
- ^ a b Robbins, Nicole; Caplan, Tavia; Cowen, Leah E. (2017-09-08). “Molecular Evolution of Antifungal Drug Resistance” (英語). Annual Review of Microbiology 71 (1): 753-775. doi:10.1146/annurev-micro-030117-020345. ISSN 0066-4227.
- ^ Ellis, David (2002-01-01). “Amphotericin B: spectrum and resistance” (英語). Journal of Antimicrobial Chemotherapy 49 (suppl_1): 7-10. doi:10.1093/jac/49.suppl_1.7. ISSN 1460-2091.
- ^ 深澤万左友「リポソーマル アムホテリシンB」『日本医真菌学会雑誌』第46巻第4号、日本医真菌学会、2005年、229-231頁、doi:10.3314/jjmm.46.229、ISSN 0916-4804、NAID 130003672136。
- ^ Hashimoto, Seiji (2009-01). “Micafungin: a sulfated echinocandin” (英語). The Journal of Antibiotics 62 (1): 27-35. doi:10.1038/ja.2008.3. ISSN 0021-8820.
- ^ 新見京子、新見昌一「キャンディン系抗真菌薬と耐性機構」『日本医真菌学会雑誌』第50巻第2号、日本医真菌学会、2009年4月、57-66頁、doi:10.3314/jjmm.50.057、ISSN 09164804、NAID 10024793163。
- ^ Tomasz, M. (1995-09). “Mitomycin C: small, fast and deadly (but very selective)”. Chemistry & Biology 2 (9): 575-579. doi:10.1016/1074-5521(95)90120-5. ISSN 1074-5521. PMID 9383461.
- ^ 河野一通、河西政次「マイトマイシン類の化学研究」『有機合成化学協会誌』第48巻第9号、有機合成化学協会、1990年、824-833頁、doi:10.5059/yukigoseikyokaishi.48.824、ISSN 00379980、NAID 130000926361。
- ^ Galm, Ute; Hager, Martin H.; Van Lanen, Steven G.; Ju, Jianhua; Thorson, Jon S.; Shen, Ben (2005-02-01). “Antitumor Antibiotics: Bleomycin, Enediynes, and Mitomycin” (英語). Chemical Reviews 105 (2): 739-758. doi:10.1021/cr030117g. ISSN 0009-2665.
- ^ 天然物化学(初版), p. 138−139.
- ^ a b c 池田治生, 大村智「放線菌ゲノム解析を応用した有用物質生産系の構築」『化学と生物』第44巻第6号、日本農芸化学会、2006年6月、391-398頁、doi:10.1271/kagakutoseibutsu1962.44.391、ISSN 0453073X、NAID 10017578177。
- ^ Dalhoff, Axel (2021-02). “Selective toxicity of antibacterial agents—still a valid concept or do we miss chances and ignore risks?” (英語). Infection 49 (1): 29-56. doi:10.1007/s15010-020-01536-y. ISSN 0300-8126. PMC 7851017. PMID 33367978.
- ^ a b Gopinath, Smita; Kim, Myoungjoo V.; Rakib, Tasfia; Wong, Patrick W.; van Zandt, Michael; Barry, Natasha A.; Kaisho, Tsuneyasu; Goodman, Andrew L. et al. (2018-05). “Topical application of aminoglycoside antibiotics enhances host resistance to viral infections in a microbiota-independent manner” (英語). Nature Microbiology 3 (5): 611-621. doi:10.1038/s41564-018-0138-2. ISSN 2058-5276. PMC 5918160. PMID 29632368.
- ^ Woods Acevedo, Mikal A.; Pfeiffer, Julie K. (2020-07). “Microbiota-independent antiviral effects of antibiotics on poliovirus and coxsackievirus” (英語). Virology 546: 20-24. doi:10.1016/j.virol.2020.04.001. PMC 7253499. PMID 32452414.
- ^ 基礎と応用 現代微生物学(初版), p. 49.
- ^ a b c 天然物化学(初版), p. 18-21.
- ^ 天然物化学(初版), p. 21-22.
- ^ Felnagle, Elizabeth A.; Jackson, Emily E.; Chan, Yolande A.; Podevels, Angela M.; Berti, Andrew D.; McMahon, Matthew D.; Thomas, Michael G. (2008-03). “Nonribosomal peptide synthetases involved in the production of medically relevant natural products”. Molecular Pharmaceutics 5 (2): 191-211. doi:10.1021/mp700137g. ISSN 1543-8384. PMC 3131160. PMID 18217713.
- ^ a b c 基礎と応用 現代微生物学(初版), p. 50-54.
- ^ Yarbrough, George G.; Taylor, Dean P.; Rowlands, Robert T.; Crawford, Mark S.; Lasure, Linda L. (1993). “Screening microbial metabolites for new drugs. Theoretical and practical issues.” (英語). The Journal of Antibiotics 46 (4): 535-544. doi:10.7164/antibiotics.46.535. ISSN 0021-8820.
- ^ Molinari, Gabriella (2009), Guzmán, Carlos A.; Feuerstein, Giora Z., eds., Natural Products in Drug Discovery: Present Status and Perspectives, 655, Springer New York, pp. 13-27, doi:10.1007/978-1-4419-1132-2_2, ISBN 978-1-4419-1131-5 2021年10月10日閲覧。
- ^ a b Payne, David J.; Gwynn, Michael N.; Holmes, David J.; Pompliano, David L. (2007-01). “Drugs for bad bugs: confronting the challenges of antibacterial discovery” (英語). Nature Reviews Drug Discovery 6 (1): 29-40. doi:10.1038/nrd2201. ISSN 1474-1776.
- ^ a b 池田, 治生「ポストゲノム時代に向けた微生物由来天然物医薬品の探索研究」『化学と生物』第54巻第1号、2015年、17-26頁、doi:10.1271/kagakutoseibutsu.54.17、ISSN 0453-073X。
- ^ a b c d Fedorenko, Victor; Genilloud, Olga; Horbal, Liliya; Marcone, Giorgia Letizia; Marinelli, Flavia; Paitan, Yossi; Ron, Eliora Z. (2015). “Antibacterial Discovery and Development: From Gene to Product and Back”. BioMed Research International 2015: 591349. doi:10.1155/2015/591349. ISSN 2314-6133. PMC 4538407. PMID 26339625.
- ^ a b c Elander, R. P. (2003-06). “Industrial production of β-lactam antibiotics” (英語). Applied Microbiology and Biotechnology 61 (5-6): 385-392. doi:10.1007/s00253-003-1274-y. ISSN 0175-7598.
- ^ 渡辺哲夫、阿部仁之助「合成ペニシリンとセファロスポリン」『化学と生物』第9巻第1号、1971年、10-17頁、doi:10.1271/kagakutoseibutsu1962.9.10、ISSN 0453-073X。
- ^ 伊藤芳雄、寺島孜郎「1β‐メチルカルバペネム鍵合成中間体の合成」『有機合成化学協会誌』第47巻第7号、有機合成化学協会、1989年、606-618頁、doi:10.5059/yukigoseikyokaishi.47.606、ISSN 00379980、NAID 130000931433。
- ^ a b c d e f Leekha S, Terrell CL, Edson RS (February 2011). “General principles of antimicrobial therapy”. Mayo Clinic Proceedings 86 (2): 156-167. doi:10.4065/mcp.2010.0639. PMC 3031442. PMID 21282489.
- ^ a b Antibiotics Simplified.. Jones & Bartlett Publishers. (2011). pp. 15-17. ISBN 978-1-4496-1459-1
- ^ Flowers CR, Seidenfeld J, Bow EJ, Karten C, Gleason C, Hawley DK, Kuderer NM, Langston AA, Marr KA, Rolston KV, Ramsey SD (February 2013). “Antimicrobial prophylaxis and outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology clinical practice guideline”. Journal of Clinical Oncology 31 (6): 794-810. doi:10.1200/JCO.2012.45.8661. PMID 23319691.
- ^ Bow EJ (July 2013). “Infection in neutropenic patients with cancer”. Critical Care Clinics 29 (3): 411-441. doi:10.1016/j.ccc.2013.03.002. PMID 23830647.
- ^ Freifeld, Alison G.; Bow, Eric J.; Sepkowitz, Kent A.; Boeckh, Michael J.; Ito, James I.; Mullen, Craig A.; Raad, Issam I.; Rolston, Kenneth V. et al. (2011-02-15). “Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America” (英語). Clinical Infectious Diseases 52 (4): e56-e93. doi:10.1093/cid/cir073. ISSN 1058-4838.
- ^ 冲中 敬二「抗がん剤治療患者における感染症対策について」『日本化学療法学会雑誌』第68巻第1号、2020年、132-142頁。
- ^ Pangilinan R, Tice A, Tillotson G (October 2009). “Topical antibiotic treatment for uncomplicated skin and skin structure infections: review of the literature”. Expert Review of Anti-Infective Therapy 7 (8): 957-965. doi:10.1586/eri.09.74. PMID 19803705.
- ^ a b Lipsky BA, Hoey C (November 2009). “Topical antimicrobial therapy for treating chronic wounds”. Clinical Infectious Diseases 49 (10): 1541-1549. doi:10.1086/644732. PMID 19842981.
- ^ Heal CF, Banks JL, Lepper PD, Kontopantelis E, van Driel ML (November 2016). “Topical antibiotics for preventing surgical site infection in wounds healing by primary intention”. The Cochrane Database of Systematic Reviews 11 (11): CD011426. doi:10.1002/14651858.CD011426.pub2. PMC 6465080. PMID 27819748.
- ^ Kerantzas, Christopher A.; Jacobs, William R. (2017-05-03). Rubin, Eric J.; Collier, R. John. eds. “Origins of Combination Therapy for Tuberculosis: Lessons for Future Antimicrobial Development and Application” (英語). mBio 8 (2). doi:10.1128/mBio.01586-16. ISSN 2161-2129. PMC 5350467. PMID 28292983.
- ^ a b c Tamma, Pranita D.; Cosgrove, Sara E.; Maragakis, Lisa L. (2012-07). “Combination Therapy for Treatment of Infections with Gram-Negative Bacteria” (英語). Clinical Microbiology Reviews 25 (3): 450-470. doi:10.1128/CMR.05041-11. ISSN 0893-8512. PMC 3416487. PMID 22763634.
- ^ a b c d Ocampo PS, Lázár V, Papp B, Arnoldini M, Abel zur Wiesch P, Busa-Fekete R, Fekete G, Pál C, Ackermann M, Bonhoeffer S (August 2014). “Antagonism between bacteriostatic and bactericidal antibiotics is prevalent”. Antimicrobial Agents and Chemotherapy 58 (8): 4573-4582. doi:10.1128/AAC.02463-14. PMC 4135978. PMID 24867991.
- ^ a b Bollenbach T (October 2015). “Antimicrobial interactions: mechanisms and implications for drug discovery and resistance evolution”. Current Opinion in Microbiology 27: 1-9. doi:10.1016/j.mib.2015.05.008. PMID 26042389.
- ^ Drawz SM, Bonomo RA (January 2010). “Three decades of beta-lactamase inhibitors”. Clinical Microbiology Reviews 23 (1): 160-201. doi:10.1128/CMR.00037-09. PMC 2806661. PMID 20065329.
- ^ a b c d e McEwen, Scott A.; Collignon, Peter J. (2018-04-06). Aarestrup, Frank Møller; Schwarz, Stefan; Shen, Jianzhong et al.. eds. “Antimicrobial Resistance: a One Health Perspective” (英語). Microbiology Spectrum 6 (2). doi:10.1128/microbiolspec.ARBA-0009-2017. ISSN 2165-0497.
- ^ a b Teuber, M (2001-10-01). “Veterinary use and antibiotic resistance”. Current Opinion in Microbiology 4 (5): 493-499. doi:10.1016/S1369-5274(00)00241-1.
- ^ a b c Sundin, George W.; Wang, Nian (2018-08-25). “Antibiotic Resistance in Plant-Pathogenic Bacteria” (英語). Annual Review of Phytopathology 56 (1): 161-180. doi:10.1146/annurev-phyto-080417-045946. ISSN 0066-4286.
- ^ “2019 Summary Report on Antimicrobials Sold or Distributed for Use in Food-Producing Animals | FDA”. www.fda.gov. 2021年9月29日閲覧。
- ^ 田中 信男・中村 昭四郎『抗生物質大要―化学と生物活性(第3版増補)』東京大学出版会、1984年、26頁。ISBN 4-13-062020-7。OCLC 834194215。
- ^ ロブ・ナイト等、山田卓司等訳、「細菌が人をつくる」p139、TEDブックス、2018年5月30日、ISBN 978-4-255-01057-1
- ^ Allen, Heather K.; Levine, Uri Y.; Looft, Torey; Bandrick, Meggan; Casey, Thomas A. (2013-03). “Treatment, promotion, commotion: antibiotic alternatives in food-producing animals” (英語). Trends in Microbiology 21 (3): 114-119. doi:10.1016/j.tim.2012.11.001.
- ^ Brüssow, Harald (2015-07). “Growth promotion and gut microbiota: insights from antibiotic use: Growth, microbiota and antibiotics” (英語). Environmental Microbiology 17 (7): 2216-2227. doi:10.1111/1462-2920.12786.
- ^ a b Wegener, Henrik C (2003-10). “Antibiotics in animal feed and their role in resistance development” (英語). Current Opinion in Microbiology 6 (5): 439-445. doi:10.1016/j.mib.2003.09.009.
- ^ Castanon, J.I.R. (2007-11). “History of the Use of Antibiotic as Growth Promoters in European Poultry Feeds” (英語). Poultry Science 86 (11): 2466-2471. doi:10.3382/ps.2007-00249.
- ^ 見里朝正「ブラストサイジンSの生化学」『化学と生物』第2巻第5号、日本農芸化学会、1964年、272-276頁、doi:10.1271/kagakutoseibutsu1962.2.272、ISSN 0453073X、NAID 130003439534。
- ^ McManus, Patricia S.; Stockwell, Virginia O.; Sundin, George W.; Jones, Alan L. (2002). “Antibiotic use in plant agriculture”. Annual Review of Phytopathology 40: 443-465. doi:10.1146/annurev.phyto.40.120301.093927. ISSN 0066-4286. PMID 12147767.
- ^ Vidaver, Anne K. (2002-06). “Uses of Antimicrobials in Plant Agriculture” (英語). Clinical Infectious Diseases 34 (s3): S107-S110. doi:10.1086/340247. ISSN 1058-4838.
- ^ Yamaguchi, Isamu (2004), Kawasaki, Shinji, ed. (英語), Overview on the Chemical Control of Rice Blast Disease, Springer Netherlands, pp. 1-13, doi:10.1007/978-0-306-48582-4_1, ISBN 978-90-481-6268-0 2021年10月23日閲覧。
- ^ 廣岡卓、石井英夫「植物病害の薬剤防除」『日本植物病理学会報』第80巻100th_Anniversary、日本植物病理學會、2014年、S172-S178、doi:10.3186/jjphytopath.80.S172、ISSN 00319473、NAID 130004779389。
- ^ 大野博司『共生微生物 : 生物と密接に関わるミクロな生命体』化学同人〈Dojin bioscience series ; 27〉、2016年、150-151頁。ISBN 978-4-7598-1728-7。 NCID BB22393247。OCLC 1033626853。
- ^ a b 標準微生物学(第10版), p. 159.
- ^ a b Palumbi, S. R. (2001-09-07). “Humans as the World's Greatest Evolutionary Force”. Science 293 (5536): 1786-1790. doi:10.1126/science.293.5536.1786.
- ^ Abramson, Murray A.; Sexton, Daniel J. (1999-06). “Nosocomial Methicillin-Resistant and Methicillin-Susceptible Staphylococcus Aureus Primary Bacteremia: At What Costs?” (英語). Infection Control & Hospital Epidemiology 20 (6): 408-411. doi:10.1086/501641. ISSN 0899-823X.
- ^ a b c d e Munita, Jose M.; Arias, Cesar A. (2016-03-25). Kudva, Indira T.; Zhang, Qijing. eds. “Mechanisms of Antibiotic Resistance” (英語). Microbiology Spectrum 4 (2). doi:10.1128/microbiolspec.VMBF-0016-2015. ISSN 2165-0497. PMC 4888801. PMID 27227291.
- ^ a b Andersson, Dan I.; Hughes, Diarmaid (2010-04). “Antibiotic resistance and its cost: is it possible to reverse resistance?” (英語). Nature Reviews Microbiology 8 (4): 260-271. doi:10.1038/nrmicro2319. ISSN 1740-1526.
- ^ 新谷 政己「「プラスミドパラドックス」~プラスミドはなぜ「生き残って」いる?~」『生物工学会誌』第96巻、2018年、25頁。
- ^ Lambert, P. A. (2002). “Mechanisms of antibiotic resistance in Pseudomonas aeruginosa”. Journal of the Royal Society of Medicine 95 Suppl 41: 22-26. ISSN 0141-0768. PMC 1308633. PMID 12216271.
- ^ a b Alekshun, Michael N.; Levy, Stuart B. (2007-03). “Molecular Mechanisms of Antibacterial Multidrug Resistance” (英語). Cell 128 (6): 1037-1050. doi:10.1016/j.cell.2007.03.004.
- ^ Nordmann, Patrice; Poirel, Laurent; Carrër, Amélie; Toleman, Mark A.; Walsh, Timothy R. (2011-02). “How To Detect NDM-1 Producers” (英語). Journal of Clinical Microbiology 49 (2): 718-721. doi:10.1128/JCM.01773-10. ISSN 0095-1137. PMC 3043507. PMID 21123531.
- ^ a b Moellering, Robert C. (2010-12-16). “NDM-1 — A Cause for Worldwide Concern”. New England Journal of Medicine 363 (25): 2377-2379. doi:10.1056/NEJMp1011715. ISSN 0028-4793. PMID 21158655.
- ^ Magiorakos, A.-P.; Srinivasan, A.; Carey, R.B.; Carmeli, Y.; Falagas, M.E.; Giske, C.G.; Harbarth, S.; Hindler, J.F. et al. (2012-03). “Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance” (英語). Clinical Microbiology and Infection 18 (3): 268-281. doi:10.1111/j.1469-0691.2011.03570.x.
- ^ 俊英, 岡島、雅之, 五十嵐、陽子, 江口、龍太郎, 内海「多剤耐性細菌に有効な次世代型抗菌薬:耐性細菌の出現しない抗菌薬の開発は可能か」『化学と生物』第57巻第7号、日本農芸化学会、2019年、416-427頁、doi:10.1271/kagakutoseibutsu.57.416。
- ^ Rice, Louis B. (2008-04-15). “Federal Funding for the Study of Antimicrobial Resistance in Nosocomial Pathogens: No ESKAPE” (英語). The Journal of Infectious Diseases 197 (8): 1079-1081. doi:10.1086/533452. ISSN 0022-1899.
- ^ Melander, E.; Ekdahl, K.; Jönsson, G.; Mölstad, S. (2000-12). “Frequency of penicillin-resistant pneumococci in children is correlated to community utilization of antibiotics”. The Pediatric Infectious Disease Journal 19 (12): 1172-1177. doi:10.1097/00006454-200012000-00011. ISSN 0891-3668. PMID 11144379.
- ^ a b c Larson, Elaine (2007-04-01). “Community Factors in the Development of Antibiotic Resistance” (英語). Annual Review of Public Health 28 (1): 435-447. doi:10.1146/annurev.publhealth.28.021406.144020. ISSN 0163-7525.
- ^ Livermore, David M.; Reynolds, Rosy; Stephens, Peter; Duckworth, Georgia; Felmingham, David; Johnson, Alan P.; Murchan, Stephen; Murphy, Olive et al. (2006-10). “Trends in penicillin and macrolide resistance among pneumococci in the UK and the Republic of Ireland in relation to antibiotic sales to pharmacies and dispensing doctors” (英語). International Journal of Antimicrobial Agents 28 (4): 273-279. doi:10.1016/j.ijantimicag.2006.05.025.
- ^ a b Hawkey, P. M. (2008-09-01). “The growing burden of antimicrobial resistance” (英語). Journal of Antimicrobial Chemotherapy 62 (Supplement 1): i1-i9. doi:10.1093/jac/dkn241. ISSN 0305-7453.
- ^ Fleming-Dutra, Katherine E.; Hersh, Adam L.; Shapiro, Daniel J.; Bartoces, Monina; Enns, Eva A.; File, Thomas M.; Finkelstein, Jonathan A.; Gerber, Jeffrey S. et al. (2016-05-03). “Prevalence of Inappropriate Antibiotic Prescriptions Among US Ambulatory Care Visits, 2010-2011” (英語). JAMA 315 (17): 1864. doi:10.1001/jama.2016.4151. ISSN 0098-7484.


 French
French Deutsch
Deutsch