ホタルルシフェリン
| ホタルルシフェリン | |
|---|---|
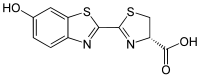 | |
(4S)-2-(6-hydroxy-1,3-benzothiazol-2-yl)-4,5-dihydrothiazole-4-carboxylic acid | |
別称 D-(−)-Luciferin, beetle luciferin | |
| 識別情報 | |
| CAS登録番号 | 2591-17-5 |
| PubChem | 92934 |
| ChemSpider | 4588411 16735812 One of the other tautomeric representations |
| UNII | 5TBB02N29K |
| EC番号 | 219-981-3 |
| |
| |
| 特性 | |
| 化学式 | C11H8N2O3S2 |
| モル質量 | 280.32 g mol−1 |
| λmax | 330 nm (neutral and somewhat acidic aqueous solutions) [1] |
| 吸光度 | ε330 = 18.2 mM−1 cm−1 [1] |
| 危険性 | |
| GHSピクトグラム |  |
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H315, H319, H335 |
| Pフレーズ | P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ホタルルシフェリン (Firefly luciferin、beetle luciferinとも) は、ホタル、railroad worm (Phengodidae)、starworm (Rhagophthalmidae)、コメツキムシ (Pyrophorini)の生物発光系に使用されるルシフェリンまたは発光化合物。ルシフェラーゼ (EC 1.13.12.7) の基質であり、多くのホタルの種類からの特徴的な黄色の発光に関与している。
他のすべてのルシフェリンと同様に、光を引き出すには酸素が必要である。しかし、発光にはアデノシン三リン酸 (ATP) とマグネシウムが必要であることが分かっている[2][3]。
歴史[編集]
ホタルの発光の化学に関する初期の研究の多くは、ジョンズ・ホプキンズ大学のWilliam D. McElroyの研究室で行われた。ルシフェリンは1949年に初めて単離及び精製されたが、化合物を高収率で結晶化する手順が開発されるまでには数年を要した。これは、合成と構造の解明とともに、ジョンズ・ホプキンズ大学化学科のDr. Emil H. Whiteにより行われた[4]。ルシフェリンのカルボキシ基を考慮して、抽出には酸塩基抽出が用いられた。ルシフェリンは、粉砕した約1万5千個のホタルの発光部位から低pHで酢酸エチルを使用して効果的に抽出することができた[5]。構造は、赤外分光法、紫外可視近赤外分光法、および化合物を識別可能な断片に分解する合成法を組み合わせて使用することで後に確認された[6]。
性質[編集]
結晶ルシフェリンは蛍光性であり、327nmにピークを持つ紫外光を吸収し、530nmにピークを持つ光を放出することが分かった。オキシルシフェリンが一重項励起状態から基底状態に緩和することで可視発光が生じる[7]。アルカリ性溶液では、ベンゾチアゾールのヒドロキシ基の脱プロトン化に起因すると思われる吸収の赤方偏移が見られたが、蛍光発光に影響はなかった。ルシフェリンのAMPエステルであるルシフェニルアデニル酸塩は、溶液中で自然に発光することが分かっている[8]。ホタルの種類により、同じルシフェリンを使用しても発する色が大きく異なる。Photuris pennsylvanicaの発する色の波長は552 nm(緑黄色)であり、Pyrophorus plagiophthalamusの発する色の波長は582 nm(橙色)と測定されている。このような違いはpHの変化やルシフェラーゼの一次構造の違いによるものと思われる[9]。ホタルルシフェリンの基質を改変することで赤方偏移した発光(波長675nmまで)が得られている[10]。
生物活性[編集]
in vivoでのホタルルシフェリンの合成は完全には解明されていない。D-システインと2-シアノ-6-ヒドロキシベンゾチアゾールとの縮合反応であり、化合物を合成的に生成するために使用されるのと同じ反応である、酵素経路の最終段階のみが研究されている[11]。これは、2つの化合物の原子の放射標識とluciferin-regenerating enzymeの同定により確認された[12]。
ホタルでは、ルシフェラーゼにより触媒されるルシフェリンの酸化により、ペルオキシ化合物である1,2-ジオキセタンが生成される。ジオキセタンは不安定であり、二酸化炭素と励起ケトンに自然に崩壊し、発光(生物発光)により過剰なエネルギーを放出する[13]。

ホタルルシフェリンとその修飾基質は脂肪酸を模倣しており、生体内の脂肪酸アミドヒロラーゼ (FAAH) の局在化に用いられている[14]。ホタルルシフェリンは、ABCG2トランスポーターの基質であり、トランスポーターの阻害剤をスクリーニングするための生物発光イメージングハイスループットアッセイの一部として使用されている[15]。
出典[編集]
- ^ a b “D-luciferin product information”. Sigma Aldrich. 2021年5月閲覧。
- ^ McElroy WD (1947). “The Energy Source for Bioluminescence in an Isolated System.”. Proc Natl Acad Sci USA 33 (11): 342–345. Bibcode: 1947PNAS...33..342M. doi:10.1073/pnas.33.11.342. PMC 1079070. PMID 16588763.
- ^ “Function of adenosine triphosphate in the activation of luciferin.”. Arch Biochem Biophys 64 (2): 257–271. (1956). doi:10.1016/0003-9861(56)90268-5. PMID 13363432.
- ^ “Purification of firefly luciferin.”. J Cell Physiol 34 (3): 457–466. (1949). doi:10.1002/jcp.1030340310. PMID 15406363.
- ^ “The Preparation and Properties of Crystalline Firely Luciferin”. Arch Biochem Biophys 72 (2): 358–368. (1957). doi:10.1016/0003-9861(57)90212-6. PMID 13479120.
- ^ “The Structure and Synthesis of Firefly Luciferin”. J Am Chem Soc 83 (10): 2402–2403. (1961). doi:10.1021/ja01471a051.
- ^ “Firefly Bioluminescence: A Mechanistic Approach of Luciferase Catalyzed Reactions”. IUBMB Life 61 (1): 6–17. (2009). doi:10.1002/iub.134. PMID 18949818.
- ^ “The synthesis and function of luciferyl-adenylate and oxyluciferyl-adenylate.”. J Biol Chem 233 (6): 1528–1537. (1958). PMID 13610868.
- ^ “The Spectral Distribution of Firefly Light.”. J Gen Physiol 48 (1): 95–104. (1964). doi:10.1085/jgp.48.1.95. PMC 2195396. PMID 14212153.
- ^ “Multicolor Bioluminescence Obtained Using Firefly Luciferin”. Current Topics in Medicinal Chemistry 16 (24): 2648–2655. (2016). doi:10.2174/1568026616666160413135055. PMID 27072707.
- ^ “Analogs of Firefly Luciferin.”. J. Org. Chem. 30 (7): 2344–2348. (1965). doi:10.1021/jo01018a054.
- ^ “Oxyluciferin, a Luminescence Product of Firefly Luciferase, Is Enzymatically Regenerated into Luciferin.”. J Biol Chem 276 (39): 36508–36513. (2001). doi:10.1074/jbc.M105528200. PMID 11457857.
- ^ Aldo Roda Chemiluminescence and Bioluminescence: Past, Present and Future, p. 57, Royal Society of Chemistry, 2010, ISBN 1-84755-812-7
- ^ “Luciferin Amides Enable in Vivo Bioluminescence Detection of Endogenous Fatty Acid Amide Hydrolase Activity”. J. Am. Chem. Soc. 137 (27): 8684–8687. (2015). doi:10.1021/jacs.5b04357. PMC 4507478. PMID 26120870.
- ^ “Identification of Inhibitors of ABCG2 by a Bioluminescence Imaging-Based High-Throughput Assay.”. Cancer Res. 69.
外部リンク[編集]
- Bioluminescence Page showing major luciferin types


 French
French Deutsch
Deutsch