Фулерени — Вікіпедія
| Ця стаття містить неперекладені фрагменти іноземною мовою. |





Фулере́ни або бакіболи — одна з кількох алотропних модифікацій вуглецю. Найвідоміший фулерен — молекула C60, яка має ідеальну форму футбольного м'яча[1].
Відкриті в 1985 Робертом Керлом, Гарольдом Крото й Річардом Смолі[1], ці молекули, що складаються тільки з атомів вуглецю, отримали свою назву на честь Річарда Бакмінстера Фулера — архітектора, що прославився побудовою ажурних куполів. Першовідкривачі отримали Нобелівську премію з хімії в 1996 році[1].
Природні фулерени можна знайти в сажі. Кристалічна форма фулеренів називається фулеритом.
Термін «Фулерен» застосовують до широкого класу сполук із мінімально можливою будовою у 60 атомів вуглецю, що поєднані ковалентним зв'язком у сферичну молекулу, де кожен атом вуглецю поєднаний із трьома іншими, утворюючи п'ятикутники та шестикутники на поверхнях. Найбільша молекула фулерену складається із 560 атомів вуглецю.[джерело?] Найбільш вивченою молекулою фулерену є молекула С60. С60 найменший фулерен, що відповідає правилу ізольованого пентагону і тому він є найменшим стійким фулереном.[2] Вміст С60 найвищий у зазвичай експериментально отримуваній суміші фулеренів, хоча С60 термодинамічно є найменш стабільним серед стійких фулеренів. Його ентальпія утворення 8,66 ккал/атом більша за ентальпію утворення, наприклад, С70 на 0,34 ккал/атом[3]. Найстійкішою алотропною модифікацією вуглецю за стандартних умов є графіт з ентальпією утворення 0,00 ккал/атом. Тобто, С60 є кінетично контрольованим продуктом в реакції утворення фулеренів.
Історія відкриття фулерену незвичайна. У 1973 радянські вчені Д.А. Бочвар і Е. Н. Гальперін опублікували результати квантово-хімічних розрахунків з яких випливало, що повинна існувати стійка форма вуглецю, яка містить у молекулі 60 вуглецевих атомів і не має жодних замісників. У тій же статті була запропонована форма такої гіпотетичної молекули. Висновки цієї роботи здавалися в той час зовсім фантастичними. Ніхто не міг собі уявити, що така молекула може існувати, і, тим більше — не уявлявся спосіб її одержання. Ця теоретична робота трохи випередила свій час і була спочатку просто забута.
У 1980-х астрофізичні дослідження дозволили встановити, що в спектрах деяких зірок, так званих «червоних гігантах», виявлені смуги, що вказують на існування чисто вуглецевих молекул різного розміру.
У 1985 англійські вчені Гарольд Крото і Річард Смоллі почали проводити дослідження вже в «земних» умовах. Вони вивчали мас-спектри пари графіту, отриманих під ударом лазерного променя, і виявили, що в спектрах є два сигнали, інтенсивність яких набагато вища, ніж всіх інших. Сигнали відповідали масам 720 і 840, що вказувало на існування великих агрегатів з вуглецевих атомів — С60 і С70. Мас-спектри дозволяють установити лише молекулярну масу частинки і не більш того, однак цього виявилося досить, щоб фантазія вчених запрацювала. У підсумку була запропонована структура багатогранника, зібраного з п'яти — і шестикутників. Це було точне повторення структури, запропонованої 12 років тому Бочваром і Гальперном.
Свою назву фулерени отримали за прізвищем архітектора Бакмінстера Фулера, котрий сконструював купол і павільйон США на виставці у Монреалі у 1967 році у вигляді сполучених п'ятикутників та шестикутників. Однак заради справедливості необхідно відмітити, що подібна форма є серед популярних форм Архімеда. Окрім того, збережена дерев'яна модель такої форми, яку виконав Леонардо да Вінчі, а Ейлер отримав формулу для різних поверхонь:
- Nn • 6 — n = 12 s
де n — розмірність, Nn — кількість багатокутників розмірності n, s — характеристика кривизни поверхні. Так як s = 1 для кулі та s = 0 для площини, то із формули (1) випливає, що для утворення сферичної поверхні необхідно 12 п'ятикутників n = 5 та довільна кількість шестикутників (n = 6).
Класичним вважається фулерен, що складається з 60 атомів Карбону (С60). У його молекулі атоми Карбону утворюють 12 п'ятичленних та 20 шестичленних циклів, причому п'ятичленні цикли повністю розмежовані шестичленними і не мають спільних атомів.
Якийсь час фулерен був доступний лише в кількостях, достатніх для спектральних досліджень, але не хімічних. Одержати фулерен у помітних кількостях вдалося Д. Хаффману і В. Кретчмеру, що провели випарювання графіту за допомогою електричної дуги в атмосфері гелію. Сажа, що утворюється в цьому процесі, була проекстрагована бензолом. З розчину виділили сполуки, що мають суміш С60 і С70. Друга сполука утворюється в кількостях, приблизно в шість разів менших, ніж перша, і тому основна маса досліджень проводиться з С60. Описаний спосіб одержання фулерену з тими чи іншими технологічними варіаціями на сьогодні все ще єдиний. Вміст фулеренів у сажі, яка утворюється, досягає 44 %. Існують схеми синтезу фулерену. засобами органічної хімії, але вони поки що не реалізовані. У каталогах хімічних реактивів речовина С60 має назву бакмінстерфулерен, хіміки частіше називають його просто фулереном. Є й інша образна назва — футболен. Подібність з покришкою футбольного м'яча очевидна. Існує ще гібрид обох назв — бакібол[1]. Відкриття фулерену буквально приголомшило хіміків. Здавалося, що про елементарний вуглець відомо практично усе. Від інших алотропних модифікацій вуглецю фулерен відрізняється насамперед тим, що це індивідуальні кінцеві молекули, що мають замкнуту форму. Фулерен на відміну від відомих раніше трьох форм вуглецю розчинний в органічних розчинниках (бензол, гексан, сірковуглець). З розчинів фулерен кристалізується у виді дрібних темно-коричневих кристалів. Для рентгеноструктурного аналізу вони не придатні, тому що через сферичну форму молекул їхня структура невпорядкована. Побачити молекулу фулерена «своїми очима» вдалося далеко не відразу, лише після того, як був отриманий продукт взаємодії фулерена з тетраоксидом осмію OsO4 у присутності третбутилпіридину, який добре кристалізується.
Чотиривалентність вуглецю у формулі фулерена повністю виконується. Правильніше зображувати фулерен у вигляді каркаса з простими короткими зв'язками, що чергуються, але частіше застосовують спрощене зображення, де каркас складається з одинарних рисок. Ще одна незвичайна структурна особливість фулерену полягає в тому, що його молекула має внутрішню порожнину, діаметр якої приблизно 0,5 нм. Зовнішній діаметр самої молекули 0,71 нм. Внутрішній діаметр, природно, менше зовнішнього, оскільки атоми вуглецю і їхні електронні оболонки теж мають певний розмір.
Фулерен — винятково стійка сполука. У кристалічному вигляді він не реагує з киснем повітря, стійкий до дії кислот і лугів, не плавиться до температури 360 °С. Хімічні властивості знаходяться в повній згоді зі згаданими вище структурними особливостями — фулерен не вступає в реакції, характерні для ароматичних сполук. Неможливі реакції заміщення, тому що в атомів вуглецю немає ніяких бічних замісників. Достатня кількість ізольованих кратних зв'язків дозволяє вважати фулерен поліолефіновою системою. Для нього найтиповішим є приєднання по кратному зв'язку.
Фулерен є яскраво вираженим акцептором електронів і при дії сильних відновників (лужні метали) може приймати до шести електронів, утворюючи аніон С606-. Крім того, він легко приєднує нуклеофіли і вільні радикали. При відновленні лужними металами (наприклад, цезієм чи рубідієм) відбувається перенесення електрона від атома металу до фулерену. Сполуки, що утворюються, мають низькотемпературну надпровідність, критична температура появи надпровідності 33К.
Для фулерена є ще одна можливість утворювати сполуки, використовуючи внутрішню порожнину вуглецевої кулі, діаметр якої достатній, щоб у ній міг розміститися атом металу чи невелика молекула. Таким чином, відкривається шлях до одержання хімічних сполук зовсім нового типу, де атом механічно утримується усередині замкненого середовища.
Спосіб введення атома металу у внутрішню порожнину фулерену практично не відрізняється від способу одержання самого фулерену. Графіт перед випаровуванням просочують солями металів. У продуктах реакції виявлені сполуки складу С60La, С60Y, С60U). Усередину заздалегідь сформованої порожнини крізь стінку удалося поки ввести лише атом гелію (завдяки його невеликим розмірам) шляхом бомбардування фулерена іонами гелію в газовій фазі.
 |  | 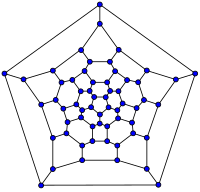 |  |
| 20-fullerene (dodecahedral graph) | 26-fullerene graph | 60-fullerene (truncated icosahedral graph) | 70-fullerene graph |
Родинні сполуки й аналоги фулерена поки що нечисленні. Найвідоміший аналог — С70 — був отриманий практично одночасно з С60. Одержання його в чистому вигляді пов'язане з великими труднощами, тому він вивчений менше. За формою він близький до еліпсоїда і через злегка витягнуту форму одержав назву «регбібол». Таким чином, продовжений стиль назв фулерена С60 (футболен, бакібол). Розміри осей еліпсоїда 0,788 і 0,682 нм. Нагадаємо, що у фулерена С60 усі вершини еквівалентні, а зв'язки між ними тільки двох типів (прості і подвійні). У регбіболі є вершини п'яти типів, наприклад вершини, де сходиться три шестикутні грані. Довжина зв'язку має вісім значень в інтервалі 0,138-0,146 нм. Таким чином, розставити однозначно в структурі подвійні і прості зв'язки неможливо. На подовжених кінцях яйцеподібної молекули знаходяться дві п'ятикутні грані. До них примикають найбільше реакційноздатні зв'язки, за властивостями близькі до кратних. Особливу групу утворюють так звані фулеренові трубки — тубулени, які являють собою порожні циліндричні утворення, зібрані із шестикутників і які мають, як правило, на кінці сферичну кришку, що включає п'ятикутні грані.
За кімнатної температури фулерени С60 і С70 не реагують із такими молекулами: оксид азоту, кисень, оксид сірки. Попри це було зафіксовано ряд нових хімічних реакцій із фулеренами.
Отримано і охарактеризовано найпростіший дигідрований фулерен із двома воднями С60Н2. Синтезовані галогенопохідні фулеренів. Прямим приєднанням флуору отримана серія С60Fх та С70Fy де х менше або дорівнює 48, а у менше або дорівнює 56. Проведене хлорування та бромування фулеренів. Хлорування проводиться у нагрітих до 250 °С трубках. Як правило, приєднується 24 атоми хлору. За температури 400°С поліхлорфулерени дехлоруються у вихідний фулерен.
Таким чином, можна констатувати, що відкриття фулерену знаменувало появу класу сполук, які являють собою нову незвичайну форму елементного вуглецю. Це замкнуті каркаси, протяжні циліндричні чи багатошарові утворення, здатні до хімічних перетворень як на зовнішній поверхні, так і у внутрішній порожнині.
Гідратований фулерен С60 — C60HyFn — це міцний, високогідрофільний супрамолекулярний комплекс, що складається з молекули фулерена С60, ув'язненої у першу гідратну оболонку, яка містить 24 молекули води: C60·(H2O)24. Гідратна оболонка утворюється внаслідок донорно-акцепторної взаємодії неподілених пар електронів кисню молекул води з електрон-акцепторними центрами на поверхні фулерена. При цьому, молекули води, орієнтовані поблизу поверхні фулерена зв'язані між собою об'ємною сіткою водневих зв'язків. Розмір C60HyFn — 1,6-1,8 нм. У той же час, максимальна концентрація С60, у вигляді C60HyFn, яку вдалося створити у воді, еквівалентна 4 мг/мл[4] [5] [6] [7]. Фотографія водного розчину С60HyFn з концентрацією С60 0,22 мг/мл праворуч.
У 1999 році японсько-російському колективу з Міжнародного центру досліджень матеріалів (Японія) вдалося знайти багатошарові фулерени. Вони були отримані із сажі, шляхом лазерного піролізу бензену. Сажу протягом години випалювали за температури 3000 °С у атмосфері аргону. Після прожарювання у вакуумі за температури 1600 °С була отримана плівка осаду, яка складалася з молекул фулерену діаметром 8,1 Å та 11,9 Å, що відповідає С80 та С180. Як видно з фотографії, отриманої за допомогою електронного мікроскопа, є молекули, що складаються з кількох шарів. На фото можна побачити два їх різновиди: подвійну сферу діаметром 14 Å та потрійну кулю діаметром 20 Å. Це, на думку авторів досліду, перше спостереження вкладених один в одного фулеренів, т. зв. оніонів (англ. onion). Хоча останнє твердження і суперечливе, оскільки ще в 1980 році Ііджіма спостерігав за допомогою електронної мікроскопії високого розрішення оніоні утворення.[8] Якщо розрахувати діаметри молекул, то виходить, що в першому випадку це С60 всередині С240, а в другому — С80 та С240, вкладені, як матрьошки, в С560. Такі багатошарові фулерени — новий вид вуглецевих кластерів.
Незважаючи на те, що фулерен був відкритий понад 25 років тому, його вплив на живі організми досі залишається невідомим. Хоча теоретично показано, що фулерени не є токсичними[9], їхня безпечність для людей все ще широко обговорюється. Однак, у квітні 2012 року група французьких вчених[10] оприлюднила статтю з підсумками досліджень на щурах. У статті вказується, що щури, яким щодня давали певну дозу фулерену С60 з оливковою олією, прожили вдвічі довше, ніж щури, які фулерену не вживали. Вважається, що такий ефект спостерігається через те, що фулерени поглинають вільні радикали, які сприяють старінню[7]. Однак ще невідомо чи будуть вони мати такий же ефект у людей.
- ↑ а б в г Слюсар, В.И. (2009). Наноантенны: подходы и перспективы. - C. 58 - 65 (PDF). Электроника: наука, технология, бизнес. – 2009. - № 2. с. C. 58 – 65.
- ↑ X. Lu, Z. Chen. Curved Pi-Conjugation, Aromaticity, and the Related Chemistry of Small Fullerenes (<C60) and Single-Walled Carbon Nanotubes. Chemical Reviews. 105 (10): 3643—3696. doi:10.1021/cr030093d.(англ.)
- ↑ Froimowitz, Mark (1991). Molecular geometries and heats of formation of С60 and С70 as computed by MM2-87. Journal of Computational Chemistry. 12 (9): 1129—1133. doi:10.1002/jcc.540120911.(англ.)
- ↑ G.V. Andrievsky, M.V. Kosevich, O.M. Vovk, V.S. Shelkovsky, L.A.Vashchenko. On the production of an aqueous colloidal solution of fullerenes // J. Chem. Soc., Chem. Commun. — 1995. — Т. 12. — С. 1281–1282. — DOI:.(англ.)
- ↑ G.V. Andrievsky, V.K. Klochkov, A. Bordyuh, G.I. Dovbeshko. Comparative analysis of two aqueous-colloidal solutions of C60 fullerene with help of FTIR reflectance and UV–Vis spectroscopy // Chem. Phys. Letters. — Т. 364, вип. 1-2. — С. 8-17. — DOI:. Процитовано 30.04.2012.(англ.)
- ↑ G.V. Andrievsky, V.K. Klochkov, L.I. Derevyanchenko. Is the C60 Fullerene Molecule Toxic?! // Fullerenes, Nanotubes and Carbon Nanostructures. — 2005. — Т. 13, вип. 4. — С. 363-376. — DOI:. Процитовано 30.04.2012.(англ.)
- ↑ а б G.V. Andrievsky, V.I. Bruskov, A.A. Tykhomyrov, S.V. Gudkov. Peculiarities of the antioxidant and radioprotective effects of hydrated C60 fullerene nanostuctures in vitro and in vivo // Free Radical Biology & Medicine. — 2009. — Т. 47, вип. 6. — С. 786–793. — DOI:. Процитовано 30.04.2012.(англ.)
- ↑ Iijima, Sumio (1980). Direct Observation of the Tetrahedral Bonding in Graphitized Carbon Black by High Resolution Electron Microscopy. Journal of Crystal Growth. 50: 675—683. doi:10.1016/0022-0248(80)90013-5.
- ↑ Kolosnjaj J, Szwarc H, Moussa F. Toxicity studies on fullerenes and derivatives // Advances in Experimental Medicine and Biology. — 2007. — Т. 620. — С. 168-180. — DOI:. Процитовано 30.04.2012.[недоступне посилання](англ.)
- ↑ T. Baati et al. The prolongation of the lifespan of rats by repeated oral administration of 60 fullerene // Biomaterials. — 2012. — Т. 33, вип. 19. — С. 4936-4946. — DOI:. Процитовано 30.04.2012.(англ.)
- Hirsch, A.; Brettreich, M. Fullerenes: Chemistry and Reactions; WILEY-VCH Verlag GmbH & Co. KGaA: Weinheim, 2005. (англ.)
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Основи хімії і фізики горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4
- Ефремкин А. Ф., Иванов В. Б., Романюк А. П., Шибанов В. В. Структурные особенности диенстирольных термоэластопластов, модифицированных мономерами // Ж. ВМС. А. 1990. Т. 32. № 9, с. 1995—2001.
- Иванов В. Б., Романюк А. П., Шибанов В. В. Кинетика полимеризации в диенстирольных блок-сополимерах // Ж. ВМС. 1993 г. Т. 35. № 2, с. 119—124.
- Ван-Чин-Сян Ю. Я., Романюк О. П. Дослідження пошарової полімеризації трикомпонентних систем на основі термоеластопласту. Ж. Вісник НУ «Львівська політехніка» № 426. Львів. 2001 р., с. 24-28.
- Фуллерены и структуры углерода. Успехи физических наук. т. 165, № 9. Сентябрь 1995 г. С. 977—1009.
- Слюсар, В.И. (2009). Наноантенны: подходы и перспективы. - C. 58 - 65 (PDF). Электроника: наука, технология, бизнес. – 2009. - № 2. с. C. 58 – 60.
- ФУЛЕРЕНИ //Фармацевтична енциклопедія
- Фулерени // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.


 French
French Deutsch
Deutsch