Demir(III) fosfat - Vikipedi
 | |
 | |
| Adlandırmalar | |
|---|---|
Iron(III) phosphate | |
Diğer adlar Ferric orthophosphate, Ferric phosphate | |
| Tanımlayıcılar | |
| |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.030.123 |
PubChem CID | |
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| |
| Özellikler | |
| Molekül formülü | FePO4 |
| Görünüm | sarı-kahverengi katı |
| Yoğunluk | 3.056 g/cm3 (anhydrous) 2.87 g/cm3 (20 °C, dihydrate) |
| Erime noktası | 250 (dihydrate) decomposes[1] |
| Çözünürlük (su içinde) | anhydrous: insoluble dihydrate: 0.642 g/100 mL (100 °C)[1] |
| +11,500.0·10−6 cm3/mol | |
| Termokimya | |
Isı sığası (C) | 180.5 J/mol·K (dihydrate)[1] |
Standart molar entropi (S⦵298) | 171.3 J/mol·K (dihydrate)[1] |
Standart formasyon entalpisi (ΔfH⦵298) | -1888 kJ/mol (dihydrate)[1] |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |  [2] [2] |
| İşaret sözcüğü | Warning |
| Tehlike ifadeleri | H315, H319, H335[2] |
| Önlem ifadeleri | P261, P305+P351+P338[2] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları | |
Demir (III) fosfat (ayrıca ferrik fosfat), FePO4 formülüne sahip inorganik bir bileşiktir. FePO4'ün dört polimorfu ve dihidrat FePO4·(H2O)2'nin iki polimorfu dahil olmak üzere birkaç ilgili materyal bilinmektedir.[3][4]
Yapısı[değiştir | kaynağı değiştir]
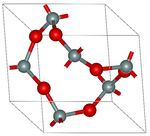
FePO4'ün en yaygın biçimi α-kuvars yapısını benimser. Bu nedenle P ve Fe tetrahedral moleküler geometriye sahiptir. Yüksek basınçlarda, oktahedral Fe merkezleri ile daha yoğun bir yapıya faz değişimi oluşur. Dihidratın iki polimorfunda, Fe merkezi iki karşılıklı cis su ligandları ile oktahedraldir.[5]
Kullanımı[değiştir | kaynağı değiştir]
Demir(III) fosfat, organik tarım uygulamasında kullanım için onaylanmış birkaç mollussisitten biridir.[6]
Çelik ve metal imalat süreçlerinde kullanılabilir. Metal bir yüzeye bağlandığında, demir fosfat metalin daha fazla oksidasyonunu önler.
Demir fosfat kaplamalar, temel olarak, demir veya çelik alt tabakaya yapışmayı arttırmak veya boyamak için taban kaplamaları olarak da kullanılır ve çoğunlukla paslanmaya karşı da kullanılır. Aynı zamanda bu yüzeylere kumaş, ahşap ve diğer malzemelerin yapıştırılmasında da kullanılabilir. Demir fosfat kaplamalar genellikle bir boyama veya toz kaplama işleminin bir parçası olarak uygulanır.
Demir fosfat, düşük bir elektronik iletkenliğine sahip olmasına rağmen lityum iyon pilde bir interkalasyon elektrodu olarak da kullanılabilir. Bununla birlikte, son yıllarda, bir elektrot malzemesi olarak kullanımı, malzeme mühendislerinin elektronik iletkenlik sorununu aştığı için giderek daha yaygın hale gelmiştir. FePO4, termal stabilitesi ve iyi şarj döngüsü sayesinde elektrikli araçlardaki aküler için ideal bir elektrot malzemesidir.
Mevzuat[değiştir | kaynağı değiştir]
Avrupa Birliği'nde gıda katkı maddesi olarak demir(III) fosfata izin verilmez. 2007 yılında 2002/46 / EC direktifinde izin verilen maddeler listesinden geri çekilmiştir.
Güvenlik[değiştir | kaynağı değiştir]
Memelilerde demir fosfat göz, deri ve solunum yolu tahrişine neden olabilir ve yutulursa zararlı olabilir.
Organik Pestisit Olarak Kullanımı[değiştir | kaynağı değiştir]
Organik pestisit olarak kullanımı tartışmalıdır. Demir (III) fosfat içeren tuzak salyangoz yemleri, bahçecilikte oldukça yenidir ve tehlikeleri henüz tam olarak araştırılmamış veya anlaşılmamıştır.[7]
Amerika Birleşik Devletleri'nde, demir fosfat içeren ürünlere belirtilmemiş EDTA (etilen-diamin-tetraasetik asit) ilavesi toksisiteyi büyük ölçüde arttırmaktadır.[8]
Bu ürünlerin 2006 yılında İsviçre organik sertifikasyon kuruluşu (FiBL) tarafından gözden geçirilmesi, EDTA içerdiklerini keşfetti. Belirtilen ürünlerin metaldehit yemlerinden daha güvenli olmadıkları söylenmektedir.[9]
Kaynakça[değiştir | kaynağı değiştir]
- ^ a b c d e "iron(III) phosphate dihydrate". chemister.ru. 16 Nisan 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2014.
- ^ a b c Sigma-Aldrich Co., Iron(III) phosphate dihydrate. Retrieved on 3 Mayıs 2014.
- ^ Roncal-Herrero, T., Rodriguez-Blanco, J.D., Benning, L.G., Oelkers, E.H. (2009) Precipitation of Iron and Aluminium Phosphates Directly from Aqueous Solution as a Function of Temperature from 50 to 200°C. Crystal Growth & Design, 9, 5197-5205. doi: 10.1021/cg900654m.
- ^ Song, Y.; Zavalij, P. Y.; Suzuki, M.; Whittingham, M. S. (2002). "New Iron(III) Phosphate Phases: Crystal Structure and Electrochemical and Magnetic Properties" (PDF). Inorganic Chemistry. 41 (22). ss. 5778-5786. doi:10.1021/ic025688q. PMID 12401083. 14 Temmuz 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 3 Temmuz 2014.
- ^ Zaghib, K.; Julien, C. M. (1 Ocak 2005). "Structure and electrochemistry of FePO4·2H2O hydrate". Journal of Power Sources. Cilt 142. ss. 279-284. doi:10.1016/j.jpowsour.2004.09.042. 14 Temmuz 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2014.
- ^ "COMMISSION REGULATION (EC) No 889/2008". European Union law. 22 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Temmuz 2014.
- ^ "Arşivlenmiş kopya". 11 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Nisan 2018.
- ^ "Arşivlenmiş kopya". 7 Nisan 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Nisan 2018.
- ^ "Arşivlenmiş kopya" (PDF). 10 Temmuz 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 15 Nisan 2018.


 French
French Deutsch
Deutsch