Реакции присоединения — Википедия
Реакции присоединения (англ. addition reaction) — в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может осуществляться как по связи углерод-углерод, так и по связи углерод-гетероатом. Реакции присоединения обозначают английскими буквами «Ad».
Общий вид реакций присоединения по связи углерод-углерод:
Общий вид реакций присоединения по связи углерод-кислород:
Обычно реагент, к которому происходит присоединение, называют субстратом, а другой («Х-Y») — атакующим реагентом.
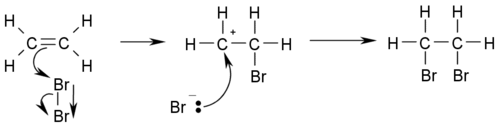
Примером реакции присоединения может служить бромирование этилена:
Реакции присоединения часто являются обратимыми, составляя пару с реакциями отщепления, поэтому следует иметь в виду, что механизм для такой «парной» реакции присоединения-отщепления является общим[1].
В зависимости от природы атакующей частицы и механизма реакции различают нуклеофильное, электрофильное, радикальное или синхронное присоединение.
Реакции нуклеофильного присоединения[править | править код]
В реакциях нуклеофильного присоединения атакующей частицей является нуклеофил, то есть отрицательно заряженная частица или частица со свободной электронной парой.
Общий вид реакций нуклеофильного присоединения:
Реакции нуклеофильного присоединения обозначаются «AdN».
Реакции нуклеофильного присоединения по связи С=С довольно редки, наибольшее распространение и практическое значение имеет присоединение по связи С=O[2]:
Среди реакций нуклеофильного присоединения наиболее распространен приведенный выше двухстадийный бимолекулярный механизм AdN2 : вначале нуклеофил медленно присоединяется по кратной связи с образованием карбаниона, который на второй стадии быстро атакует электрофильная частица[3].
Реакции электрофильного присоединения[править | править код]
В реакциях электрофильного присоединения атакующей частицей является электрофил, то есть положительно заряженная (с дефицитом электронов) частица, чаще всего протон H+.
Общий вид реакций электрофильного присоединения:
Реакции электрофильного присоединения обозначаются «AdE».
Реакции электрофильного присоединения широко распространены среди реакций непредельных углеводородов: алкенов, алкинов и диенов[4].
Примером таких реакций служит гидратация алкенов:
Электрофильное присоединение по связи углерод-гетероатом также достаточно распространено, причем чаще всего такой связью является С=O:
Среди реакций электрофильного присоединения наиболее распространен приведенный выше двухстадийный бимолекулярный механизм AdE2 : вначале электрофил медленно присоединяется по кратной связи с образованием карбкатиона, который на второй стадии подвергается нуклеофильной атаке[3].
Реакции радикального присоединения[править | править код]
В реакциях радикального присоединения атакующей частицей являются свободные радикалы.
Реакции радикального присоединения обозначаются «AdR».
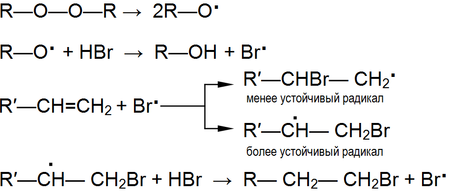
Реакции радикального присоединения обычно протекают вместо реакций электрофильного присоединения в присутствии источника свободных радикалов[3]:
Реакции синхронного присоединения[править | править код]
В некоторых случаях присоединение по кратной связи происходит с одновременной атакой обоих атомов, что не позволяет определить приоритет атаки. Такой механизм называется синхронным присоединением. Реакции синхронного присоединения приводят к образованию циклических продуктов, поэтому они часто носят название циклоприсоединение.
Примечания[править | править код]
- ↑ Керри Ф, Сандберг Р. Углубленный курс органической химии: пер. с англ., в 2-х томах. — М.: Химия, 1981.
- ↑ Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
- ↑ 1 2 3 Марч Дж. Органическая химия, пер. с англ., т. 3, — M.: Мир, 1988
- ↑ Химическая энциклопедия./ Электрофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 5.


 French
French Deutsch
Deutsch