Получение спиртов — Википедия
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Существует огромное количество методов получения спиртов, при этом их можно разделить на две условных группы:
- химические способы получения спиртов — синтетические спирты;
- биохимические способы получения спиртов — биоспирты.
Химические способы получения спиртов[править | править код]
Занимая одну из центральных позиций в органической химии, спирты могут быть получены из множества других соединений. На практике в качестве исходных веществ для синтеза спиртов наиболее часто используют [1][2] :
- алкилгалогениды — щелочной гидролиз или реакция с супероксидом калия;
- алкены — кислотная гидратация, реакция гидроксимеркурирования-демеркурирования или гидроборирование с последующим окислением, а также промышленные методы оксо-синтеза;
- карбонильные соединения — восстановление или взаимодействие с реактивами Гриньяра.
Далее в разделе будет подробно рассмотрена химия существующих методов получения одноатомных спиртов. Промышленные аспекты получения спиртов, включая биохимические методы синтеза, подробно рассмотрены в подразделе «Получение спиртов в промышленности».
Краткий обзор методов органического синтеза многоатомных спиртов будет рассмотрен в соответствующем подразделе.
Получение спиртов из галогеноуглеводородов[править | править код]
Галогенпроизводные углеводородов под действием оснований трансформируются с образованием спиртов (реакция нуклеофильного замещения).
Обычно, первичные и вторичные галогенуглеводороды вступают в реакцию по одностадийному SN2 механизму[3]. Пример — гидролиз бромэтана:

Реакции такого типа, обычно, происходят — с обращением геометрической конфигурации исходного вещества[3]. Реакционная способность алкинов уменьшается при переходе от производных йода к производным фтора [4] При этом фторпроизводные устойчивы к нуклеофильному замещению в обычных условиях и практически не используются для получения спиртов.
Первичные хлоралканы удовлетворительно гидролизуются под действием водного раствора щёлочи при нагревании[5]:
Для реакций, протекающих по SN2 механизму, используют только полярные растворители, причем скорость превращения возрастает при использовании вместо протонных растворителей (например: вода или спирт) апротонные (например: диметилсульфоксид); при этом в апротонных растворителях нуклеофильность уходящих групп будет иной[3]:
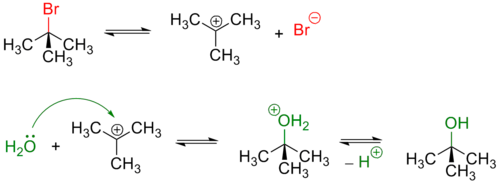
Третичные и в меньшей степени вторичные галогенуглеводороды гидролизуются по двухстадийному SN1 механизму[3]:
Реакция, протекающая по SN1 механизму проводят в полярных протонных растворителях, чаще всего воде или водном растворе метилового или этилового спирта.
Из-за устойчивости карбкатиона по такому механизму гидролизуются галогеналкены:
Так как в процессе реакции образуется карбкатион, его атака (в идеальных условиях без учёта фактора влияния заместителей) нуклеофилом может происходить с обеих сторон, что приводит к рацемизации образующегося продукта.
Для высокореакционных реагентов используют мягкое замещение с использованием соединений одновалентного серебра или двухвалентной ртути[5]:

В современной лабораторной практике описанные выше реакции сольволиза проводят достаточно редко, так как спирты — более доступные полупродукты — являются исходным объектом для синтеза галогенпроизводных. Кроме того, следует помнить, что помимо изменения стереохимии исходных компонентов, реакции замещения конкурируют с элиминированием, а также перегруппировками, что часто приводит к нежелательным продуктам[3]:
В то же время существует достаточно новый метод превращения в спирты алкилгалогенидов действием на последние супероксида калия в среде диметилсульфоксида в присутствии 18-краун-6, при этом происходит практически полное геометрическое обращение[2]:
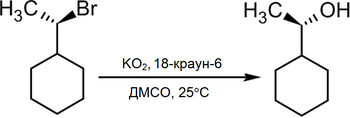 |
Получение спиртов из алкенов[править | править код]
Гидратация алкенов[править | править код]
Кислотная гидратация алкенов исторически была первым синтетическим методом получения спиртов (см. подраздел «История открытия спиртов»).
Общий механизм процесса (реакция электрофильного присоединения AdE2) представлен ниже[6]:
Присоединение происходит по правилу Марковникова.
В случае использования серной кислоты в качестве катализатора промежуточным продуктом является эфир серной кислоты (R-CH(OSO2OH)-CH3), который в условиях реакции полностью гидролизуется до спирта[6].
Для проведения реакции кроме серной кислоты используют и другие реагенты: смесь муравьиной и каталитического количества серной кислоты (в отдельных случаях позволяет добиться стереоспецифичности), смесь муравьиной и хлорной кислоты, трифторуксуную кислоту и др[7].
Реакции вторичных алкенов, вследствие перегруппировок карбокатионов, часто приводят к образованию смеси продуктов, что затрудняет их использование для получения вторичных спиртов[8]:
В лабораторной практике метод кислотной гидратации применим весьма ограниченно как из-за перспективы получения смеси продуктов, так и низких выходов. Чаще его используют для получения третичных спиртов, но и в этом случае выход, обычно, не превышает 40-45 %[8]:
 |
В промышленности, помимо жидкофазной используют прямую газофазную гидратацию алкенов. В качестве катализаторов используется фосфорная кислота на твердом носителе при 200—300 °C и давлении 2-8 МПа; при этом выход спиртов достигает 95 %[9]:
Гидроксимеркурирование-демеркурирование алкенов[править | править код]
Метод получения спиртов гидроксимеркурированием-демеркурированием алкенов имеет ряд важных преимуществ перед реакцией кислотного гидролиза[10]:
- отсутствие перегруппировок для склонных для этого субстратов;
- анти-стереоспецифичность для нормальных алкенов за исключением особых случаев пространственного затруднения;
- лучшие выходы;
- строгая ориентация по правилу Марковникова.
Механизм реакции выглядит следующим образом[11]:
 |
Присоединение ацетата ртути к алкену происходит по электрофильному механизму, а демеркурирование имеет радикальную природу; так как последняя стадия не обладает высокой стереоселективностью, то и весь процесс не стереоспецифичен в строгом смысле[12].
Синтез спиртов гидроксимеркурированием-демеркурированием алкенов протекает в мягких условиях, с выходами близкими к количественным (90-98 %) и практически без образования побочных продуктов; при этом промежуточное ртутьорганическое соединение не требует выделения — все стадии реакции протекают в один за другим[12].
Практические примеры использования реакции (в скобках указаны выходы, показывающие соотношение образующихся продуктов)[12]:
Гидроборирование алкенов с последующим окислением[править | править код]
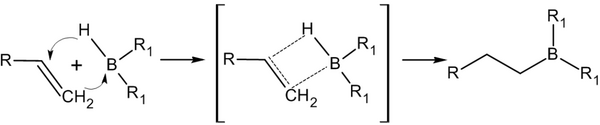
Присоединение гидридов бора к алкенам и последующее их расщепление в щелочной среде, открытое Г. Брауном в 1958 году, является столь важной реакцией, что за её обнаружение и изучение в 1979 году учёный был удостоен Нобелевской премии по химии[13].
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причем присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода[14]:
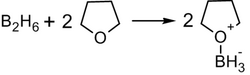
В синтезе используется, обычно, не собственно диборан, а его донорно-акцептоный комплекс с простым эфиром; а сам диборан получают реакцией борогидрида натрия с трифторидом бора в среде тетрагидрофурана[14]:
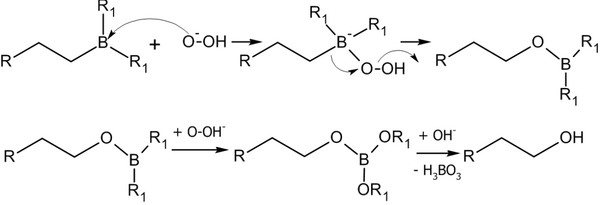
Алкилбораны легко расщепляются под действием пероксида водорода в щелочной среде, образуя спирты[14]:
Реакция гидроборирования является реакцией син-присоединения — её результатом становятся цис-аддукты.
Данный метод имеет широкое препаративное значение. Например, алкены с концевой двойной связью дают первичные спирты с выходами 80-90 %. Примеры практического использования метода (в скобках указаны выходы, показывающие соотношение образующихся продуктов)[7]:
Пример синтеза бициклических терпеновых спиртов[15]:
Для повышения селективности реакции гидроборирования используют замещённые, пространственно затруднённые бораны[16]:
| Тексилборан 2,3-диметилбутил-2-боран | Дисиамилборан бис-(1,2-диметилпропил)боран | 9-ББН 9-борабицикло[3,3,1]нонан | Диизопинокамфеилборан (+)3-дипинанилборан |
 |  |  |
Использование, например, в реакции со стиролом дисиамилборана (DIAB) повышает выход первичного спирта с 80 % до 98 %[17]:
Высокая селективность указанных выше производных борана позволяет избирательно вступать в реакцию с цис-изомером, находящемся в смеси транс-изомером или гидроборировать одну двойную связь из двух имеющихся в молекуле алкена, например[6]:
Гидроборирование алкенов с последующим присоединением окиси углерода[править | править код]
Одним из лучших способов получения третичных спиртов является присоединение к окиси углерода к алкилборанам. Реакция легко протекает при обычном давлении и температуре около 125 °C, в качестве растворителя используется диглим[7]:
Этот метод даёт неплохие выходы со многими алкенами[14]:
Если данную реакцию проводить в присутствии водного раствора щёлочи, получаются вторичные спирты[18]:
Гидроформилирование алкенов[править | править код]
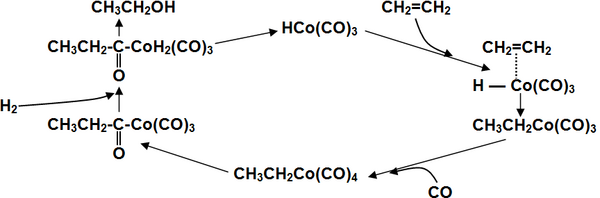
Широко используемая в промышленности классическая реакция гидроформилирования алкенов, то есть каталитического присоединение к ним водорода и монооксида углерода с получением на выходе альдегидов[19], может быть проведена таким образом, что продуктом её реакции сразу будут спирты без выделения промежуточных карбонильных соединений Это метод иногда называют восстановительным гидроформилированием.
Катализирует реакцию координационно ненасыщенный гидрокарбонил кобальта, образующийся в ходе реакции[19]:
Для получения спиртов в одну стадию в качестве катализаторов используют карбонилы кобальта, модифицированные фосфинами, что помимо более активного гидрирования, позволяет добиться существенно более высокой селективности выхода нормальных продуктов (до 90 %) вследствие стерического эффекта объёмного фосфинового лиганда в переходном состоянии[20].
Получение спиртов из простых эфиров и спиртов[править | править код]
Реакция гомологизации спиртов[править | править код]
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол[21]:
Реакция гомологизации по своему механизму близка реакции гидроформилирования алкенов и в настоящее время с помощью модифицированных катализаторов кобальта и рутения и добавления йодид-ионов в качестве промоторов удаётся добиться 90 % выхода по этанолу[21].
Исходный метанол также получают из окиси углерода (катализаторы на основе оксидов меди и цинка, давление 5-10 МПа, температура 250 °C)[21], так что общая схема выглядит следующим образом:
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
Реакция Гербе́[править | править код]
Реакция Гербе представляет собой высокотемпературный (200 °C, давление 5—6 МПа) процесс каталитической конденсации первичных алифатических спиртов, не имеющих разветвления в α-положении, по следующей схеме[22]:
В качестве катализаторов используют сложную смесь на основе никеля Ренея, меди, солей железа и других компонентов[23].
Предполагаемый условный механизм реакции[23]:
или
Реакция имеет ограниченное применение как из-за жестких условий её проведения и относительно низкого выхода (как правило, до 70 %), так и образования кислоты и альдегида в качестве побочного продукта[23].
Кислотное расщепление простых эфиров[править | править код]
В лабораторной практике подобный способ получения спиртов крайне редок, так как именно спирты служат исходным компонентом для синтеза простых эфиров. Вместе с тем, если в качестве исходного объекта выбран, скажем природный простой эфир сложной структуры, его лабораторное расщепление до исходного спирта может оказаться востребованным. Кроме того, в некоторых случаях для защиты гидроксильной группы в процессе многоступенчатого синтеза, её могут перевести в эфирную и вводить в реакцию уже простой эфир. По окончании процесса для обратного превращения соединения в спирт может потребоваться расщепление эфира (см. подробнее подраздел «Защита через простые эфиры»).
Обычно реакцию проводят нагреванием эфира и концентрированного раствора бромоводородной или йодоводородной кислоты, при этом расщепление может осуществляться как по механизму SN1, так и SN2[24]:
 |  |
Если в реакцию вступают несимметричные эфиры, в результате получаются два спирта и два галогенпроизводных, однако если эфир метиловый, продуктом реакции будет спирт и метилиодид или метилбромид[25]:
Для расщепления эфиров могут использоваться также кислоты Льюиса: BF3, BCl3, AlCl3 и др[25], а также сильные органические кислоты. Например, расщепление трет-бутилциклогексилового эфира трифторуксуной кислотой происходит по механизму SN1 с образованием циклогексанола и 2-метилпропена[26]:
Перегруппировка Виттига[править | править код]
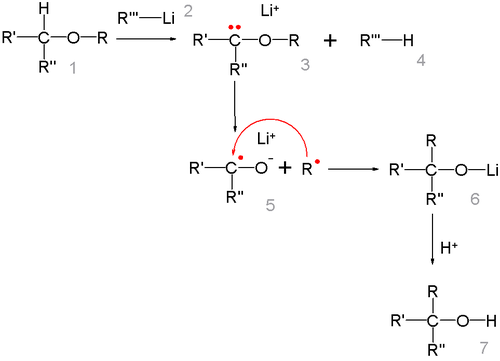
Простые эфиры под действием фениллития перегруппировываются в спирты (Георг Виттиг, 1942 год):
Реакция представляет собой карбанионную перегруппировку, которая осуществляется через радикальный механизм расщепления-рекомбинации[27]:
Говоря о стереохимии перегруппировки Виттига, следует отметить, что образование новой C-C связи происходит настолько быстро, что радикал R не успевает инвертироваться, поэтому обычно, реакция протекает с сохранением исходной конфигурации[28]. Изучение перегруппировки на примере β-алкоксиалкилаллиловых эфиров (общий вид: ) показало, что в результате реакции с выходом 14-32 % образовывались син-1,3-диол производные с селективностью 90-95 %[29].
Перегруппировка Виттига может осуществляться не только с помощью алкил- или ариллитиевых соединений (фениллитий, бутиллитий, метиллитий, диэтиламид лития и пр.), но и под действием других сильных оснований; например, следующая реакция протекает в жидком аммиаке в присутствии амида калия (выход 90 %)[30]:
Для аллильно-замещённых субстратов (1,2)-перегруппировка конкурирует с (2,3)-перегруппировкой, которую можно наблюдать практически полностью независимо при низких температурах[27]:
Получение спиртов из альдегидов и кетонов[править | править код]
В данном разделе помимо получения собственно спиртов из альдегидов и кетонов приведены синтезы гидроксикарбонильных соединений (кетоспирты и производные гидроксикарбоновых кислот; смотри подразделы «Альдольная конденсация», «Бензоиновая конденсация», «Реакция Реформатского», «Реакция Иванова»). Это связано с тем, что приведённые реакции являются мощными препаративными методами и широко используются на практике.
Этинилирование карбонильных соединений[править | править код]
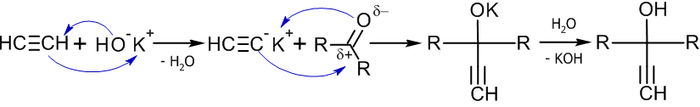
Важным методом получения ацетиленовых спиртов является реакция Фаворского, иначе говоря, реакция этинилирования карбонильных соединений:
В реакцию вступают незамещённые алкины (берутся в большом избытке), кетоны и некоторые альдегиды (чаще всего используется формальдегид) в присутствии оснований (KOH или NaNH2 в органическом растворителе) при температуре от −70 до +40 °C, давлении 0,4-0,9 МПа[31].
Механизм данной реакции связан с нуклеофильным присоединеним этинильного карбаниона к карбонильной группе[32]:
Примеры реакций[33]:
Существуют, по-меньшей мере, две модификации этого метода:
- Реакция Реппе — конденсация алкинов с альдегидами или кетонами в присутствии каталитических количеств ацетиленидов меди, серебра или ртути[34].
- Реакция Нефа — реакция с последующим гидролизом ацетиленидов щелочных металлов с кетонами, включая α,β-непредельные и ароматические карбонильные соединения[35].
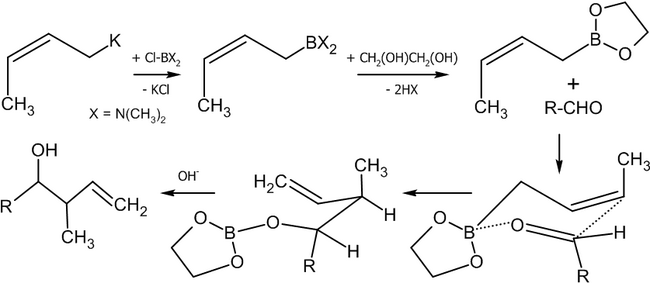
Взаимодействие альдегидов с аллилборанами[править | править код]
Современным методом получения аллильных спиртов заданной конфигурации является применение в качестве агента аллилборана, который реагирует с альдегидами в присутствии оснований по следующей схеме[36]:
Реакция была использована, в частности, в качестве базовой для полного синтеза ряда природных соединений и их аналогов, например, феромонов короеда[36]:
| Ипсенол | Ипсдиенол |
 |  |
Существуют различные методики этой реакции, среди которых:
Если в реакцию вступают цис-алкены, в основном, будут образовываться син-продукты присоединения (97 % от общего выхода).
Другим удобным агентом, реагирующим по данной схеме является аллилборный эфир винной кислоты (Рауш, 1985 год)[38].
Как видно из схемы, меняя температуру реакции, можно вызвать миграцию атома бора к соседнему углероду, получив тот или иной изомерный спирт.
Реакция Сакураи[править | править код]
Другой способ аллилирования, заключающийся в электрофильном взаимодействии аллилсиланов с различными соединениями в присутствии кислот Льюиса носит название реакции Сакураи. С точки зрения получения спиртов, существуют две модификации подобного синтеза[39]:
- Реакция с карбонильными соединениями с получением вторичных или третичных спиртов:
- Реакция с эпоксидами с получением вторичных спиртов:
В качестве катализаторов реакции могут выступать: TiCl4, BF3, SnCl4 и пр.
Пример практического использования реакции Сакураи[40]:
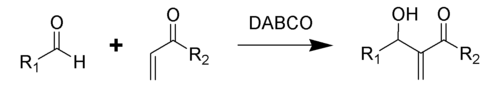
Реакция Бэйлиса-Хиллмана-Морита[править | править код]
Традиционная реакция Бэйлиса-Хиллмана-Морита представляет собой метод получения аллиловых кетоспиртов взаимодействием альдегидов с метилвинилкетонами или другими активированными алкенами в присутствии третичных фосфинов и каталитических количеств фенола или его производных[41]. Впоследствии реакция была несколько модифицирована: в качестве катализатора стали использовать третичные амины (например: 1,4-диазобицикло[2.2.2]октан или DABCO[42]):
Предположительно, механизм реакции выглядит следующим образом[43]:
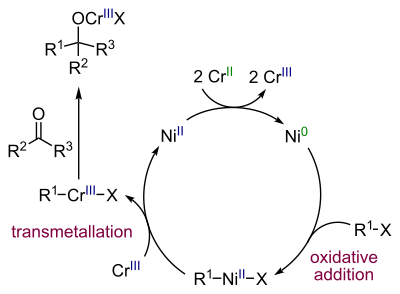
Реакция Нозаки-Хияма-Киши[править | править код]
Реакция Нозаки-Хияма-Киши представляет собой современный метод получения спиртов селективным восстановительным сочетанием альдегидов с винил- или аллилгалогенидами (бромиды или йодиды) в присутствии хром-никелевого катализатора[44]:
Каталитический цикл реакции выглядит следующим образом[45]:
Каталитическое сочетание альдегидов с аллиловыми спиртами и их производными[править | править код]
Аналогом синтетического метода, рассмотренного в предыдущем подразделе, является реакция сочетания альдегидов с аллиловыми спиртами и их производными в присутствии катализаторов. В научной литературе описано множество лабораторных методик осуществления подробного синтеза с примененением органических соединений кремния, олова, хрома, лития, рутения, палладия, цинка, титана, циркония и других металлов.
Приведём некоторые характерные примеры использования этого метода на практике:
- Реакция аллилацетата с альдегидами в присутствии солей рутения (Denmark S. E., Nguyen S. T., 2009 год)[46]:
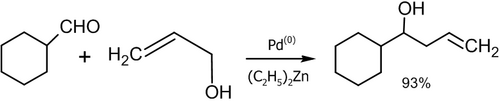
- Реакция аллилового спирта с алифатическими альдегидами в присутствии палладиевого катализатора (Masanari Kimura, Masamichi Shimizu, Kazufumi Shibata, Minoru Tazoe, Yoshinao Tamaru, 2003 год)[47]:
- Реакция аллилтрибутилстанната с альдегидами в присутствии рениевого комплекса (Yutaka Nishiyama, Fujio Kakushoua, Noboru Sonoda, 2004 год)[48]:
Более подробно о современных методах получения спиртов реакцией аллиловых спиртов и их производных с карбонильными соединениями можно прочитать в монографии: Junzo Otera. Modern Carbonyl Chemistry — Wiley-VCH, Weinheim, 2000—613 Pages — ISBN 978-3-527-29871-6.
Реакция Канниццаро[править | править код]
Реакция Канниццаро представляет собой оксилительно-восстановительное диспропорционирование альдегидов в первичные спирты и карбоновые кислоты под действием оснований[49]:
На первом этапе реакции происходит нуклеофильное присоединение основания (например: гидроксид-аниона) к карбонильному углероду альдегида. Образующийся анион депротонируется (это требует воздействия достаточно сильного основания) с образованием промежуточного дианиона, который затем вступает в реакцию с молекулой альдегида: 
В реакцию Канниццаро вступают альдегиды, не способные к енолизации (не имеющие α-водорода), поскольку для последних преобладающей будет альдольная конденсация. Например, в известном примере с бензальдегидом, выход бензилового спирта может достигать 90 %[50]:
Чаще реакция Канниццаро используется для синтеза ароматических и гетероароматических спиртов[50].
Для повышения реакционного диапазона используемых альдегидов и увеличения выхода спиртов на практике используется перекрестная реакция Канниццаро, то есть использование двух различных альдегидов, причем в качестве альдегида-восстановителя обычно используется формальдегид, который в ходе реакции окисляется в муравьиную кислоту[51]:
В настоящее время существуют более эффективные синтетические методы, поэтому полезность реакции Канниццаро ограничена, как правило, диспропорционированием кетоальдегидов в гидроксикарбоновые кислоты[52]:
Циангидринный синтез[править | править код]
Карбонильные соединения, особенно альдегиды и стерически не затруднённые кетоны, легко вступают в реакции нуклеофильного присоединения c цианистым водородом (нуклеофил CN−) с образованием циангидринов[53]:
Для ароматических кетонов вместо HCN используют цианид диэтилалюминия (C2H5)2AlCN или цианотриметилсилан (CH3)3SiCN, продукт присоединения которого затем гидролизуется до циангидрина[53]:
Далее при необходимости циангидрин легко гидролизуется до гидроксикислоты или восстанавливается в аминоспирт:
Альдольная конденсация[править | править код]
Альдольная конденсация — это одна из старейших реакций органического синтеза (1872 год, Вюрц), в которой две молекулы альдегида или кетона под действием основания или кислоты соединяясь, образуют кетоспирты или альдоли[54]:
Возможны два механизма этой реакции: щелочной или кислотный, однако с точки зрения синтеза спиртов, последний менее предпочтителен, так как часто реакция не останавливается на стадии спирта а протекает дальше с дегидратацией и образованием непредельных карбонильных соединений (кротоновая конденсация)[54].
Механизм конденсации, происходящий под действием основания, следующий[54]:
Для проведения конденсации, как видно из её механизма, необходимо, чтобы хотя бы одна из молекул содержала водород в α-положении к карбонильной группе. Обычно, для отрыва этого атома водорода силы гидроксид-иона бывает достаточно, но в отдельных случаях используют и более сильные основания, например — бутиллитий.
Возможны пять комбинаций протекания альдольной конденсации[53]:
- Взаимодействие двух молекул одного альдегида: реакция легко осуществима и приводит к одному продукту, однако из-за электроноакцепторного эффекта альдегидной группы, использование их для синтеза спиртов не эффективно из-за обычно преобладающего расщепления образующегося альдоля до непредельного альдегида, например:
- Взаимодействие двух молекул различных альдегидов: теоретически реакция может привести к четырём разным продуктам, но если один из альдегидов не будет содержать α-карбонильный водород, возможно осуществление только перекрестной реакции;
- Взаимодействие двух молекул одного кетона: реакция сильно смещена влево, поэтому для её проведения либо пользуются специальным оборудованием (аппарат Сокслета), позволяющим фактически удалять из реакционной зоны продукт реакции или использовать в качестве основания особые реагенты (например: нитрид бария);
- Взаимодействие двух молекул разных кетонов: применяется довольно редко и в случаях, когда один из кетонов не содержит α-карбонильный водород;
- Взаимодействие одной молекулы альдегида с одной молекулой кетона: чаще всего в качестве альдегида используют формальдегид, который даёт один продукт конденсации. Другой вариант — использование не самого кетона, а его енольной формы, например в виде литиевой соли или силилового эфира.
Кроме собственно альдегида, возможно использование имина и диизопропиламида лития в качестве основания[53]:
Разновидностью альдольной реакции является реакция Мукаямы, в которой используются силиленольные эфиры:
Бензоиновая конденсация[править | править код]
Бензоиновая конденсация представляет собой обратимое образование из альдегидов (преимущественно — ароматических) под действием цианид-ионов CN− α-оксикетонов (ацилоинов) с общей формулой —СR(ОН)—С(O)О—:
В этой реакции на первом этапе цианид анион вступает в реакцию нуклеофильного присоединения с альдегидом. Перегруппировка образующегося интермедиата в карбанион завершается дальнейшим присоединением второй карбонильной группы также по нуклеофильному механизму. Завершает реакцию переноса протона и отщепление цианидной группы с образованием бензоина в качестве конечного продукта.
Реакция Иванова[править | править код]
Реакция Иванова представляет собой метод получения β-гидроксикарбоновых кислот общей формулой —CR(OH)—CR1(COOH)— из карбонильных соединений и реактивов Иванова: магнийгалогенпроизводных солей арилуксусных кислот (обычно — фенилуксусной кислоты)[55]. Например:
При необходимости оксикислота может быть легко превращена в соответствующий спирт методом декарбоксилирования.
Получение спиртов из карбоновых кислот и сложных эфиров[править | править код]
Гидролиз сложных эфиров карбоновых кислот[править | править код]
Гидролиз сложных эфиров карбоновых кислот является типичной реакцией алифатического нуклеофильного замещения, проходящей по следующей условной схеме:
Обычно реакцию проводят при нагревании в щелочной среде. В частности, данный способ является одним из промышленных путей получения глицерина из животных или растительных жиров.
Этот раздел не завершён. |
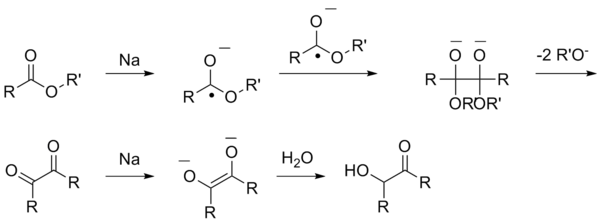
Ацилоиновая конденсация[править | править код]
Ацилоиновая конденсация представляет собой получение α-гидроксикетонов (ацилоинов) восстановлением сложных эфиров металлическим натрием:
Данная реакция включает в себя несколько стадий, при которых сначала образуются анион-радикалы, а после ряда трансформаций алкоголяты, которые под действием воды переходят в ацилоины.
Этот раздел не завершён. |
Декарбонилирование карбоновых кислот[править | править код]
Декарбонилирование (отщепление CO) карбоновых кислот достаточно редкий лабораторный способ получения спиртов, который может быть осуществлён с использованием металлических катализаторов.
Этот раздел не завершён. |
Получение спиртов восстановлением эпоксидов и карбонильных соединений[править | править код]
Этот раздел не завершён. |
Восстановление эпоксидов гидридами металлов[править | править код]
Этот раздел не завершён. |
Восстановление карбонильных соединений гидридами металлов[править | править код]
Этот раздел не завершён. |
Восстановление карбонильных соединений по реакции Меервейна-Пондорфа-Верлея[править | править код]
Этот раздел не завершён. |
Восстановление карбонильных соединений органическими реагентами[править | править код]
Этот раздел не завершён. |
Восстановление ароматических кетонов щелочными металлами[править | править код]
Этот раздел не завершён. |
Восстановление карбоновых кислот и сложных эфиров по методу Буво-Блана[править | править код]
Этот раздел не завершён. |
Восстановление хлорангидридов карбоновых кислот[править | править код]
Этот раздел не завершён. |
Каталитическое гидрирование карбонильных соединений[править | править код]
Этот раздел не завершён. |
Получение спиртов с использованием металлорганических соединений[править | править код]
Этот раздел не завершён. |
Присоединение реактивов Гриньяра к эпоксидам[править | править код]
Этот раздел не завершён. |
Присоединение реактивов Гриньяра к альдегидам или кетонам[править | править код]
Этот раздел не завершён. |
Присоединение реактивов Гриньяра к сложным эфирам или ацилгалогенидам[править | править код]
Этот раздел не завершён. |
Получение спиртов окислительными методами[править | править код]
Окисление алканов и циклоалканов[править | править код]
Этот раздел не завершён. |
Окисление алкенов[править | править код]
Многоатомные спирты можно получить путём мягкого окисления (по Вагнеру) алкенов - для этого необходимо пропустить их через водный раствор окислителя, например - перманганата калия, - при температуре от 0 до 5 градусов Цельсия:  Также возможно и получение вторичных спиртов методом жёсткого окисления разветвлённых алкенов (либо подкисленным раствором окислителя, либо оксидом осмия (VIII)) с последующим восстановлением:
Также возможно и получение вторичных спиртов методом жёсткого окисления разветвлённых алкенов (либо подкисленным раствором окислителя, либо оксидом осмия (VIII)) с последующим восстановлением:
Озонолиз алкенов с последующим восстановлением[править | править код]
Спирт можно получить озонированием алкена с дальнейшей реакцией с сильным восстановителем (тетрагидроборат натрия, тетрадигидроалюминат лития):
Реакцию озонолиза следует проводить с использованием таких органических растворителей, как хлористый метилен или этилацетат[56].
Реакция Циглера[править | править код]
Является методом синтеза высших спиртов (С8 и выше) при помощи алюминийорганических соединений. Алюминийорганические соединения легко могут быть получены из олефинов в присутствии водорода. Данным методом можно получать чистые первичные спирты:
Этот раздел не завершён. |
Окисление реактивов Гриньяра[править | править код]
Этот раздел не завершён. |
Окисление Тамао-Кумада-Флеминга[править | править код]
Этот раздел не завершён. |
Прочие методы получения спиртов[править | править код]
Гидролиз эфиров неорганических кислот[править | править код]
Этот раздел не завершён. |
Диазотирование первичных алифатических аминов[править | править код]
Этот раздел не завершён. |
Реакция Демьянова[править | править код]
Этот раздел не завершён. |
Реакция Фриделя-Крафтса[править | править код]
Этот раздел не завершён. |
Восстановление сложных эфиров тиокислот[править | править код]
Этот раздел не завершён. |
Реакция Кулинковича[править | править код]
Этот раздел не завершён. |
Краткий обзор методов органического синтеза многоатомных спиртов[править | править код]
Получение 1,2-диолов гидратацией эпоксидов[править | править код]
Этот раздел не завершён. |


 French
French Deutsch
Deutsch


![{\displaystyle {\mathsf {C_{6}H_{13}\!\!-\!\!CHBr\!\!-\!\!CH_{3}+H_{2}O}}\ {\xrightarrow[{25^{o}C,\ CH_{3}OC_{2}H_{4}OCH_{3}}]{Hg(ClO_{4})_{2}}}\ {\mathsf {C_{6}H_{13}\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}\ _{(88\%)}+HBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/643f43404fcb95e30c049dafabe0c13acf4b4477)



![{\displaystyle {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+H_{3}O^{+}}}\rightleftarrows {\mathsf {[R\!\!-\!\!CH^{+}\!\!-\!\!CH_{3}]+H_{2}O}}\rightarrow {\mathsf {R\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}+H^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d328267dd281e15799995b90729af2a748ef526d)
![{\displaystyle {\mathsf {CH_{3}(CH_{2})_{3}CH\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[{85-100^{o}C}]{HCOOH,\ HClO_{4}}}\ \ {\mathsf {CH_{3}(CH_{2})_{3}CH(OH)CH_{3}+CH_{3}(CH_{2})_{2}CH(OH)CH_{2}CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04382bada416065ffd5c1141a1f46a2388782eaf)
![{\displaystyle {\mathsf {(}}{CH_{3})_{2}C\!\!=\!\!CH_{2}+H_{2}O}\ {\xrightarrow[{10-20^{o}C}]{65\%H_{2}SO_{4}}}\ \ {\mathsf {(CH_{3})_{2}C(OH)CH_{3}}}\ _{(45\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b715302d49cbd0703414fb74e7113d1ee4ee394e)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[{300^{o}C,\ 70-80\ ATM}]{H_{3}PO_{4}/SiO_{2}}}\ \ {\mathsf {CH_{3}CH_{2}OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2c8c9eee5ff95e5e128eee08d10f3b756374b18)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CH_{2}+H_{2}O}}\ {\xrightarrow[{200^{o}C,\ 20-30\ ATM}]{H_{3}PO_{4}/SiO_{2}}}\ \ {\mathsf {CH_{3}CH(OH)CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e529dc175a1a28f3d2bf041bb254e7a4853b4b3)
![{\displaystyle {\mathsf {CH_{3}(CH_{2})_{3}CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {CH_{3}(CH_{2})_{3}CH(OH)CH_{3}}}\ _{(99,5\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ca0165e755be7689f5a86d2758d414b1a2da3d0)
![{\displaystyle {\mathsf {C_{6}H_{5}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {C_{6}H_{5}\!\!-\!\!C(CH_{3})(OH)\!\!-\!\!CH_{3}}}\ _{(100\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f296e2a5d0bfb1838eac9c83a38d72583280e9c8)
![{\displaystyle {\mathsf {(CH_{3})_{3}C\!\!-\!\!CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{2)\ NaBH_{4};\ H_{2}O}]{1)\ (CH_{3}COO)_{2}Hg,;\ THF-H_{2}O;\ 20^{o}C}}\ \ {\mathsf {(CH_{3})_{3}C\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}}}\ _{(97\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3435fa8d8414081f9f598cae2d36115b131012de)


![{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {RCH_{2}\!\!-\!\!CH_{2}OH}}\ _{(94\%)}+{\mathsf {RCH(OH)\!\!-\!\!CH_{3}}}\ _{(6\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c2b1070a75ab8dd5b19a5a192f9b06bf8d4ff1)
![{\displaystyle {\mathsf {C_{6}H_{5}CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {C_{6}H_{5}CH_{2}\!\!-\!\!CH_{2}OH}}\ _{(80\%)}+{\mathsf {C_{6}H_{5}CH(OH)\!\!-\!\!CH_{3}}}\ _{(20\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/517b7f559eccc8bf0b46316c3b00fad22b0a5b66)
![{\displaystyle {\mathsf {(CH_{3})_{2}CHCH\!\!=\!\!CHCH_{3}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{B_{2}H_{6}}}\ \ {\mathsf {(CH_{3})_{2}CHCH_{2}CH(OH)CH_{3}}}\ _{(57\%)}+{\mathsf {(CH_{3})_{2}CHCH(OH)CH_{2}CH_{3}}}\ _{(43\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81b80b2d3a569a3922217a4619e2735589d7d447)


![{\displaystyle {\mathsf {C_{6}H_{5}CH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{DIAB}}\ \ {\mathsf {C_{6}H_{5}CH_{2}\!\!-\!\!CH_{2}OH}}\ _{(98\%)}+{\mathsf {C_{6}H_{5}CH(OH)\!\!-\!\!CH_{3}}}\ _{(2\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/71266e52684055ea9e54dacdfd61636e1d9f2196)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!(CH_{2})_{3}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}}}\ {\xrightarrow[{H_{2}O_{2},\ OH^{-}}]{(Sia)_{2}BH}}\ \ {\mathsf {HOCH_{2}\!\!-\!\!CH_{2}\!\!-\!\!(CH_{2})_{3}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/512dad8f188aab6338939c59597445cfb7f40dd1)

![{\displaystyle {\mathsf {(RCH_{2}\!\!-\!\!CH_{2}-)_{3}B+CO}}{\xrightarrow {125^{o}C}}{\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{3}B^{-}\!\!\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {O^{+}]}}\rightarrow {\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{2}B\!\!-\!\!CO\!\!-\!\!CH_{2}CH_{2}R]}}\rightarrow }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c321c4c32849482f1301a2b54d802a31e86a612)
![{\displaystyle \rightarrow {\mathsf {[(RCH_{2}\!\!-\!\!CH_{2}-)_{3}C\!\!-\!\!B\!\!=\!\!O]}}{\xrightarrow[{NaOH,\ H_{2}O}]{H_{2}O_{2}}}{\mathsf {(RCH_{2}\!\!-\!\!CH_{2}-)_{3}COH+Na[B(OH)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/211637566b6dbbd36c8966d5f1231d963b04545b)
![{\displaystyle {\mathsf {CH_{3}CH\!\!=\!\!CHCH_{3}}}{\xrightarrow[{3)\ H_{2}O_{2},\ NaOH,\ H_{2}O}]{1)\ B_{2}H_{6};\ 2)\ CO}}{\mathsf {(CH_{3}CH_{2}CH(CH_{3})-)_{3}COH}}\ _{(87\%)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/acfb6d0a6d5c002959880578fa3022eb9dda40ce)






![{\displaystyle {\mathsf {C+H_{2}O}}\rightarrow {\mathsf {CO+H_{2}}}\rightarrow {\mathsf {CH_{3}OH}}\ {\xrightarrow[{-\ H_{2}O}]{CO\ +\ H_{2}}}\ \ {\mathsf {CH_{3}CH_{2}OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f2e3410591ebad2e5821584fa4fc68aad8d10200)

















![{\displaystyle {\mathsf {RCOR'+CH_{2}\!\!=\!\!CHCH_{2}Si(CH_{3})_{3}}}\ {\xrightarrow[{H_{2}O}]{Lewis\ acid}}\ {\mathsf {RR'C(OH)CH_{2}CH\!\!=\!\!CH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6c420605cd1d7b79587a1becd220bfd02155530)
![{\displaystyle {\mathsf {(CHR\!\!-\!\!CHR)O+CH_{2}\!\!=\!\!CHCH_{2}Si(CH_{3})_{3}}}\ {\xrightarrow[{H_{2}O}]{Lewis\ acid}}\ {\mathsf {RCH(OH)CH(R)CH_{2}CH\!\!=\!\!CH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7850c9b031fda24164c2f838fc3dc26ff98e352)
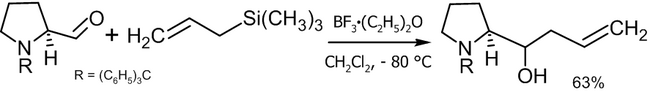

![{\displaystyle {\mathsf {R'\!\!-\!\!CHO+R\!\!-\!\!CH\!\!=\!\!CHBr}}\ {\xrightarrow[{(CH_{3})_{2}S=O}]{CrCl_{2},\ NiBr_{2}}}\ {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH(OH)R'}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a98eec60089d57d2df1fa9c60c94de1d47606c2)

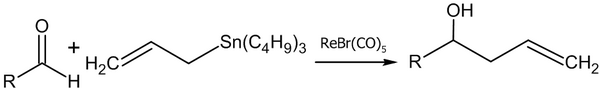














![{\displaystyle {\mathsf {R\!\!-\!\!CO\!\!-\!\!R+[Ar\!\!-\!\!CH^{-}\!\!\!\!-\!\!COONa]MgCl^{+}}}\rightarrow {\mathsf {[Ar\!\!-\!\!CR(COONa)\!\!-\!\!CHR(OMgCl)]}}\rightarrow {\mathsf {Ar\!\!-\!\!CR(COOH)\!\!-\!\!CHROH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac338f015e3b2ba9bb5f4c364b3fcdeb6a9fe005)





![{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}}}\ {\xrightarrow[{-RH}]{H_{2},\ AlR_{3}}}\ {\mathsf {RCH_{2}CH_{2}\!\!-\!\!AlR_{2}}}\ {\xrightarrow {O_{2}}}\ {\mathsf {RCH_{2}CH_{2}\!\!-\!\!O\!\!-\!\!Al(OR)_{2}}}\ {\xrightarrow {H_{2}O}}\ {\mathsf {RCH_{2}CH_{2}OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/754c67e54bba7c18c2fb0a982958ff4d2f2bb257)

