Дендритные клетки — Википедия
| Дендритная клетка | |
|---|---|
 | |
| Ткань | Иммунная система |
Дендри́тные кле́тки (ДК, англ. Dendritic cells, DC) — специализированные на презентации антигенов лейкоциты, имеющие характерную отростчатую морфологию. Дендритные клетки относят к «профессиональным» антигенпрезентирующим клеткам. Дендритные клетки играют важнейшую роль в функционировании иммунной системы, поскольку они необходимы для активации T-клеточного ответа. Дендритные клетки экспрессируют молекулы главного комплекса гистосовместимости I (MHC-I) и II (MHC-II), на которых представляют фрагменты антигенов T-клеткам. Без участия антигенпрезентирующих клеток T-клетки не могут распознать антиген.
Почти все дендритные клетки имеют костномозговое происхождение, за исключением фолликулярных дендритных клеток, имеющих мезенхимальное происхождение. Дендритные клетки костномозгового происхождения могут относиться как к миелоидному, так и лимфоидному ряду. Дендритные клетки можно получить из фибробластов, а также из моноцитов периферической крови или стволовых клеток костного мозга. Существует несколько разновидностей дендритных клеток: миелоидные дендритные клетки, плазмоцитоидные дендритные клетки, фолликулярные дендритные клетки и клетки Лангерганса.
Дендритные клетки играют важную роль в развитии и терапии аутоиммунных заболеваний, рака и других болезней. Для ряда вирусов, например, ВИЧ, дендритные клетки выступают в роли мишени. Иногда дендритные клетки сами становятся причиной рака и претерпевают злокачественное перерождение.
Дендритные клетки впервые описал Пауль Лангерганс в 1868 году. Впоследствии найденную им разновидность дендритных клеток назвали клетками Лангерганса. Функциональную роль дендритных клеток удалось установить во второй половине XX века. В 1973 году Ральф Стайнман и Занвиль Кон ввели в употребление термин «дендритные клетки». В 2011 году за открытие дендритных клеток Стайнману была присуждена Нобелевская премия по физиологии или медицине.
Строение[править | править код]
Дендритные клетки представляют собой подвижные крупные (диаметром 15—20 мкм) клетки овальной или многоугольной формы с эксцентрически расположенным ядром[1][2] и длинными цитоплазматическими выростами, причём некоторые цитоплазматические выросты превышают 10 мкм. Цитоплазма дендритных клеток содержит небольшое количество внутриклеточным органелл[3], но достаточно большое количество митохондрий[4]. Отростчатая морфология, наличие псевдоподий и ворсинок присущи всем зрелым дендритным клеткам независимо от их специализации. Именно наличию отростков дендритные клетки обязаны своим названием[5]. К свойствам, универсальным для всех дендритных клеток, можно также отнести повышенный уровень экспрессии главного комплекса гистосовместимости I (MHC-I) и II (MHC-II) классов, а также костимулирующих молекул CD80 и CD86. Кроме того, все дендритные клетки могут путём пиноцитоза или, в меньшей степени, фагоцитоза захватывать антиген для дальнейшего процессинга и презентации его T-клеткам, что приводит к активации последних[6].
В крови здоровых людей дендритные клетки имеют малый уровень экспрессии молекул CD83, CD80, CCR7, независимо от типа клетки[2][7].
Развитие[править | править код]

Начало дендритным клеткам дают кроветворные стволовые клетки, то есть дендритные клетки, за исключением фолликулярных дендритных клеток, имеющих мезенхимальное происхождение, происходят из костного мозга. Дендритные клетки образуются из клеток-предшественников как миелоидного, так и лимфоидного ряда, причём дифференцировка предшественников в дендритные клетки возможна даже на ранних стадиях развития. В то же время допускается существование особой клетки-предшественницы дендритных клеток[6].
Большинство дендритных клеток принадлежат к миелоидному ряду. Считается, что in vivo дендритные клетки могут образовываться как из гранулоцитарно-моноцитарных предшественников, так и из моноцитов. В культуре миелоидные дендритные клетки можно получить и из клеток костного мозга в присутствии GM-CSF и других цитокинов, а также из моноцитов в присутствии GM-CSF и IL-4. Дендритные клетки лимфоидного ряда дифференцируются из общего лимфоидного предшественника, а также предшественников T- и B-клеток, в частности, тимоцитов на самой ранней стадии их развития в тимусе (DN1-клеток). Предшественников лимфоидных и миелоидных дендритных клеток объединяет экспрессия цитокинового рецептора FLT3, что отличает их от предшественников других иммунных клеток. Таким образом, дендритные клетки могут образовываться из 6—7 клеточных источников[8].
В периферической крови присутствуют незрелые дендритные клетки, которые составляют менее 0,5 % от общего числа лейкоцитов в кровотоке и выступают предшественниками дендритных клеток миелоидного и лимфоидного рядов, а также клеток Лангерганса. Маркерами клеток-предшественников миелоидных клеток являются молекулы CD11c и MHC-II. Большинство незрелых дендритных клеток кровотока составляют так называемые плазмоцитоидные дендритные клетки, которые относятся к лимфоидному ряду. Незрелые дендритные клетки мигрируют из периферической крови в ткани благодаря тому, что на их поверхности располагаются рецепторы к практически всем β-хемокинам. Хотя дендритные клетки присутствуют во многих тканях и органах, их количество мало, поэтому и открыты они были сравнительно поздно. Как и макрофаги, дендритные клетки подразделяют на резидентные, которые присутствуют преимущественно в барьерных тканях (в коже и слизистых оболочках), и воспалительные[9].
Функции[править | править код]
Основная функция дендритных клеток — презентация антигенов T-лимфоцитам, поэтому их относят к «профессиональным» антигенпрезентирующим клеткам. По эффективности презентации они на два порядка превосходят макрофаги благодаря повышенной экспрессии MHC, особенно MHC-II, а также молекул-костимуляторов. Презентация антигена дендритными клетками наивным T-клеткам запускает иммунный ответ[10].
Дендритные клетки активно и непрерывно распознают патогены (точнее, патоген-ассоциированные молекулярные паттерны, PAMP[11]) с помощью Toll-подобных рецепторов и поглощают соответствующие антигены по пути пиноцитоза и, в меньшей степени, фагоцитоза[6]. Если чужеродных антигенов вокруг дендритной клетки нет, то она поглощает и презентирует T-клеткам материал собственных тканей организма, но без корецепторного стимула, и иммунный ответ против собственных тканей организма не развивается. До активации антигеном дендритные клетки остаются незрелыми и имеют низкую презентирующую способность. Созревание дендритной клетки происходит при распознавании патогена Toll-подобными рецепторами. Дендритные клетки миелоидного ряда, подобно макрофагам, несут рецепторы маннозы, липополисахарида, а также TLR2 и TLR4, позволяющие распознавать грамотрицательные и грамположительные бактерии соответственно. Плазмоцитоидные дендритные клетки несут TLR7 и TLR9, распознающие ДНК вирусов и бактерий[12].
После распознавания патогена в дендритных клетках увеличивается продукция цитокинов и хемокинов, а также повышается экспрессия адгезивных молекул, необходимые для представления антигенов и стимуляции Т-клеток[13]. В большинстве случаев фрагменты процессированного антигена представляются дендритными клетками в комплексе с MHC-II. В отличие от других антигенпрезентирующих клеток дендритные клетки могут презентовать антиген цитотоксическим CD8+ T-лимфоцитам в комплексе с MHC-I. Этот процесс известен как кросс-презентация[14]. Одна зрелая дендритная клетка может активировать от 100 до 3 тысяч T-клеток[15].
Под действием хемокинов CCL19, CCL21 и CXCL12 зрелые дендритные клетки мигрируют из покровных тканей и по тканевой жидкости попадают в лимфатические сосуды, откуда перемещаются в региональные лимфоидные органы, например, в паракортикальную зону лимфатических узлов. В ходе миграции дендритная клетка практически утрачивает способность к эндоцитозу и проводит процессинг антигена с дальнейшим представлением его фрагментов в составе MHC. Попадание дендритных клеток в T-зависимую зону лимфатических узлов обеспечивается изменением экспрессии рецепторов хемокинов. Вместо рецепторов для хемокинов, которые продуцируются клетками барьерных тканей, дендритные клетки начинают экспрессировать рецепторы CCR7 и CXCR4, которые распознают хемокины, выделяемые клетками стромы T-зависимых зон лимфатических узлов. В этих зонах происходит презентация антигенов дендритными клетками T-лимфоцитам и активация последних через корецепторы CD40, CD80 и CD86. Контакт дендритной клетки и T-клетки через презентированный на MHC-II антиген получил название иммунологического синапса. Без иммунологического синапса дальнейшее развитие иммунного ответа невозможно[16]. Именно большое количество MHC-II, а также CD80 и CD86 на поверхности зрелых дендритных клеток делает их антигенпрезентирующими[17]. Активированные дендритные клетки продуцируют CD154, который связывается с CD40 на поверхности дендритных клеток[3]. Зрелые дендритные клетки, доставившие антиген в T-зависимую зону лимфоузла, становятся частью его стромы и называются интердигитальными дендритными клетками, так как между их отростками, напоминающими пальцы, располагаются T-лимфоциты[11].
Резидентные миелоидные дендритные клетки заселяют органы на стадии клеток-предшественников или незрелых дендритных клеток и завершают своё развитие уже в органе, который в дальнейшем не покидают. Многие резидентные дендритные клетки располагаются в тимусе, зародышевых центрах, маргинальной зоне селезёнки, печени и других органах[11].
Клетки эпителия миндалин и желудочно-кишечного тракта продуцируют хемокин MIP-3α, который привлекает незрелые дендритные клетки за счёт взаимодействия с рецептором CCR6 на поверхности незрелых дендритных клеток. Синтез этого хемокина активируется при воспалении. При созревании дендритные клетки перестают экспрессировать CCR6 и перестают реагировать на MIP-3α, но на их поверхности появляется другой хемокиновый рецептор — CCR7. Созревающие дендритные клетки начинают реагировать на хемокины MIP-3β и SLC, продуцируемый вторичными лимфоидными тканями, что привлекает дендритные клетки в лимфоузлы[3].
Некоторые факторы могут системно изменять и даже нарушать функционирование дендритных клеток. Так, дислипидемия изменяет функцию презентации антигена, а никотин повреждает их способность начинать пролиферацию Т-клеток и вырабатывать цитокины[18].
Разновидности дендритных клеток[править | править код]
Зрелые дендритные клетки подразделяют на два типа: DC1 (миелоидные) и DC2 (лимфоидные). Основные свойства клеток этих типов представлены в таблице ниже[17]:
| Характеристика | DC1 | DC2 |
|---|---|---|
| Происхождение | Миелоидные | Лимфоидные |
| Индуцирующие цитокины | IL-12, IFNγ | IL-10 |
| Фенотип | CD11chiCD123lo | CD11c-CD123hi |
| Продуцируемые цитокины | IL-12 | IFNγ |
| Влияние на T-клетки | Активация | Индукция анергии |
Незрелые лимфоидные дендритные клетки представлены плазмоцитоидными дендритными клетками. Особняком стоят эпидермальные дендритные клетки, известные как клетки Лангерганса, и фолликулярные дендритные клетки, имеющие мезенхимальное, а не костномозговое происхождение. В тимусе присутствуют в основном лимфоидные дендритные клетки, но есть и миелоидные. В селезёнке и брыжеечных лимфатических узлах преобладают в разных соотношениях популяции миелоидных лимфоидных клеток. В лимфатических узлах, связанных с кожей, помимо миелоидных дендритных клеток в больших количествах присутствуют клетки Лангерганса[19].
Согласно альтернативной классификации, дендритные клетки подразделяются на классические и плазмоцитоидные (см. ниже). Классические дендритные клетки стимулируют T-клеточный ответ. Именно классические дендритные клетки являются преобладающей группой дендритных клеток в лимфоидных тканях. Классические дендритные клетки дополнительно подразделяются на основные и кросс-презентирующие[20]. Плазмоцитоидные дендритные клетки — это незрелые клетки, которые происходят от того же предшественника, что и классические дендритные клетки, и локализованы в основном в кровотоке, в меньшей степени — в лимфоидных органах. В отличие от классических дендритных клеток, плазмоцитоидные дендритные клетки практически неспособны к фагоцитозу и не поглощают антигены. Основной функцией плазмоцитоидных клеток является продукция интерферона[21].
Миелоидные дендритные клетки[править | править код]
Миелоидные дендритные клетки (МДК) — дендритные клетки-предшественницы гемопоэтического происхождения. МДК имеют схожую морфологию, а также эндоцитозную и ферментативную активность с макрофагами и моноцитами. Локализируются в эпидермисе, дерме, дыхательных путях, кишечнике, тимусе, селезёнке, печени и лимфоидной ткани. Они характеризуются низким уровнем экспрессии MHC, а также костимуляторных и адгезивных молекул. С помощью пиноцитоза и фагоцитоза МДК захватывают чужеродные антигены, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHC-II. Затем они мигрируют в местные лимфатические узлы, где стимулируют пролиферацию и дифференцировку антигенспецифических Т-лимфоцитов, провоцируя и стимулируя иммунный ответ. В ответ на стимуляцию индукторами созревания, МДК продуцируют преимущественно цитокины Т-Хелпера 1 типа, включая IL-6, IL12RB1, фактор некроза опухоли и интерферон γ. Маркерами МДК являются молекулы CD1c и CD141[4][7][22].
Плазмоцитоидные дендритные клетки[править | править код]
Плазмоцитоидные дендритные клетки (ПДК) — незрелые клетки лимфоидного происхождения, морфологически напоминают плазматические клетки. ПДК — преобладающая разновидность незрелых дендритных клеток, циркулирующих в крови. ПДК меньше моноцитов (8—10 мкм), их ядро имеет менее выраженную выемку. Помимо кровотока, ПДК локализируются в Т-клеточных зонах лимфоидных тканей, миндалинах, тимусе, печени, лёгких и в коже. В присутствии IL-3 и бактериальных антигенов ПДК дифференцируются в зрелые лимфоидные дендритные клетки. На своей поверхности ПДК не несут молекул CD83, CD11b и CD11c, которые характерны для миелоидных дендритных клеток, а также CD13 и CD14, характерные для большинства миелоидных клеток. В ПДК экспрессируются гены RAG, которые необходимы для перестройки генов антигенраспознающих рецепторов. На поверхности ПДК присутствуют CD45R0 и рецепторы для IL-3, при этом MHC-II представлены в меньшей степени, чем на миелоидных дендритных клетках, причём молекулы MHC-II есть не только на поверхности, но и в цитоплазме. В геномах ПДК имеются признаки перестройки генов T-клеточных рецепторов, которые характерны для T-клеток. ПДК выделяют в больших количествах интерфероны I типа (α, β и ω), являясь основными поставщиками интерферона клеткам крови, поэтому ПДК также известны как клетки-продуценты интерферона. ПДК секретируют большие количества интерферонов преимущественно на первые сутки после стимуляции нуклеиновыми кислотами вирусного происхождения. Также они ответственны за производство цитокинов IL-4 и IL-10, которые переключают дифференцировку наивных Т-хелперов в Т-хелперы 2 типа. В спектре Toll-подобных рецепторов, экспрессируемых ПДК, преобладают рецепторы, находящиеся на цитоплазматических гранулах и распознающие нуклеиновые кислоты. В частности, экспрессия TLR9, лигандами которого являются CpG-олигонуклеотиды бактериальной ДНК, позволяет им обнаруживать патогены. Маркерами ПДК являются молекулы CD303, CD304, CD141, рецептор IL-3 CD123, а также иммуноглобулиноподобные рецепторы CD85k и CD85g[4][13][22][23][24].
ПДК попадают в лимфатические узлы тем же путём, что и T-клетки, а именно, через высокий эндотелий посткапиллярных венул. В то же время клетки-предшественницы миелоидных дендритных клеток проникают в лимфоузлы вместе с афферентным током лимфы. Как упоминалось выше, в течение первых суток после стимуляции вирусами или IL-3 ПДК усиленно экспрессируют интерфероны. В течение вторых суток они дифференцируются в зрелые дендритные клетки лимфоидного ряда. По мере созревания на поверхности ПДК повышается количество молекул MHC-II, появляются молекулы-костимуляторы CD80 и CD86. Во время созревания ПДК продолжают выделять интерфероны, но в меньшем количестве. При вирусной стимуляции созревающая ПДЦ способствует дифференцировке T-хелперов 1 типа (Th1-клеток), продуцирующих интерферон γ, а при стимуляции IL-3 — T-хелперов 2 типа (Th2-клеток), продуцирующих IL-4[25].
Фолликулярные дендритные клетки[править | править код]
Фолликулярные дендритные клетки (ФДК) — зрелые клетки, в отличие от остальных дендритных клеток, имеют мезенхимальное происхождение. Прочно соединяясь десмосомами отростков, образуют стабильную сеть, благодаря которой они не мигрируют в другие области. ФДК локализируются в клеточных зонах лимфатических узлов и селезёнке. Они представляют антиген В-лимфоцитам во вторичных лимфоидных органах. Антиген на поверхности ФДК пассивен, сохраняет исходную конформацию антигена с антителом. Эти клетки являются особым микроокружением, на котором происходит уникальный для В-лимфоцитов процесс соматической гипермутации вариабельных сегментов генов, кодирующих антитела, и отбор наиболее аффинных к антигену вариантов антител. Они не экспрессируют белки MHC-II, но несут много молекул Fcγ-рецепторов, CR1 и CR2, что позволяет им связывать иммунные комплексы и представлять содержащийся в комплексах антиген В-лимфоцитам. При повторном поступлении антигена в организм, когда он связывается с ранее наработанными антителами, ФДК стимулируют B-клетки памяти[4][26].
Клетки Лангерганса[править | править код]
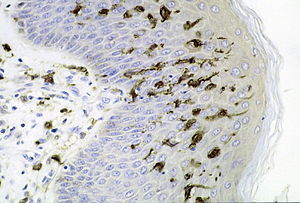

Клетки Лангерганса — эпидермальные дендритные клетки миелоидного ряда. Своё название клетки Лангерганса получили в честь первооткрывателя Пауля Лангерганса, который описал их в конце XIX века как отростчатые клетки эпидермиса, однако их принадлежность к иммунным клеткам была установлена позднее. Клетки Лангерганса имеют ряд признаков, отличающих их от всех остальных дендритных клеток. В их цитоплазме присутствуют слоистые включения, известные как гранулы Бирбека, а на поверхности присутствует рецептор лангерин (CD208), относящийся к лектинам и присутствующий уже на циркулирующих в кровотоке клетках-предшественниках, и «неклассическая» молекула MHC — CD1a, которая предназначена для презентации липидных антигенов. Гранулы Бирбека представляют собой овально вытянутые структуры с центрально расположенным фрагментированным стержнем, происходящие из атипичных гранул, и напоминают по форме теннисные ракетки. Гранулы Бирбека, возможно, являются эндосомами, участвующими в захвате антигена[3]. Атипичные гранулы клеток Лангерганса морфологически отличаются от лизосом наличием прозрачного ореола, разделяющего наружную мембрану гранулы и её центральную зону[4]. Также в цитоплазме клеток Лангерганса присутствует трубчато-везикулярная система — соединение модифицированного и гипертрофированного комплекса Гольджи с гладким эндоплазматическим ретикулумом[4]. Кроме упомянутых выше лангерина и CD1a, на поверхности клеток Лангерганса присутствуют такие молекулы, как Е-кадгерин, CD20, CD11c, CD13, CD14 и CD33. Развитие клеток Лангерганса до конца не изучено. Считается, что они развиваются преимущественно из гемопоэтических клеток желточного мешка, а также, хотя и в меньшей степени, из костномозговых предшественников[27]. Клетки Лангерганса локализируются в эпидермисе, сальных и потовых железах, волосяных фолликулах, эпителии полости рта, носа, пищевода, лёгких, влагалища и толстой кишки. Основная функция клеток Лангерганса — регуляция гомеостаза всего организма и реализация защитных реакций кожи[28]. С помощью отростков они связаны с нервными окончаниями эпидермиса и с гемомикроциркуляторным руслом сосочкового слоя дермы. Благодарю этому на клетках Лангерганса замыкаются 3 регуляторные системы — иммунная, нервная и эндокринная. Уникальная особенность Клеток Лангерганса — сохранение антигена патогена в иммуногенной форме длительное время[29]. После захвата антигена клетки Лангерганса перемещают антигенные пептиды в местные лимфатические узлы через центральные лимфатические сосуды и участвуют в дифференцировке наивных Т-лимфоцитов в Т-хелперы[4][13].
Клиническое значение[править | править код]
Дендритные клетки задействованы в иммунном ответе организма на многие вирусы и могут поражаться некоторыми из них. Так, клетки Лангерганса участвуют в быстром ВИЧ-инфицировании. Клетки экспрессируют рецепторные структуры для ВИЧ — CD4 и рецепторы хемокинов. После захвата антигена или инфицирования ВИЧ через 30 минут клетки Лангерганса мигрируют в лимфатические узлы, благодаря чему они способствуют быстрому распространению ВИЧ по организму[4]. Дендритные клетки обеспечивают выработку интерферонов при заражении такими вирусами, как цитомегаловирус и вирус гриппа[30]. Хантавирус при попадании в организм эффективно заражает дендритные клетки, при этом не провоцируя лизис или апоптоз. Хантавирус активирует незрелые клетки, вследствие чего повышается экспрессия MHC, а также костимулирующих и адгезивных молекул. Инфицированные хантавирусом клетки усиливают высвобождение провоспалительных цитокинов, в частности, фактора некроза опухоли и α-интерферона. Таким образом, хантавирусы вызывают сильный иммунный ответ, являющийся частью патогенеза вирусной инфекции[31]. Показано, что фолликулярные дендритные клетки могут способствовать размножению прионов при скрейпи[32].
Дендритные клетки вовлечены в патогенез ряда аутоиммунных заболеваний. У больных системной красной волчанкой активность дендритных клеток патологически повышена, вследствие чего повышается выделение интерферонов, стимулирующих дифференцировку клеток-предшественниц дендритных клеток. Зрелые дендритные клетки поглощают ДНК, содержание которой в крови при системной красной волчанке увеличивается, и начинается иммунный ответ: в организме образуются антитела против его собственной ДНК, которые и обуславливают заболевание[4]. Показана роль дендритных клеток в развитии аллергии, а также воспалительных заболеваний кишечника, таких как болезнь Крона и язвенный колит[33][34][35].
Иногда дендритные клетки претерпевают злокачественное перерождение. Например, саркомы, происходящие из фолликулярных дендритных клеток, обычно затрагивают лимфоидные ткани, но также могут поражать печень, жёлчные протоки, поджелудочную железу, щитовидную железу и другие органы[36]. Повышенное содержание дендритных клеток в опухоли коррелирует с лучшим прогнозом, таким образом, дендритные клетки могут оказывать влияние на развитие опухолей[37][38]. Дендритные клетки активируют T-хелперы и цитотоксические T-клетки, которые могут подавлять развитие опухоли. Кроме того, дендритные клетки могут влиять на успех иммунотерапии рака, в частности, основанной на применении ингибиторов контрольных точек[39][40].
Применение в медицине[править | править код]
Способность дендритных клеток управлять иммунными процессами, а также успехи в разработке систем для получения клеток с заданными параметрами привели к их использованию в иммунотерапии рака и некоторых аутоиммунных заболеваний, а также атеросклероза[18]. Иммунотерапия рака, направленная на дендритные клетки, была успешно протестирована на пациентах с гепатоцеллюлярной карциномой, карциномой почек, меланомой и лимфомами. Использование активации дендритных клеток в противораковой иммунотерапии основано на их способности активировать иммунный ответ против опухоли[41]. Чтобы активировать дендритные клетки, используют цитокины, сшитые с опухолевыми антигенами[42]. Как правило, в опухолях дендритных клеток немного, однако повышенная плотность популяций дендритных клеток считается маркером благоприятного прогноза[37][38]. Дендритные клетки, входящие в состав опухолей, могут активировать T-хелперы и цитотоксические T-клетки, которые, в свою очередь, могут подавлять рост опухоли[40][43].
Благодаря способности модулировать силу иммунного ответа дендритные клетки могут быть использованы в терапии аутоиммунных заболеваний, в частности, ревматоидного артрита. Дендритные клетки могут подавлять аутореактивные T-клетки и тем самым препятствовать развитию аутоиммунного процесса[44][45]. Нарушения в работе дендритных клеток связаны с развитием других аутоиммунных заболеваний, таких как системная красная волчанка, болезнь Крона и язвенный колит, а также аллергии[33][34][35].
Дендритные клетки сами могут подвергаться злокачественному перерождению. В частности, при бластической неоплазии плазмоцитоидных дендритных клеток злокачественные плазмоцитоидные дендритные клетки проникают в кожу, костный мозг, нервную ткань и другие ткани и органы. Встречается также лейкоз, вызванный злокачественным перерождением плазмоцитоидных дендритных клеток. В этом случае злокачественные плазмоцитоидные дендритные клетки в большом количестве (минимум 2 % всех ядерных клеток крови) присутствуют в кровотоке[46].
Дендритные клетки активизируются не только патогенами, их можно активировать искусственными стимуляторами. Пробиотический коктейль VSL#3 способен изменять экспрессию антигена и создание цитокинов. В высоких дозах пробиотик также повышает экспрессию молекул CD80, CD86, CD40 и MHC. С помощью пробиотиков можно регулировать количество дендритных клеток, таким образом способствуя лечению кишечных заболеваний[47].
В 2018 году удалось осуществить прямое перепрограммирование фибробластов в антигенпрезентирующие дендритные клетки, в ходе которого из фибробластов человека и мыши были получены дендритные клетки, представляющие антигены. В исследовании использовалась искусственная экспрессия факторов транскрипции для перепрограммирования дифференцированных клеток в сторону плюрипотентности. Путём комбинаций из 18 факторов транскрипции, экспрессируемые в клетках, были выявлены факторы транскрипции PU.1, IRF8 и BATF3, нужные для перепрограммирования как мышиных, так и человеческих фибробластов в индуцированные дендритные клетки. Как и обычные дендритные клетки, они могут выделять цитокины, поглощать и презентировать антигены. Мышиные индуцированные дендритные клетки способны перекрёстно представлять антигены CD8+ Т-клеткам[48].
Дендритные клетки являются одной из мишеней вируса иммунодефицита человека. Одной из молекул, содействующих проникновению ВИЧ внутрь дендритных клеток, является поверхностный белок DC-SIGN[49]. В дендритные клетки способны проникать и некоторые другие вирусы, например, SARS, также использующий DC-SIGN для проникновения в дендритные клетки[50].
История изучения[править | править код]

Впервые дендритные клетки были обнаружены в 1868 году Паулем Лангергансом и впоследствии названы клетками Лангерганса в честь него[4]. Лангерганс открыл дендритные клетки, будучи студентом университета, с помощью метода для выявления непигментных клеток эпидермиса, который был разработан Юлиусом Конгеймом. Однако функции обнаруженных им отростчатых клеток Лангерганс не установил[51].
В 1957 году Фрэнк Макфарлейн Бёрнет предложил теорию клональной селекции, постулирующую, что при иммунном ответе активируются и делятся только те T-лимфоциты, T-клеточный рецептор которых связывает антиген[52]. T-клетки неспособны реагировать на антигены самостоятельно, однако посредник, который представлял бы антигены T-клеткам, оставался неизвестным[53]. В начале 1960-х годов было сформулировано представление о A-клетках — малочисленных клетках, перерабатывающих антиген и производящих его презентацию T-лимфоцитам. В 1966 году Роберт Мишелл и Ричард Даттон показали, что добиться активации T-клеток можно, добавив к ним суспензию из клеток селезёнки[54]. В 1973 году Ральф Стайнман и Занвиль Кон применили термин «дендритные клетки» по отношению к отростчатым клеткам, располагающимся в лимфоидных органах. В 2011 году Стайнману была присуждена Нобелевской премии по физиологии или медицине за открытие дендритных клеток[55]. К концу 1980-х годов были накоплены данные, свидетельствующие, что именно дендритные клетки являются «профессиональными» антигенпрезентирующими клетками[10].
Примечания[править | править код]
- ↑ Reis e Sousa C. Dendritic cells in a mature age. (англ.) // Nature Reviews. Immunology. — 2006. — June (vol. 6, no. 6). — P. 476—483. — doi:10.1038/nri1845. — PMID 16691244.
- ↑ 1 2 Талаев Владимир Юрьевич. Механизмы управления миграцией миелоидных дендритных клеток и клеток лангерганса // Иммунология. — 2012. — Т. 33, вып. 2. — С. 104–112. — ISSN 0206-4952. Архивировано 8 августа 2021 года.
- ↑ 1 2 3 4 Бурместер, Пецутто, 2014, с. 54.
- ↑ 1 2 3 4 5 6 7 8 9 10 Грищенко Е. А. Дендритные клетки: основные представления // Аллергология и иммунология в педиатрии. — 2015. — Вып. 2 (41). — С. 9–17. — ISSN 2500-1175. Архивировано 30 июля 2021 года.
- ↑ Dendritic Cells | British Society for Immunology (англ.). www.immunology.org. Дата обращения: 13 августа 2021. Архивировано 13 августа 2021 года.
- ↑ 1 2 3 Недоспасов, Купраш, 2021, с. 76.
- ↑ 1 2 Фалалеева С.а, Курилин В.в, Шкаруба Н.с, Чумасова О.а, Сизиков А.э. Характеристика подтипов дендритных клеток периферической крови у больных ревматоидным артритом // Медицинская иммунология. — 2013. — Т. 15, вып. 4. — С. 343–350. — ISSN 1563-0625. Архивировано 1 августа 2021 года.
- ↑ Недоспасов, Купраш, 2021, с. 76—77.
- ↑ Недоспасов, Купраш, 2021, с. 77—78.
- ↑ 1 2 Недоспасов, Купраш, 2021, с. 75.
- ↑ 1 2 3 Недоспасов, Купраш, 2021, с. 79.
- ↑ Хаитов, 2019, с. 194—195.
- ↑ 1 2 3 Талаев Владимир Юрьевич, Плеханова Мария Владимировна. Исследование миграции дендритных клеток и трафика антигенов в целях совершенствования средств иммунопрофилактики // Журнал МедиАль. — 2014. — Вып. 2 (12). — С. 154–171. Архивировано 1 августа 2021 года.
- ↑ Хаитов, 2019, с. 193—194.
- ↑ British Society for Immunology: Dendritic Cells. Дата обращения: 13 августа 2021. Архивировано 13 августа 2021 года.
- ↑ Хаитов, 2019, с. 195—196.
- ↑ 1 2 Недоспасов, Купраш, 2021, с. 80.
- ↑ 1 2 Бобрышев Ю. В., Орехов А. Н. Дендритные клетки и их потенциальная значимость для иммунотерапии атеросклероза // Атеросклероз и дислипидемии. — 2013. — Вып. 4. — С. 4–15. — ISSN 2219-8202. Архивировано 31 июля 2021 года.
- ↑ Недоспасов, Купраш, 2021, с. 81.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 112.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 110—111.
- ↑ 1 2 Цветков В. В., Сологуб Т. В, Токин И. И. Биология дендритных клеток человека и их роль в инфекционной патологии // Российский медико-биологический вестник имени академика И. П. Павлова. — 2014. — Вып. 3. — С. 68–74. — ISSN 0204-3475. Архивировано 6 августа 2021 года.
- ↑ Недоспасов, Купраш, 2021, с. 78.
- ↑ Хаитов, 2019, с. 194.
- ↑ Недоспасов, Купраш, 2021, с. 79—80.
- ↑ Follicular Dendritic Cells and Germinal Centers (англ.) // International Review of Cytology. — 1996-01-01. — Vol. 166. — P. 139–179. — ISSN 0074-7696. — doi:10.1016/S0074-7696(08)62508-5. Архивировано 30 июля 2021 года.
- ↑ Недоспасов, Купраш, 2021, с. 78—79.
- ↑ Мяделец О. Д., Кичигина Т. Н., Мяделец В. О., Стефаненко Е. В., Аблецова Ю. П. Сравнительная характеристика клеток Лангерганса производных кожи у человека и белой крысы // Вестник Витебского государственного медицинского университета. — 2008. — Т. 7, вып. 1. — С. 12–23. — ISSN 1607-9906. Архивировано 8 августа 2021 года.
- ↑ Flohé S, Lang T, Moll H. Synthesis, stability, and subcellular distribution of major histocompatibility complex class II molecules in Langerhans cells infected with Leishmania major (англ.) // Infection and Immunity. — 1997. — August (vol. 65, no. 8). — P. 3444—3450. — ISSN 0019-9567. — doi:10.1128/iai.65.8.3444-3450.1997.
- ↑ Yun Tae Jin, Igarashi Suzu, Zhao Haoquan, Perez Oriana A., Pereira Marcus R., Zorn Emmanuel, Shen Yufeng, Goodrum Felicia, Rahman Adeeb, Sims Peter A., Farber Donna L., Reizis Boris. Human plasmacytoid dendritic cells mount a distinct antiviral response to virus-infected cells (англ.) // Science Immunology. — 2021. — 2 April (vol. 6, no. 58). — ISSN 2470-9468. — doi:10.1126/sciimmunol.abc7302.
- ↑ Raftery Martin J., Kraus Annette A., Ulrich Rainer, Krüger Detlev H., Schönrich Günther. Hantavirus Infection of Dendritic Cells (англ.) // Journal of Virology. — 2002. — November (vol. 76, no. 21). — P. 10724—10733. — ISSN 0022-538X. — doi:10.1128/JVI.76.21.10724-10733.2002.
- ↑ Montrasio F., Frigg R., Glatzel M., Klein M. A., Mackay F., Aguzzi A., Weissmann C. Impaired prion replication in spleens of mice lacking functional follicular dendritic cells. (англ.) // Science (New York, N.Y.). — 2000. — 19 May (vol. 288, no. 5469). — P. 1257—1259. — doi:10.1126/science.288.5469.1257. — PMID 10818004.
- ↑ 1 2 Baumgart D. C., Metzke D., Schmitz J., Scheffold A., Sturm A., Wiedenmann B., Dignass A. U. Patients with active inflammatory bowel disease lack immature peripheral blood plasmacytoid and myeloid dendritic cells. (англ.) // Gut. — 2005. — February (vol. 54, no. 2). — P. 228—236. — doi:10.1136/gut.2004.040360. — PMID 15647187.
- ↑ 1 2 Baumgart D. C., Thomas S., Przesdzing I., Metzke D., Bielecki C., Lehmann S. M., Lehnardt S., Dörffel Y., Sturm A., Scheffold A., Schmitz J., Radbruch A. Exaggerated inflammatory response of primary human myeloid dendritic cells to lipopolysaccharide in patients with inflammatory bowel disease. (англ.) // Clinical And Experimental Immunology. — 2009. — September (vol. 157, no. 3). — P. 423—436. — doi:10.1111/j.1365-2249.2009.03981.x. — PMID 19664152.
- ↑ 1 2 Baumgart D. C., Carding S. R. Inflammatory bowel disease: cause and immunobiology. (англ.) // Lancet (London, England). — 2007. — 12 May (vol. 369, no. 9573). — P. 1627—1640. — doi:10.1016/S0140-6736(07)60750-8. — PMID 17499605.
- ↑ van Nierop K., de Groot C. Human follicular dendritic cells: function, origin and development. (англ.) // Seminars In Immunology. — 2002. — August (vol. 14, no. 4). — P. 251—257. — doi:10.1016/s1044-5323(02)00057-x. — PMID 12163300.
- ↑ 1 2 Broz M. L., Binnewies M., Boldajipour B., Nelson A. E., Pollack J. L., Erle D. J., Barczak A., Rosenblum M. D., Daud A., Barber D. L., Amigorena S., Van't Veer L. J., Sperling A. I., Wolf D. M., Krummel M. F. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. (англ.) // Cancer Cell. — 2014. — 10 November (vol. 26, no. 5). — P. 638—652. — doi:10.1016/j.ccell.2014.09.007. — PMID 25446897.
- ↑ 1 2 Binnewies M., Mujal A. M., Pollack J. L., Combes A. J., Hardison E. A., Barry K. C., Tsui J., Ruhland M. K., Kersten K., Abushawish M. A., Spasic M., Giurintano J. P., Chan V., Daud A. I., Ha P., Ye C. J., Roberts E. W., Krummel M. F. Unleashing Type-2 Dendritic Cells to Drive Protective Antitumor CD4+ T Cell Immunity. (англ.) // Cell. — 2019. — 18 April (vol. 177, no. 3). — P. 556—571. — doi:10.1016/j.cell.2019.02.005. — PMID 30955881.
- ↑ Moynihan K. D., Opel C. F., Szeto G. L., Tzeng A., Zhu E. F., Engreitz J. M., Williams R. T., Rakhra K., Zhang M. H., Rothschilds A. M., Kumari S., Kelly R. L., Kwan B. H., Abraham W., Hu K., Mehta N. K., Kauke M. J., Suh H., Cochran J. R., Lauffenburger D. A., Wittrup K. D., Irvine D. J. Eradication of large established tumors in mice by combination immunotherapy that engages innate and adaptive immune responses. (англ.) // Nature Medicine. — 2016. — December (vol. 22, no. 12). — P. 1402—1410. — doi:10.1038/nm.4200. — PMID 27775706.
- ↑ 1 2 Garris C. S., Arlauckas S. P., Kohler R. H., Trefny M. P., Garren S., Piot C., Engblom C., Pfirschke C., Siwicki M., Gungabeesoon J., Freeman G. J., Warren S. E., Ong S., Browning E., Twitty C. G., Pierce R. H., Le M. H., Algazi A. P., Daud A. I., Pai S. I., Zippelius A., Weissleder R., Pittet M. J. Successful Anti-PD-1 Cancer Immunotherapy Requires T Cell-Dendritic Cell Crosstalk Involving the Cytokines IFN-γ and IL-12. (англ.) // Immunity. — 2018. — 18 December (vol. 49, no. 6). — P. 1148—1161. — doi:10.1016/j.immuni.2018.09.024. — PMID 30552023.
- ↑ Células Dendríticas que Atacan al Cáncer. Дата обращения: 28 декабря 2021. Архивировано из оригинала 10 мая 2009 года.
- ↑ Moynihan K. D., Opel C. F., Szeto G. L., Tzeng A., Zhu E. F., Engreitz J. M., Williams R. T., Rakhra K., Zhang M. H., Rothschilds A. M., Kumari S., Kelly R. L., Kwan B. H., Abraham W., Hu K., Mehta N. K., Kauke M. J., Suh H., Cochran J. R., Lauffenburger D. A., Wittrup K. D., Irvine D. J. Eradication of large established tumors in mice by combination immunotherapy that engages innate and adaptive immune responses. (англ.) // Nature Medicine. — 2016. — December (vol. 22, no. 12). — P. 1402—1410. — doi:10.1038/nm.4200. — PMID 27775706.
- ↑ Martin E., O'Sullivan B., Low P., Thomas R. Antigen-specific suppression of a primed immune response by dendritic cells mediated by regulatory T cells secreting interleukin-10. (англ.) // Immunity. — 2003. — January (vol. 18, no. 1). — P. 155—167. — doi:10.1016/s1074-7613(02)00503-4. — PMID 12530984.
- ↑ McDowell, N. Cell re-education reverses autoimmune attack. Дата обращения: 28 декабря 2021. Архивировано 14 мая 2015 года.
- ↑ Kim M. J., Nasr A., Kabir B., de Nanassy J., Tang K., Menzies-Toman D., Johnston D., El Demellawy D. Pediatric Blastic Plasmacytoid Dendritic Cell Neoplasm: A Systematic Literature Review. (англ.) // Journal Of Pediatric Hematology/oncology. — 2017. — October (vol. 39, no. 7). — P. 528—537. — doi:10.1097/MPH.0000000000000964. — PMID 28906324.
- ↑ Drakes Maureen, Blanchard Thomas, Czinn Steven. Bacterial Probiotic Modulation of Dendritic Cells (англ.) // Infection and Immunity. — 2004. — June (vol. 72, no. 6). — P. 3299—3309. — ISSN 0019-9567. — doi:10.1128/IAI.72.6.3299-3309.2004.
- ↑ Rosa Fábio F., Pires Cristiana F., Kurochkin Ilia, Ferreira Alexandra G., Gomes Andreia M., Palma Luís G., Shaiv Kritika, Solanas Laura, Azenha Cláudia, Papatsenko Dmitri, Schulz Oliver, Reis e Sousa Caetano, Pereira Carlos-Filipe. Direct reprogramming of fibroblasts into antigen-presenting dendritic cells (англ.) // Science Immunology. — 2018. — 14 December (vol. 3, no. 30). — ISSN 2470-9468. — doi:10.1126/sciimmunol.aau4292.
- ↑ Cavrois M., Neidleman J., Kreisberg J. F., Greene W. C. In vitro derived dendritic cells trans-infect CD4 T cells primarily with surface-bound HIV-1 virions. (англ.) // PLoS Pathogens. — 2007. — January (vol. 3, no. 1). — P. e4—4. — doi:10.1371/journal.ppat.0030004. — PMID 17238285.
- ↑ Yang Z. Y., Huang Y., Ganesh L., Leung K., Kong W. P., Schwartz O., Subbarao K., Nabel G. J. pH-dependent entry of severe acute respiratory syndrome coronavirus is mediated by the spike glycoprotein and enhanced by dendritic cell transfer through DC-SIGN. (англ.) // Journal Of Virology. — 2004. — June (vol. 78, no. 11). — P. 5642—5650. — doi:10.1128/JVI.78.11.5642-5650.2004. — PMID 15140961.
- ↑ Langerhans, P. Uber die nerven der menschlichen haut. — 1868. — Т. 1868, № 44. — С. 325—337.
- ↑ Burnet F. M. A modification of Jerne's theory of antibody production using the concept of clonal selection. (англ.) // CA: A Cancer Journal For Clinicians. — 1976. — March (vol. 26, no. 2). — P. 119—121. — doi:10.3322/canjclin.26.2.119. — PMID 816431.
- ↑ Katsnelson A. Kicking off adaptive immunity: the discovery of dendritic cells. (англ.) // The Journal Of Experimental Medicine. — 2006. — 10 July (vol. 203, no. 7). — P. 1622—1622. — doi:10.1084/jem.2037fta. — PMID 16886239.
- ↑ Mishell R. I., Dutton R. W. Immunization of normal mouse spleen cell suspensions in vitro. (англ.) // Science (New York, N.Y.). — 1966. — 26 August (vol. 153, no. 3739). — P. 1004—1006. — doi:10.1126/science.153.3739.1004. — PMID 5917547.
- ↑ Ralph M. Steinman - Biographical (англ.). Nobel Media. Дата обращения: 3 октября 2011. Архивировано 30 августа 2012 года.
Литература[править | править код]
- Бурместер Г.-Р., Пецутто А. Наглядная иммунология. — М.: БИНОМ. Лаборатория знаний, 2014. — 320 с. — ISBN 978-5-9963-1731-8.
- Иммунология по Ярилину / Недоспасов С. А., Купраш Д. В.. — М.: ГЭОТАР-Медиа, 2021. — 808 с. — ISBN 978-5-9704-4552-2. — doi:10.33029/9704-4552-5-IA-2021-1-808.
- Хаитов Р. М. Иммунология: структура и функции иммунной системы. — М.: ГЭОТАР-Медиа, 2019. — 328 с. — ISBN 978-5-9704-4962-2.
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |


 French
French Deutsch
Deutsch