Абсолютная конфигурация — Википедия

Абсолютная конфигурация — это пространственное расположение атомов в хиральной молекуле или группе и его стереохимическое описание[1]. Абсолютная конфигурация обычно касается органических молекул, где атом углерода связан с четырьмя различными заместителями. В таком случае молекула может существовать в виде двух энантиомеров. Абсолютная конфигурация описывается при помощи набора правил, устанавливающих взаимное расположение заместителей у хирального центра. Наиболее распространенный метод обозначения абсолютной конфигурации основан на использовании дескрипторов R или S, которые присваиваются в соответствии с правилами Кана — Ингольда — Прелога . Обозначения R и S происходят от латинских слов rectus и sinister, которые обозначают "правый" и "левый" соответственно[источник не указан 416 дней].
Хиральные молекулы могут различаться по своим химическим свойствам, но при этом быть идентичными по физическим, что может затруднить различение энантиомеров. Абсолютную конфигурацию для хиральной молекулы (в чистом виде) чаще всего определяют с помощью рентгеноструктурного анализа, хотя и с некоторыми серьёзными ограничениями. Все энантиомерно чистые хиральные молекулы кристаллизуются в одной из 65 кристаллографических групп (хиральных пространственных групп). Альтернативные методы включают оптическую вращательную дисперсию, колебательный круговой дихроизм, ультрафиолетово-видимую спектроскопию, использование реагентов хирального сдвига в ПМР и визуализации кулоновского взрыва[2][3].
История[править | править код]
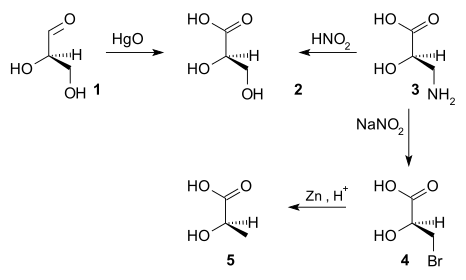
До 1951 года не удавалось получить абсолютную конфигурацию хиральных соединений.[4] Но однажды было решено, что (+)- глицеральдегид является d-энантиомером. Конфигурация других хиральных соединений была затем связана с конфигурацией (+)-глицеральдегида с помощью последовательностей химических реакций. Например, окисление (+)-глицеринового альдегида (1) оксидом ртути дает (-)-глицериновую кислоту (2), реакция, которая не изменяет стереоцентр. Таким образом, абсолютная конфигурация (-)-глицериновой кислоты должна быть такой же, как у (+)-глицеральдегида. Азотистая кислота окисляет (+)-изосерин (3) дает (-)-глицериновую кислоту, устанавливая, что (+)-изосерин также имеет такую же абсолютную конфигурацию. (+)-Изосерин может быть преобразован двухстадийным процессом бромирования с последующим восстановлением цинком с образованием (-)-молочной кислоты, поэтому (-)-молочная кислота имеет такую же абсолютную конфигурацию. Если бы реакция давала энантиомер известной конфигурации, на что указывает противоположный знак оптического вращения, это указывало бы на то, что абсолютная конфигурация обращена.
В 1951 году Йоханнес Мартин Байвойет впервые использовал в рентгеноструктурном анализе эффект аномальной дисперсии, который сейчас называют резонансным рассеянием, для определения абсолютной конфигурации. [5] Исследуемым соединением был (+)-тартрат рубидия-натрия, и из его конфигурации (R, R) было сделано заключение, что первоначальное предположение для (+)-глицеральдегида было правильным.
Несмотря на огромное и уникальное влияние на доступ к молекулярным структурам, рентгеноструктурный анализ вызывает некоторые проблемы. Процесс кристаллизации молекул-мишеней требует много времени и ресурсов и не может быть применен к таким системам, как многие биомолекулы (некоторые белки являются исключением) и катализаторы in situ. Другое важное ограничение состоит в том, что молекула должна содержать «тяжелые» атомы (например, брома) для усиления рассеяния.[6] Кроме того, существенные искажения сигнала возникают из-за влияния ближайших соседей в любой кристаллической структуре и из-за растворителей, используемых в процессе кристаллизации.
Совсем недавно были введены новые методы прямого исследования абсолютной конфигурации одиночных молекул в газовой фазе, обычно в сочетании с квантово-механическими теоретическими расчетами ab initio, что позволило преодолеть некоторые ограничения рентгеноструктурного анализа. [7]
Условные обозначения[править | править код]
По абсолютной конфигурации: R- и S-[править | править код]

Система R/S является важной номенклатурной системой для обозначения энантиомеров. Этот подход обозначает каждый хиральный центр как R или S в соответствии с системой, по которой каждому его заместителю назначается приоритет в соответствии с правилами Кана-Ингольда-Прелога на основе атомного номера. Когда центр ориентирован так, что заместитель с самым низким приоритетом из четырех направлен в сторону от наблюдателя, наблюдатель увидит один из двух возможных вариантов: если приоритет остальных трех заместителей уменьшается по часовой стрелке, он обозначается R (Rectus); если он уменьшается против часовой стрелки, это S (Sinister).[8]
(R) или (S) пишется курсивом и в скобках. Если имеется несколько хиральных атомов углерода, например (1R, 4S), номер указывает положение атома углерода, предшествующего каждой конфигурации.[9]
Система R/S также не имеет фиксированной связи с системой d/l . Например, боковая цепь серина содержит гидроксильную группу -ОН. Если бы вместо него была тиоловая группа -SH, маркировка d/l, по ее определению, не изменилась бы. Но эта замена обращает обозначение молекулы R/S, потому что приоритет для CH2OH ниже, чем для CO2H, но приоритет для CH2SH выше, чем для CO2H. По этой причине система d/l по-прежнему широко используется в некоторых областях биохимии, таких как химия аминокислот и углеводов, поскольку удобно иметь одно и то же обозначение хиральных центров для часто встречающихся структур данного типа в высших организмах. В системе d/l почти все встречающиеся в природе аминокислоты имеют конфигурацию l, в то время как встречающиеся в природе углеводы почти все имеют конфигурацию d. Все протеиногенные аминокислоты имеют конфигурацию S, за исключением цистеина, который имеют конфигурацию R.
По оптическому вращению: (+)- и (-)- или d- и l-[править | править код]
Энантиомер может быть назван по направлению, в котором он вращает плоскость поляризованного света. Вращение света по часовой стрелке к зрителю обозначено (+) энантиомером. Его зеркальное отражение - (-). (+) и (-) изомеры были также названы d- и l- (для правовращающих и левовращающих соответственно); но обозначение с помощью d- и l- легко спутать с обозначением d и l, поэтому ИЮПАК не одобряет его.[10]
По относительной конфигурации: d- и l-[править | править код]
Оптический изомер может быть назван по пространственной конфигурации его атомов. Система d/l (названная в честь латинского dexter и laevus, правый и левый соответственно), которую не следует путать с системой d- и l-, см. выше, делает это, связывая молекулу с глицеральдегидом. Глицеральдегид хирален, и два его изомера обозначены буквами d и l (в публикациях обычно обозначаются маленькими заглавными буквами). Возможность химических превращений глицеральдегида, без влияния на его конфигурацию, и его историческое использование для определения конфигурации других молекул (возможно, в сочетании с его удобством в качестве одной из самых маленьких используемых хиральных молекул) привело к его использованию в номенклатуре. В этой системе соединения называются по аналогии с глицеральдегидом, что, в общем, дает однозначные обозначения, но лучше всего работает в небольших биомолекулах, подобных глицеральдегиду. Одним из примеров является хиральная аминокислота аланин, которая имеет два оптических изомера, которые обозначены в соответствии с тем, из какого изомера глицеральдегида они могут быть получены. С другой стороны, глицин, аминокислота, образованная от глицеринового альдегида, не обладает оптической активностью, так как она не хиральна (ахиральна).
Обозначения d/l не связаны с (+)/(-) — они не указывают, какой энантиомер является правовращающим, а какой левовращающим. Скорее, это указывает на стереохимию соединения по сравнению со стереохимией правовращающего или левовращающего энантиомера глицеральдегида. Правовращающий изомер глицеринового альдегида на самом деле является d-изомером. Девять из девятнадцати l-аминокислот, обычно встречающихся в белках, являются правовращающими (при длине волны 589 нм), а d-фруктозу также называют левулозой, потому что она обладает левовращающим действием.
Смотрите также[править | править код]
Рекомендации[править | править код]
- ↑ IUPAC Gold Book internet edition: «absolute configuration».
- ↑ Snapshots differentiate molecules from their mirror image (англ.). www.mpg.de. Дата обращения: 16 февраля 2021. Архивировано 24 января 2023 года.
- ↑ Pitzer, Martin (6 September 2013). "Direct Determination of Absolute Molecular Stereochemistry in Gas Phase by Coulomb Explosion Imaging". Science (англ.). 341 (6150): 1096—1100. Bibcode:2013Sci...341.1096P. doi:10.1126/science.1240362. ISSN 0036-8075. PMID 24009390.
- ↑ Organic Chemistry (4th Edition) Paula Y. Bruice
- ↑ Bijvoet, J. M. (August 1951). "Determination of the Absolute Configuration of Optically Active Compounds by Means of X-Rays". Nature (англ.). 168 (4268): 271—272. Bibcode:1951Natur.168..271B. doi:10.1038/168271a0. ISSN 0028-0836.
- ↑ Haesler, J. (March 2007). "Absolute configuration of chirally deuterated neopentane" (PDF). Nature (англ.). 446 (7135): 526—529. Bibcode:2007Natur.446..526H. doi:10.1038/nature05653. ISSN 0028-0836. PMID 17392783. Архивировано (PDF) 15 августа 2017. Дата обращения: 8 марта 2023.
- ↑ Fehre, K. (2022). "A new route for enantio-sensitive structure determination by photoelectron scattering on molecules in the gas phase". Physical Chemistry Chemical Physics. 24 (43): 26458—26465. arXiv:2101.03375. Bibcode:2022PCCP...2426458F. doi:10.1039/D2CP03090J. PMID 36305893.
- ↑ Andrew Streitwieser & Clayton H. Heathcock. Introduction to Organic Chemistry. — 3rd. — Macmillan Publishing Company, 1985.
- ↑ Klein, David R. Organic Chemistry : []. — 2nd. — Wiley, 2013-12-31. — P. 208. — ISBN 978-1118454312.
- ↑ Moss, G. P. (1 January 1996). "Basic terminology of stereochemistry (IUPAC Recommendations 1996)". Pure and Applied Chemistry. 68 (12): 2193—2222. doi:10.1351/pac199668122193. ISSN 1365-3075. Архивировано 14 октября 2017. Дата обращения: 16 февраля 2021.


 French
French Deutsch
Deutsch