Vitamina D – Wikipédia, a enciclopédia livre
| Vitamina D Alerta sobre risco à saúde | |
|---|---|
 | 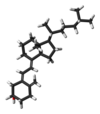 |
| Nome IUPAC | (3β,5Z,7E)-9,10-secocholesta- 5,7,10(19)-trien-3-ol |
| Outros nomes | vitamina , 7-dehidrocolesterol ativado. |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/C27H44O/c1-19(2)8-6-9-21(4)25-15-16-26-22 (10-7-17-27(25,26)5)12-13-23-18-24(28)14-11 -20(23)3/h12-13,19,21,24-26,28H,3,6-11,14-18 H2,1-2,4-5H3/b22-12+,23-13-/t21-,24+,25-,26?, 27-/m1/s1 |
| Propriedades | |
| Fórmula molecular | |
| Massa molar | 384.64 g/mol |
| Aparência | Branco, cristais em forma de agulha |
| Ponto de fusão | 83–86 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Vitamina D faz parte de um grupo de secosteroides solúveis em gordura responsáveis por aumentar a absorção intestinal de cálcio, magnésio e fosfato e por muitos outros efeitos biológicos.[1][2] Em humanos, os compostos mais importantes neste grupo são a vitamina D3 (também conhecida como colecalciferol) e a vitamina D2 (ergocalciferol).[1][2][3]
A principal fonte natural da vitamina é a síntese de colecalciferol nas camadas inferiores da epiderme da pele por meio de uma reação química dependente da exposição ao sol (especificamente radiação UVB).[4][5] O colecalciferol e o ergocalciferol podem ser ingeridos na dieta e por meio de suplementos.[2][6] Apenas alguns alimentos, como a carne de peixe gordo, contêm naturalmente quantidades significativas de vitamina D.[1][7] Nos EUA e em outros países, o leite de vaca e os substitutos do leite derivados de plantas são fortificados com vitamina D, assim como muitos cereais matinais. Os cogumelos expostos à luz ultravioleta contribuem com quantidades úteis de vitamina D.[1] As recomendações dietéticas normalmente assumem que toda a vitamina D de uma pessoa é administrada por via oral, pois a exposição ao sol na população é variável e as recomendações sobre a quantidade de exposição ao sol que é segura são incertas em visão do risco de câncer de pele.[1]
A vitamina D da dieta ou da síntese da pele é biologicamente inativa. No entanto, é ativada por duas etapas de hidroxilação de enzimas proteicas, a primeira no fígado e a segunda nos rins.[3] Como a vitamina D pode ser sintetizada em quantidades adequadas pela maioria dos mamíferos se expostos à uma quantidade suficiente de luz solar, ela não é essencial, portanto, tecnicamente, não é uma vitamina.[2] Em vez disso, pode ser considerado um hormônio, com a ativação do pró-hormônio da vitamina D resultando na forma ativa, calcitriol, que então produz efeitos por meio de um receptor nuclear em vários locais.[2]
O colecalciferol é convertido no fígado em calcifediol (25-hidroxicolecalciferol); ergocalciferol é convertido em 25-hidroxiergocalciferol. Esses dois metabólitos da vitamina D (chamados de 25-hidroxivitamina D ou 25 (OH) D) são medidos no soro para determinar o status da vitamina D de uma pessoa.[8][9] O calcifediol é posteriormente hidroxilado pelos rins e algumas células do sistema imunológico para formar calcitriol (também conhecido como 1,25-diidroxicolecalciferol), a forma biologicamente ativa da vitamina D.[10][11] O calcitriol circula como um hormônio no sangue, tendo um papel importante na regulação a concentração de cálcio e fosfato, promovendo o crescimento saudável e a remodelação óssea. O calcitriol também tem outros efeitos, incluindo alguns no crescimento celular, funções neuromusculares e imunológicas e na redução da inflamação.[1]
A vitamina D tem um papel significativo na homeostase e no metabolismo do cálcio. Sua descoberta deveu-se ao esforço para encontrar a substância alimentar que falta em crianças com raquitismo (a forma infantil da osteomalácia).[12] Os suplementos de vitamina D são administrados para tratar ou prevenir a osteomalácia e o raquitismo. As evidências de outros efeitos sobre a saúde da suplementação de vitamina D na população em geral são inconsistentes.[1] O efeito da suplementação de vitamina D sobre a mortalidade não é claro, com uma meta-análise encontrando uma pequena redução na mortalidade em idosos e outra concluindo que não existe uma justificativa clara para recomendar a suplementação com esse propósito.[13][14]
Formas[editar | editar código-fonte]
| Nome | Composição química | Estrutura |
|---|---|---|
| Vitamina D1 | Mistura de compostos moleculares de ergocalciferol com lumisterol, 1: 1 | |
| Vitamina D2 | ergocalciferol (feito de ergosterol) |  |
| Vitamina D3 | colecalciferol (feito de 7-desidrocolesterol na pele). |  |
| Vitamina D4 | 22-dihidroergocalciferol |  |
| Vitamina D5 | sitocalciferol (feito a partir de 7-desidrossitosterol) |  |
Existem várias formas (vitaminas) de vitamina D. As duas formas principais são a vitamina D2 ou ergocalciferol e a vitamina D3ou colecalciferol. A vitamina D sem um subscrito refere-se a D2 ou D3, ou a ambos, e é conhecida coletivamente como calciferol.[15]
A vitamina D2 foi caracterizada quimicamente em 1931. Em 1935, a estrutura química da vitamina D3 foi definida e resultou da irradiação ultravioleta do 7-desidrocolesterol. Uma nomenclatura química para as formas de vitamina D foi recomendada em 1981, mas nomes alternativos permanecem de uso comum.[3][16]
Quimicamente, as várias formas de vitamina D são secosteroides, isto é, esteroides nos quais uma das ligações dos anéis de esteroides é quebrada.[17] A diferença estrutural entre a vitamina D2 e a vitamina D3 está na cadeia lateral, que contém uma ligação dupla, entre os carbonos 22 e 23, e um grupo metil no carbono 24 na vitamina D2.[3]
Muitos análogos da vitamina D foram sintetizados.[3]
Biologia[editar | editar código-fonte]
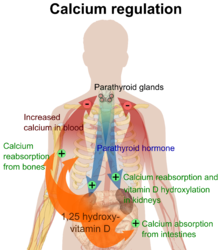
O metabólito ativo da vitamina D, calcitriol, medeia seus efeitos biológicos ligando-se ao receptor da vitamina D (VDR), que está localizado principalmente nos núcleos das células-alvo.[17] A ligação do calcitriol ao VDR permite que o VDR atue como um fator de transcrição que modula a expressão gênica de proteínas de transporte (como TRPV6 e calbindina), que estão envolvidas na absorção de cálcio no intestino.[19] O receptor da vitamina D pertence à superfamília de receptores nucleares de receptores de esteroides/hormônios tireoidianos, e os VDRs são expressos por células na maioria dos órgãos, incluindo cérebro, coração, pele, gônadas, próstata e mama.
A ativação do VDR no intestino, osso, rim e células da glândula paratireóide leva à manutenção dos níveis de cálcio e fósforo no sangue (com a ajuda do hormônio da paratireóide e calcitonina) e à manutenção da densidade óssea.[20]
Um dos papéis mais importantes da vitamina D é manter o equilíbrio do cálcio nos ossos, promovendo a absorção de cálcio nos intestinos, promovendo a reabsorção óssea pelo aumento do número de osteoclastos, mantendo os níveis de cálcio e fosfato para a formação óssea e permitindo o funcionamento adequado do hormônio da paratireóide para manter o níveis adequados de cálcio no sérum. A deficiência de vitamina D pode resultar em menor densidade óssea e um risco aumentado de densidade óssea reduzida (osteoporose) ou fratura óssea, porque a falta de vitamina D altera o metabolismo mineral no corpo.[21] Assim, a vitamina D também é crítica para a remodelação óssea por meio de seu papel como um potente estimulador da reabsorção óssea.[21]
O VDR regula a proliferação e diferenciação celular. A vitamina D também afeta o sistema imunológico, e os VDRs são expressos em vários leucócitos, incluindo monócitos e células T e B ativadas.[22] In vitro, a vitamina D aumenta a expressão do gene da tirosina hidroxilase nas células medulares adrenais e afeta a síntese de fatores neurotróficos, óxido nítrico sintase e glutationa.[23]
A expressão do receptor de vitamina D diminui com a idade e as descobertas sugerem que a vitamina D está diretamente relacionada à força, massa e função musculares, todos sendo fatores importantes para as funções normais do organismo e para o desempenho de um atleta.[24]
Deficiência[editar | editar código-fonte]
Estima-se que um bilhão de pessoas em todo o mundo sejam insuficientes ou deficientes em vitamina D.[24] A deficiência de vitamina D é generalizada na população europeia.[25] Uma dieta com vitamina D insuficiente em conjunto com exposição inadequada ao sol causa a deficiência de vitamina D. A deficiência grave de vitamina D em crianças causa raquitismo, um amolecimento e enfraquecimento dos ossos, uma doença rara nos países desenvolvidos.[26]
A deficiência de vitamina D é encontrada em todo o mundo em idosos e permanece comum em crianças e adultos.[27][28][29] A deficiência resulta em mineralização óssea prejudicada e dano ósseo que leva a doenças que amolecem os ossos, incluindo raquitismo em crianças e osteomalácia em adultos.[30] O calcifediol baixo no sangue (25-hidroxivitamina D) pode resultar da baixa exposição ao sol.[31] A deficiência de vitamina D pode fazer com que a absorção intestinal do cálcio da dieta caia para 15%.[20] Quando não possui a deficiência, o indivíduo costuma absorver entre 60 e 80%.[20]
Saúde óssea[editar | editar código-fonte]
Raquitismo[editar | editar código-fonte]
O raquitismo, uma doença infantil, é caracterizada pelo crescimento prejudicado e ossos fracos, deformados e moles que se dobram e se curvam com o peso quando as crianças começam a andar. O raquitismo geralmente aparece entre os 3 e 18 meses de idade.[32] Os casos continuam a ser relatados na América do Norte e em outros países ocidentais e são vistos principalmente em bebês amamentados e naqueles com pele mais escura.[32] Essa condição é caracterizada por pernas arqueadas,[30] que podem ser causadas por deficiência de cálcio ou fósforo, bem como por falta de vitamina D; hoje, é amplamente encontrada em países menos desenvolvidos na África, Ásia ou Oriente Médio e naqueles com doenças genéticas, como o raquitismo por deficiência de pseudovitamina D.[33][34]
A deficiência materna de vitamina D pode causar doença óssea evidente antes do nascimento e comprometimento da qualidade óssea após o nascimento.[35][36] O raquitismo nutricional existe em países com intensa luz solar o ano todo, como a Nigéria, e pode ocorrer sem deficiência de vitamina D.[37][38]
Embora o raquitismo e a osteomalácia sejam agora raros no Reino Unido, surtos ocorreram em algumas comunidades de imigrantes nas quais os portadores de osteomalácia incluíam mulheres com exposição ao ar livre à luz do dia aparentemente adequada e vestindo roupas ocidentais.[39] Ter a pele mais escura e reduzir a exposição ao sol não produzia raquitismo, a menos que a dieta se desviasse de um padrão onívoro ocidental, que é caracterizado por alto consumo de carne, peixe e ovos.[40][41][42] Os fatores de risco dietéticos para o raquitismo incluem a abstinência de alimentos de origem animal.[39][43]
A deficiência de vitamina D continua sendo a principal causa de raquitismo entre bebês na maioria dos países porque o leite materno tem baixo teor de vitamina D e os costumes sociais e as condições climáticas podem prevenir a exposição solar adequada. Em países ensolarados como Nigéria, África do Sul e Bangladesh, onde o raquitismo ocorre entre bebês e crianças mais velhas, ele fora atribuído à baixa ingestão de cálcio na dieta, característica de dietas à base de cereais com acesso limitado a produtos lácteos.[42]
O raquitismo era anteriormente um grande problema de saúde pública entre a população dos Estados Unidos; em Denver, onde os raios ultravioleta são cerca de 20% mais fortes do que ao nível do mar na mesma latitude,[44] quase dois terços de 500 crianças tinham raquitismo moderado no final da década de 1920.[45] Um aumento na proporção de proteína animal[43][46] na dieta americana do século 20, juntamente com o aumento do consumo de leite fortificado com quantidades relativamente pequenas de vitamina D,[47][48] coincidiu com um declínio dramático no número de casos de raquitismo.[20] Além disso, nos Estados Unidos e no Canadá, o leite fortificado com vitamina D, os suplementos vitamínicos ajudaram a erradicar a maioria dos casos de raquitismo em crianças com problemas de má absorção de gordura.[30]
Osteomalacia e osteoporose[editar | editar código-fonte]
A osteomalácia é uma doença em adultos que resulta da deficiência de vitamina D. As características desta doença são o amolecimento dos ossos, levando à flexão da coluna vertebral, arqueamento das pernas, fraqueza muscular, fragilidade óssea e aumento do risco de fraturas.[49] A osteomalácia reduz a absorção de cálcio e aumenta a perda de cálcio do osso, o que aumenta o risco de fraturas ósseas. A osteomalácia geralmente está presente quando os níveis de 25-hidroxivitamina D são menores que cerca de 10 ng/mL.[50] Embora se acredite que os efeitos da osteomalácia contribuam para a dor musculoesquelética crônica, não há evidências persuasivas de níveis mais baixos de vitamina D em quem sofre de dor crônica ou de que a suplementação alivia a dor musculoesquelética crônica inespecífica.[51][52]
A osteoporose é uma condição de densidade mineral óssea reduzida com aumento da fragilidade óssea e risco de fraturas ósseas. A osteoporose pode ser um efeito de longo prazo da insuficiência de cálcio e/ou vitamina D, pelo menos em parte. Isso pode resultar da ingestão inadequada de cálcio, com vitamina D insuficiente, contribuindo para a redução da absorção de cálcio.[1]
Pigmentação da pele[editar | editar código-fonte]
Pessoas de pele escura que vivem em climas temperados demonstraram ter baixos níveis de vitamina D, mas o significado disso não é certo.[53][54][55] Pessoas de pele escura são menos eficientes na produção de vitamina D porque a melanina na pele impede a síntese de vitamina D.[56] A deficiência de vitamina D é comum em hispânicos e afro-americanos nos Estados Unidos, com níveis caindo significativamente no inverno.[57] Isso se deve aos níveis de melanina na pele, pois atua como um protetor natural da exposição ao sol.[57]
Suplementação[editar | editar código-fonte]
A suplementação com vitamina D é um método confiável para prevenir ou tratar o raquitismo. Os efeitos da suplementação de vitamina D na saúde não esquelética são incertos.[58][59] Uma revisão de 2013 não encontrou nenhum efeito da suplementação nas taxas de doenças não esqueléticas, exceto uma redução provisória na mortalidade em idosos.[60] Os suplementos de vitamina D não alteram os resultados de enfarte do miocárdio, acidente vascular cerebral ou doença cerebrovascular, cancro, fraturas ósseas ou osteoartrite do joelho.[14][61] Os baixos níveis de vitamina D podem resultar de doenças, em vez de causar doenças.[60]
Um relatório do Instituto de Medicina dos Estados Unidos (IOM) afirma: "Os resultados relacionados ao câncer, doenças cardiovasculares, hipertensão, diabetes e síndrome metabólica, desempenho físico, funcionamento imunológico, distúrbios autoimunes, infecções, funcionamento neuropsicológico e pré-eclâmpsia não poderiam ser associados de forma confiável com a ingestão de cálcio ou vitamina D e frequentemente eram conflitantes. "[62] Alguns pesquisadores afirmam que o IOM foi muito definitivo em suas recomendações e cometeu um erro matemático ao calcular o nível de vitamina D no sangue associado à saúde óssea.[63] Os membros do painel do IOM afirmam que usaram um "procedimento padrão para recomendações dietéticas" e que o relatório se baseia solidamente nos dados. A pesquisa sobre suplementos de vitamina D, incluindo ensaios clínicos em grande escala, continua.[63]
Mortalidade, todas as causas[editar | editar código-fonte]
Foi descoberto que a suplementação de vitamina D3 leva a um risco reduzido de morte em idosos, mas o efeito não foi considerado pronunciado, ou certo o suficiente, para tornar a ingestão de suplementos recomendável.[13][14][60] Outras formas (vitamina D2, alfacalcidol e calcitriol) não parecem ter nenhum efeito benéfico em relação ao risco de morte.[13] Os níveis sanguíneos elevados parecem estar associados a um menor risco de morte, mas não está claro se a suplementação pode resultar neste benefício.[64] Tanto o excesso quanto a deficiência de vitamina D parecem causar funcionamento anormal e envelhecimento prematuro.[65][66][67] A relação entre as concentrações séricas de calcifediol e todas as causas de mortalidade é "em forma de U": a mortalidade é elevada em níveis altos e baixos de calcifediol, em relação a níveis moderados.[62] Os danos da vitamina D parecem ocorrer em um nível mais baixo de vitamina D na população negra do que na população branca.[62]
Saúde óssea[editar | editar código-fonte]
Em geral, nenhuma boa evidência suporta a crença comum de que os suplementos de vitamina D podem ajudar a prevenir a osteoporose.[14] Seu uso geral para a prevenção desta doença em pessoas sem deficiência de vitamina D, portanto, provavelmente não é necessário.[68] Para pessoas mais velhas com osteoporose, tomar vitamina D com cálcio pode ajudar a prevenir fraturas de quadril, mas também aumenta ligeiramente o risco de problemas estomacais e renais.[69] Um estudo descobriu que a suplementação com 800 UI ou mais por dia, em pessoas com mais de 65 anos foi "algo favorável na prevenção de fratura de quadril e fratura não vertebral".[70] O efeito é pequeno ou nenhum para pessoas que vivem de forma independente.[71][72] Os baixos níveis séricos de vitamina D foram associados a quedas e à baixa densidade mineral óssea.[73] Tomar vitamina D extra, no entanto, não parece alterar o risco.[74]
Atletas com deficiência de vitamina D correm um risco maior de fraturas por estresse e/ou grandes rupturas, principalmente aqueles que praticam esportes de contato. O maior benefício com a suplementação é observado em atletas deficientes (níveis séricos de 25 (OH) D <30 ng/mL) ou gravemente deficientes (níveis séricos de 25 (OH) D <25 ng/mL). Diminuições incrementais nos riscos são observadas com aumento das concentrações séricas de 25 (OH) D chegando a 50 ng/mL, sem benefícios adicionais observados em níveis além deste ponto.[75]
Por ter encontrado evidências crescentes de benefícios para a saúde óssea, embora não tenha encontrado boas evidências de outros benefícios, a Food and Drug Administration (FDA) dos EUA exigiu que os fabricantes declarassem a quantidade de vitamina D nos rótulos de informações nutricionais, como "nutrientes de importância para a saúde pública ", desde maio de 2016. Por uma proposta de prorrogação do prazo, alguns fabricantes tiveram até o dia 1 de julho de 2021 para cumprir.[76]
Câncer[editar | editar código-fonte]
Os suplementos de vitamina D têm sido amplamente comercializados por suas alegadas propriedades anticâncer.[77] Associações foram mostradas em estudos observacionais entre baixos níveis de vitamina D e o risco de desenvolvimento de certos tipos de câncer.[78] Não está claro, entretanto, se a ingestão de vitamina D adicional na dieta ou como suplementos afeta o risco de câncer. Avaliações têm descrito a evidência como sendo "inconsistente, inconclusiva quanto à causalidade e insuficiente para informar as necessidades nutricionais"[62] e "não suficientemente robusta para tirar conclusões".[71] Uma revisão de 2014 descobriu que os suplementos não tiveram efeito significativo no risco de câncer.[14]
Outra revisão de 2014 concluiu que a vitamina D3 pode diminuir o risco de morte por câncer (uma morte a menos em 150 pessoas tratadas ao longo de 5 anos), mas foram observadas preocupações com a qualidade dos dados.[13] Havia evidências insuficientes para recomendar suplementos de vitamina D para todas as pessoas com câncer, embora algumas evidências sugerissem que o baixo teor de vitamina D pode estar associado a um pior resultado para alguns tipos de câncer, e que níveis mais elevados de 25-hidroxivitamina D no momento do diagnóstico estavam associados a melhores resultados.[79][80] Uma revisão sistemática e meta-análise de 2020 em pessoas com câncer colorretal encontrou evidências de um benefício clinicamente significativo da suplementação de vitamina D nos resultados, incluindo a sobrevida, embora a análise tenha limitações.[81]
Sistema cardiovascular[editar | editar código-fonte]
Tomar suplementos de vitamina D não reduz significativamente o risco de acidente vascular cerebral, doença cerebrovascular, infarto do miocárdio ou doença isquêmica do coração.[14][82] A suplementação pode não ter efeito sobre a pressão arterial.[83]
Sistema imune[editar | editar código-fonte]
Doenças infecciosas[editar | editar código-fonte]
Em geral, a vitamina D atua ativando o sistema imunológico inato e amortecendo o sistema imunológico adaptativo com efeitos antibacterianos, antivirais e antiinflamatórios.[84][85] A deficiência da vitamina D tem sido associada ao aumento do risco ou gravidade de infecções virais, incluindo HIV[86][87] e COVID-19.[88] Os baixos níveis de vitamina D parecem ser um fator de risco para tuberculose e,[89] historicamente, era usada como tratamento.[90]
A suplementação de vitamina D em baixas doses (400 a 1000 UI/dia) pode diminuir ligeiramente o risco geral de infecções agudas do trato respiratório.[91] Os benefícios foram encontrados em crianças pequenas e adolescentes (idades entre 1 e 16 anos) e não foram confirmados com doses mais altas (> 1000 UI por dia ou mais).[91] A suplementação de vitamina D reduz substancialmente a taxa de exacerbações moderadas ou graves da DPOC em pessoas com níveis basais de 25 (OH) D abaixo de 25 nmol/L, mas não naquelas com deficiência menos grave.[92]
Asma[editar | editar código-fonte]
Embora os dados provisórios vinculem os baixos níveis de vitamina D à asma, as evidências que sustentam um efeito benéfico da suplementação nos asmáticos são inconclusivas.[93] Uma revisão descobriu que a suplementação de vitamina D pode reduzir a necessidade de esteroides usados para inibir a frequência de episódios em pessoas com asma leve a moderada, e que a suplementação não teve efeito sobre os sintomas da asma no dia-a-dia.[94] Na prática geral, a suplementação com vitamina D não é recomendada para o tratamento ou prevenção da asma.[95]
Doença inflamatória intestinal[editar | editar código-fonte]
Os baixos níveis de vitamina D estão associados a duas formas principais de doença inflamatória intestinal humana (DII): doença de Crohn e colite ulcerativa.[96] Uma meta-análise da terapia com vitamina D em pacientes com DII com deficiência de vitamina D mostrou que a suplementação é eficaz na correção dos níveis de vitamina D e está associada a melhorias nos escores de atividade clínica da doença e marcadores bioquímicos.[97]
Outras condições[editar | editar código-fonte]
Diabetes - Uma revisão sistemática de 2014 concluiu que os estudos disponíveis não mostram evidências de que a suplementação de vitamina D3 tenha um efeito na homeostase da glicose ou na prevenção do diabetes.[98] Um artigo de revisão de 2016 relatou que, embora haja evidências crescentes de que a deficiência de vitamina D pode ser um fator de risco para diabetes, as evidências gerais sobre os níveis de vitamina D e diabetes mellitus são contraditórias, exigindo mais estudos.[99]
TDAH - Uma meta-análise de estudos observacionais mostrou que crianças com TDAH têm níveis mais baixos de vitamina D e que havia uma pequena associação entre níveis baixos de vitamina D no momento do nascimento e desenvolvimento posterior de TDAH.[100] Vários pequenos ensaios clínicos randomizados de suplementação de vitamina D indicaram melhora dos sintomas de TDAH, como impulsividade e hiperatividade.[101]
Depressão - Os ensaios clínicos de suplementação de vitamina D para sintomas depressivos foram geralmente de baixa qualidade e não mostram nenhum efeito geral, embora a análise de subgrupo tenha mostrado que a suplementação para participantes com sintomas depressivos clinicamente significativos ou transtorno depressivo teve um efeito moderado.[102]
Cognição e demência - uma revisão sistemática de estudos clínicos encontrou uma associação entre os baixos níveis de vitamina D com prejuízo cognitivo e um maior risco de desenvolver a doença de Alzheimer. No entanto, concentrações mais baixas de vitamina D também estão associadas à má nutrição e a menos tempo ao ar livre. Portanto, existem explicações alternativas para o aumento do comprometimento cognitivo e, portanto, não foi possível estabelecer uma relação causal direta entre os níveis de vitamina D e a cognição.[103]
Gravidez - baixos níveis de vitamina D na gravidez estão associados ao diabetes gestacional, pré-eclâmpsia e bebês pequenos (para a idade gestacional).[104]. Embora a ingestão de suplementos de vitamina D durante a gravidez aumente os níveis de vitamina D no sangue da mãe a termo,[105] a extensão total dos benefícios para a mãe ou para o bebê não está clara.[104][105][106] Mulheres grávidas que tomam uma quantidade adequada de vitamina D durante a gestação podem apresentar um risco menor de pré-eclâmpsia e efeitos imunológicos positivos[107][108] A suplementação de vitamina D também pode reduzir o risco de diabetes gestacional, bebês menores que o normal e de baixa taxa de crescimento.[107][109] As mulheres grávidas muitas vezes não tomam a quantidade recomendada de vitamina D.[108]
Perda de peso - embora haja a hipótese de que a suplementação de vitamina D pode ser um tratamento eficaz para a obesidade, além da restrição calórica, uma revisão sistemática não encontrou associação de suplementação com peso corporal ou massa gorda.[110] Uma meta-análise de 2016 descobriu que o status de vitamina D circulante melhorou com a perdade peso, indicando que a massa gorda pode estar inversamente associada aos níveis de vitamina D.[111]
Alegações de saúde permitidas[editar | editar código-fonte]
As agências reguladoras governamentais estipulam para as indústrias de alimentos e suplementos dietéticos certas alegações de saúde como permitidas, conforme declarações na embalagem.
Autoridade Europeia para a Segurança dos Alimentos
- auxilia na função normal do sistema imunológico[112]
- auxilia na resposta inflamatória normal[112]
- função muscular normal[112]
- risco reduzido de queda em pessoas com mais de 60 anos[113]
Food and Drug Administration (FDA)
- "Cálcio e vitamina D adequados, como parte de uma dieta bem balanceada, junto com a atividade física, podem reduzir o risco de osteoporose."[114]
- "Cálcio adequado e exercícios regulares podem ajudar a obter ossos fortes em crianças e adolescentes e podem reduzir o risco de osteoporose em adultos mais velhos. Uma ingestão adequada de vitamina D também é necessária."[115]
Outras agências possíveis com orientação de reivindicação: Japão FOSHU[116] e Austrália-Nova Zelândia.[117]
Ingestão dietética[editar | editar código-fonte]
Níveis recomendados[editar | editar código-fonte]
Várias instituições propuseram recomendações diferentes para a quantidade de ingestão diária de vitamina D. Elas variam de acordo com a definição precisa, idade, gravidez ou lactantes, e as suposições de extensão feitas em relação à síntese de vitamina D da pele.[62][118][119][120][121] Conversão: 1 µg (micrograma) = 40 UI (unidades internacionais).[118]
| Reino Unido | ||
| Faixa etária | Ingestão (μg/dia) | Ingestão máxima (μg/dia)[118] |
|---|---|---|
| Bebês amamentados de 0 a 12 meses | 8,5 a 10 | 25 |
| Bebês alimentados com fórmula (<500 ml/d) | 10 | 25 |
| Crianças 1 a 10 anos | 10 | 50 |
| Crianças >10 e adultos | 10 | 100 |
| Estados Unidos | ||
| Faixa etária | IDR (UI/dia) | (μg/dia)[62] |
| Bebês 0 a 6 meses | 400* | 10 |
| Bebês 6 a 12 meses | 400* | 10 |
| 1 a 70 anos | 600 | 15 |
| 71+ anos | 800 | 20 |
| Grávidas/Lactantes | 600 | 15 |
| Faixa etária | Ingestão superior tolerável (UI/dia) | (µg/dia) |
| Bebês 0 a 6 meses | 1.000 | 25 |
| Bebês 6 a 12 meses | 1.500 | 37,5 |
| 1 a 3 anos | 2.500 | 62,5 |
| 4 a 8 anos | 3.000 | 75 |
| 9+ anos | 4.000 | 100 |
| Grávidas/Lactantes | 4.000 | 100[62] |
| Canadá | ||
| Faixa etária | IDR (UI) | Ingestão superior tolerável (UI)[119] |
| Bebês 0 a 6 meses | 400* | 1.000 |
| Bebês 7 a 12 meses | 400* | 1.500 |
| Crianças 1 a 3 anos | 600 | 2.500 |
| Crianças 4 a 8 anos | 600 | 3.000 |
| Crianças e Adultos 9 a 70 anos | 600 | 4.000 |
| Adultos > 70 anos | 800 | 4.000 |
| Gravidez e lactantes | 600 | 4.000 |
| Austrália e Nova Zelândia | ||
| Faixa etária | Ingestão recomendada (μg) | Ingestão superior tolerável (μg)[120] |
| Bebês 0 a 12 meses | 5* | 25 |
| Crianças 1 a 18 anos | 5* | 80 |
| Adultos 19 a 50 anos | 5* | 80 |
| Adultos 51 a 70 anos | 10* | 80 |
| Adultos > 70 anos | 15* | 80 |
| Autoridade Europeia para a Segurança dos Alimentos | ||
| Faixa etária | Ingestão recomendada (μg)[121] | Ingestão superior tolerável (μg)[122] |
| Bebês 0 a 12 meses | 10 | 25 |
| Crianças 1 a 10 anos | 15 | 50 |
| Crianças 11 a 17 anos | 15 | 100 |
| Adultos | 15 | 100 |
| Gravidez e lactantes | 15 | 100 |
| * Ingestão recomendada. Valores ainda não estabelecidos. | ||
Reino Unido[editar | editar código-fonte]
O Serviço Nacional de Saúde do Reino Unido (NHS) recomenda que pessoas com risco de deficiência de vitamina D, bebês amamentados, bebês alimentados com fórmula que tomam menos de 500 ml/dia e crianças de 6 meses a 4 anos, devem tomar suplementos de vitamina D diariamente durante todo o o ano para garantir a ingestão suficiente.[118] Isso inclui pessoas com síntese cutânea limitada de vitamina D, que não costumam ficar ao ar livre, são frágeis, não vivem em casa, vivem em uma casa de repouso ou geralmente usam roupas que cobrem a maior parte da pele, ou com pele escura. Outras pessoas podem obter vitamina D adequada com a exposição ao sol de abril a setembro. O NHS e a Public Health England recomendam que todos, incluindo mulheres grávidas e lactantes, considerem tomar um suplemento diário contendo 10 µg (400 UI) de vitamina D durante o outono e o inverno devido baixa incidência de raios solares para a síntese de vitamina D.[123]
Estados Unidos[editar | editar código-fonte]
A ingestão dietética de referência para vitamina D emitida em 2010 pelo Institute of Medicine (IoM) (renomeada National Academy of Medicine em 2015), substituiu as recomendações anteriores que eram expressas em termos de ingestão adequada. As recomendações foram formuladas assumindo que o indivíduo não tem síntese cutânea de vitamina D devido à exposição solar inadequada. A ingestão de referência para vitamina D refere-se à ingestão total de alimentos, bebidas e suplementos, e assume que as necessidades de cálcio estão sendo atendidas.[62] O nível de ingestão superior tolerável (UL) é definido como "a ingestão diária média mais alta de um nutriente que é provavelmente não representam risco de efeitos adversos à saúde para quase todas as pessoas na população em geral. "[62] Embora os ULs sejam considerados seguros, as informações sobre os efeitos de longo prazo são incompletas e esses níveis de ingestão não são recomendados para longo prazo consumo.[62]
Para fins de rotulagem de alimentos e suplementos dietéticos dos EUA, a quantidade em uma porção é expressa como uma porcentagem do valor diário (% DV). Para fins de rotulagem de vitamina D, 100% do valor diário era de 400 UI (10 μg), mas em 27 de maio de 2016, foi revisado para 800 UI (20 μg) para ficar de acordo com a IDR.[124][125] A conformidade com os regulamentos de rotulagem atualizados foi exigida até 1º de janeiro de 2020 para fabricantes com US$ 10 milhões ou mais em vendas anuais de alimentos, e em 1º de janeiro de 2021 para fabricantes com menor volume de vendas de alimentos.[76][126] Uma tabela dos antigos e novos valores diários para adultos é fornecida na Referência Diária Ingestão.
Canadá[editar | editar código-fonte]
A Health Canada publicou a ingestão dietética recomendada (IDR) e os níveis de ingestão superiores toleráveis de vitamina D em 2012, com base no relatório do Institute of Medicine.[62][119]
Austrália e Nova Zelândia[editar | editar código-fonte]
Austrália e Nova Zelândia publicaram valores de referência de nutrientes, incluindo diretrizes para ingestão dietética de vitamina D em 2005.[120] Cerca de um terço dos australianos têm deficiência de vitamina D.[127]
União Europeia[editar | editar código-fonte]
A Autoridade Europeia para a Segurança dos Alimentos (EFSA) em 2016 revisou as evidências atuais, estabelecendo que relação entre a concentração sérica de 25 (OH) D e os resultados de saúde musculoesquelética é amplamente variável. Eles consideraram que os requisitos médios e os valores de ingestão de referência da população para a vitamina D não podem ser derivados, e que uma concentração sérica de 25 (OH) D de 50 nmol/L era um valor alvo adequado. Para todas as pessoas com mais de 1 ano de idade, incluindo mulheres grávidas ou amamentando, eles estabelecem uma ingestão adequada de 15 µg/dia (600 UI).[121][121]
A EFSA revisou os níveis seguros de ingestão em 2012, estabelecendo o limite superior tolerável para adultos em 100 μg/dia (4000 UI), uma conclusão semelhante à do IOM.[122]
A Agência Alimentar Nacional Sueca recomenda uma ingestão diária de 10 µg (400 UI) de vitamina D3 para crianças e adultos até 75 anos e 20 µg (800 UI) para adultos com 75 anos ou mais.[128]
Organizações não governamentais na Europa fizeram suas próprias recomendações. A Sociedade Alemã de Nutrição recomenda 20 µg.[129] A Sociedade Europeia de Menopausa e Andropausa recomenda que mulheres na pós-menopausa consumam 15 µg (600 UI) até os 70 anos e 20 µg (800 UI) a partir dos 71 anos. Esta dose deve ser aumentada para 100 µg (4.000 UI) em algumas pacientes com níveis muito baixos de vitamina D ou em caso de comorbidades.[130]
Dieta[editar | editar código-fonte]
Embora a vitamina D esteja presente naturalmente em apenas alguns alimentos, é comumente adicionada como uma fortificação em alimentos industrializados. Em alguns países, os alimentos básicos são fortificados artificialmente com vitamina D.[1][131]
Fontes naturais[editar | editar código-fonte]
-
Fontes animais Fonte[132] UI/g Irregular Gema de ovo cozida
0,7 44 UI/ovo de 61g Fígado de boi, cozido, refogado
0,5 Óleo de fígado de peixe, como óleo de fígado de bacalhau
100 450 UI/colher de chá (4,5 g) Espécies de peixes gordurosos Salmão, rosa, cozido 5,2 Cavala, cozido, calor seco 4,6 Atum enlatado em óleo 2,7 Sardinhas, enlatadas em óleo, escorridas
1,9 -
Fontes fúngicas Fontes μg/g UI/g Cladonia arbuscula vit. D3 0,67 a 2,04 27 a 82 vit. D2 0,22 a 0,55 8,8 a 22 Agaricus bisporus (cogumelo comum): D2 + D3
Portobello Cru 0,003 0,1 Exposto à luz ultravioleta 0,11 4,46 Crimini Cru 0,001 0,03 Exposto à luz ultravioleta 0,32 12,8
Em geral, a vitamina D3 é encontrada em alimentos de origem animal, especialmente peixes, carnes, vísceras, ovos e laticínios.[134] A vitamina D2 é encontrada em fungos e é produzida por irradiação ultravioleta de ergosterol.[135] O conteúdo de vitamina D2 em cogumelos e Cladina arbuscula, um líquen, aumenta com a exposição à luz ultravioleta e é emulado por lâmpadas ultravioleta industriais para fortificação.[133][135][136] O Departamento de Agricultura dos Estados Unidos relata os conteúdos D2 e D3 combinados em um valor.
Fortificação de alimentos[editar | editar código-fonte]
Alimentos industrializados fortificados com vitamina D incluem alguns sucos de frutas e bebidas à base de suco de frutas, barras energéticas, bebidas à base de proteína de soja, certos queijos e produtos de queijo, produtos de farinha, fórmulas infantis, muitos cereais matinais e leite.[137][138]
Em 2016 nos Estados Unidos, a Food and Drug Administration (FDA) alterou os regulamentos de aditivos alimentares para fortificação de leite,[139] declarando que os níveis de vitamina D3 não excedem 42 UI de vitamina D por 100 g (400 UI por quarto dos EUA) de leite lácteo, 84 UI de vitamina D2 por 100 g (800 UI por litro) de leites vegetais e 89 UI por 100 g (800 UI por litro) em iogurtes à base de plantas ou em bebidas à base de soja.[140][141][142] Leites vegetais são definidos como bebidas à base de soja, amêndoa, arroz, entre outras fontes vegetais, que se apresentam como alternativas ao leite lácteo.[143][144]
Enquanto alguns estudos descobriram que a vitamina D3 aumenta os níveis de 25 (OH) D no sangue mais rapidamente e permanece ativa no corpo por mais tempo,[145][146] outros afirmam que as fontes de vitamina D2 são igualmente biodisponíveis e eficazes como D3 para aumentar e manter a 25 (OH) D.[135][147][148]
Preparo da comida[editar | editar código-fonte]
O teor de vitamina D em alimentos típicos é reduzido de forma variável com o cozimento. Alimentos cozidos, fritos e assados retiveram de 69 a 89% da vitamina D original.[149]
Níveis séricos recomendados[editar | editar código-fonte]

As recomendações sobre os níveis séricos recomendados de 25 (OH) D variam entre as autoridades e variam com base em fatores como a idade.[1] Os laboratórios dos EUA geralmente relatam níveis de 25 (OH) D em ng/mL.[152] Outros países costumam usar nmol/L.[152] Um ng/mL é aproximadamente igual a 2,5 nmol/L.[153]
Uma revisão de 2014 concluiu que os níveis séricos mais vantajosos para 25 (OH) D para todos os resultados pareciam ser próximos a 30 ng/mL (75 nmol/L).[154] Os níveis ideais de vitamina D ainda são controversos e outra revisão concluiu que intervalos de 30 a 40 ng/mL (75 a 100 nmol/L) deveriam ser recomendados para atletas.[155] Parte da controvérsia se deve ao fato de vários estudos terem encontrado diferenças nos níveis séricos de 25 (OH) D entre os grupos étnicos; estudos apontam para razões genéticas e ambientais por trás dessas variações.[156] A suplementação para atingir esses níveis recomendados pode causar calcificação vascular.[55]
Uma meta-análise de 2012 mostrou que o risco de doenças cardiovasculares aumenta quando os níveis sanguíneos de vitamina D são mais baixos em uma faixa de 8 a 24 ng/mL (20 a 60 nmol/L), embora os resultados entre os estudos analisados tenham sido inconsistentes.[157]
Em 2011, um comitê do IOM concluiu que um nível sérico de 25 (OH) D de 20 ng/mL (50 nmol/L) é necessário para a saúde óssea e geral. As ingestões dietéticas de referência para vitamina D são escolhidas com uma margem de segurança e 'ultrapassam' o valor sérico pretendido para garantir que os níveis especificados de ingestão alcancem os níveis séricos desejados de 25 (OH) D em quase todas as pessoas. Nenhuma contribuição para o nível sérico de 25 (OH) D é presumida a partir da exposição ao sol e as recomendações são totalmente aplicáveis a pessoas com pele escura ou exposição desprezível à luz solar. O Instituto descobriu que concentrações séricas de 25 (OH) D acima de 30 ng/mL (75 nmol/L) "não estão consistentemente associadas a um benefício aumentado". Níveis séricos de 25 (OH) D acima de 50 ng/mL (125 nmol/L) podem ser motivo de preocupação. No entanto, algumas pessoas com 25 (OH) D sérico entre 30 e 50 ng/mL (75 nmol/L-125 nmol/L) também terão vitamina D. inadequada[62]
Excesso[editar | editar código-fonte]
A toxicidade da vitamina D é rara.[29] É causada pela suplementação com altas doses de vitamina D, em vez da luz solar. O limite para a toxicidade da vitamina D não foi estabelecido; no entanto, de acordo com algumas pesquisas, o nível de ingestão superior tolerável (UL) é de 4.000 UI/dia para idades de 9 a 71[158] (100 µg/dia), enquanto outra pesquisa conclui que, em adultos saudáveis, a ingestão prolongada de mais de 50.000 UI/dia (1250 μg) pode produzir toxicidade evidente após vários meses e pode aumentar os níveis séricos de 25-hidroxivitamina D para 150 ng/mL ou mais.[29][159] Aqueles com certas condições médicas, como hiperparatireoidismo[160] primário, são muito mais sensíveis à vitamina D e desenvolvem hipercalcemia em resposta a qualquer aumento na nutrição de vitamina D, enquanto a hipercalcemia materna durante a gravidez pode aumentar a sensibilidade fetal aos efeitos da vitamina D e levar a uma síndrome de retardo mental e deformidades faciais.[160][161]
A hipercalcemia infantil idiopática é causada por uma mutação do gene CYP24A1, levando a uma redução na degradação da vitamina D. Os bebês que sofrem dessa mutação têm uma sensibilidade aumentada à vitamina D e, em caso de ingestão adicional, um risco de hipercalcemia.[162][163] O distúrbio pode continuar na idade adulta.[164]
Uma revisão publicada em 2015 observou que os efeitos adversos foram relatados apenas em concentrações séricas de 25 (OH) D acima de 200 nmol/L.[155]
Casos publicados de toxicidade envolvendo hipercalcemia em que a dose de vitamina D e os níveis de 25-hidroxivitamina D são conhecidos, todos envolvem uma ingestão de ≥40.000 UI (1.000 μg) por dia.[160]
Mulheres grávidas ou amamentando devem consultar um médico antes de tomar um suplemento de vitamina D. O FDA aconselhou os fabricantes de suplementos de vitamina D líquidos que os conta-gotas que acompanham esses produtos devem ser marcados de forma clara e precisa para 400 unidades internacionais (1 UI é o equivalente biológico de 25 ng de colecalciferol/ergocalciferol). Além disso, para produtos destinados a bebês, o FDA recomenda que o conta-gotas não tenha mais de 400 UI..[165] Para bebês (do nascimento aos 12 meses), o limite superior tolerável (quantidade máxima que pode ser tolerada sem danos) é estabelecido em 25 μg/dia (1.000 UI). Mil microgramas por dia em bebês produziu toxicidade em um mês[159] Depois de ser encomendado pelos governos canadense e americano, o Institute of Medicine (IOM) desde 30 de novembro de 2010, aumentou o limite superior tolerável (UL) para 2.500 UI por dia para idades de 1-3 anos, 3.000 UI por dia para idades de 4-8 anos e 4.000 UI por dia para idades de 9-71 + anos (incluindo mulheres grávidas ou lactantes).[158]
O calcitriol em si é autorregulado em um ciclo de feedback negativo e também é afetado pelo hormônio da paratireóide, fator de crescimento de fibroblastos 23, citocinas, cálcio e fosfato.[166]
Efeitos do excesso[editar | editar código-fonte]
A overdose de vitamina D causa hipercalcemia, o que é uma forte indicação de toxicidade da vitamina D - isso pode ser observado com um aumento na micção e sede. Se a hipercalcemia não for tratada, ela resultará em depósitos excessivos de cálcio em tecidos moles e órgãos como rins, fígado e coração, resultando em dor e danos aos órgãos.[29][30][49]
Os principais sintomas da overdose de vitamina D são hipercalcemia, incluindo anorexia, náuseas e vômitos. Estes podem ser seguidos por poliúria, polidipsia, fraqueza, insônia, nervosismo, prurido e, em última instância, insuficiência renal. Além disso, podem ocorrer proteinúria, cilindros urinários, azotemia e calcificação metastática (especialmente nos rins).[159] Outros sintomas de toxicidade da vitamina D incluem retardo mental em crianças pequenas, crescimento e formação óssea anormal, diarréia, irritabilidade, perda de peso e depressão severa.[29][49]
A toxicidade da vitamina D é tratada interrompendo a suplementação de vitamina D e restringindo a ingestão de cálcio. A lesão renal pode ser irreversível. A exposição à luz solar por longos períodos de tempo normalmente não causa toxicidade pela vitamina D. As concentrações de precursores de vitamina D produzidos na pele atingem um equilíbrio e qualquer vitamina D adicional produzida é degradada.[160]
Biossíntese[editar | editar código-fonte]
A síntese da vitamina D na natureza depende da presença de radiação ultravioleta e subsequente ativação no fígado e nos rins. Muitos animais sintetizam vitamina D3 a partir do 7-desidrocolesterol e muitos fungos sintetizam vitamina D2 a partir do ergosterol.[135][167]
Fotoquímica[editar | editar código-fonte]


A transformação que converte o 7-desidrocolesterol em vitamina D3 ocorre em duas etapas.[168][169] Primeiro, o 7-desidrocolesterol é fotolisado pela luz ultravioleta em uma reação eletrocíclica de abertura do anel conrotatória de 6 elétrons; o produto é a pré-vitamina D3. Em segundo lugar, a pré-vitamina D3 se isomeriza espontaneamente em vitamina D3 (colecalciferol) em um desvio de hidreto sigmatrópico [1,7] antarafacial. À temperatura ambiente, a transformação da pré-vitamina D3 em vitamina D3 em um solvente orgânico leva cerca de 12 dias para ser concluída. A conversão da pré-vitamina D3 em vitamina D3 na pele é cerca de 10 vezes mais rápida do que em um solvente orgânico.[170]
A conversão de ergosterol em vitamina D2 segue um procedimento semelhante, formando a pré-vitamina D2 por fotólise, que se isomeriza em vitamina D2 (ergocalciferol).[171] A transformação da pré-vitamina D2 em vitamina D2 em metanol tem uma taxa comparável à da pré-vitamina D3. O processo é mais rápido em cogumelos de botão brancos.[135]
Síntese na pele[editar | editar código-fonte]

A vitamina D3 é produzida fotoquimicamente a partir do 7-desidrocolesterol da pele da maioria dos animais vertebrados, incluindo humanos.[172] O precursor da vitamina D3, 7-desidrocolesterol é produzido em quantidades relativamente grandes. O 7-desidrocolesterol reage com a luz UVB em comprimentos de onda de 290 a 315 nm.[173] Esses comprimentos de onda estão presentes na luz solar, bem como na luz emitida pelas lâmpadas UV em câmaras de bronzeamento (que produzem ultravioleta principalmente no espectro UVA, mas normalmente produzem 4% a 10% das emissões totais de UV como UVB). A exposição à luz através das janelas é insuficiente porque o vidro bloqueia quase completamente a luz UVB.[174]
Quantidades adequadas de vitamina D podem ser produzidas com exposição moderada ao sol no rosto, braços e pernas (para aqueles com menos melanina), em média 5 a 30 minutos duas vezes por semana, ou aproximadamente 25% do tempo para queimaduras solares mínimas. Quanto mais escura a pele e mais fraca a luz do sol, mais minutos de exposição são necessários. A overdose de vitamina D é impossível devido à exposição aos raios ultravioleta: a pele atinge um equilíbrio onde a vitamina se degrada tão rápido quanto é criada.[29][175]
A pele consiste em duas camadas primárias: a camada interna, chamada derme, e a epiderme externa, mais fina. A vitamina D é produzida nos queratinócitos de dois estratos mais internos da epiderme, o estrato basal e o estrato espinhoso, que também são capazes de produzir calcitriol e expressar o VDR.[176]
Evolução[editar | editar código-fonte]
A vitamina D pode ser sintetizada apenas por um processo fotoquímico. O fitoplâncton do oceano (como o coccolitóforo e a Emiliania huxleyi) fotossintetiza a vitamina D há mais de 500 milhões de anos. Vertebrados primitivos no oceano podiam absorver cálcio do oceano em seus esqueletos e comer plâncton rico em vitamina D.
Os vertebrados terrestres precisavam de outra fonte de vitamina D além das plantas para terem seus esqueletos calcificados. Eles tiveram que ingeri-lo ou serem expostos à luz solar para fotossintetizá-lo em sua pele.[167][170] Os vertebrados terrestres fotossintetizam a vitamina D há mais de 350 milhões de anos.[177]
Em pássaros e mamíferos peludos, os pelos ou penas impedem que os raios ultravioleta atinjam a pele. Em vez disso, a vitamina D é criada a partir de secreções oleosas da pele depositadas nas penas ou pelos e é obtida por via oral durante a limpeza.[178] No entanto, alguns animais, como o rato-toupeira-pelado, são naturalmente deficientes em colecalciferol, pois os níveis séricos de vitamina D 25-OH são indetectáveis.[179] Cães e gatos são praticamente incapazes de síntese de vitamina D devido à alta atividade da 7-desidrocolesterol redutase, mas eles a obtêm de presas.[180]
Síntese industrial[editar | editar código-fonte]
A vitamina D3 (colecalciferol) é produzida industrialmente pela exposição do 7-desidrocolesterol à luz UVB, seguido de purificação.[181] O 7-desidrocolesterol é uma substância natural presente nos órgãos dos peixes, principalmente no fígado,[182] ou na gordura da lã (lanolina) das ovelhas. A vitamina D2(ergocalciferol) é produzida de forma semelhante, usando ergosterol de levedura ou cogumelos como matéria-prima.[135][181]
Mecanismo de ação[editar | editar código-fonte]
Ativação metabólica[editar | editar código-fonte]

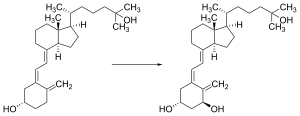
A vitamina D é transportada pela corrente sanguínea para o fígado, onde é convertida no pró-hormônio calcifediol. O calcifediol circulante pode então ser convertido em calcitriol, a forma biologicamente ativa da vitamina D, nos rins.[183]
Quer seja produzida na pele ou ingerida, a vitamina D é hidroxilada no fígado na posição 25 (canto superior direito da molécula) para formar 25-hidroxicolecalciferol (calcifediol ou 25 (OH) D).[3] Essa reação é catalisada pela enzima microssomal vitamina D 25-hidroxilase, produto do gene humano CYP2R1, e expressa pelos hepatócitos.[184] Uma vez feito, o produto é liberado no plasma, onde é ligado a uma proteína transportadora α-globulina chamada proteína de ligação à vitamina D.[185]
O calcifediol é transportado para os túbulos proximais dos rins, onde é hidroxilado na posição 1-α (parte inferior direita da molécula) para formar o calcitriol (1,25-diidroxicolecalciferol, 1,25 (OH) 2D). A conversão de calcifediol em calcitriol é catalisada pela enzima 25-hidroxivitamina D3 1-alfa-hidroxilase, que é o produto do gene humano CYP27B1. A atividade do CYP27B1 é aumentada pelo hormônio da paratireoide e também pelo baixo cálcio ou fosfato.[2][183]
Após a etapa final de conversão no rim, o calcitriol é liberado na circulação. Ao se ligar à proteína de ligação à vitamina D, o calcitriol é transportado por todo o corpo, incluindo os órgãos-alvo clássicos do intestino, rim e osso.[17] O calcitriol é o ligante natural mais potente do receptor da vitamina D, que medeia a maioria das ações fisiológicas da vitamina D.[2][183]
Além dos rins, o calcitriol também é sintetizado por outras células, incluindo monócitos-macrófagos no sistema imunológico. Quando sintetizado por monócitos-macrófagos, o calcitriol atua localmente como uma citocina, modulando as defesas do corpo contra invasores microbianos ao estimular o sistema imunológico inato.[183]
Inativação[editar | editar código-fonte]
A atividade do calcifediol e do calcitriol pode ser reduzida por hidroxilação na posição 24 pela vitamina D3 24-hidroxilase, formando secalciferol e calcitetrol, respectivamente.[3]
Diferença entre substratos[editar | editar código-fonte]
A vitamina D2(ergocalciferol) e a vitamina D3(colecalciferol) compartilham um mecanismo de ação semelhante ao descrito acima..[3] Os metabólitos produzidos pela vitamina D2 às vezes são nomeados com um prefixo er- ou ergo para diferenciá-los dos equivalentes baseados em D3[16]
- Os metabólitos produzidos a partir da vitamina D2 tendem a se ligar menos à proteína de ligação à vitamina D.[3] É questionado se esta diferença leva a uma meia-vida mais curta
- A vitamina D3 pode ser alternativamente hidroxilada em calcifediol pelo esterol 27-hidroxilase (CYP27A1), mas a vitamina D2 não.[3]
- O ergocalciferol pode ser diretamente hidroxilado na posição 24 pelo CYP27A1.[3] Essa hidroxilação também leva a um maior grau de inativação: a atividade do calcitriol diminui para 60% do original após a 24-hidroxilação,[186] enquanto o ercalcitriol sofre uma diminuição de 10 vezes na atividade na conversão em ercalcitetrol.[187]
Mecanismos intracelulares[editar | editar código-fonte]
O calcitriol entra na célula-alvo e se liga ao receptor da vitamina D no citoplasma. Esse receptor ativado entra no núcleo e se liga aos elementos de resposta à vitamina D (VDRE), que são sequências de DNA específicas dos genes. A transcrição desses genes é estimulada e produz maiores níveis das proteínas que medeiam os efeitos da vitamina D.[3]
História[editar | editar código-fonte]
Os pesquisadores americanos Elmer McCollum e Marguerite Davis em 1914 descobriram uma substância no óleo de fígado de bacalhau que mais tarde foi chamada de "vitamina A".[12] O médico britânico Edward Mellanby notou que cães alimentados com óleo de fígado de bacalhau não desenvolveram raquitismo e concluiu que a vitamina A, ou um fator intimamente associado, pode prevenir a doença. Em 1922, Elmer McCollum testou óleo de fígado de bacalhau modificado, no qual a vitamina A havia sido destruída.[12] O óleo modificado curou os cães doentes, então McCollum concluiu que o fator do óleo de fígado de bacalhau, que curava o raquitismo, era diferente da vitamina A. Ele a chamou de vitamina D porque foi a quarta vitamina a ser nomeada.[188][189] Não se percebeu inicialmente que, ao contrário de outras vitaminas, a vitamina D pode ser sintetizada por humanos por meio da exposição à luz ultravioleta.
Em 1925,.[12] foi estabelecido que quando o 7-deidrocolesterol é irradiado com luz, uma forma de vitamina solúvel em gordura é produzida (agora conhecida como D3). Alfred Fabian Hess afirmou: "Luz é igual a vitamina D."[190] Adolf Windaus, da Universidade de Göttingen, na Alemanha, recebeu o Prêmio Nobel de Química em 1928 por seu trabalho sobre a constituição dos esteróis e sua conexão com as vitaminas.[191] Em 1929, um grupo do NIMR em Hampstead, Londres, trabalhava na estrutura da vitamina D, que ainda era desconhecida, assim como na estrutura dos esteroides. Realizou-se uma reunião com J.B.S. Haldane, J.D. Bernal e Dorothy Crowfoot para discutir possíveis estruturas, que contribuíram para reunir uma equipe. A cristalografia de raios X demonstrou que as moléculas de esterol eram planas, não como proposto pela equipe alemã liderada por Windaus. Em 1932, Otto Rosenheim e Harold King publicaram um artigo apresentando estruturas para esteróis e ácidos biliares que encontraram aceitação imediata[192] A colaboração acadêmica informal entre os membros da equipe Robert Benedict Bourdillon, Otto Rosenheim, Harold King e Kenneth Callow foi muito produtiva e levou ao isolamento e caracterização da vitamina D.[193] Nesse momento, a política do Conselho de Pesquisa Médica era não patentear descobertas, acreditando que os resultados da pesquisa médica devem ser abertos a todos. Na década de 1930, Windaus esclareceu ainda mais a estrutura química da vitamina D.[194]
Em 1923, o bioquímico americano Harry Steenbock, da Universidade de Wisconsin, demonstrou que a irradiação por luz ultravioleta aumentava o conteúdo de vitamina D dos alimentos e outros materiais orgânicos.[195] Depois de irradiar comida de roedores, Steenbock descobriu que os roedores estavam curados do raquitismo. A deficiência de vitamina D é uma causa conhecida de raquitismo. Usando US$300 do próprio dinheiro, Steenbock patenteou sua invenção. Sua técnica de irradiação foi usada para alimentos, principalmente para o leite. Quando sua patente expirou em 1945, o raquitismo já havia sido eliminado nos Estados Unidos.[196]
Em 1969, após estudar fragmentos nucleares de células intestinais, uma proteína de ligação específica para a vitamina D, chamada de receptor de vitamina D, foi identificada por Mark Haussler e Tony Norman.[197] Entre 1971 e 1972, foi descoberto o metabolismo posterior da vitamina D em formas ativas. No fígado, a vitamina D foi convertida em calcifediol. O calcifediol é então convertido pelos rins em calcitriol, a forma biologicamente ativa da vitamina D. O calcitriol circula como um hormônio no sangue, regulando a concentração de calcium e fosfato na corrente sanguínea e promovendo o crescimento saudável e a remodelação óssea. Os metabólitos da vitamina D, calcifediol e calcitriol, foram identificados por equipes concorrentes lideradas por Michael F. Holick no laboratório de Hector DeLuca e por Tony Norman e colegas.[10][11][198]
Pesquisas[editar | editar código-fonte]
Há evidências conflitantes sobre os benefícios das intervenções com vitamina D,[199] uma visão supostamente uma ingestão de 4.000 a 12.000 UI/dia da exposição ao sol com níveis séricos concomitantes de 25-hidroxivitamina D de 40 a 80 ng/mL,[200] enquanto outra visão é que o soro concentrações acima de 50 ng/mL não são plausíveis.[57][200]
Os Institutos Nacionais de Saúde dos Estados Unidos para Suplementos Alimentares estabeleceram uma Iniciativa Vitamina D em 2014 para rastrear pesquisas atuais e fornecer educação aos consumidores.[201] Em sua atualização de 2020, foi reconhecido que um crescente corpo de pesquisas sugere que a vitamina D pode desempenhar algum papel na prevenção e tratamento de diabetes tipos 1 e 2, intolerância à glicose, hipertensão, esclerose múltipla e outras condições médicas. No entanto, concluiu-se que as evidências disponíveis eram inadequadas ou muito contraditórias para confirmar a eficácia da vitamina D nessas condições, exceto pelos resultados mais positivos sobre a saúde óssea.[1]
Alguns estudos preliminares relacionam os baixos níveis de vitamina D com doenças mais tarde na vida.[202] Uma meta-análise encontrou uma diminuição na mortalidade em pessoas idosas.[13] Outra meta-análise cobrindo mais de 350.000 pessoas concluiu que a suplementação de vitamina D em indivíduos residentes na comunidade não selecionados não reduz os resultados esqueléticos (fratura total) ou não esqueléticos (infarto do miocárdio, doença isquêmica do coração, acidente vascular cerebral, doença cerebrovascular, câncer) em mais de 15%, e que novos ensaios de pesquisa com desenho semelhante são improváveis de alterar essas conclusões.[14] Uma meta-análise de 2019 descobriu que um pequeno aumento no risco de acidente vascular cerebral quando suplementos de calcium foram adicionados à vitamina D.[203] As evidências de 2013 são insuficientes para determinar se a vitamina D afeta o risco de câncer.[204]
COVID-19[editar | editar código-fonte]
A deficiência de vitamina D demonstrou aumentar potencialmente o risco de infecções respiratórias graves. Isso causou um interesse renovado por esse potencial em 2020 durante a pandemia COVID-19.[205]
Diversas revisões sistemáticas e metanálises de múltiplos estudos descreveram as associações da deficiência de vitamina D com resultados adversos no COVID-19.[206][207][208] Um descobriu que, embora a deficiência não estivesse associada a uma maior probabilidade de se infectar com COVID-19, havia associações significativas entre a deficiência ou insuficiência de vitamina D com doença mais grave, incluindo aumentos nas taxas de hospitalização e mortalidade em cerca de 80%.[206] Duas outras meta-análises de cerca de 40 estudos mostraram que o risco de infecção era maior em pessoas com deficiência de vitamina D.[207][208] O grupo com deficiência de vitamina D teve cerca de duas vezes o risco de doença com maior gravidade e, em algumas análises, uma associação significativa com maiores taxas de mortalidade.[207][208] Outro, revisando 31 estudos, relatou que pacientes com COVID-19 tendem a ter níveis mais baixos de 25 (OH) D do que indivíduos saudáveis, mas afirmou que a tendência de associações com desfechos de saúde foi limitada pela baixa qualidade dos estudos e pela possibilidade de mecanismos de causalidade reversa.[209]
Em julho de 2020, os Institutos Nacionais de Saúde dos EUA encontraram evidências insuficientes para recomendar a favor ou contra o uso da suplementação de vitamina D para prevenir ou tratar COVID-19.[210] O Instituto Nacional para Excelência em Saúde e Cuidados (NICE) do Reino Unido não recomenda oferecer um suplemento de vitamina D às pessoas apenas para prevenir ou tratar COVID-19.[211][212] Ambas as organizações incluíram recomendações para continuar as recomendações estabelecidas anteriormente sobre a suplementação de vitamina D por outros motivos, como saúde óssea e muscular, conforme aplicável. Ambas as organizações observaram que mais pessoas podem precisar de suplementação devido à menor quantidade de exposição ao sol durante a pandemia.[210][211]
A principal complicação da COVID-19 é a síndrome do desconforto respiratório agudo (SDRA), que pode ser agravada pela deficiência de vitamina D,[213] uma associação que não é específica para infecções por coronavírus.[213]
Uma série de ensaios em diferentes países estão em andamento ou foram publicados, observando o uso da vitamina D e seus metabólitos, como o calcifediol, na prevenção e no tratamento de infecções por SARS-CoV-2.[213][214] Uma meta-análise de três estudos sobre o efeito da suplementação oral de vitamina D ou calcifediol indicou uma taxa de admissão na unidade de terapia intensiva (UTI) mais baixa (odds ratio: 0,36) em comparação com aqueles sem suplementação, mas sem uma mudança na mortalidade.[215] Uma revisão da Cochrane, também de três estudos, concluiu que as evidências para a eficácia da suplementação de vitamina D para o tratamento de COVID-19 são muito incertas.[216] Eles descobriram que havia uma heterogeneidade clínica e metodológica substancial nos três estudos incluídos, principalmente por causa das diferentes estratégias de suplementação, formulações de vitamina D (uma usando calcifediol), estado de pré-tratamento e resultados relatados.[216] Outra meta-análise afirmou que o uso de altas doses de vitamina D em pacientes com COVID-19 não é baseado em evidências sólidas, embora a suplementação de calcifediol possa ter um efeito protetor nas admissões em UTI.[209]
Referências
- ↑ a b c d e f g h i j k «Office of Dietary Supplements - Vitamin D». ods.od.nih.gov (em inglês). 9 de outubro de 2020. Consultado em 31 de outubro de 2020
- ↑ a b c d e f g Norman AW (agosto de 2008). «From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health». The American Journal of Clinical Nutrition. 88 (2): 491S–499S. PMID 18689389. doi:10.1093/ajcn/88.2.491S
- ↑ a b c d e f g h i j k l Bikle DD (março de 2014). «Vitamin D metabolism, mechanism of action, and clinical applications». Chemistry & Biology. 21 (3): 319–29. PMC 3968073
 . PMID 24529992. doi:10.1016/j.chembiol.2013.12.016
. PMID 24529992. doi:10.1016/j.chembiol.2013.12.016 - ↑ MacDonald, James (18 de julho de 2019). «How Does the Body Make Vitamin D from Sunlight?». JSTOR Daily. Consultado em 22 de julho de 2019
- ↑ Holick MF, MacLaughlin JA, Clark MB, Holick SA, Potts JT, Anderson RR, et al. (outubro de 1980). «Photosynthesis of previtamin D3 in human skin and the physiologic consequences». Science. 210 (4466): 203–5. Bibcode:1980Sci...210..203H. JSTOR 1685024. PMID 6251551. doi:10.1126/science.6251551
- ↑ Calvo MS, Whiting SJ, Barton CN (fevereiro de 2005). «Vitamin D intake: a global perspective of current status». The Journal of Nutrition. 135 (2): 310–6. PMID 15671233. doi:10.1093/jn/135.2.310
- ↑ Lehmann U, Gjessing HR, Hirche F, Mueller-Belecke A, Gudbrandsen OA, Ueland PM, et al. (outubro de 2015). «Efficacy of fish intake on vitamin D status: a meta-analysis of randomized controlled trials». The American Journal of Clinical Nutrition. 102 (4): 837–47. PMID 26354531. doi:10.3945/ajcn.114.105395
- ↑ «Vitamin D Tests». Lab Tests Online (USA). American Association for Clinical Chemistry. Consultado em 23 de junho de 2013
- ↑ Hollis BW (janeiro de 1996). «Assessment of vitamin D nutritional and hormonal status: what to measure and how to do it». Calcified Tissue International. 58 (1): 4–5. PMID 8825231. doi:10.1007/BF02509538
- ↑ a b Holick MF, Schnoes HK, DeLuca HF (abril de 1971). «Identification of 1,25-dihydroxycholecalciferol, a form of vitamin D3 metabolically active in the intestine». Proceedings of the National Academy of Sciences of the United States of America. 68 (4): 803–4. Bibcode:1971PNAS...68..803H. PMC 389047
 . PMID 4323790. doi:10.1073/pnas.68.4.803
. PMID 4323790. doi:10.1073/pnas.68.4.803 - ↑ a b Norman AW, Myrtle JF, Midgett RJ, Nowicki HG, Williams V, Popják G (julho de 1971). «1,25-dihydroxycholecalciferol: identification of the proposed active form of vitamin D3 in the intestine». Science. 173 (3991): 51–4. Bibcode:1971Sci...173...51N. PMID 4325863. doi:10.1126/science.173.3991.51
- ↑ a b c d Wolf G (junho de 2004). «The discovery of vitamin D: the contribution of Adolf Windaus». The Journal of Nutrition. 134 (6): 1299–302. PMID 15173387. doi:10.1093/jn/134.6.1299
- ↑ a b c d e Bjelakovic G, Gluud LL, Nikolova D, Whitfield K, Wetterslev J, Simonetti RG, et al. (janeiro de 2014). «Vitamin D supplementation for prevention of mortality in adults». The Cochrane Database of Systematic Reviews (Systematic review). 1 (1): CD007470. PMID 24414552. doi:10.1002/14651858.CD007470.pub3
- ↑ a b c d e f g Bolland MJ, Grey A, Gamble GD, Reid IR (abril de 2014). «The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis». The Lancet. Diabetes & Endocrinology (Meta-analysis). 2 (4): 307–320. PMID 24703049. doi:10.1016/S2213-8587(13)70212-2
- ↑ Dorland's Illustrated Medical Dictionary, under Vitamin (Table of Vitamins)
- ↑ a b «UIPAC-UIB Joint Commission on Biochemical Nomenclature (JCBN): Nomenclature of vitamin D. Recommendations 1981». European Journal of Biochemistry. 124 (2): 223–7. Maio de 1982. PMID 7094913. doi:10.1111/j.1432-1033.1982.tb06581.x
- ↑ a b c Fleet JC, Shapses SA (2020). «Vitamin D». In: BP Marriott, DF Birt, VA Stallings, AA Yates. Present Knowledge in Nutrition, Eleventh Edition. London, United Kingdom: Academic Press (Elsevier). pp. 93–114. ISBN 978-0-323-66162-1
- ↑ Boron, Walter F.; Boulpaep, Emile L. (29 de março de 2016). Medical Physiology E-Book. [S.l.]: Elsevier Health Sciences. ISBN 978-1-4557-3328-6
- ↑ Bouillon R, Van Cromphaut S, Carmeliet G (fevereiro de 2003). «Intestinal calcium absorption: Molecular vitamin D mediated mechanisms». Journal of Cellular Biochemistry. 88 (2): 332–9. PMID 12520535. doi:10.1002/jcb.10360
- ↑ a b c d Holick MF (dezembro de 2004). «Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease». The American Journal of Clinical Nutrition. 80 (6 Suppl): 1678S–88S. PMID 15585788. doi:10.1093/ajcn/80.6.1678S
- ↑ a b Bell TD, Demay MB, Burnett-Bowie SA (setembro de 2010). «The biology and pathology of vitamin D control in bone». Journal of Cellular Biochemistry. 111 (1): 7–13. PMC 4020510
 . PMID 20506379. doi:10.1002/jcb.22661
. PMID 20506379. doi:10.1002/jcb.22661 - ↑ Watkins RR, Lemonovich TL, Salata RA (maio de 2015). «An update on the association of vitamin D deficiency with common infectious diseases». Canadian Journal of Physiology and Pharmacology. 93 (5): 363–8. PMID 25741906. doi:10.1139/cjpp-2014-0352
- ↑ Puchacz E, Stumpf WE, Stachowiak EK, Stachowiak MK (fevereiro de 1996). «Vitamin D increases expression of the tyrosine hydroxylase gene in adrenal medullary cells». Brain Research. Molecular Brain Research. 36 (1): 193–6. PMID 9011759. doi:10.1016/0169-328X(95)00314-I
- ↑ a b Angeline ME, Gee AO, Shindle M, Warren RF, Rodeo SA (fevereiro de 2013). «The effects of vitamin D deficiency in athletes». The American Journal of Sports Medicine. 41 (2): 461–4. PMID 23371942. doi:10.1177/0363546513475787
- ↑ Cashman KD, Dowling KG, Škrabáková Z, Gonzalez-Gross M, Valtueña J, De Henauw S, et al. (abril de 2016). «Vitamin D deficiency in Europe: pandemic?». The American Journal of Clinical Nutrition. 103 (4): 1033–44. PMC 5527850
 . PMID 26864360. doi:10.3945/ajcn.115.120873
. PMID 26864360. doi:10.3945/ajcn.115.120873 - ↑ «Rickets». National Health Service. 8 de março de 2012. Consultado em 9 de julho de 2012
- ↑ Munns CF, Shaw N, Kiely M, Specker BL, Thacher TD, Ozono K, et al. (fevereiro de 2016). «Global Consensus Recommendations on Prevention and Management of Nutritional Rickets». The Journal of Clinical Endocrinology and Metabolism. 101 (2): 394–415. PMC 4880117
 . PMID 26745253. doi:10.1210/jc.2015-2175
. PMID 26745253. doi:10.1210/jc.2015-2175 - ↑ Eriksen EF, Glerup H (2002). «Vitamin D deficiency and aging: implications for general health and osteoporosis». Biogerontology. 3 (1–2): 73–7. PMID 12014847. doi:10.1023/A:1015263514765
- ↑ a b c d e f Holick MF (julho de 2007). «Vitamin D deficiency». The New England Journal of Medicine. 357 (3): 266–81. PMID 17634462. doi:10.1056/NEJMra070553
- ↑ a b c d Brown, Judith E.; Isaacs, Janet; Krinke, Bea; Lechtenberg, Ellen; Murtaugh, Maureen (28 de junho de 2013). Nutrition Through the Life Cycle. [S.l.]: Cengage Learning. ISBN 978-1-285-82025-5
- ↑ Schoenmakers I, Goldberg GR, Prentice A (junho de 2008). «Abundant sunshine and vitamin D deficiency». The British Journal of Nutrition. 99 (6): 1171–3. PMC 2758994
 . PMID 18234141. doi:10.1017/S0007114508898662
. PMID 18234141. doi:10.1017/S0007114508898662 - ↑ a b Wagner CL, Greer FR (novembro de 2008). «Prevention of rickets and vitamin D deficiency in infants, children, and adolescents». Pediatrics. 122 (5): 1142–52. PMID 18977996. doi:10.1542/peds.2008-1862
- ↑ Lerch C, Meissner T (outubro de 2007). Lerch C, ed. «Interventions for the prevention of nutritional rickets in term born children». The Cochrane Database of Systematic Reviews (4): CD006164. PMID 17943890. doi:10.1002/14651858.CD006164.pub2
- ↑ Zargar AH, Mithal A, Wani AI, Laway BA, Masoodi SR, Bashir MI, Ganie MA (junho de 2000). «Pseudovitamin D deficiency rickets--a report from the Indian subcontinent». Postgraduate Medical Journal. 76 (896): 369–72. PMC 1741602
 . PMID 10824056. doi:10.1136/pmj.76.896.369
. PMID 10824056. doi:10.1136/pmj.76.896.369 - ↑ Elidrissy AT (setembro de 2016). «The Return of Congenital Rickets, Are We Missing Occult Cases?». Calcified Tissue International (Review). 99 (3): 227–36. PMID 27245342. doi:10.1007/s00223-016-0146-2
- ↑ Paterson CR, Ayoub D (outubro de 2015). «Congenital rickets due to vitamin D deficiency in the mothers». Clinical Nutrition (Review). 34 (5): 793–8. PMID 25552383. doi:10.1016/j.clnu.2014.12.006
- ↑ Oramasionwu GE, Thacher TD, Pam SD, Pettifor JM, Abrams SA (agosto de 2008). «Adaptation of calcium absorption during treatment of nutritional rickets in Nigerian children» (PDF). The British Journal of Nutrition. 100 (2): 387–92. PMID 18197991. doi:10.1017/S0007114507901233
- ↑ Fischer PR, Rahman A, Cimma JP, Kyaw-Myint TO, Kabir AR, Talukder K, et al. (outubro de 1999). «Nutritional rickets without vitamin D deficiency in Bangladesh». Journal of Tropical Pediatrics. 45 (5): 291–3. PMID 10584471. doi:10.1093/tropej/45.5.291
- ↑ a b Dunnigan MG, Henderson JB (novembro de 1997). «An epidemiological model of privational rickets and osteomalacia». The Proceedings of the Nutrition Society. 56 (3): 939–56. PMID 9483661. doi:10.1079/PNS19970100
- ↑ Robertson I, Ford JA, McIntosh WB, Dunnigan MG (janeiro de 1981). «The role of cereals in the aetiology of nutritional rickets: the lesson of the Irish National Nutrition Survey 1943-8». The British Journal of Nutrition. 45 (1): 17–22. PMID 6970590. doi:10.1079/BJN19810073
- ↑ Clements MR (1989). «The problem of rickets in UK Asians». Journal of Human Nutrition and Dietetics. 2 (2): 105–116. doi:10.1111/j.1365-277X.1989.tb00015.x
- ↑ a b Pettifor JM (dezembro de 2004). «Nutritional rickets: deficiency of vitamin D, calcium, or both?». The American Journal of Clinical Nutrition. 80 (6 Suppl): 1725S–9S. PMID 15585795. doi:10.1093/ajcn/80.6.1725S
- ↑ a b Dunnigan MG, Henderson JB, Hole DJ, Barbara Mawer E, Berry JL (dezembro de 2005). «Meat consumption reduces the risk of nutritional rickets and osteomalacia». The British Journal of Nutrition. 94 (6): 983–91. PMID 16351777. doi:10.1079/BJN20051558
- ↑ «Cell Biology and Cancer Curriculum Supplement». Office of Science Education. Consultado em 24 de agosto de 2010. Cópia arquivada em 8 de junho de 2010
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ Weick MT (novembro de 1967). «A history of rickets in the United States». The American Journal of Clinical Nutrition. 20 (11): 1234–41. PMID 4862158. doi:10.1093/ajcn/20.11.1234
- ↑ Garrison RH, Somer E (1997). The Nutrition Desk Reference. [S.l.]: McGraw-Hill. ISBN 978-0-87983-826-3
- ↑ Dupuis EM (1 de fevereiro de 2002). Nature's Perfect Food: How Milk Became America's Drink. [S.l.]: NYU Press. ISBN 978-0-8147-1938-1
- ↑ Teegarden D, Lyle RM, Proulx WR, Johnston CC, Weaver CM (maio de 1999). «Previous milk consumption is associated with greater bone density in young women». The American Journal of Clinical Nutrition. 69 (5): 1014–7. PMID 10232644. doi:10.1093/ajcn/69.5.1014
- ↑ a b c Insel, Paul; Ross, Don; Bernstein, Melissa; McMahon, Kimberley (18 de março de 2015). Discovering Nutrition. [S.l.]: Jones & Bartlett Publishers. ISBN 978-1-284-06465-0
- ↑ Holick MF (março de 2006). «High prevalence of vitamin D inadequacy and implications for health». Mayo Clinic Proceedings. 81 (3): 353–73. PMID 16529140. doi:10.4065/81.3.353
- ↑ Straube S, Andrew Moore R, Derry S, McQuay HJ (janeiro de 2009). «Vitamin D and chronic pain». Pain. 141 (1–2): 10–3. PMID 19084336. doi:10.1016/j.pain.2008.11.010
- ↑ Gaikwad M, Vanlint S, Mittinity M, Moseley GL, Stocks N (maio de 2017). «Does vitamin D supplementation alleviate chronic nonspecific musculoskeletal pain? A systematic review and meta-analysis». Clinical Rheumatology. 36 (5): 1201–1208. PMID 26861032. doi:10.1007/s10067-016-3205-1
- ↑ Lowe NM, Bhojani I (junho de 2017). «Special considerations for vitamin D in the south Asian population in the UK». Therapeutic Advances in Musculoskeletal Disease. 9 (6): 137–144. PMC 5466148
 . PMID 28620422. doi:10.1177/1759720X17704430
. PMID 28620422. doi:10.1177/1759720X17704430 - ↑ O'Connor MY, Thoreson CK, Ramsey NL, Ricks M, Sumner AE (2013). «The uncertain significance of low vitamin D levels in African descent populations: a review of the bone and cardiometabolic literature». Progress in Cardiovascular Diseases. 56 (3): 261–9. PMC 3894250
 . PMID 24267433. doi:10.1016/j.pcad.2013.10.015
. PMID 24267433. doi:10.1016/j.pcad.2013.10.015 - ↑ a b Freedman BI, Register TC (junho de 2012). «Effect of race and genetics on vitamin D metabolism, bone and vascular health». Nature Reviews. Nephrology. 8 (8): 459–66. PMID 22688752. doi:10.1038/nrneph.2012.112
- ↑ Khalid AT, Moore CG, Hall C, Olabopo F, Rozario NL, Holick MF, et al. (setembro de 2017). «Utility of sun-reactive skin typing and melanin index for discerning vitamin D deficiency». Pediatric Research. 82 (3): 444–451. PMC 5570640
 . PMID 28467404. doi:10.1038/pr.2017.114
. PMID 28467404. doi:10.1038/pr.2017.114 - ↑ a b c Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. (julho de 2011). «Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline». The Journal of Clinical Endocrinology and Metabolism. 96 (7): 1911–30. PMID 21646368. doi:10.1210/jc.2011-0385
- ↑ Chung M, Balk EM, Brendel M, Ip S, Lau J, Lee J, et al. (agosto de 2009). «Vitamin D and calcium: a systematic review of health outcomes». Evidence Report/Technology Assessment (183): 1–420. PMC 4781105
 . PMID 20629479
. PMID 20629479 - ↑ Theodoratou E, Tzoulaki I, Zgaga L, Ioannidis JP (abril de 2014). «Vitamin D and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials». BMJ. 348: g2035. PMC 3972415
 . PMID 24690624. doi:10.1136/bmj.g2035
. PMID 24690624. doi:10.1136/bmj.g2035 - ↑ a b c Autier P, Boniol M, Pizot C, Mullie P (janeiro de 2014). «Vitamin D status and ill health: a systematic review». The Lancet. Diabetes & Endocrinology. 2 (1): 76–89. PMID 24622671. doi:10.1016/S2213-8587(13)70165-7
- ↑ Hussain S, Singh A, Akhtar M, Najmi AK (setembro de 2017). «Vitamin D supplementation for the management of knee osteoarthritis: a systematic review of randomized controlled trials». Rheumatology International. 37 (9): 1489–1498. PMID 28421358. doi:10.1007/s00296-017-3719-0
- ↑ a b c d e f g h i j k l Institute of Medicine (IoM) (2011). «8, Implications and Special Concerns». In: Ross AC, Taylor CL, Yaktine AL, Del Valle HB. Dietary Reference Intakes for calcium and Vitamin D. Col: The National Academies Collection: Reports funded by National Institutes of Health. [S.l.]: National Academies Press. ISBN 978-0-309-16394-1. PMID 21796828. doi:10.17226/13050
- ↑ a b Maxmen A (julho de 2011). «Nutrition advice: the vitamin D-lemma» (PDF). Nature. 475 (7354): 23–5. PMID 21734684. doi:10.1038/475023a
- ↑ Schöttker B, Jorde R, Peasey A, Thorand B, Jansen EH, Groot L, et al. (ConsortUIm on Health Ageing: Network of Cohorts in Europe the United States) (junho de 2014). «Vitamin D and mortality: meta-analysis of individual participant data from a large consortUIm of cohort studies from Europe and the United States». BMJ. 348 (jun17 16): g3656. PMC 4061380
 . PMID 24938302. doi:10.1136/bmj.g3656
. PMID 24938302. doi:10.1136/bmj.g3656 - ↑ Tuohimaa P (março de 2009). «Vitamin D and aging». The Journal of Steroid Biochemistry and Molecular Biology. 114 (1–2): 78–84. PMID 19444937. doi:10.1016/j.jsbmb.2008.12.020
- ↑ Tuohimaa P, Keisala T, Minasyan A, Cachat J, Kalueff A (dezembro de 2009). «Vitamin D, nervous system and aging». Psychoneuroendocrinology. 34 (Suppl 1): S278–86. PMID 19660871. doi:10.1016/j.psyneuen.2009.07.003
- ↑ Manya H, Akasaka-Manya K, Endo T (julho de 2010). «Klotho protein deficiency and aging». Geriatrics & Gerontology International. 10 Suppl 1 (Suppl 1): S80-7. PMID 20590845. doi:10.1111/j.1447-0594.2010.00596.x
- ↑ Reid IR, Bolland MJ, Grey A (janeiro de 2014). «Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis». Lancet. 383 (9912): 146–55. PMID 24119980. doi:10.1016/s0140-6736(13)61647-5
- ↑ Avenell A, Mak JC, O'Connell D (abril de 2014). «Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men». The Cochrane Database of Systematic Reviews. 4 (4): CD000227. PMC 7032685
 . PMID 24729336. doi:10.1002/14651858.CD000227.pub4
. PMID 24729336. doi:10.1002/14651858.CD000227.pub4 - ↑ Bischoff-Ferrari HA, Willett WC, Orav EJ, Oray EJ, Lips P, Meunier PJ, et al. (julho de 2012). «A pooled analysis of vitamin D dose requirements for fracture prevention» (PDF). The New England Journal of Medicine. 367 (1): 40–9. PMID 22762317. doi:10.1056/NEJMoa1109617. hdl:1871/48765
- ↑ a b Chung M, Lee J, Terasawa T, Lau J, Trikalinos TA (dezembro de 2011). «Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the U.S. Preventive Services Task Force». Annals of Internal Medicine. 155 (12): 827–38. PMID 22184690. doi:10.7326/0003-4819-155-12-201112200-00005
- ↑ Zhao JG, Zeng XT, Wang J, LUI L (dezembro de 2017). «Association Between calcium or Vitamin D Supplementation and Fracture Incidence in Community-Dwelling Older Adults: A Systematic Review and Meta-analysis». JAMA. 318 (24): 2466–2482. PMC 5820727
 . PMID 29279934. doi:10.1001/jama.2017.19344
. PMID 29279934. doi:10.1001/jama.2017.19344 - ↑ Cranney A, Horsley T, O'Donnell S, Weiler H, Puil L, Ooi D, et al. (agosto de 2007). «Effectiveness and safety of vitamin D in relation to bone health». Evidence Report/Technology Assessment (158): 1–235. PMC 4781354
 . PMID 18088161
. PMID 18088161 - ↑ Bolland MJ, Grey A, Gamble GD, Reid IR (julho de 2014). «Vitamin D supplementation and falls: a trial sequential meta-analysis». The Lancet. Diabetes & Endocrinology. 2 (7): 573–80. PMID 24768505. doi:10.1016/S2213-8587(14)70068-3
- ↑ Shuler FD, Wingate MK, Moore GH, Giangarra C (novembro de 2012). «Sports health benefits of vitamin d». Sports Health. 4 (6): 496–501. PMC 3497950
 . PMID 24179588. doi:10.1177/1941738112461621
. PMID 24179588. doi:10.1177/1941738112461621 - ↑ a b «Changes to the Nutrition Facts Label». U.S. Food and Drug Administration (FDA). 27 de maio de 2016. Consultado em 16 de maio de 2020
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ Byers T (julho de 2010). «Anticancer vitamins du Jour--The ABCED's so far». American Journal of Epidemiology (Review). 172 (1): 1–3. PMC 2892535
 . PMID 20562190. doi:10.1093/aje/kwq112
. PMID 20562190. doi:10.1093/aje/kwq112 - ↑ Feldman D, Krishnan AV, Swami S, Giovannucci E, Feldman BJ (maio de 2014). «The role of vitamin D in reducing cancer risk and progression». Nature Reviews. Cancer. 14 (5): 342–57. PMID 24705652. doi:10.1038/nrc3691
- ↑ Li M, Chen P, Li J, Chu R, Xie D, Wang H (julho de 2014). «Review: the impacts of circulating 25-hydroxyvitamin D levels on cancer patient outcomes: a systematic review and meta-analysis». The Journal of Clinical Endocrinology and Metabolism. 99 (7): 2327–36. PMID 24780061. doi:10.1210/jc.2013-4320
- ↑ Buttigliero C, Monagheddu C, Petroni P, Saini A, Dogliotti L, Ciccone G, Berruti A (2011). «Prognostic role of vitamin d status and efficacy of vitamin D supplementation in cancer patients: a systematic review». The Oncologist. 16 (9): 1215–27. PMC 3228169
 . PMID 21835895. doi:10.1634/theoncologist.2011-0098
. PMID 21835895. doi:10.1634/theoncologist.2011-0098 - ↑ Vaughan-Shaw PG, Buijs LF, Blackmur JP, Theodoratou E, Zgaga L, Din FV, Farrington SM, Dunlop MG (setembro de 2020). «The effect of vitamin D supplementation on survival in patients with colorectal cancer: systematic review and meta-analysis of randomised controlled trials». British Journal of Cancer. 123 (11): 1705–1712. PMC 7686489
 . PMID 32929196. doi:10.1038/s41416-020-01060-8
. PMID 32929196. doi:10.1038/s41416-020-01060-8 - ↑ Barbarawi M, Kheiri B, Zayed Y, Barbarawi O, Dhillon H, Swaid B, et al. (agosto de 2019). «Vitamin D Supplementation and Cardiovascular Disease Risks in More Than 83 000 Individuals in 21 Randomized Clinical Trials: A Meta-analysis». JAMA Cardiology. 4 (8): 765–776. PMC 6584896
 . PMID 31215980. doi:10.1001/jamacardio.2019.1870
. PMID 31215980. doi:10.1001/jamacardio.2019.1870 - ↑ Beveridge LA, Struthers AD, Khan F, Jorde R, Scragg R, Macdonald HM, et al. (maio de 2015). «Effect of Vitamin D Supplementation on Blood Pressure: A Systematic Review and Meta-analysis Incorporating Individual Patient Data». JAMA Internal Medicine. 175 (5): 745–54. PMC 5966296
 . PMID 25775274. doi:10.1001/jamainternmed.2015.0237
. PMID 25775274. doi:10.1001/jamainternmed.2015.0237 - ↑ Hewison M (2011). «Vitamin D and innate and adaptive immunity». Vitamins and the Immune System. Col: Vitamins & Hormones. 86. [S.l.: s.n.] pp. 23–62. ISBN 9780123869609. PMID 21419266. doi:10.1016/B978-0-12-386960-9.00002-2
- ↑ Bishop E, Ismailova A, Dimeloe SK, Hewison M, White JH (agosto de 2020). «Vitamin D and immune regulation: antibacterial, antiviral, anti-inflammatory». JBMR Plus. 5. PMC 7461279
 . PMID 32904944. doi:10.1002/jbm4.10405
. PMID 32904944. doi:10.1002/jbm4.10405 - ↑ Beard JA, Bearden A, Striker R (março de 2011). «Vitamin D and the anti-viral state». Journal of Clinical Virology. 50 (3): 194–200. PMC 3308600
 . PMID 21242105. doi:10.1016/j.jcv.2010.12.006
. PMID 21242105. doi:10.1016/j.jcv.2010.12.006 - ↑ Spector SA (2011). «Vitamin D and HIV: letting the sun shine in». Topics in Antiviral Medicine. 19 (1): 6–10. PMC 6148856
 . PMID 21852710
. PMID 21852710 - ↑ Bilezikian JP, Bikle D, Hewison M, Lazaretti-Castro M, Formenti AM, Gupta A, et al. (novembro de 2020). «MECHANISMS IN ENDOCRINOLOGY: Vitamin D and COVID-19». European Journal of Endocrinology. 183 (5): R133–R147. PMID 32755992. doi:10.1530/EJE-20-0665 1 Verifique
|doi=(ajuda) - ↑ Nnoaham KE, Clarke A (fevereiro de 2008). «Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis». International Journal of Epidemiology. 37 (1): 113–9. CiteSeerX 10.1.1.513.3969
 . PMID 18245055. doi:10.1093/ije/dym247
. PMID 18245055. doi:10.1093/ije/dym247 - ↑ Luong K, Nguyen LT (junho de 2011). «Impact of vitamin D in the treatment of tuberculosis». The American Journal of the Medical Sciences. 341 (6): 493–8. PMID 21289501. doi:10.1097/MAJ.0b013e3182070f47
- ↑ a b «SACN rapid review: Vitamin D and acute respiratory tract infections». GOV.UK (em inglês). Consultado em 6 de janeiro de 2021
- ↑ Jolliffe DA, Greenberg L, Hooper RL, Mathyssen C, Rafiq R, de Jongh RT, Camargo CA, Griffiths CJ, Janssens W, Martineau AR (abril de 2019). «Vitamin D to prevent exacerbations of COPD: systematic review and meta-analysis of individual participant data from randomised controlled trials». Thorax. 74 (4): 337–345. PMID 30630893. doi:10.1136/thoraxjnl-2018-212092
- ↑ Hart PH (junho de 2012). «Vitamin D supplementation, moderate sun exposure, and control of immune diseases». Discovery Medicine. 13 (73): 397–404. PMID 22742645
- ↑ Martineau AR, Cates CJ, Urashima M, Jensen M, Griffiths AP, Nurmatov U, et al. (setembro de 2016). «Vitamin D for the management of asthma». The Cochrane Database of Systematic Reviews. 9: CD011511. PMC 6457769
 . PMID 27595415. doi:10.1002/14651858.cd011511.pub2
. PMID 27595415. doi:10.1002/14651858.cd011511.pub2 - ↑ Paul G, Brehm JM, Alcorn JF, Holguín F, Aujla SJ, Celedón JC (janeiro de 2012). «Vitamin D and asthma». American Journal of Respiratory and Critical Care Medicine. 185 (2): 124–32. PMC 3297088
 . PMID 22016447. doi:10.1164/rccm.201108-1502CI
. PMID 22016447. doi:10.1164/rccm.201108-1502CI - ↑ Del Pinto R, Pietropaoli D, Chandar AK, Ferri C, Cominelli F (novembro de 2015). «Association Between Inflammatory Bowel Disease and Vitamin D Deficiency: A Systematic Review and Meta-analysis». Inflammatory Bowel Diseases. 21 (11): 2708–17. PMC 4615394
 . PMID 26348447. doi:10.1097/MIB.0000000000000546
. PMID 26348447. doi:10.1097/MIB.0000000000000546 - ↑ Guzman-Prado Y, Samson O, Segal JP, Limdi JK, Hayee B (maio de 2020). «Vitamin D Therapy in Adults With Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis». Inflammatory Bowel Diseases. 26 (12): 1819–1830. PMID 32385487. doi:10.1093/ibd/izaa087
- ↑ Seida JC, Mitri J, Colmers IN, Majumdar SR, Davidson MB, Edwards AL, et al. (outubro de 2014). «Clinical review: Effect of vitamin D3 supplementation on improving glucose homeostasis and preventing diabetes: a systematic review and meta-analysis». The Journal of Clinical Endocrinology and Metabolism (Review). 99 (10): 3551–60. PMC 4483466
 . PMID 25062463. doi:10.1210/jc.2014-2136
. PMID 25062463. doi:10.1210/jc.2014-2136 - ↑ Nakashima A, Yokoyama K, Yokoo T, Urashima M (março de 2016). «Role of vitamin D in diabetes mellitus and chronic kidney disease». World Journal of Diabetes (Review). 7 (5): 89–100. PMC 4781904
 . PMID 26981182. doi:10.4239/wjd.v7.i5.89
. PMID 26981182. doi:10.4239/wjd.v7.i5.89 - ↑ Khoshbakht, Yadollah; Bidaki, Reza; Salehi-Abargouei, Amin (2018). «Vitamin D Status and Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis of Observational Studies». Advances in Nutrition. 9 (1): 9–20. PMC 6333940
 . PMID 29438455. doi:10.1093/advances/nmx002
. PMID 29438455. doi:10.1093/advances/nmx002 - ↑ Jing Gan, Peter Galer 3, Dan Ma, Chao Chen, Tao Xiong (novembro de 2019). «The Effect of Vitamin D Supplementation on Attention-Deficit/Hyperactivity Disorder: A Systematic Review and Meta-Analysis of Randomized Controlled Trials». J Child Adolesc Psychopharmacol. 29 (9): 670–687. PMID 31368773. doi:10.1089/cap.2019.0059
- ↑ Shaffer JA, Edmondson D, Wasson LT, Falzon L, Homma K, Ezeokoli N, et al. (abril de 2014). «Vitamin D supplementation for depressive symptoms: a systematic review and meta-analysis of randomized controlled trials». Psychosomatic Medicine. 76 (3): 190–6. PMC 4008710
 . PMID 24632894. doi:10.1097/psy.0000000000000044
. PMID 24632894. doi:10.1097/psy.0000000000000044 - ↑ Balion C, Griffith LE, Strifler L, Henderson M, Patterson C, Heckman G, et al. (setembro de 2012). «Vitamin D, cognition, and dementia: a systematic review and meta-analysis». Neurology. 79 (13): 1397–405. PMC 3448747
 . PMID 23008220. doi:10.1212/WNL.0b013e31826c197f
. PMID 23008220. doi:10.1212/WNL.0b013e31826c197f - ↑ a b Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O'Beirne M, Rabi DM (março de 2013). «Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies». BMJ. 346: f1169. PMID 23533188. doi:10.1136/bmj.f1169
- ↑ a b Palacios C, De-Regil LM, Lombardo LK, Peña-Rosas JP (novembro de 2016). «Vitamin D supplementation during pregnancy: Updated meta-analysis on maternal outcomes». The Journal of Steroid Biochemistry and Molecular Biology. 164: 148–155. PMC 5357731
 . PMID 26877200. doi:10.1016/j.jsbmb.2016.02.008
. PMID 26877200. doi:10.1016/j.jsbmb.2016.02.008 - ↑ Roth DE, Leung M, Mesfin E, Qamar H, Watterworth J, Papp E (novembro de 2017). «Vitamin D supplementation during pregnancy: state of the evidence from a systematic review of randomised trials». BMJ. 359: j5237. PMC 5706533
 . PMID 29187358. doi:10.1136/bmj.j5237
. PMID 29187358. doi:10.1136/bmj.j5237 - ↑ a b Palacios C, KostUIk LK, Peña-Rosas JP (julho de 2019). «Vitamin D supplementation for women during pregnancy». The Cochrane Database of Systematic Reviews. 7: CD008873. PMC 3747784
 . PMID 31348529. doi:10.1002/14651858.CD008873.pub4
. PMID 31348529. doi:10.1002/14651858.CD008873.pub4 - ↑ a b Wagner CL, Taylor SN, Dawodu A, Johnson DD, Hollis BW (março de 2012). «Vitamin D and its role during pregnancy in attaining optimal health of mother and fetus». Nutrients. 4 (3): 208–30. PMC 3347028
 . PMID 22666547. doi:10.3390/nu4030208
. PMID 22666547. doi:10.3390/nu4030208 - ↑ Bi WG, Nuyt AM, Weiler H, Leduc L, Santamaria C, Wei SQ (julho de 2018). «Association Between Vitamin D Supplementation During Pregnancy and Offspring Growth, Morbidity, and Mortality: A Systematic Review and Meta-analysis». JAMA Pediatrics. 172 (7): 635–645. PMC 6137512
 . PMID 29813153. doi:10.1001/jamapediatrics.2018.0302
. PMID 29813153. doi:10.1001/jamapediatrics.2018.0302 - ↑ Pathak K, Soares MJ, Calton EK, Zhao Y, Hallett J (junho de 2014). «Vitamin D supplementation and body weight status: a systematic review and meta-analysis of randomized controlled trials». Obesity Reviews. 15 (6): 528–37. PMID 24528624. doi:10.1111/obr.12162
- ↑ Mallard SR, Howe AS, Houghton LA (outubro de 2016). «Vitamin D status and weight loss: a systematic review and meta-analysis of randomized and nonrandomized controlled weight-loss trials». The American Journal of Clinical Nutrition. 104 (4): 1151–1159. PMID 27604772. doi:10.3945/ajcn.116.136879
- ↑ a b c European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies (NDA) (2010). «Scientific opinion on the substantiation of health claims related to vitamin D and normal function of the immune system and inflammatory response (ID 154, 159), maintenance of normal muscle function (ID 155) and maintenance of normal cardiovascular function (ID 159) pursuant to Article 13(1) of Regulation (EC) No 1924/2006». EFSA Journal. 8 (2): 1468–85. doi:10.2903/j.efsa.2010.1468
- ↑ European Food Safety Authority (EFSA) Panel on Dietetic Products, Nutrition and Allergies (NDA) (2011). «Scientific opinion on the substantiation of a health claim related to vitamin D and risk of falling pursuant to Article 14 of Regulation (EC) No 1924/2006» (PDF). EFSA Journal. 9 (9): 2382–2400. doi:10.2903/j.efsa.2011.2382
- ↑ «Guidance for Industry: Food Labeling Guide». Food and Drug Administration (FDA). Janeiro de 2013
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «Health Canada Scientific Summary on the U. S. Health Claim Regarding calcium and Osteoporosis». Bureau of Nutritional Sciences Food Directorate, Health Products and Food Branch Health Canada. 1 de maio de 2000
- ↑ «Regulatory Systems of Health Claims in Japan» (PDF). Japan Consumer Affairs Agency, Food Labelling Division. 1 de junho de 2011. Consultado em 29 de janeiro de 2012. Arquivado do original (PDF) em 6 de março de 2012
- ↑ «Vitamin D». Nutrient Reference Values for Australia and New Zealand. Australian Ministry of Health. 9 de setembro de 2005. Arquivado do original em 27 de fevereiro de 2012
- ↑ a b c d «Vitamins and minerals – Vitamin D». National Health Service. 3 de agosto de 2020. Consultado em 15 de novembro de 2020
- ↑ a b c «Vitamin D and calcium: Updated Dietary Reference Intakes». Nutrition and Healthy Eating. Health Canada. 5 de dezembro de 2008. Consultado em 28 de abril de 2018
- ↑ a b c «Nutrient reference values for Australia and New Zealand» (PDF). National Health and Medical Research Council. 9 de setembro de 2005. Consultado em 28 de abril de 2018. Arquivado do original (PDF) em 21 de janeiro de 2017
- ↑ a b c d EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (29 de junho de 2016). «Dietary reference values for vitamin D». EFSA Journal. 14 (10): e04547. doi:10.2903/j.efsa.2016.4547
- ↑ a b EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (2012). «Scientific Opinion on the Tolerable Upper Intake Level of vitamin D». EFSA Journal (Submitted manuscript). 10 (7). 2813 páginas. doi:10.2903/j.efsa.2012.2813
- ↑ «PHE publishes new advice on vitamin D». Public Health England. 21 de julho de 2016. Consultado em 15 de novembro de 2020
- ↑ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982.» (PDF). Consultado em 20 de agosto de 2019
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Consultado em 16 de maio de 2020
- ↑ «Industry Resources on the Changes to the Nutrition Facts Label». U.S. Food and Drug Administration (FDA). 21 de dezembro de 2018. Consultado em 16 de maio de 2020
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ Salleh A (12 de junho de 2012). «Vitamin D food fortification on the table». Australian Broadcasting Corporation
- ↑ «Vitamin D (translated)» (em sueco). Swedish National Food Agency. Consultado em 19 de outubro de 2018
- ↑ Vitamin-D-Bedarf bei fehlender endogener Synthese Deutsche Gesellschaft für Ernährung, January 2012
- ↑ Pérez-López FR, Brincat M, Erel CT, Tremollieres F, Gambacciani M, Lambrinoudaki I, et al. (janeiro de 2012). «EMAS position statement: Vitamin D and postmenopausal health». Maturitas. 71 (1): 83–8. PMID 22100145. doi:10.1016/j.maturitas.2011.11.002
- ↑ Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes (1997). DRI, Dietary reference intakes: for calcium, phosphorus, magnesUIm, vitamin D, and fluoride. Washington, D.C: National Academy Press. 250 páginas. ISBN 978-0-309-06350-0. PMID 23115811. doi:10.17226/5776
- ↑ «Search, National Nutrient Database for Standard Reference Release 27». US Department of Agriculture, Agricultural Research Service. 2014. Consultado em 12 de junho de 2015
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ a b Wang T, Bengtsson G, Kärnefelt I, Björn LO (setembro de 2001). «Provitamins and vitamins D₂and D₃in Cladina spp. over a latitudinal gradient: possible correlation with UV levels». Journal of Photochemistry and Photobiology. B, Biology (Submitted manuscript). 62 (1–2): 118–22. PMID 11693362. doi:10.1016/S1011-1344(01)00160-9
- ↑ Schmid A, Walther B (julho de 2013). «Natural vitamin D content in animal products». Advances in Nutrition. 4 (4): 453–62. PMC 3941824
 . PMID 23858093. doi:10.3945/an.113.003780
. PMID 23858093. doi:10.3945/an.113.003780 - ↑ a b c d e f Keegan RJ, Lu Z, Bogusz JM, Williams JE, Holick MF (janeiro de 2013). «Photobiology of vitamin D in mushrooms and its bioavailability in humans». Dermato-Endocrinology. 5 (1): 165–76. PMC 3897585
 . PMID 24494050. doi:10.4161/derm.23321
. PMID 24494050. doi:10.4161/derm.23321 - ↑ Haytowitz DB (2009). «Vitamin D in mushrooms» (PDF). Nutrient Data Laboratory, US Department of Agriculture. Consultado em 16 de abril de 2018
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ de Lourdes Samaniego-Vaesken M, Alonso-Aperte E, Varela-Moreiras G (2012). «Vitamin food fortification today». Food & Nutrition Research. 56. 5459 páginas. PMC 3319130
 . PMID 22481896. doi:10.3402/fnr.v56i0.5459
. PMID 22481896. doi:10.3402/fnr.v56i0.5459 - ↑ Spiro A, Buttriss JL (dezembro de 2014). «Vitamin D: An overview of vitamin D status and intake in Europe». Nutrition Bulletin. 39 (4): 322–350. PMC 4288313
 . PMID 25635171. doi:10.1111/nbu.12108
. PMID 25635171. doi:10.1111/nbu.12108 - ↑ «Vitamin D for Milk and Milk Alternatives». Food and Drug Administration (FDA). 15 de julho de 2016. Consultado em 22 de fevereiro de 2017
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «Federal Register: Food Additives Permitted for Direct Addition to Food for Human Consumption; Vitamin D2». Food and Drug Administration, US Department of Health and Human Services. 18 de julho de 2016. Consultado em 22 de fevereiro de 2017
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «§172.379 Vitamin D2». Electronic Code of Federal Regulations. Consultado em 16 de julho de 2019
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «§172.380 Vitamin D3». Electronic Code of Federal Regulations. Consultado em 16 de julho de 2019
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ «Dairy Milk alternatives». nutritionrefined. 9 de agosto de 2019
- ↑ «Alternative to dairy milk». osoblanco. 16 de janeiro de 2020
- ↑ Tripkovic L (2013). «Vitamin D2 vs. vitamin D3: Are they one and the same?». Nutrition Bulletin. 38 (2): 243–248. doi:10.1111/nbu.12029
- ↑ Alshahrani F, Aljohani N (setembro de 2013). «Vitamin D: deficiency, sufficiency and toxicity». Nutrients. 5 (9): 3605–16. PMC 3798924
 . PMID 24067388. doi:10.3390/nu5093605
. PMID 24067388. doi:10.3390/nu5093605 - ↑ Biancuzzo RM, Clarke N, Reitz RE, Travison TG, Holick MF (março de 2013). «Serum concentrations of 1,25-dihydroxyvitamin D2 and 1,25-dihydroxyvitamin D3 in response to vitamin D2 and vitamin D3 supplementation». The Journal of Clinical Endocrinology and Metabolism. 98 (3): 973–9. PMC 3590486
 . PMID 23386645. doi:10.1210/jc.2012-2114
. PMID 23386645. doi:10.1210/jc.2012-2114 - ↑ Borel P, Caillaud D, Cano NJ (2015). «Vitamin D bioavailability: state of the art» (PDF). Critical Reviews in Food Science and Nutrition. 55 (9): 1193–205. PMID 24915331. doi:10.1080/10408398.2012.688897
- ↑ Jakobsen J, Knuthsen P (abril de 2014). «Stability of vitamin D in foodstuffs during cooking». Food Chemistry. 148: 170–5. PMID 24262542. doi:10.1016/j.foodchem.2013.10.043
- ↑ Wahl DA, Cooper C, Ebeling PR, Eggersdorfer M, Hilger J, Hoffmann K, et al. (29 de agosto de 2012). 5 «A global representation of vitamin D status in healthy populations» Verifique valor
|url=(ajuda) (PDF). Archives of Osteoporosis. 7 (1–2): 155–72. PMID 23225293. doi:10.1007/s11657-012-0093-0. hdl:11343/220606 - ↑ Wahl DA, Cooper C, Ebeling PR, Eggersdorfer M, Hilger J, Hoffmann K, et al. (1 de fevereiro de 2013). «A global representation of vitamin D status in healthy populations: reply to comment by Saadi». Archives of Osteoporosis. 8 (1–2). 122 páginas. PMID 23371520. doi:10.1007/s11657-013-0122-7
- ↑ a b «25(OH)D levels in ng/mL». health harvard edu/. 19 de dezembro de 2016
- ↑ «nmol converter». endmemo
- ↑ Bischoff-Ferrari HA (2014). «Optimal serum 25-hydroxyvitamin D levels for multiple health outcomes». Sunlight, Vitamin D and Skin Cancer. Advances in Experimental Medicine and Biology (Review). 810. [S.l.: s.n.] pp. 500–25. ISBN 978-0-387-77573-9. PMID 25207384. doi:10.1007/978-0-387-77574-6_5
- ↑ a b Dahlquist DT, Dieter BP, Koehle MS (2015). «Plausible ergogenic effects of vitamin D on athletic performance and recovery». Journal of the International Society of Sports Nutrition (Review). 12. 33 páginas. PMC 4539891
 . PMID 26288575. doi:10.1186/s12970-015-0093-8
. PMID 26288575. doi:10.1186/s12970-015-0093-8 - ↑ Engelman CD, Fingerlin TE, Langefeld CD, Hicks PJ, Rich SS, Wagenknecht LE, et al. (setembro de 2008). «Genetic and environmental determinants of 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D levels in Hispanic and African Americans». The Journal of Clinical Endocrinology and Metabolism. 93 (9): 3381–8. PMC 2567851
 . PMID 18593774. doi:10.1210/jc.2007-2702
. PMID 18593774. doi:10.1210/jc.2007-2702 - ↑ Wang L, Song Y, Manson JE, Pilz S, März W, Michaëlsson K, et al. (novembro de 2012). «Circulating 25-hydroxy-vitamin D and risk of cardiovascular disease: a meta-analysis of prospective studies». Circulation: Cardiovascular Quality and Outcomes. 5 (6): 819–29. PMC 3510675
 . PMID 23149428. doi:10.1161/CIRCOUTCOMES.112.967604
. PMID 23149428. doi:10.1161/CIRCOUTCOMES.112.967604 - ↑ a b Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. (janeiro de 2011). «The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know». The Journal of Clinical Endocrinology and Metabolism. 96 (1): 53–8. PMC 3046611
 . PMID 21118827. doi:10.1210/jc.2010-2704
. PMID 21118827. doi:10.1210/jc.2010-2704 - ↑ a b c Vitamin D na edição profissional do Manual Merck de Diagnóstico e Terapia
- ↑ a b c d Vieth R (maio de 1999). «Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety» (PDF). The American Journal of Clinical Nutrition. 69 (5): 842–56. PMID 10232622. doi:10.1093/ajcn/69.5.842
- ↑ Tolerable Upper Intake Limits for Vitamins And Minerals (PDF). [S.l.]: European Food Safety Authority. Dezembro de 2006. ISBN 978-92-9199-014-6
- ↑ Schlingmann KP, Kaufmann M, Weber S, Irwin A, Goos C, John U, et al. (agosto de 2011). «Mutations in CYP24A1 and idiopathic infantile hypercalcemia». The New England Journal of Medicine. 365 (5): 410–21. PMID 21675912. doi:10.1056/NEJMoa1103864
- ↑ De Paolis E, Scaglione GL, De Bonis M, Minucci A, Capoluongo E (outubro de 2019). «CYP24A1 and SLC34A1 genetic defects associated with idiopathic infantile hypercalcemia: from genotype to phenotype». Clinical Chemistry and Laboratory Medicine. 57 (11): 1650–1667. PMID 31188746. doi:10.1515/cclm-2018-1208
- ↑ Tebben PJ, Singh RJ, Kumar R (outubro de 2016). «Vitamin D-Mediated Hypercalcemia: Mechanisms, Diagnosis, and Treatment». Endocrine Reviews. 37 (5): 521–547. PMC 5045493
 . PMID 27588937. doi:10.1210/er.2016-1070
. PMID 27588937. doi:10.1210/er.2016-1070 - ↑ «FDA Cautions on Accurate Vitamin D Supplementation for Infants» (Nota de imprensa). Food and Drug Administration (FDA). 15 de junho de 2010. Arquivado do original em 12 de janeiro de 2017
 Este artigo incorpora texto desta fonte, que está no domínio público.
Este artigo incorpora texto desta fonte, que está no domínio público. - ↑ Olmos-Ortiz A, Avila E, Durand-Carbajal M, Díaz L (janeiro de 2015). «Regulation of calcitriol biosynthesis and activity: focus on gestational vitamin D deficiency and adverse pregnancy outcomes». Nutrients. 7 (1): 443–80. PMC 4303849
 . PMID 25584965. doi:10.3390/nu7010443
. PMID 25584965. doi:10.3390/nu7010443 - ↑ a b Holick MF (1992). «Evolutionary biology and pathology of vitamin D». Journal of Nutritional Science and Vitaminology. Spec No: 79–83. PMID 1297827. doi:10.3177/jnsv.38.Special_79
- ↑ Holick MF (abril de 1987). «Photosynthesis of vitamin D in the skin: effect of environmental and life-style variables». Federation Proceedings. 46 (5): 1876–82. PMID 3030826
- ↑ Deluca HF (janeiro de 2014). «History of the discovery of vitamin D and its active metabolites». BoneKEy Reports. 3. 479 páginas. PMC 3899558
 . PMID 24466410. doi:10.1038/bonekey.2013.213
. PMID 24466410. doi:10.1038/bonekey.2013.213 - ↑ a b Holick MF (março de 2004). «Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis». The American Journal of Clinical Nutrition. 79 (3): 362–71. PMID 14985208. doi:10.1093/ajcn/79.3.362
- ↑ Eyley, Stephen C.; Williams, Dudley H. (1975). «Photolytic production of vitamin D. The preparative value of a photo-sensitiser». Journal of the Chemical Society, Chemical Communications (20): 858a. doi:10.1039/C3975000858A
- ↑ Crissey SD, Ange KD, Jacobsen KL, Slifka KA, Bowen PE, Stacewicz-Sapuntzakis M, et al. (janeiro de 2003). «Serum concentrations of lipids, vitamin d metabolites, retinol, retinyl esters, tocopherols and selected carotenoids in twelve captive wild felid species at four zoos». The Journal of Nutrition. 133 (1): 160–6. PMID 12514284. doi:10.1093/jn/133.1.160
- ↑ Holick MF (2018). «Chapter 4: Photobiology of Vitamin D». In: Feldman D, Pike JW, Bouillon R, Giovannucci E, Goltzman D, Hewison M. Vitamin D: Volume 1: Biochemistry, Physiology and Diagnostics 4th ed. London, UK: Academic Press. ISBN 978-0-12-809965-0
- ↑ Holick, MF (2020). «Sunlight, UV Radiation, Vitamin D, and Skin Cancer: How Much Sunlight Do We Need?». Advances in Experimental Medicine and Biology. 1268: 19–36. ISBN 978-3-030-46226-0. PMID 32918212. doi:10.1007/978-3-030-46227-7_2.
108 references
- ↑ Holick MF (fevereiro de 2002). «Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health». Current Opinion in Endocrinology, Diabetes and Obesity. 9 (1): 87–98. doi:10.1097/00060793-200202000-00011
- ↑ Bikle, DD (março de 2010). «Vitamin D and the skin.». Journal of Bone and Mineral Metabolism. 28 (2): 117–30. PMID 20107849. doi:10.1007/s00774-009-0153-8
- ↑ Holick, Michael F. (1 de abril de 2010). The Vitamin D Solution: A 3-Step Strategy to Cure Our Most Common Health Problems. [S.l.]: Penguin Publishing Group. ISBN 978-1-101-22293-5
- ↑ Agarwal, Sabrina C.; Stout, Samuel D. (28 de junho de 2011). Bone Loss and Osteoporosis: An Anthropological Perspective. [S.l.]: Springer Science & Business Media. ISBN 978-1-4419-8891-1. Cópia arquivada (PDF) em 29 de janeiro de 2006.
The high 25(OH)D concentrations, and relatively high vitamin D requirements of apes and monkeys are understandable in light of their biology—their body surface area relative to mass is generally greater than for humans, and they are inveterate groomers, consuming by mouth the vitamin D generated from the oils secreted by skin into fur. Although much of the vitamin D produced within human skin is absorbed directly, birds and furbearing animals acquire most of their vitamin D orally, as they groom themselves (Bicknell and Prescott, 1946; Carpenter and Zhao, 1999). Vitamin D is generated from the oily secretions of skin into fur. The oral consumption of UV-exposed dermal excretion is the way many animals acquire the "nutrient," vitamin D. Although Fraser (1983) has argued that dermal absorption of vitamin D may be more natural, what we know from animals indicates that oral consumption is equally physiological. Since vitamin D can be extracted from UV-exposed human sweat and skin secretions (Bicknell and Prescott, 1946), it is also reasonable to think that early humans obtained some of their vitamin D by mouth as well, by licking the skin.
- ↑ Yahav S, Buffenstein R (janeiro de 1993). «Cholecalciferol supplementation alters gut function and improves digestibility in an underground inhabitant, the naked mole rat (Heterocephalus glaber), when fed on a carrot diet». The British Journal of Nutrition. 69 (1): 233–41. PMID 8384476. doi:10.1079/BJN19930025
- ↑ Zafalon, Rafael V. A.; Risolia, Larissa W.; Pedrinelli, Vivian; Vendramini, Thiago H. A.; Rodrigues, Roberta B. A.; Amaral, Andressa R.; Kogika, Marcia M.; Brunetto, Marcio A. (janeiro de 2020). «Vitamin D metabolism in dogs and cats and its relation to diseases not associated with bone metabolism». Journal of Animal Physiology and Animal Nutrition. 104 (1): 322–342. PMID 31803981. doi:10.1111/jpn.13259
- ↑ a b Holick MF (novembro de 2005). «The vitamin D epidemic and its health consequences» (PDF). The Journal of Nutrition. 135 (11): 2739S–48S. PMID 16251641. doi:10.1093/jn/135.11.2739S.
[Vitamin D3] is produced commercially by extracting 7-dehydrocholesterol from wool fat, followed by UVB irradiation and purification [...] [Vitamin D2] is commercially made by irradiating and then purifying the ergosterol extracted from yeast
- ↑ Takeuchi A, Okano T, Sayamoto M, Sawamura S, Kobayashi T, Motosugi M, Yamakawa T (fevereiro de 1986). «Tissue distribution of 7-dehydrocholesterol, vitamin D3 and 25-hydroxyvitamin D3 in several species of fishes». Journal of Nutritional Science and Vitaminology. 32 (1): 13–22. PMID 3012050. doi:10.3177/jnsv.32.13
- ↑ a b c d Adams JS, Hewison M (fevereiro de 2010). «Update in vitamin D». The Journal of Clinical Endocrinology and Metabolism. 95 (2): 471–8. PMC 2840860
 . PMID 20133466. doi:10.1210/jc.2009-1773
. PMID 20133466. doi:10.1210/jc.2009-1773 - ↑ Cheng JB, Levine MA, Bell NH, Mangelsdorf DJ, Russell DW (maio de 2004). «Genetic evidence that the human CYP2R1 enzyme is a key vitamin D 25-hydroxylase». Proceedings of the National Academy of Sciences of the United States of America. 101 (20): 7711–5. Bibcode:2004PNAS..101.7711C. PMC 419671
 . PMID 15128933. doi:10.1073/pnas.0402490101
. PMID 15128933. doi:10.1073/pnas.0402490101 - ↑ Laing CJ, Cooke NE (2004). «Section I: Ch. 8: Vitamin D Binding Protein». In: Feldman D, Glorieux FH, Pike JW. Vitamin D. 1 2 ed. [S.l.]: Academic Press. pp. 117–134. ISBN 978-0122526879
- ↑ Holick MF, Kleiner-Bossaller A, Schnoes HK, Kasten PM, Boyle IT, DeLuca HF (outubro de 1973). «1,24,25-Trihydroxyvitamin D3. A metabolite of vitamin D3 effective on intestine». The Journal of Biological Chemistry. 248 (19): 6691–6. PMID 4355503. doi:10.1016/S0021-9258(19)43408-X
- ↑ Horst RL, Reinhardt TA, Ramberg CF, Koszewski NJ, Napoli JL (julho de 1986). «24-Hydroxylation of 1,25-dihydroxyergocalciferol. An unambiguous deactivation process». The Journal of Biological Chemistry. 261 (20): 9250–6. PMID 3013880. doi:10.1016/S0021-9258(18)67647-1
- ↑ Carere, Suzanne (25 de julho de 2007). «Age-old children's disease back in force». Toronto Star. Consultado em 24 de agosto de 2010. Arquivado do original em 17 de maio de 2008
- ↑ McClean FC, Budy AM (28 de janeiro de 1964). «Vitamin A, Vitamin D, Cartilage, Bones, and Teeth». Vitamins and Hormones. 21. [S.l.]: Academic Press. pp. 51–52. ISBN 978-0-12-709821-0
- ↑ «History of Vitamin D». University of California at Riverside. 2011. Consultado em 9 de maio de 2014. Arquivado do original em 16 de outubro de 2017
- ↑ «Adolf Windaus – Biography». Nobelprize.org. 25 de março de 2010. Consultado em 25 de março de 2010
- ↑ Rosenheim O, King H (1932). «The Ring-system of sterols and bile acids. Part II». J. Chem. Technol. Biotechnol. 51 (47): 954–7. doi:10.1002/jctb.5000514702
- ↑ Askew FA, Bourdillon RB, Bruce HM, Callow RK, St. L. Philpot J, Webster TA (1932). «Crystalline Vitamin D». Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. 109 (764): 488–506. JSTOR 81571. doi:10.1098/rspb.1932.0008
- ↑ Hirsch AL (2011). «Industrial aspects of vitamin D». In: Feldman DJ, Pike JW, Adams JS. Vitamin D. [S.l.]: Academic Press. 73 páginas. ISBN 978-0-12-387035-3
- ↑ Ziedonis AA, Mowery DC, Nelson RR, Bhaven NS (2004). Ivory tower and industrial innovation: university-industry technology transfer before and after the Bayh-Dole Act in the United States. [S.l.]: Stanford Business Books. pp. 39–40. ISBN 978-0-8047-4920-6
- ↑ Marshall, James (setembro de 2010). Elbridge a Stuart: Founder of Carnation Company. [S.l.]: Kessinger Publishing. ISBN 978-1-164-49678-6
- ↑ Haussler MR, Norman AW (janeiro de 1969). «Chromosomal receptor for a vitamin D metabolite». Proceedings of the National Academy of Sciences of the United States of America. 62 (1): 155–62. Bibcode:1969PNAS...62..155H. PMC 285968
 . PMID 5253652. doi:10.1073/pnas.62.1.155 <
. PMID 5253652. doi:10.1073/pnas.62.1.155 <


 French
French Deutsch
Deutsch
