Fotoquímica – Wikipédia, a enciclopédia livre

Fotoquímica ou actinoquímica é um ramo da química que estuda as interações de átomos e pequenas moléculas com a luz (ou radiação eletromagnética).[1] Alguns processos importantes relacionados com a fotoquímica são a fotossíntese, fotólise, fotografia e fotofosforilação.
Alguns campos de aplicação e estudo deste campo científico são a espectroscopia UV/visível, as reações fotoquímicas em química orgânica e diversos processos bioquímicos, como a já citada fotossíntese, a produção de melanina humana e a relacionada produção de filtros solares eficientes.
Bases científicas[editar | editar código-fonte]
Como muitos campos científicos, a fotoquímica utiliza o sistema de medidas métrico ou SI. Unidades e constantes importantes que apresentam-se regularmente incluem o metro (e variantes tais como o centímetro, milímetro, nanometro, etc), segundos, hertz, joules, moles, a constante dos gases R, e a constante de Boltzmann. Estas unidades e constantes são também relacionadas ao campo da físico-química.
Fotoquímica pode também ser apresentada didaticamente como uma reação em que ocorre a absorção de luz. Normalmente uma reação (não somente uma reação fotoquímica) ocorre quando uma molécula ganha a energia de ativação necessária para iniciar as transformações químicas. Um simples exemplo poderia ser a combustão de gasolina (um hidrocarboneto) em dióxido de carbono e água. Esta é uma reação química onde uma ou mais moléculas/espécies químicas são convertidas em outras. Para esta reação ocorrer, a energia de ativação deve ser fornecida na forma de calor ou de uma faísca. No caso das reações fotoquímicas, a luz é o mecanismo que fornece a energia de ativação.
A primeira lei da fotoquímica, conhecida como lei de Grotthuss–Draper (formulada pelos químicos Theodor Grotthuss e John W. Draper), estabelece que a luz deve ser absorvida por uma substância química para produzir uma reação fotoquímica.[2]
A lei de Beer-Lambert estabelece que há uma relação exponencial entre a fração de radiação absorvida por uma substância e a concentração da substância, e que esta fração de radiação absorvida é independende da intensidade da radiação incidente.[3]
A segunda lei da fotoquímica, a lei de Stark-Einstein, estabelece que para cada fóton de luz absorvido por um sistema químico, somente uma molécula é ativada em uma reação fotoquímica. Isto é também conhecido como a lei de fotoequivalência e foi derivada por Albert Einstein no tempo em que a teoria quântica (dos fótons) de luz estava sendo desenvolvida.[2]
A absorção de um fóton de luz pela molécula de reagente resulta em um estado cuja energia é maior do que a energia inicial, conhecido como estado excitado. A perda do excesso de energia absorvida pode ocorrer por emissão do estado excitado singlete (fluorescência), por emissão do estado excitado triplete (fosforescência), por um processo de relaxação não radiativo ou por uma reação química.[4] A intensidade de uma transição eletrônica é regida pelo princípio de Franck–Condon.[5] O princípio institui que durante uma transição eletrônica, a probabilidade de ocorrer uma mudança de um nível de energia vibracional para outro será maior se as duas funções de onda coincidirem significativamente.[6][7]
A regra de Kasha estabelece que a emissão do fóton (fluorescência ou fosforescência) por uma molécula eletronicamente excitada somente ocorre com rendimentos quânticos apreciáveis a partir do estado excitado de menor energia de uma dada multiplicidade. Esta regra foi proposta pelo físico-químico e espectroscopista molecular americano Michael Kasha em 1950.[8][9] Um corolário da regra de Kasha é a regra de Kasha–Vavilov, que estabelece que o rendimento quântico de luminescência é em geral independente do comprimento de onda de excitação.[10]
A eficiência dos vários processos mencionados acima pode ser medida através de rendimentos quânticos ou eficiências quânticas, que descrevem a fração de moléculas retidas em cada etapa em relação ao total de fótons absorvidos.[2] A soma dos rendimentos quânticos é 1 (exceto para reações em cadeia).[11]
Adicionalmente, a absorção do fóton pode permitir que ocorra uma reação não apenas fornecendo a energia de ativação necessária, mas também alterando a simetria da configuração eletrônica molecular e permitindo um caminho de reação outrora inacessível, conforme descrito pelas regras de seleção de Woodward-Hoffmann.[12] Uma reação de cicloadição 2+2 é um exemplo de reação pericíclica que pode ser analisada utilizando tais regras ou pela teoria dos orbitais moleculares de fronteira, também relacionada.
Reações fotoquímicas envolvem a reorganização eletrônica iniciada pela radiação eletromagnética e são muitas ordens de magnitude mais rápidas que as reações térmicas. Frequentemente são observadas reações da ordem de 10−9 segundos e processos na faixa de 10−15 segundos.
Regiões espectrais[editar | editar código-fonte]
O espectro eletromagnético é amplo e os fotoquímicos tipicamente trabalham em apenas algumas regiões-chave. Algumas das seções mais amplamente usadas, e seus comprimentos de onda, são as seguintes:
- Ultravioleta: 100–400 nm
- Luz visível: 400–700 nm
- Infravermelho próximo: 700–2500 nm
- Infravermelho médio: 2500 - 25000 nm
- Infravermelho distante: 25–1000 nm
Aplicações[editar | editar código-fonte]
Muitos processos químicos importantes envolvem fotoquímica. Um exemplo é a fotossíntese, na qual algumas plantas utilizam a luz solar para converterem dióxido de carbono e água em glicose e oxigênio no interior dos cloroplastos, contribuindo no metabolismo celular. A glicose é usada pela mitocôndria na produção de adenosina trifosfato. Os humanos dependem da fotoquímica para a formação da vitamina D. Em vaga-lumes, as enzimas localizadas no abdomem do inseto produzem bioluminescência. A visão é iniciada pela reação fotoquímica da rodopsina.[13]
Processos fotoquímicos também podem ser altamente destrutivos, provocando a degradação de materiais como o cloreto de polivinila (PVC).[14] Os frascos de remédio são feitos com vidro escurecido (vidro âmbar) para evitar que o fármaco contido sofra algum processo fotoquímico. Uma reação bastante conhecida é a geração de oxigênio singlete a partir da reação de fotossensibilização do oxigênio triplete. Fotossensibilizadores típicos incluem a tetrafenilporfirina e o azul de metileno. O oxigênio singlete resultante é um agente oxidande extremamente agressivo, capaz de converter ligações C-H em grupos C-OH. Na terapia fotodinâmica, a luz é empregada para destruir tumores pela ação do oxigênio singlete.
Os tióis ou mercaptanas são produzidas pela adição fotoquímica de sulfeto de hidrogênio (H2S) em olefinas. Uma das aplicações das mercaptanas é fornecer um odor perceptível ao gás natural (inodoro), garantindo que um vazamento de gás seja rapidamente identificado. Muitas polimerizações são iniciadas por fotoiniciadores, os quais decompoem por absorção de luz e produzem os radicais livres necessários à polimerização radicalar. Alguns caminhos de reação fotoquímicos permitem a síntese de certas classes de compostos, como os ciclobutanos (compostos estereoespecíficos), os quais não são facilmente (em alguns casos são quase impossíveis) de serem preparados utilizando rotas de síntese orgânica convencionais.
Montagem experimental[editar | editar código-fonte]

Reações fotoquímicas necessitam de uma fonte de luz que emita no comprimento de onda correspondente à transição eletrônica do reagente. Nos estudos seminais (e na vida cotidiana) a luz solar era a fonte luminosa empregada, apesar de ser uma fonte policromática. Atualmente, lâmpadas de vapor de mercúrio são as de uso mais corriqueiro no laboratório. As lâmpadas de vapor de mercúrio de baixa pressão emitem em 254 nm. Outras fontes monocromáticas são LEDs e lasers. Para fontes policromáticas, comprimentos de onda específicos podem ser selecionados através de filtros.
A luz emitida deve chegar ao grupo funcional em questão sem ser bloqueada pelo reator, meio reacional ou outros grupos funcionais presentes. Em muitas aplicações, o quartzo é empregado tanto em reatores como no recipiente que contem a lâmpada, por absorver apenas em comprimentos de onda abaixo dos 200 nm. O vidro Pirex absorve em comprimentos de onda inferiores a 275 nm.
O solvente escolhido é um parâmetro experimental importante por ser um reagente em potencial. Consequentemente, a utilização de solventes clorados é evitada, pois a ligação C-Cl pode levar à cloração do substrato. Solventes que eventualmente absorvam a radiação podem evitar que os fótons cheguem ao reagente. Os hidrocarbonetos absorvem apenas em comprimentos de onda curtos e são então preferidos em experimentos fotoquímicos que necessitem de fótons com alta energia. Solventes que contenham ligações insaturadas absorvem em comprimentos de onda mais longos e são úteis para filtrar os comprimentos de onda curtos. Por exemplo, ciclohexano e acetona "cortam" (absorvem fortemente) comprimentos de onda menores que 215 e 330 nm, respectivamente.
Excitação[editar | editar código-fonte]
A fotoexcitação é o primeiro passo em um processo fotoquímico, onde o reagente é levado ao estado excitado. O fóton pode ser absorvido diretamente pelo reagente ou por um fotossensibilizador, que absorve o fóton e transfere a energia para o reagente. O processo oposto, conhecido como supressão, é quando um estado fotoexcitado é desativado por um reagente químico.
A maioria das transformações fotoquímicas ocorre através de uma série de etapas simples, conhecidas como processos fotoquímicos primários.[15] Um exemplo destes processos é a transferência de prótons no estado excitado (ESPT).
Fotoquímica Orgânica[editar | editar código-fonte]
Muitas reações importantes de alcenos ocorrem via transição π-π* fotoinduzida. O primeiro estado eletrônico excitado de um alceno carece da ligação π, de modo que a rotação em torno da ligação C-C é facilitada e a molécula pode seguir por reações não observadas termicamente. Estas reações incluem isomerização cis-trans, cicloadição a outro alceno (no estado fundamental) resultando em derivados do ciclobutano. A isomerização cis-trans de um (poli)alceno ocorre na retina, um dos componentes do mecanismo da visâo. A dimerização de alcenos é relevante nos processos de danos ao ADN, onde dímeros de timina são observados após iluminar o ADN com radiação ultravioleta. Tais dímeros de timina interferem na transcrição molecular. Os efeitos benéficos da luz solar estão associados a indução fotoquímica da reação de retrociclização do ergosterol, fornecendo a vitamina D. Na reação DeMayo um alceno reage com uma 1,3-dicetona via enol e resulta em uma 1,5-dicetona. Outra reação fotoquímica comum é o rearranjo di-π-metano de Zimmerman, formando um aril- ciclopropano substituído.[16][17]
Do ponto de vista industrial, cerca de 100.000 toneladas de cloreto de benzila são preparadas anualmente através da reação fotoquímica em fase gasosa entre tolueno e cloro.[18] O fóton induz a ruptura homolítica da ligação Cl-Cl, e o radical de cloro resultante converte o tolueno no radical benzílico:
- Cl2 + hν → 2 Cl·
- C6H5CH3 + Cl· → C6H5CH2· + HCl
- C6H5CH2· + Cl· → C6H5CH2Cl
Fotoquímica inorgânica e organometálica[editar | editar código-fonte]
Compostos de coordenação e organometálicos também são fotorreativos e a fotosensibilidade de compostos inorgânicos já é conhecida há muito tempo. A fotografia, por exemplo, foi desenvolvida com base nas propriedades fotoquímicas da prata. Outro exemplo antigo de fotodecomposição de um composto inorgânico é a reação de Eder, que consiste exposição de cloreto de mercúrio(I) e oxalato de amônio à luz UV, podendo ser explorada em actinometria.[19]
Nas décadas de 1950 e 1960 houve grande expansão na área de fotoquímica dos compostos de coordenação pelo desenvolvimento das teorias de campo cristalino e de campo ligante, as quais formaram as bases para interpretação dos espectros de absorção desses compostos. Além disso, o desenvolvimento instrumental da época permitiu aos cientistas maior precisão e exatidão nas análises realizadas.[20]
A fotoexcitação de um composto de coordenação segue a mesma ideia dos compostos orgânicos e consiste na sua interação com radiação eletromagnética, gerando uma espécie no estado excitado, designado A*.
- A + hν → A*
A construção do diagrama de Jablonksi para os complexos metálicos se dá a partir da formulação de orbitais moleculares dos mesmos. Os orbitais moleculares do complexo são o resultado da combinação linear dos orbitais moleculares do ligante com os orbitais do metal, incluindo seus orbitais d. As transições eletrônicas de um complexo metálico a partir de seu estado fundamental podem resultar em estados excitados de campo ligante, de transferência de carga (do metal para o ligante, TCML, ou do ligante para o metal, TCLM), de intervalência (transferência de carga em complexos polimetálicos) ou transições intraligantes. Assim, os complexos metálicos tendem a possuir processos fotoquímicos mais complicados que moléculas orgânicas, não só pela variedade da natureza das transições (e, consequentemente, dos estados excitados), como pela multiplicidade dos estados fundamental e excitado, podendo diferir do simplete e do triplete (usualmente observados para compostos orgânicos), especialmente em complexos com baixa simetria.[21]
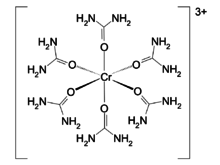
Um exemplo clássico é o complexo octaédrico [Cr(uréia)6]3+, que apresenta como estado fundamental um quarteto 4A2g e estados excitados dupletes e quartetos. Este complexo apresenta uma banda de fluorescência (originada da transição 4T2g → 4A2g), que é a imagem especular da sua banda de absorção, com deslocamento Stokes para o vermelho. Também é possível ver uma banda de fosforescência fina no espectro do complexo [Cr(uréia)6]3+, originada de uma transição em que há mudança da multiplicidade de spin, 2Eg → 4A2g.[22]
Pelo Princípio de Franck-Condon, a excitação eletrônica a partir do estado fundamental do complexo resultará em um estado excitado com características vibracionais distintas. Entretanto, o excesso de energia vibracional é rapidamente perdido em solução devido ao equilíbrio térmico com o solvente, denominado estado excitado termicamente equilibrado (estado thexi).[22]
Reações fotoquímicas de Compostos de Coordenação[editar | editar código-fonte]
As reações fotoquímicas são aquelas em que o reagente se encontra no estado excitado. Elas podem levar a produtos diferentes de reações realizadas no escuro ou com o aumento da temperatura. As reações fotoquímicas em compostos de coordenação podem ser divididas em intramoleculares (como, por exemplo, a fotodissociação e a fotoisomerização) e intermoleculares (como as reações fotoredox e as de fotosubstituição).[23]
Fotosubstituição[editar | editar código-fonte]
Em geral, o mecanismo de fotoreração mais comum para os compostos de coordenação resulta na dissociação dos ligantes, uma vez que o fóton excita um elétron da ligação com o metal para um orbital antiligante em relação aos grupos ligantes. As reações de fotosubstituição em compostos de coordenação foram as que receberam mais atenção no início do desenvolvimento desta área e contribuíram para o seu progresso. Deste modo, carbonilas metálicas que resistem à substituição térmica procedem à descarbonilação sob irradiação com luz ultravioleta (UV). A irradiação UV de uma solução de hexacarbonila de molibdênio em THF fornece o complexo de THF, o qual é sinteticamente útil:[24]
- Mo(CO)6 + THF → Mo(CO)5(THF) + CO
Em uma reação relacionada, a fotólise da pentacarbonila de ferro[25][26] resulta em nonacarbonila de ferro (figura acima):
- 2 Fe(CO)5 → Fe2(CO)9 + CO
O estudo deste tipo de reação é particularmente interessante para complexos cineticamente inertes no estado fundamental, como, por exemplo, os de íons crômio(III), de configuração eletrônica d3 e de cobalto(III), de configuração eletrônica d6. Como exemplo, tem-se a reação de fotosolvatação de um complexo de crômio(III) [23]:
- [Cr(NH3)6]3+ + H2O + hν → [Cr(NH3)5(H2O)]3+ + NH3
Fotoredox[editar | editar código-fonte]
Em transferências eletrônicas induzidas por luz uma espécie no estado excitado transfere elétrons a uma molécula receptora. As reações fotoredox de compostos de coordenação tornam essa classe de compostos promissora para aplicação em fotocatálise, por exemplo, para a separação da água e redução de dióxido de carbono. O complexo de rutênio com bipiridina [Ru(bpy)3]2+ é um exemplo clássico na fotoquímica inorgânica e em reações fotoredox. Quando o complexo [Ru(bpy)3]2+ absorve radiação na região da sua banda de transferência de carga metal-ligante, ocorre a formação do complexo excitado, *[Ru(bpy)3]2+. O estado excitado simplete formado sofre inicialmente um cruzamento intersistema, gerando um estado triplete, que é o responsável pelo longo tempo de vida deste complexo. O estado excitado *[Ru(bpy)3]2+ pode participar em reações onde atua como oxidante (envolvendo a formação de um intermediário de Ru+) e como redutor (envolvendo a formação de um intermediário de Ru3+).[27]
Fotoisomerização[editar | editar código-fonte]
São reações em que há mudanças estruturais em complexos metálicos devido à fotoexcitação, porém sua composição permanece inalterada. Exemplos incluem a isomerização óptica, geométrica (cis-trans), de ligação e a fototautomerização. O nitroprussiato de sódio apresenta fotoisomeria de ligação. A incidência de luz sobre o nitroprussiato, no qual o NO se coordena pelo átomo de nitrogênio, pode gerar isômeros metaestáveis, em que o NO se coordenada de pelo oxigênio ou por ambos os átomos, além de produtos de fotodissociação.[28]
- [Fe(CN)5NO]2- + hν → [Fe(CN)5(η1-ON)]2− + [Fe(CN)5(η2-NO)]2−
Alguns complexos de rutênio(II) com dimetilsulfóxido também apresentam fotoisomeria de ligação. A incidência de luz na região da banda de transferência de carga do metal para o ligante sobre este tipo de complexo leva à formação do isômero em que o dimetilsulfóxido se coordena pelo oxigênio. Isso leva à mudança de cor do complexo, tornando promissores para o desenvolvimento de dispositivos fotocrômicos.[29]
Aspectos Históricos[editar | editar código-fonte]
Apesar de o processo de fotobranqueamento ser praticado desde a antiguidade, a primeira reação fotoquímica foi descrita pelo químico e farmacêutico alemão Johann Bartholomew Trommsdorf em 1834.[30] Ele observou que cristais do composto α-santonina (incolor) ficavam amarelos e quebravam-se quando eram expostos à luz solar. Em um estudo de 2007 a reação foi descrita como uma sucessão de três passos ocorrendo no interior do cristal.[31]
O primeiro passo é a reação de rearranjo levando a um intermediário da ciclopentadienona (2), o segundo passo é uma dimerização através de uma reação de Diels-Alder (3) e o terceiro passo envolve uma cicloadição [2+2] intramolecular (4). O efeito de explosão do cristal é atribuído à grande mudança de volume no passo de dimerização.
Referências
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Fotoquímica" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ a b c K. K. Rohatgi-Mukherjee (1991). Fundamentals of Photochemistry (Revised Edition) (em inglês). Calcutta, India: New Age International Limited, Publishers. p. 3–7. 371 páginas. ISBN 0852267843. Consultado em 5 de Março de 2011
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Lei de Beer-Lambert" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Nicholas J. Turro (1991). Modern Molecular Photochemistry (em inglês). Sausalito, CA: University Science Books. p. 1-628. 628 páginas. ISBN 978-0935702712. Consultado em 5 de Março de 2011
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Princípio de Franck-Condon" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Franck, J. (1926). «Elementary processes of photochemical reactions». Transactions of the Faraday Society (em inglês). 21: 536–542. doi:10.1039/tf9262100536
- ↑ Condon, E. (1926). «A theory of intensity distribution in band systems». Physical Review (em inglês). 28: 1182–1201. doi:10.1103/PhysRev.28.1182
- ↑ Kasha, M. (1950). «Characterization of electronic transitions in complex molecules». Discussions of the Faraday Society (em inglês). 9 (1): 14-19. doi:10.1039/DF9500900014
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Regra de Kasha" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Regra de Kasha-Vavilov" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Rendimento Quântico" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Robert B. Woodward, Roald Hoffmann (1970). Die Erhaltung der Orbitalsymmetrie (em alemão). Weinheim: Verlag Chemie. p. 1–178. 178 páginas. ISBN 3-527-25323-8
- ↑ Christophe Dugave (2006). Cis-trans isomerization in biochemistry (em inglês). Munique: Wiley-VCH. p. 56. ISBN 3527313044. Consultado em 5 de Março de 2011
- ↑ Charles E. Wilkes, James W. Summers, Charles A. Daniels (Eds.) (2005). PVC Handbook (em inglês). Munique: Carl Hamser Verlag. p. 270. ISBN 1-56990-379-4. Consultado em 5 de Março de 2011
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Processos Fotoquímicos Primários" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "Rearranjo di-metano" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Howard E. Zimmerman, Diego Armesto (1996). «Synthetic Aspects of the Di-π-methane Rearrangement». Chemical Reviews (em inglês). 96 (8): 3065-3112. doi:10.1021/cr910109c
- ↑ M. Rossberg; et al. (2006). «Chlorinated Hydrocarbons». Ullmann’s Encyclopedia of Industrial Chemistry (em inglês). Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_233.pub2
- ↑ G. Wilkinson, Comprehensive Coordination Chemistry: The Synthesis, Reactions, Properties & Applications of Coordination Compounds, Pergamon Press, 1987.
- ↑ J. Sýkora, J. Šima, Coord. Chem. Rev. 1990, 107, 1–212
- ↑ V. Balzani, G. Bergamini, S. Campagna, F. Puntoriero, in Photochem. Photophysics Coord. Compd. I, Springer Berlin Heidelberg, Berlin, Heidelberg, 2007, pp. 1–36
- ↑ a b G. Wilkinson, Comprehensive Coordination Chemistry: The Synthesis, Reactions, Properties & Applications of Coordination Compounds, Pergamon Press, 1987
- ↑ a b G. Stochel, M. Brindell, W. Macyk, Z. Stasicka, K. Szaciowski, Bioinorganic Photochemistry, John Wiley & Sons, Ltd, Chichester, UK, 2009
- ↑ Wolfgang A. Herrmann (Ed.) (2000). Synthetic Methods of Organometallic and Inorganic Chemistry. Transition Metals Pt.3 (em inglês). 9. Munique: Thieme Publishing Group. p. 23-25. ISBN 978-3131151414. Consultado em 5 de Março de 2011
- ↑ Edmund Speyer, Hans Wolf (1924). «Über die Bildungsweise von Eisen-nonacarbonyl aus Eisen-pentacarbonyl». Berichte der Deutschen Chemischen Gesellschaft. (em alemão). 60: 1424-1425. doi:10.1002/cber.19270600626
- ↑ Ludwig Mond, C. Langer (1891). «On iron carbonyls». J. Chem. Soc., Trans. (em inglês). 59: 1090–1093. doi:10.1039/CT8915901090
- ↑ C. K. Prier, D. A. Rankic, D. W. C. MacMillan, Chem. Rev. 2013, 113, 5322–5363.
- ↑ M. S. Lynch, M. Cheng, B. E. Van Kuiken, M. Khalil, J. Am. Chem. Soc. 2011, 133, 5255–5262.
- ↑ J. J. Rack, J. R. Winkler, H. B. Gray, J. Am. Chem. Soc. 2001, 123, 2432–2433.
- ↑ J. B. Trommsdorf (1834). «Ann. Chem. Pharm.» (em alemão). 11 páginas
- ↑ Arunkumar Natarajan, C. K. Tsai, Saeed I. Khan, Patrick McCarren, K. N. Houk, and Miguel A. Garcia-Garibay (2007). «The Photoarrangement of α-Santonin is a Single-Crystal-to-Single-Crystal Reaction: A Long Kept Secret in Solid-State Organic Chemistry Revealed». J. Am. Chem. Soc. (em inglês). 129 (32): 9846-9847. doi:10.1021/ja073189o


 French
French Deutsch
Deutsch