Colangiocarcinoma – Wikipédia, a enciclopédia livre
| Colangiocarcinoma | |
|---|---|
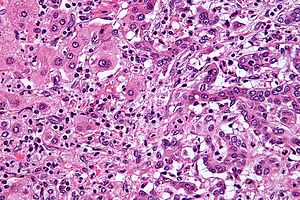
| Micrografia de colangiocarcinoma intra-hepático (direita) adjacente aos hepatócitos benignos (esquerda). Coloração H&E | |
| Sinônimos | Câncer de vias biliares[1] Colangiocarcinoma intra-hepático |
| Especialidade | Oncologia |
| Classificação e recursos externos | |
| CID-10 | C22.1 |
| CID-9 | 155.1, 156.1 |
| CID-ICD-O | 8160/3 |
| CID-11 | 2110597275 |
| OMIM | 615619 |
| DiseasesDB | 2505 |
| MedlinePlus | 000291 |
| eMedicine | 277393, 365065 |
| MeSH | D018281 |
Colangiocarcinoma, também conhecido como câncer de vias biliares, é uma forma de câncer que se forma nos ductos biliares.[2] Os sintomas da doença podem incluir dor abdominal, pele amarelada, perda de peso, prurido generalizado e febre. Também podem ocorrer fezes esbranquiçadas ou urina escura. Outros cânceres do trato biliar incluem o de vesícula biliar e o de ampola de Vater.[3]
Os fatores de risco incluem colangite esclerosante primária (uma doença inflamatória dos ductos biliares), colite ulcerosa, cirrose, hepatite C, hepatite B, infecção por certos parasitas de fígado e algumas malformações congênitas do órgão.[4] No entanto, a maioria das pessoas não possui fatores de risco identificáveis. Suspeita-se do diagnóstico com base em uma combinação de exames de sangue, imagiologia médica, endoscopia e, às vezes, exploração cirúrgica. A doença é confirmada pelo exame de células do tumor em microscópio.[5] É tipicamente um adenocarcinoma (um câncer que forma glândulas ou secreta mucina).
O diagnóstico é tipicamente incurável. Nesses casos, os tratamentos paliativos podem incluir ressecção cirúrgica, quimioterapia, radioterapia e procedimentos de stent. Em cerca de um terço dos casos que envolvem o ducto biliar comum e menos comumente em outros locais, o tumor pode ser completamente removido por cirurgia, oferecendo a chance de cura. Mesmo quando a remoção cirúrgica é bem sucedida, quimioterapia e radioterapia são geralmente recomendadas. Em certos casos, a cirurgia pode incluir um transplante de fígado.[6] Mesmo quando a cirurgia é bem sucedida, a sobrevida em cinco anos é tipicamente menor que 50%.
O colangiocarcinoma é raro no mundo ocidental, com estimativas ocorrendo em 0,5 a 2 pessoas por 100 000 ao ano. As taxas são mais altas no sudeste da Ásia, onde parasitas de fígado são comuns.[7] As taxas em partes da Tailândia são de 60 por 100 000 ao ano. Geralmente ocorre em pessoas na faixa dos 70 anos; no entanto, naqueles com colangite esclerosante primária, ocorre frequentemente nos anos 40. As taxas de colangiocarcinoma no fígado no mundo ocidental têm aumentado.[8]
Sinais e sintomas[editar | editar código-fonte]

As indicações físicas mais comuns de colangiocarcinoma são testes de função hepática anormais (amarelecimento dos olhos e da pele que ocorre quando os ductos biliares são bloqueados pelo tumor), icterícia, dor abdominal (30%–50%), prurido generalizado (66%), perda de peso (30%–50%), febre (até 20%) e alterações na cor das fezes ou da urina.[9][10] Até certo ponto, os sintomas dependem da localização do tumor: pacientes com colangiocarcinoma nos ductos biliares extra-hepáticos (fora do fígado) são mais propensos a ter icterícia, enquanto aqueles com tumores dos ductos biliares dentro do fígado mais frequentemente têm dor sem icterícia.[11]
Exames de sangue da função hepática em pacientes com a doença frequentemente revelam o chamado "quadro obstrutivo", com níveis elevados de bilirrubina, fosfatase alcalina e gamaglutamiltranspeptidase, e níveis relativamente normais de transaminases. Tais achados laboratoriais sugerem obstrução dos ductos biliares, em vez de inflamação ou infecção do parênquima hepático, como a principal causa da icterícia.[12]
Fatores de risco[editar | editar código-fonte]
Embora a maioria dos pacientes apresente nenhum fator de risco evidente conhecido, vários fatores de risco para o desenvolvimento de colangiocarcinoma foram descritos. No mundo ocidental, a mais comum delas é a colangite esclerosante primária (CEP), uma doença inflamatória dos ductos biliares que está intimamente associada à colite ulcerosa (CU).[13] Estudos epidemiológicos sugeriram que o risco de desenvolver a doença ao longo da vida para uma pessoa com CEP é da ordem de 10% a 15%,[14] embora as séries de autópsias tenham encontrado taxas tão altas quanto 30% nessa população.[15]

Certas doenças hepáticas parasitárias também podem ser fatores de risco. A colonização de parasitas do fígado Opisthorchis viverrini (encontrado no Sudeste Asiático)[16][17][18] ou Clonorchis sinensis (encontrado na China, Taiwan, leste da Rússia, Coreia e Vietnã)[19][20] tem sido associado ao desenvolvimento de colangiocarcinoma. Programas de controle que visam desencorajar o consumo de alimentos crus e mal cozidos foram bem-sucedidos na redução da incidência do câncer de vias biliares em alguns países.[21] Pacientes com doença hepática crônica, seja na forma de hepatite viral (por exemplo, hepatite B ou hepatite C),[22][23][24] doença hepática alcoólica ou cirrose hepática devido a outras causas, apresentam risco significativamente aumentado de colangiocarcinoma.[25][26] A infecção pelo vírus da imunodeficiência humana (HIV) também foi identificada em um estudo como um fator de risco potencial para a doença, embora não esteja claro se o próprio HIV ou outros fatores correlacionados e confundidores foram responsáveis pela associação.[25]
Estudos demonstraram que bactérias do gênero Helicobacter, como a Helicobacter bilis e a Helicobacter hepaticus, podem colonizar a vesícula biliar, causando infecções. Além da presença de Helicobacter nos tratos biliares, quando isoladas do trato e do tecido biliar, elas podem ter implicações no desenvolvimento de formas de cânceres na região.[27]
Anormalidades hepáticas congênitas, como a síndrome de Caroli (um tipo específico de cinco cistos de colédoco reconhecidos), têm sido associadas a um risco de aproximadamente 15% de desenvolver colangiocarcinoma ao longo da vida.[28][29] Os raros distúrbios hereditários da síndrome de Lynch II e a papilomatose biliar também foram descobertas associadas à doença.[30][31] A presença de cálculos biliares (colelitíase) não está claramente associada ao câncer.[32][33][34] No entanto, os cálculos intra-hepáticos (chamado hepatolitíase), que são raros no Ocidente, mas comuns em partes da Ásia, têm sido fortemente associados ao colangiocarcinoma. A exposição ao torotraste, uma forma de dióxido de tório que foi usada como meio de contraste radiológico, tem sido associada ao desenvolvimento de colangiocarcinoma até 30 a 40 anos após a exposição; o torotraste foi proibido nos Estados Unidos nos anos 50 devido a sua carcinogenicidade.[35][36][37]
Fisiopatologia[editar | editar código-fonte]

O colangiocarcinoma pode afetar qualquer área dos ductos biliares, dentro ou fora do fígado. Os tumores que ocorrem nos ductos biliares dentro do fígado são referidos como intra-hepáticos, os que ocorrem nos ductos fora do órgão são extra-hepáticos e os tumores que ocorrem no local onde os ductos biliares saem do fígado podem ser referidos como peri-hilares. Um colangiocarcinoma ocorrendo na junção onde os ductos hepáticos esquerdo e direito se encontram para formar o ducto hepático comum pode ser referido de forma eponímica como um tumor de Klatskin.[38]
Embora o câncer de vias biliares seja conhecido por ter as características histológicas e moleculares de um adenocarcinoma de células epiteliais que revestem o trato biliar, a célula real de origem é desconhecida. Evidências recentes sugeriram que a célula inicial transformada que gera o tumor primário pode surgir de uma célula tronco hepática pluripotente.[39][40][41] Pensa-se que o colangiocarcinoma se desenvolve através de uma série de fases — desde hiperplasia precoce e metaplasia, através de displasia, até o desenvolvimento de carcinoma franco — num processo semelhante ao observado no desenvolvimento do câncer colorretal.[42] Acredita-se que a inflamação crônica e a obstrução dos ductos biliares, e o resultante fluxo biliar comprometido, desempenham um papel nessa progressão.[42][43][44]
Histologicamente, os colangiocarcinomas podem variar de indiferenciados a bem diferenciados. Eles são frequentemente cercados por uma resposta rápida de tecido fibrótico ou desmoplásico; na presença de fibrose extensa, pode ser difícil distinguir o colangiocarcinoma bem diferenciado do epitélio reativo normal. Não há coloração imuno-histoquímica inteiramente específica que possa distinguir tecido ductal biliar maligno de benigno, embora a coloração para citoqueratinas, antígeno carcinoembrionário e mucinas possa auxiliar no diagnóstico.[45] A maioria dos tumores (mais de 90%) são adenocarcinomas.[46]
Diagnóstico[editar | editar código-fonte]

Exames de sangue[editar | editar código-fonte]
Não há exames de sangue específicos que possam diagnosticar o colangiocarcinoma por si só. Os níveis séricos de antígeno carcinoembrionário e CA19-9 são frequentemente elevados, mas não são sensíveis ou específicos o suficiente para serem usados como ferramenta geral de triagem. No entanto, eles podem ser úteis em conjunto com métodos de imagem no apoio a um diagnóstico suspeito de colangiocarcinoma.[47]
Imagem abdominal[editar | editar código-fonte]

A ultrassonografia do fígado e das vias biliares é frequentemente usada como modalidade de imagem inicial em pacientes com suspeita de icterícia obstrutiva.[48][49] O ultrassom pode identificar obstrução e dilatação ductal e, em alguns casos, pode ser suficiente para diagnosticar o colangiocarcinoma.[50] A tomografia computadorizada (TC) também pode desempenhar um papel importante no diagnóstico da doença.[51][52][53]
Imagem da árvore biliar[editar | editar código-fonte]

Embora a imagem abdominal possa ser útil no diagnóstico de colangiocarcinoma, a imagem direta dos ductos biliares é frequentemente necessária. A colangiopancreatografia retrógrada endoscópica (CPRE), um procedimento endoscópico realizado por um gastroenterologista ou cirurgião especialmente treinado, tem sido amplamente utilizada para esse fim. Embora a CPRE seja um procedimento invasivo com riscos concomitantes, suas vantagens incluem a capacidade de obter biópsias e colocar stents ou realizar outras intervenções para aliviar a obstrução biliar.[12] A ultrassonografia endoscópica também pode ser realizada no momento da CPRE e pode aumentar a precisão da biópsia e produzir informações sobre a invasão e a operabilidade do linfonodo.[54] Como alternativa à CPRE, a colangiografia percutânea trans-hepática (CPT) pode ser utilizada. A colangiopancreatografia por ressonância magnética (CPRM) é uma alternativa não invasiva à CPRE.[55][56][57] Alguns autores sugeriram que a CPRM deve suplantar a CPRE no diagnóstico de cânceres biliares, pois pode definir com mais precisão o tumor e evitar os riscos da CPRE.[58][59][60]
Cirurgia[editar | editar código-fonte]
A exploração cirúrgica pode ser necessária para obter uma biópsia adequada e para classificar com precisão um paciente com colangiocarcinoma. A laparoscopia pode ser usada para fins de estadiamento e pode evitar a necessidade de um procedimento cirúrgico mais invasivo, como a laparotomia, em alguns pacientes.[61][62]
Patologia[editar | editar código-fonte]
Histologicamente, os colangiocarcinomas são adenocarcinomas classicamente bem moderadamente diferenciados. A imuno-histoquímica é útil no diagnóstico e pode ser usada para ajudar a diferenciar um colangiocarcinoma de carcinoma hepatocelular e metástase de outros tumores gastrointestinais.[63] As raspagens citológicas são frequentemente não diagnósticas,[64] uma vez que esses tumores geralmente têm um estroma desmoplásico e, portanto, não liberam células tumorais diagnósticas com raspagens.
Estadiamento[editar | editar código-fonte]
Embora existam pelo menos três sistemas de estadiamento para o colangiocarcinoma (por exemplo, os de Bismuth, Blumgart e do Comitê Conjunto Americano para Estadiamento do Câncer), nenhum demonstrou ser útil na previsão da sobrevida.[65] A questão de estadiamento mais importante é se o tumor pode ser removido cirurgicamente ou se é avançado demais para que o tratamento cirúrgico seja bem sucedido. Muitas vezes, essa determinação só pode ser feita no momento da cirurgia.[12]
As diretrizes gerais para operabilidade incluem:[66][67]
- Ausência de linfonodos ou metástases hepáticas;
- Ausência de envolvimento da veia porta;
- Ausência de invasão direta de órgãos adjacentes;
- Ausência de doença metastática generalizada.
Tratamento[editar | editar código-fonte]
O colangiocarcinoma é considerado uma doença incurável e rapidamente letal, a menos que todos os tumores possam ser totalmente ressecados (cortar cirurgicamente). Como a operabilidade do tumor só pode ser avaliada durante a cirurgia na maioria dos casos,[68] a maioria dos pacientes é submetida à cirurgia exploratória, a menos que já exista uma indicação clara de que o tumor é inoperável.[12] No entanto, a Mayo Clinic relatou sucesso significativo no tratamento do câncer do ducto biliar precoce com o transplante de fígado, utilizando uma abordagem protocolizada e critérios rígidos de seleção.[69]
Terapia adjuvante seguida de transplante de fígado pode ter um papel no tratamento de certos casos irressecáveis.[70] As terapias locorregionais, incluindo quimioembolização transarterial, radioembolização transarterial e terapias de ablação, têm um papel nas variantes intra-hepáticas da doença para fornecer paliação ou cura potencial em pessoas que não são candidatas a cirurgia.[71]
Quimioterapia adjuvante e radioterapia[editar | editar código-fonte]
Se o tumor pode ser removido cirurgicamente, os pacientes podem receber quimioterapia adjuvante ou radioterapia após a operação para melhorar as chances de cura. Se as margens do tecido forem negativas (ou seja, o tumor foi totalmente extirpado), a terapia adjuvante é de benefício incerto. Ambos os resultados positivo[72][73] e negativo[11][74][75] foram relatados com terapia de radiação adjuvante neste cenário, e nenhum estudo prospectivo randomizado controlado foi realizado até março de 2007. A quimioterapia adjuvante parece ser ineficaz em pacientes com tumores completamente ressecados.[76] O papel da quimiorradioterapia combinada nesse cenário não é claro. No entanto, se as margens do tecido tumoral são positivas, indicando que o tumor não foi completamente removido através de cirurgia, então a terapia adjuvante com radiação e possivelmente quimioterapia é geralmente recomendada com base nos dados disponíveis.[77]
Tratamento da doença avançada[editar | editar código-fonte]
A maioria dos casos de colangiocarcinoma apresenta-se como doença inoperável (irressecável),[78] em cujo caso os pacientes geralmente são tratados com quimioterapia paliativa, com ou sem radioterapia. Tem sido demonstrado num estudo que a quimioterapia controlada randomizada melhora a qualidade de vida e prolonga a sobrevida em pacientes com câncer de vias biliares inoperável.[79] Não existe um regime único de quimioterapia que seja universalmente utilizado, e a inscrição em ensaios clínicos é frequentemente recomendada quando possível.[77] Os agentes quimioterápicos usados no tratamento do colangiocarcinoma incluem 5-fluorouracil com leucovorina,[80] gemcitabina como agente único[81] ou gemcitabina associada à cisplatina,[82] irinotecano[83] ou capecitabina.[84] Um pequeno estudo piloto sugeriu possível benefício do inibidor erlotinibe da tirosina quinase em pacientes com a forma avançada da doença.[85] A radioterapia parece prolongar a sobrevida em pessoas com colangiocarcinoma extra-hepático ressecado,[86] e os poucos relatos de seu uso no câncer irressecável parecem mostrar uma melhora na sobrevida, mas os números são pequenos.[87]
Prognóstico[editar | editar código-fonte]
A ressecção cirúrgica oferece a única chance potencial de cura no colangiocarcinoma. Para casos não ressecáveis, a taxa de sobrevida em 5 anos é de 0%, quando a doença é inoperável porque os linfonodos distais apresentam metástases[88] e menos de 5% em geral.[89] A duração média global de sobrevida é inferior a 6 meses em pacientes com doença metastática.[90]
Para casos cirúrgicos, as chances de cura variam dependendo da localização do tumor e se o tumor pode ser removido completamente ou apenas parcialmente. Os colangiocarcinomas distais (aqueles que surgem do ducto biliar comum) são geralmente tratados cirurgicamente com um procedimento de Whipple; taxas de sobrevida em longo prazo variam de 15 a 25%, embora uma série relatou uma sobrevida de cinco anos de 54% para pacientes sem envolvimento dos gânglios linfáticos.[91] Colangiocarcinomas intra-hepáticos (aqueles que surgem dos ductos biliares dentro do fígado) são geralmente tratados com hepatectomia parcial. Várias séries relataram estimativas de sobrevida após a cirurgia, variando de 22 a 66%; o resultado pode depender do envolvimento dos gânglios linfáticos e da completude da cirurgia.[92] Os colangiocarcinomas peridilares (os que ocorrem perto de onde os ductos biliares saem do fígado) têm menor probabilidade de serem operáveis. Quando a cirurgia é possível, eles geralmente são tratados com uma abordagem agressiva, muitas vezes incluindo a remoção da vesícula biliar e, potencialmente, parte do fígado. Em pacientes com tumores peri-hilares operáveis, as taxas de sobrevida em 5 anos relatadas variam de 20 a 50%.[93]
O prognóstico pode ser pior para pacientes com colangite esclerosante primária que desenvolvem colangiocarcinoma, provavelmente porque o câncer não é detectado até que esteja avançado.[15][94] Algumas evidências sugerem que os resultados podem estar melhorando com abordagens cirúrgicas mais agressivas e terapia adjuvante.[95]
Epidemiologia[editar | editar código-fonte]
| País | IH (homem / mulher) | EH (homem / mulher) |
|---|---|---|
| Austrália | 0,70 / 0,53 | 0,90 / 1,23 |
| Escócia | 1,17 / 1,00 | 0,60 / 0,73 |
| Estados Unidos | 0,60 / 0,43 | 0,70 / 0,87 |
| França | 0,27 / 0,20 | 1,20 / 1,37 |
| Japão | 0,23 / 0,10 | 5,87 / 5,20 |
| Inglaterra / País de Gales | 0,83 / 0,63 | 0,43 / 0,60 |
| Itália | 0,13 / 0,13 | 2,10 / 2,60 |
A doença é uma forma relativamente rara de câncer; a cada ano, aproximadamente 2 000 a 3 000 novos casos são diagnosticados nos Estados Unidos, traduzindo-se em uma incidência anual de 1 a 2 casos por 100 000 pessoas.[97] Séries de autópsias relataram uma prevalência de 0,01% a 0,46%.[98][99] Há uma maior prevalência de colangiocarcinoma na Ásia, que tem sido atribuída à infestação parasitária crônica endêmica. A incidência de colangiocarcinoma aumenta com a idade e a doença é ligeiramente mais comum em homens do que em mulheres (possivelmente devido à maior taxa de colangite esclerosante primária, um importante fator de risco, em homens).[46] A prevalência de colangiocarcinoma em pacientes com colangite esclerosante primária pode chegar a 30%, com base em estudos de autópsia.[15]
Vários estudos documentaram um aumento constante na incidência de colangiocarcinoma intra-hepático nas últimas décadas; aumentos foram vistos na América do Norte, Europa, Ásia e Austrália.[100] As razões para o aumento da ocorrência de colangiocarcinoma não são claras; métodos diagnósticos melhorados podem ser parcialmente responsáveis, mas a prevalência de fatores de risco potenciais para o colangiocarcinoma, como a infecção pelo HIV, também tem aumentado durante esse período.[25]
Referências
- ↑ «Bile Duct Cancer (Cholangiocarcinoma) Treatment (PDQ®)–Health Professional Version». National Cancer Institute. 14 de março de 2018. Consultado em 26 de maio de 2020
- ↑ «NCI Dictionary of Cancer Terms». National Cancer Institute (em inglês). 2 de fevereiro de 2011. Consultado em 4 de junho de 2020
- ↑ Benavides, M; Antón, A; Gallego, J; Gómez, MA; Jiménez-Gordo, A; La Casta, A; Laquente, B; Macarulla, T; Rodríguez-Mowbray, JR; Maurel, J (dezembro de 2015). «Biliary tract cancers: SEOM clinical guidelines». Clinical & Translational Oncology. 17 (12): 982–7. PMC 4689747
 . PMID 26607930. doi:10.1007/s12094-015-1436-2
. PMID 26607930. doi:10.1007/s12094-015-1436-2 - ↑ Steele, JA; Richter, CH; Echaubard, P; Saenna, P; Stout, V; Sithithaworn, P; Wilcox, BA (17 de maio de 2018). «Thinking beyond Opisthorchis viverrini for risk of cholangiocarcinoma in the lower Mekong region: a systematic review and meta-analysis». Infectious Diseases of Poverty. 7 (1). 44 páginas. PMC 5956617
 . PMID 29769113. doi:10.1186/s40249-018-0434-3
. PMID 29769113. doi:10.1186/s40249-018-0434-3 - ↑ «Bile Duct Cancer (Cholangiocarcinoma) Symptoms, Tests, Prognosis, and Stages». National Cancer Institute (em inglês). 5 de julho de 2018. Consultado em 1 de junho de 2020
- ↑ Razumilava, N; Gores, GJ (21 de junho de 2014). «Cholangiocarcinoma». Lancet. 383 (9935): 2168–79. PMC 4069226
 . PMID 24581682. doi:10.1016/S0140-6736(13)61903-0
. PMID 24581682. doi:10.1016/S0140-6736(13)61903-0 - ↑ Bosman, Frank T. (2014). «Chapter Chapter 5.6: Liver cancer». In: Stewart, Bernard W.; Wild, Christopher P. World Cancer Report. [S.l.]: the International Agency for Research on Cancer, World Health Organization. p. Chapter 5.6. ISBN 978-92-832-0443-5

- ↑ Bridgewater, JA; Goodman, KA; Kalyan, A; Mulcahy, MF (2016). «Biliary Tract Cancer: Epidemiology, Radiotherapy, and Molecular Profiling». American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting. 35 (36): e194–203. PMID 27249723. doi:10.1200/EDBK_160831
- ↑ Nagorney D, Donohue J, Farnell M, Schleck C, Ilstrup D (1993). «Outcomes after curative resections of cholangiocarcinoma». Arch Surg. 128 (8): 871–7; discussão em 877–9. PMID 8393652. doi:10.1001/archsurg.1993.01420200045008
- ↑ «Bile Duct Cancer». USC Surgery (em inglês). Keck Medicine Web Services. Consultado em 18 de maio de 2020
- ↑ a b Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg. 224 (4): 463–73; discussão em 473–5. PMC 1235406
 . PMID 8857851. doi:10.1097/00000658-199610000-00005
. PMID 8857851. doi:10.1097/00000658-199610000-00005 - ↑ a b c d Mark Feldman; Lawrence S. Friedman; Lawrence J. Brandt, eds. (21 de julho de 2006). Sleisenger and Fordtran's Gastrointestinal and Liver Disease 8 ed. [S.l.]: Saunders. p. 1493–6. ISBN 978-1-4160-0245-1
- ↑ «Risk factors for biliary tract carcinogenesis». Ann Oncol. 10 (4): 308–11. 1999. PMID 10436847. doi:10.1023/A:1008313809752
- ↑ Estudos epidemiológicos que abordaram a incidência de colangiocarcinoma em pessoas com colangite esclerosante primária incluem os seguintes:
- Bergquist A, Ekbom A, Olsson R, Kornfeldt D, Lööf L, Danielsson A, Hultcrantz R, Lindgren S, Prytz H, Sandberg-Gertzén H, Almer S, Granath F, Broomé U (2002). «Hepatic and extrahepatic malignancies in primary sclerosing cholangitis». J Hepatol. 36 (3): 321–7. PMID 11867174. doi:10.1016/S0168-8278(01)00288-4
- Bergquist A, Glaumann H, Persson B, Broomé U (1998). «Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study». Hepatology. 27 (2): 311–6. PMID 9462625. doi:10.1002/hep.510270201
- Burak K, Angulo P, Pasha T, Egan K, Petz J, Lindor K (2004). «Incidence and risk factors for cholangiocarcinoma in primary sclerosing cholangitis». Am J Gastroenterol. 99 (3): 523–6. PMID 15056096. doi:10.1111/j.1572-0241.2004.04067.x
- ↑ a b c Rosen CB, Nagorney DM, Wiesner RH, Coffey RJ, LaRusso NF (janeiro de 1991). «Cholangiocarcinoma complicating primary sclerosing cholangitis». Annals of Surgery. 213 (1): 21–5. PMC 1358305
 . PMID 1845927. doi:10.1097/00000658-199101000-00004
. PMID 1845927. doi:10.1097/00000658-199101000-00004 - ↑ Watanapa P, Watanapa W (2002). «Liver fluke-associated cholangiocarcinoma». Br J Surg. 89 (8): 962–70. PMID 12153620. doi:10.1046/j.1365-2168.2002.02143.x
- ↑ Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T, Smout M, Pairojkul C, Bhudhisawasdi V, Tesana S, Thinkamrop B, Bethony JM, Loukas A, Brindley PJ (2007). «Liver fluke induces cholangiocarcinoma». PLoS Medicine. 4 (7): 1148–1155. PMC 1913093
 . PMID 17622191. doi:10.1371/journal.pmed.0040201
. PMID 17622191. doi:10.1371/journal.pmed.0040201 - ↑ Sripa B, Kaewkes S, Intapan PM, Maleewong W, Brindley PJ (2010). «Food-borne trematodiases in Southeast Asia epidemiology, pathology, clinical manifestation and control». Adv Parasitol. 72: 305–350. PMID 20624536. doi:10.1016/S0065-308X(10)72011-X
- ↑ Rustagi T, Dasanu CA (2012). «Risk Factors for Gallbladder Cancer and Cholangiocarcinoma: Similarities, Differences and Updates». J Gastrointest Cancer. 43 (2): 137–147. PMID 21597894. doi:10.1007/s12029-011-9284-y
- ↑ Hong ST, Fang Y (2012). «Clonorchis sinensis and clonorchiasis, an update». Parasitol Int. 61 (1): 17–24. PMID 21741496. doi:10.1016/j.parint.2011.06.007
- ↑ Sripa, B; Tangkawattana, S; Sangnikul, T (agosto de 2017). «The Lawa model: A sustainable, integrated opisthorchiasis control program using the EcoHealth approach in the Lawa Lake region of Thailand». Parasitology international. 66 (4): 346–354. PMC 5443708
 . PMID 27890720. doi:10.1016/j.parint.2016.11.013
. PMID 27890720. doi:10.1016/j.parint.2016.11.013 - ↑ Kobayashi M, Ikeda K, Saitoh S, Suzuki F, Tsubota A, Suzuki Y, Arase Y, Murashima N, Chayama K, Kumada H (2000). «Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis». Cancer. 88 (11): 2471–7. PMID 10861422. doi:10.1002/1097-0142(20000601)88:11<2471::AID-CNCR7>3.0.CO;2-T
- ↑ Yamamoto S, Kubo S, Hai S, Uenishi T, Yamamoto T, Shuto T, Takemura S, Tanaka H, Yamazaki O, Hirohashi K, Tanaka T (2004). «Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma». Cancer Sci. 95 (7): 592–5. PMID 15245596. doi:10.1111/j.1349-7006.2004.tb02492.x
- ↑ Lu H, Ye M, Thung S, Dash S, Gerber M (2000). «Detection of hepatitis C virus RNA sequences in cholangiocarcinomas in Chinese and American patients». Chin Med J (Engl). 113 (12): 1138–41. PMID 11776153
- ↑ a b c Shaib YH, El-Serag HB, Davila JA, Morgan R, McGlynn KA (março de 2005). «Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study». Gastroenterology. 128 (3): 620–6. PMID 15765398. doi:10.1053/j.gastro.2004.12.048
- ↑ Sorensen H, Friis S, Olsen J, Thulstrup A, Mellemkjaer L, Linet M, Trichopoulos D, Vilstrup H, Olsen J (1998). «Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark». Hepatology. 28 (4): 921–5. PMID 9755226. doi:10.1002/hep.510280404
- ↑ «Role of Bacteria in Oncogenesis». 23 (4). 2010: 837–857. ISSN 0893-8512. PMC 2952975
 . PMID 20930075. doi:10.1128/CMR.00012-10
. PMID 20930075. doi:10.1128/CMR.00012-10 - ↑ Lipsett P, Pitt H, Colombani P, Boitnott J, Cameron J (1994). «Choledochal cyst disease. A changing pattern of presentation». Ann Surg. 220 (5): 644–52. PMC 1234452
 . PMID 7979612. doi:10.1097/00000658-199411000-00007
. PMID 7979612. doi:10.1097/00000658-199411000-00007 - ↑ Dayton M, Longmire W, Tompkins R (1983). «Caroli's Disease: a premalignant condition?». Am J Surg. 145 (1): 41–8. PMID 6295196. doi:10.1016/0002-9610(83)90164-2
- ↑ Mecklin J, Järvinen H, Virolainen M (1992). «The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma». Cancer. 69 (5): 1112–4. PMID 1310886. doi:10.1002/cncr.2820690508
- ↑ Lee S, Kim M, Lee S, Jang S, Song M, Kim K, Kim H, Seo D, Song D, Yu E, Lee S, Min Y (2004). «Clinicopathologic review of 58 patients with biliary papillomatosis». Cancer. 100 (4): 783–93. PMID 14770435. doi:10.1002/cncr.20031
- ↑ Lee C, Wu C, Chen G (2002). «What is the impact of coexistence of hepatolithiasis on cholangiocarcinoma?». J Gastroenterol Hepatol. 17 (9): 1015–20. PMID 12167124. doi:10.1046/j.1440-1746.2002.02779.x
- ↑ Su C, Shyr Y, Lui W, P'Eng F (1997). «Hepatolithiasis associated with cholangiocarcinoma». Br J Surg. 84 (7): 969–73. PMID 9240138. doi:10.1002/bjs.1800840717
- ↑ Donato F, Gelatti U, Tagger A, Favret M, Ribero M, Callea F, Martelli C, Savio A, Trevisi P, Nardi G (2001). «Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy». Cancer Causes Control. 12 (10): 959–64. PMID 11808716. doi:10.1023/A:1013747228572
- ↑ Sahani D, Prasad S, Tannabe K, Hahn P, Mueller P, Saini S (2003). «Thorotrast-induced cholangiocarcinoma: case report». Abdom Imaging. 28 (1): 72–4. PMID 12483389. doi:10.1007/s00261-001-0148-y
- ↑ Zhu A, Lauwers G, Tanabe K (2004). «Cholangiocarcinoma in association with Thorotrast exposure». J Hepatobiliary Pancreat Surg. 11 (6): 430–3. PMID 15619021. doi:10.1007/s00534-004-0924-5
- ↑ Lipshutz, GS; Brennan, TV; Warren, RS (novembro de 2002). «Thorotrast-induced liver neoplasia: a collective review». Journal of the American College of Surgeons. 195 (5): 713–8. PMID 12437262. doi:10.1016/S1072-7515(02)01287-5
- ↑ Klatskin G (1965). «Adenocarcinoma Of The Hepatic Duct At Its Bifurcation Within The Porta Hepatis. An Unusual Tumor With Distinctive Clinical And Pathological Features». Am J Med. 32 (2): 241–56. PMID 14256720. doi:10.1016/0002-9343(65)90178-6
- ↑ Roskams T (2006). «Liver stem cells and their implication in hepatocellular and cholangiocarcinoma». Oncogene. 25 (27): 3818–22. PMID 16799623. doi:10.1038/sj.onc.1209558
- ↑ Liu C, Wang J, Ou Q (2004). «Possible stem cell origin of human cholangiocarcinoma». World J Gastroenterol. 10 (22): 3374–6. PMID 15484322. doi:10.3748/wjg.v10.i22.3374
- ↑ Sell S, Dunsford H (1989). «Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma». Am J Pathol. 134 (6): 1347–63. PMC 1879951
 . PMID 2474256
. PMID 2474256 - ↑ a b Sirica A (2005). «Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy». Hepatology. 41 (1): 5–15. PMID 15690474. doi:10.1002/hep.20537
- ↑ Holzinger F, Z'graggen K, Büchler M (1999). «Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma». Ann Oncol. 10 (Suppl 4): 122–6. PMID 10436802. doi:10.1023/A:1008321710719
- ↑ Gores G (2003). «Cholangiocarcinoma: current concepts and insights». 37 (5): 961–9. PMID 12717374. doi:10.1053/jhep.2003.50200
- ↑ de Groen P, Gores G, LaRusso N, Gunderson L, Nagorney D (1999). «Biliary tract cancers». N Engl J Med. 341 (18): 1368–78. PMID 10536130. doi:10.1056/NEJM199910283411807
- ↑ a b Henson DE, Albores-Saavedra J, Corle D (setembro de 1992). «Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates». Cancer. 70 (6): 1498–501. PMID 1516001. doi:10.1002/1097-0142(19920915)70:6<1498::AID-CNCR2820700609>3.0.CO;2-C
- ↑ Estudos do desempenho de marcadores séricos para colangiocarcinoma (como o antígeno carcinoembrionário e CA19-9) em pacientes com e sem colangite esclerosante primária incluem os seguintes:
- Nehls O, Gregor M, Klump B (2004). «Serum and bile markers for cholangiocarcinoma». Semin Liver Dis. 24 (2): 139–54. PMID 15192787. doi:10.1055/s-2004-828891
- Siqueira E, Schoen R, Silverman W, Martin J, Rabinovitz M, Weissfeld J, Abu-Elmaagd K, Madariaga J, Slivka A, Martini J (2002). «Detecting cholangiocarcinoma in patients with primary sclerosing cholangitis». Gastrointest Endosc. 56 (1): 40–7. PMID 12085033. doi:10.1067/mge.2002.125105
- Levy C, Lymp J, Angulo P, Gores G, Larusso N, Lindor K (2005). «The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis». Dig Dis Sci. 50 (9): 1734–40. PMID 16133981. doi:10.1007/s10620-005-2927-8
- Patel A, Harnois D, Klee G, LaRusso N, Gores G (2000). «The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis». Am J Gastroenterol. 95 (1): 204–7. PMID 10638584. doi:10.1111/j.1572-0241.2000.01685.x
- ↑ Saini S (1997). «Imaging of the hepatobiliary tract». N Engl J Med. 336 (26): 1889–94. PMID 9197218. doi:10.1056/NEJM199706263362607
- ↑ Sharma M, Ahuja V (1999). «Aetiological spectrum of obstructive jaundice and diagnostic ability of ultrasonography: a clinician's perspective». Trop Gastroenterol. 20 (4): 167–9. PMID 10769604
- ↑ Bloom C, Langer B, Wilson S (1999). «Role of US in the detection, characterization, and staging of cholangiocarcinoma». Radiographics. 19 (5): 1199–218. PMID 10489176. doi:10.1148/radiographics.19.5.g99se081199
- ↑ Valls C, Gumà A, Puig I, Sanchez A, Andía E, Serrano T, Figueras J (2000). «Intrahepatic peripheral cholangiocarcinoma: CT evaluation». Abdom Imaging. 25 (5): 490–6. PMID 10931983. doi:10.1007/s002610000079
- ↑ Tillich M, Mischinger H, Preisegger K, Rabl H, Szolar D (1998). «Multiphasic helical CT in diagnosis and staging of hilar cholangiocarcinoma». AJR Am J Roentgenol. 171 (3): 651–8. PMID 9725291. doi:10.2214/ajr.171.3.9725291
- ↑ Zhang Y, Uchida M, Abe T, Nishimura H, Hayabuchi N, Nakashima Y (1999). «Intrahepatic peripheral cholangiocarcinoma: comparison of dynamic CT and dynamic MRI». 23. 5 (670–7). PMID 10524843. doi:10.1097/00004728-199909000-00004
- ↑ Sugiyama M, Hagi H, Atomi Y, Saito M (1997). «Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography». Abdom Imaging. 22 (4): 434–8. PMID 9157867. doi:10.1007/s002619900227
- ↑ Schwartz L, Coakley F, Sun Y, Blumgart L, Fong Y, Panicek D (1998). «Neoplastic pancreaticobiliary duct obstruction: evaluation with breath-hold MR cholangiopancreatography». AJR Am J Roentgenol. 170 (6): 1491–5. PMID 9609160. doi:10.2214/ajr.170.6.9609160
- ↑ Zidi S, Prat F, Le Guen O, Rondeau Y, Pelletier G (2000). «Performance characteristics of magnetic resonance cholangiography in the staging of malignant hilar strictures». Gut. 46 (1): 103–6. PMC 1727781
 . PMID 10601064. doi:10.1136/gut.46.1.103
. PMID 10601064. doi:10.1136/gut.46.1.103 - ↑ Lee M, Park K, Shin Y, Yoon H, Sung K, Kim M, Lee S, Kang E (2003). «Preoperative evaluation of hilar cholangiocarcinoma with contrast-enhanced three-dimensional fast imaging with steady-state precession magnetic resonance angiography: comparison with intraarterial digital subtraction angiography». World J Surg. 27 (3): 278–83. PMID 12607051. doi:10.1007/s00268-002-6701-1
- ↑ Yeh T, Jan Y, Tseng J, Chiu C, Chen T, Hwang T, Chen M (2000). «Malignant perihilar biliary obstruction: magnetic resonance cholangiopancreatographic findings». Am J Gastroenterol. 95 (2): 432–40. PMID 10685746. doi:10.1111/j.1572-0241.2000.01763.x
- ↑ Freeman M, Sielaff T (2003). «A modern approach to malignant hilar biliary obstruction». Rev Gastroenterol Disord. 3 (4): 187–201. PMID 14668691
- ↑ Szklaruk J, Tamm E, Charnsangavej C (2002). «Preoperative imaging of biliary tract cancers». Surg Oncol Clin N Am. 11 (4): 865–76. PMID 12607576. doi:10.1016/S1055-3207(02)00032-7
- ↑ Weber S, DeMatteo R, Fong Y, Blumgart L, Jarnagin W (2002). «Staging Laparoscopy in Patients With Extrahepatic Biliary Carcinoma: Analysis of 100 Patients». Ann Surg. 235 (3): 392–9. PMC 1422445
 . PMID 11882761. doi:10.1097/00000658-200203000-00011
. PMID 11882761. doi:10.1097/00000658-200203000-00011 - ↑ Callery M, Strasberg S, Doherty G, Soper N, Norton J (1997). «Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy». J Am Coll Surg. 185 (1): 33–9. PMID 9208958. doi:10.1016/s1072-7515(97)00003-3
- ↑ Länger F, von Wasielewski R, Kreipe HH (2004). «Bedeutung der Immunhistochemie für die Diagnose des Cholangiokarzinoms» [Importância da imuno-histoquímica para o diagnóstico de colangiocarcinoma]. Pathologe (em alemão). 27 (4): 244–50. PMID 16758167. doi:10.1007/s00292-006-0836-z
- ↑ Darwin PE, Kennedy A. Colangiocarcinoma no eMedicine
- ↑ Zervos E, Osborne D, Goldin S, Villadolid D, Thometz D, Durkin A, Carey L, Rosemurgy A (2005). «Stage does not predict survival after resection of hilar cholangiocarcinomas promoting an aggressive operative approach». Am J Surg. 190 (5): 810–5. PMID 16226963. doi:10.1016/j.amjsurg.2005.07.025
- ↑ Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). «Management of Hilar Cholangiocarcinoma: Comparison of an American and a Japanese Experience». Ann Surg. 232 (2): 166–74. PMC 1421125
 . PMID 10903592. doi:10.1097/00000658-200008000-00003
. PMID 10903592. doi:10.1097/00000658-200008000-00003 - ↑ Rajagopalan V, Daines W, Grossbard M, Kozuch P (2004). «Gallbladder and biliary tract carcinoma: A comprehensive update, Part 1». Oncology (Williston Park). 18 (7): 889–96. PMID 15255172
- ↑ Su C, Tsay S, Wu C, Shyr Y, King K, Lee C, Lui W, Liu T, P'eng F (1996). «Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma». Ann Surg. 223 (4): 384–94. PMC 1235134
 . PMID 8633917. doi:10.1097/00000658-199604000-00007
. PMID 8633917. doi:10.1097/00000658-199604000-00007 - ↑ C. B. Rosen; J. K. Heimbach; G. J. Gores (2008). «Surgery for cholangiocarcinoma: the role of liver transplantation». The Official Journal of the International Hepato Pancreato Biliary Association. 10 (3): 186–9. PMC 2504373
 . PMID 18773052. doi:10.1080/13651820801992542
. PMID 18773052. doi:10.1080/13651820801992542 - ↑ Heimbach JK, Gores GJ, Haddock MG, et al. (dezembro de 2006). «Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma». Transplantation. 82 (12): 1703–7. PMID 17198263. doi:10.1097/01.tp.0000253551.43583.d1
- ↑ Kuhlmann, Jan B.; Blum, Hubert E. (maio de 2013). «Locoregional therapy for cholangiocarcinoma». Current Opinion in Gastroenterology. 29 (3): 324–8. ISSN 0267-1379. PMID 23337933. doi:10.1097/MOG.0b013e32835d9dea
- ↑ Todoroki T, Ohara K, Kawamoto T, Koike N, Yoshida S, Kashiwagi H, Otsuka M, Fukao K (2000). «Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma». Int J Radiat Oncol Biol Phys. 46 (3): 581–7. PMID 10701737. doi:10.1016/S0360-3016(99)00472-1
- ↑ Alden M, Mohiuddin M (1994). «The impact of radiation dose in combined external beam and intraluminal Ir-192 brachytherapy for bile duct cancer». Int J Radiat Oncol Biol Phys. 28 (4): 945–51. PMID 8138448. doi:10.1016/0360-3016(94)90115-5
- ↑ González González D, Gouma D, Rauws E, van Gulik T, Bosma A, Koedooder C (1999). «Role of radiotherapy, in particular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma». Ann Oncol. 10 (Suppl 4): 215–20. PMID 10436826. doi:10.1023/A:1008339709327
- ↑ Pitt H, Nakeeb A, Abrams R, Coleman J, Piantadosi S, Yeo C, Lillemore K, Cameron J (1995). «Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival». Ann Surg. 221 (6): 788–97; discussão em 797–8. PMC 1234714
 . PMID 7794082. doi:10.1097/00000658-199506000-00017
. PMID 7794082. doi:10.1097/00000658-199506000-00017 - ↑ Takada T, Amano H, Yasuda H, Nimura Y, Matsushiro T, Kato H, Nagakawa T, Nakayama T (2002). «Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma». Cancer. 95 (8): 1685–95. PMID 12365016. doi:10.1002/cncr.10831
- ↑ a b «National Comprehensive Cancer Network (NCCN) guidelines on evaluation and treatment of hepatobiliary malignancies» (PDF). NCCN. Consultado em 19 de agosto de 2018
- ↑ Vauthey J, Blumgart L (1994). «Recent advances in the management of cholangiocarcinomas». Semin. Liver Dis. 14 (2): 109–14. PMID 8047893. doi:10.1055/s-2007-1007302
- ↑ Glimelius B, Hoffman K, Sjödén P, Jacobsson G, Sellström H, Enander L, Linné T, Svensson C (1996). «Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer». Ann Oncol. 7 (6): 593–600. PMID 8879373. doi:10.1093/oxfordjournals.annonc.a010676
- ↑ Choi C, Choi I, Seo J, Kim B, Kim J, Kim C, Um S, Kim J, Kim Y (2000). «Effects of 5-fluorouracil and leucovorin in the treatment of pancreatic-biliary tract adenocarcinomas». Am J Clin Oncol. 23 (4): 425–8. PMID 10955877. doi:10.1097/00000421-200008000-00023
- ↑ Park J, Oh S, Kim S, Kwon H, Kim J, Jin-Kim H, Kim Y (2005). «Single-agent gemcitabine in the treatment of advanced biliary tract cancers: a phase II study». Jpn J Clin Oncol. 35 (2): 68–73. PMID 15709089. doi:10.1093/jjco/hyi021
- ↑ Giuliani F, Gebbia V, Maiello E, Borsellino N, Bajardi E, Colucci G (2006). «Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a multicenter phase II study of the Gruppo Oncologico dell'Italia Meridionale (GOIM)». Ann Oncol. 17 (Suppl 7): vii73–7. PMID 16760299. doi:10.1093/annonc/mdl956
- ↑ Bhargava P, Jani C, Savarese D, O'Donnell J, Stuart K, Rocha Lima C (2003). «Gemcitabine and irinotecan in locally advanced or metastatic biliary cancer: preliminary report». Oncology (Williston Park). 17 (9 Suppl 8): 23–6. PMID 14569844
- ↑ Knox J, Hedley D, Oza A, Feld R, Siu L, Chen E, Nematollahi M, Pond G, Zhang J, Moore M (2005). «Combining gemcitabine and capecitabine in patients with advanced biliary cancer: a phase II trial». J Clin Oncol. 23 (10): 2332–8. PMID 15800324. doi:10.1200/JCO.2005.51.008
- ↑ Philip P, Mahoney M, Allmer C, Thomas J, Pitot H, Kim G, Donehower R, Fitch T, Picus J, Erlichman C (2006). «Phase II study of erlotinib in patients with advanced biliary cancer». J Clin Oncol. 24 (19): 3069–74. PMID 16809731. doi:10.1200/JCO.2005.05.3579
- ↑ Bonet Beltrán M, Allal AS, Gich I,; et al. (2012). «Is adjuvant radiotherapy needed after curative resection of extrahepatic biliary tract cancers? A systematic review with a meta-analysis of observational studies». Cancer Treat Rev. 38 (2): 111–119. PMID 21652148. doi:10.1016/j.ctrv.2011.05.003
- ↑ Bridgewater JA, Goodman KA, Kalyan A, Mulcahy MF (2016). «Biliary Tract Cancer: Epidemiology, Radiotherapy, and Molecular Profiling». American Society of Clinical Oncology Educational Book. 36 (36): e194–e203. PMID 27249723. doi:10.1200/EDBK_160831
- ↑ Yamamoto M, Takasaki K, Yoshikawa T (1999). «Lymph Node Metastasis in Intrahepatic Cholangiocarcinoma». Japanese Journal of Clinical Oncology. 29 (3): 147–50. PMID 10225697. doi:10.1093/jjco/29.3.147
- ↑ Farley D, Weaver A, Nagorney D (1995). «"Natural history" of unresected cholangiocarcinoma: patient outcome after noncurative intervention». Mayo Clin Proc. 70 (5): 425–9. PMID 7537346. doi:10.4065/70.5.425
- ↑ Grove MK, Hermann RE, Vogt DP, Broughan TA (1991). «Role of radiation after operative palliation in cancer of the proximal bile ducts». Am J Surg. 161 (4): 454–58. PMID 1709795. doi:10.1016/0002-9610(91)91111-U
- ↑ Estudos de resultados cirúrgicos em colangiocarcinoma distal incluem:
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg. 224 (4): 463–73; discussão em 473–5. PMC 1235406
 . PMID 8857851. doi:10.1097/00000658-199610000-00005
. PMID 8857851. doi:10.1097/00000658-199610000-00005 - Jang J, Kim S, Park D, Ahn Y, Yoon Y, Choi M, Suh K, Lee K, Park Y (2005). «Actual Long-term Outcome of Extrahepatic Bile Duct Cancer After Surgical Resection». Ann Surg. 241 (1): 77–84. PMC 1356849
 . PMID 15621994. doi:10.1097/01.sla.0000150166.94732.88
. PMID 15621994. doi:10.1097/01.sla.0000150166.94732.88 - Bortolasi L, Burgart L, Tsiotos G, Luque-De León E, Sarr M (2000). «Adenocarcinoma of the distal bile duct. A clinicopathologic outcome analysis after curative resection». Dig Surg. 17 (1): 36–41. PMID 10720830. doi:10.1159/000018798
- Fong Y, Blumgart L, Lin E, Fortner J, Brennan M (1996). «Outcome of treatment for distal bile duct cancer». Br J Surg. 83 (12): 1712–5. PMID 9038548. doi:10.1002/bjs.1800831217
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg. 224 (4): 463–73; discussão em 473–5. PMC 1235406
- ↑ Estudos de desfecho em colangiocarcinoma intra-hepático incluem:
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg. 224 (4): 463–73; discussão em 473–5. PMC 1235406
 . PMID 8857851. doi:10.1097/00000658-199610000-00005
. PMID 8857851. doi:10.1097/00000658-199610000-00005 - Lieser M, Barry M, Rowland C, Ilstrup D, Nagorney D (1998). «Surgical management of intrahepatic cholangiocarcinoma: a 31-year experience». J Hepatobiliary Pancreat Surg. 5 (1): 41–7. PMID 9683753. doi:10.1007/PL00009949
- Valverde A, Bonhomme N, Farges O, Sauvanet A, Flejou J, Belghiti J. «Resection of intrahepatic cholangiocarcinoma: a Western experience». J Hepatobiliary Pancreat Surg. 6 (2): 122–7. PMID 10398898. doi:10.1007/s005340050094
- Nakagohri T, Asano T, Kinoshita H, Kenmochi T, Urashima T, Miura F, Ochiai T (2003). «Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma». World J Surg. 27 (3): 289–93. PMID 12607053. doi:10.1007/s00268-002-6696-7
- Weber S, Jarnagin W, Klimstra D, DeMatteo R, Fong Y, Blumgart L (2001). «Intrahepatic cholangiocarcinoma: resectability, recurrence pattern, and outcomes». J Am Coll Surg. 193 (4): 384–91. PMID 11584966. doi:10.1016/S1072-7515(01)01016-X
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). «Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors». Ann Surg. 224 (4): 463–73; discussão em 473–5. PMC 1235406
- ↑ As estimativas de sobrevida após cirurgia para colangiocarcinoma peri-hilar incluem:
- Burke E, Jarnagin W, Hochwald S, Pisters P, Fong Y, Blumgart L (1998). «Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system». Ann Surg. 228 (3): 385–94. PMC 1191497
 . PMID 9742921. doi:10.1097/00000658-199809000-00011
. PMID 9742921. doi:10.1097/00000658-199809000-00011 - Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). «Management of Hilar Cholangiocarcinoma: Comparison of an American and a Japanese Experience». Ann Surg. 232 (2): 166–74. PMC 1421125
 . PMID 10903592. doi:10.1097/00000658-200008000-00003
. PMID 10903592. doi:10.1097/00000658-200008000-00003 - Chamberlain R, Blumgart L (2000). «Hilar cholangiocarcinoma: a review and commentary». Ann Surg Oncol. 7 (1): 55–66. PMID 10674450. doi:10.1007/s10434-000-0055-4
- Washburn W, Lewis W, Jenkins R (1995). «Aggressive surgical resection for cholangiocarcinoma». Arch Surg. 130 (3): 270–6. PMID 7534059. doi:10.1001/archsurg.1995.01430030040006
- Nagino M, Nimura Y, Kamiya J, Kanai M, Uesaka K, Hayakawa N, Yamamoto H, Kondo S, Nishio H (1998). «Segmental liver resections for hilar cholangiocarcinoma». Hepatogastroenterology. 45 (19): 7–13. PMID 9496478
- Rea D, Munoz-Juarez M, Farnell M, Donohue J, Que F, Crownhart B, Larson D, Nagorney D (2004). «Major hepatic resection for hilar cholangiocarcinoma: analysis of 46 patients». Arch Surg. 139 (5): 514–23; discussão em 523–5. PMID 15136352. doi:10.1001/archsurg.139.5.514
- Launois B, Reding R, Lebeau G, Buard J (2000). «Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepatic bile duct cancers». J Hepatobiliary Pancreat Surg. 7 (2): 128–34. PMID 10982604. doi:10.1007/s005340050166
- Burke E, Jarnagin W, Hochwald S, Pisters P, Fong Y, Blumgart L (1998). «Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system». Ann Surg. 228 (3): 385–94. PMC 1191497
- ↑ Kaya M, de Groen P, Angulo P, Nagorney D, Gunderson L, Gores G, Haddock M, Lindor K (2001). «Treatment of cholangiocarcinoma complicating primary sclerosing cholangitis: the Mayo Clinic experience». Am J Gastroenterol. 96 (4): 1164–9. PMID 11316165. doi:10.1111/j.1572-0241.2001.03696.x
- ↑ Nakeeb A, Tran K, Black M, Erickson B, Ritch P, Quebbeman E, Wilson S, Demeure M, Rilling W, Dua K, Pitt H (2002). «Improved survival in resected biliary malignancies». Surgery. 132 (4): 555–63; discussão em 563–4. PMID 12407338. doi:10.1067/msy.2002.127555
- ↑ Khan SA, Taylor-Robinson SD, Toledano MB, Beck A, Elliott P, Thomas HC (dezembro de 2002). «Changing international trends in mortality rates for liver, biliary and pancreatic tumours». Journal of Hepatology. 37 (6): 806–13. PMID 12445422. doi:10.1016/S0168-8278(02)00297-0
- ↑ Landis S, Murray T, Bolden S, Wingo P (1998). «Cancer statistics, 1998». CA Cancer J Clin. 48 (1): 6–29. PMID 9449931. doi:10.3322/canjclin.48.1.6
- ↑ Vauthey JN, Blumgart LH (maio de 1994). «Recent advances in the management of cholangiocarcinomas». Seminars in Liver Disease. 14 (2): 109–14. PMID 8047893. doi:10.1055/s-2007-1007302
- ↑ Cancer Statistics Home Page — National Cancer Institute
- ↑ Múltiplos estudos independentes documentaram um aumento constante na incidência mundial de colangiocarcinoma. Alguns artigos de periódicos relevantes incluem:
- Patel T (maio de 2002). «Worldwide trends in mortality from biliary tract malignancies». BMC Cancer. 2 (10). PMC 113759
 . PMID 11991810. doi:10.1186/1471-2407-2-10
. PMID 11991810. doi:10.1186/1471-2407-2-10 - Patel T (junho de 2001). «Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States». Hepatology. 33 (6): 1353–7. PMID 11391522. doi:10.1053/jhep.2001.25087
- Shaib YH, Davila JA, McGlynn K, El-Serag HB (março de 2004). «Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase?». Journal of Hepatology. 40 (3): 472–7. PMID 15123362. doi:10.1016/j.jhep.2003.11.030
- West J, Wood H, Logan RF, Quinn M, Aithal GP (junho de 2006). «Trends in the incidence of primary liver and biliary tract cancers in England and Wales 1971-2001». British Journal of Cancer. 94 (11): 1751–8. PMC 2361300
 . PMID 16736026. doi:10.1038/sj.bjc.6603127
. PMID 16736026. doi:10.1038/sj.bjc.6603127 - Khan SA, Taylor-Robinson SD, Toledano MB, Beck A, Elliott P, Thomas HC (dezembro de 2002). «Changing international trends in mortality rates for liver, biliary and pancreatic tumours». Journal of Hepatology. 37 (6): 806–13. PMID 12445422. doi:10.1016/S0168-8278(02)00297-0
- Welzel TM, McGlynn KA, Hsing AW, O'Brien TR, Pfeiffer RM (junho de 2006). «Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States». Journal of the National Cancer Institute. 98 (12): 873–5. PMID 16788161. doi:10.1093/jnci/djj234
- Patel T (maio de 2002). «Worldwide trends in mortality from biliary tract malignancies». BMC Cancer. 2 (10). PMC 113759
Ligações externas[editar | editar código-fonte]
- «Câncer de vias biliares». na página oficial da Beneficência Portuguesa de São Paulo
- «Colangiocarcinoma». pelo portal da Fleury Medicina e Saúde
- «Colangiocarcinomas». por Luis Sérgio Leonardi e Miki Mochizuki, da página Hepcentro
- «Taxa de Sobrevida para Câncer de Via Biliar». no Instituto Oncoguia


 French
French Deutsch
Deutsch