Anilina – Wikipédia, a enciclopédia livre
Anilina[1], fenilamina ou aminobenzeno[2] é um composto orgânico, líquido, incolor e ligeiramente amarelo de odor característico e um sabor aromático cáustico[3], que se obtém a partir do nitrobenzol. Não se evapora facilmente à temperatura ambiente, sendo facilmente inflamável, queimando com uma chama fumacenta. A anilina é solúvel no éter e no álcool, bem como na maioria dos solventes orgânicos e inorgânicos.[2]
Com a anilina confeccionam-se os mais variegados corantes, desde o azul de metileno, passando pela fucsina, pela eosina, pelo vermelho-do-congo e pelo violeta-de-genciana, entre outros.[2]
Aplicações
[editar | editar código-fonte]A anilina é usada para fabricar uma ampla variedade produtos como por exemplo a espuma de poliuretano, produtos químicos agrícolas, pinturas sintéticas, antioxidantes, estabilizadores para a indústria do látex, herbicidas e vernizes e explosivos e também na fabricação de preservativos masculinos e femininos.
É usada, entre diversas outras funções, como matéria prima para inúmeros corantes, advindo daí, exatamente, o uso até errôneo deste termo como sinônimo de corante.
Estrutura e síntese
[editar | editar código-fonte]Consistindo de um grupo fenila ligado a um grupo amino, a anilina é normalmente produzida industrialmente em dois passos do benzeno:
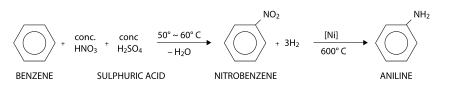
Primeiro, benzeno é nitrado usando uma mistura concentrada de ácido nítrico e ácido sulfúrico a 50 a 60 °C, o qual resulta em nitrobenzeno. No segundo passo, o nitrobenzeno é hidrogenado, tipicamente a 600 °C em presença de um catalisador de níquel para resultando na anilina. Como alternativa, anilina é também preparada do fenol e amônia, o fenol sendo derivado do cumeno.[4]
Derivados
[editar | editar código-fonte]Muitos derivados de anilina podem ser preparados de maneira similar. No comércio, três tipos de anilina são distinguidas - óleo de anilina para azul, o qual é anilina tecnicamente pura; óleo de anilina para vermelho, uma mistura de quantidades equimolares de anilina e orto- e para-toluidina; e óleo de anilina para safranina, a qual contém anilina e orto-toluidina, e é obtida pela destilação da fusão (escórias) da fucsina.
Propriedades
[editar | editar código-fonte]Oxidação
[editar | editar código-fonte]Anilina é incolor, ela lentamente oxida-se ao ar, resultando numa coloração castanho-avermelhada em amostras envelhecidas. A oxidação da anilina tem sido cuidadosamente investigada. Em solução alcalina, azobenzeno resulta, enquanto ácido arsênico produz a coloração violeta da chamada violanilina. Ácido crômico a converte em quinona, enquanto cloratos, na presença de certos sais metálicos, especialmente do vanádio), dando negro de anilina. Ácido clorídrico e clorato de potássio dão cloranil. Permanganato de potássio em solução neutra oxida-a em nitrobenzeno, em solução alcalina a azobenzeno, amônia e ácido oxálico, em solução ácida a negro de anilina. Ácido hipocloroso dá 4-aminofenol e para-amino-difenilamina.
Basicidade
[editar | editar código-fonte]Anilina é uma base fraca. Aminas aromáticas tais como a anilina são, em geral, bases muito mais fracas que aminas alifáticas. Anilina reage com ácidos fortes formando íon anilinium (ou anilínio, fenilamonium, fenilamônio) (C6H5-NH3+). O sulfato forma cristais em forma de belas placas brancas. Embora anilina seja fracamente básica, ela precipita sais de zinco, alumínio, e sais férricos, e, sob aquecimento, expele amônia de seus sais. A fraca basicidade é devido a um efeito indutivo negativo como o par solitário de elétrons no nitrogênio ser parcialmente deslocalizado no sistema pi do anel benzênico.
Acilação
[editar | editar código-fonte]Anilina reage com ácidos carboxílicos[5] ou mais facilmente com cloretos de acila tais como cloreto de acetila resultando em amidas. As amidas formadas de anilina são algumas vezes chamadas anilidas, por exemplo CH3-CO-NH-C6H5 é chamada de acetanilida. Antifebrina (acetanilida), um antipirético e analgésico, é obtido pela reação de ácido acético e anilina.
Derivados de N-alquila
[editar | editar código-fonte]Anilina combina-se diretamente com iodetos de alquila para formar aminas secundárias e terciárias. Metil e dimetilanilina são líquidos incolores preparados por aquecimento de anilina, cloridrato de anilina e metanol em um autoclave a 220 °C. Elas são de grande importância na indústria de corantes, assim como também, na produção de corantes específicos, a N,N-dietilanilina. Metilanilina ebule a 193-195 °C, dimetilanilina a 192 °C.
Derivados de enxofre
[editar | editar código-fonte]Por ebulição com dissulfeto de carbono, dá sulfocarbanilida (difenil tioureia), CS(NHC6H5)2, a qual pode ser decomposta em fenil isotiocianato, C6H5CNS, e trifenil guanidina, C6H5N=C(NHC6H5)2.
Como fenóis, derivados de anilina são altamente suscetíveis a reações de substituição eletrofílica. Por exemplo, a reação de anilina com ácido sulfúrico a 180 °C produz ácido sulfanílico, NH2C6H4SO3H, o qual pode ser convertido a sulfanilamida. Sulfanilamida é uma das sulfonamidas ou "sulfas" que foram largamente usadas como antibacterianos no início do século XX.
Diazotização
[editar | editar código-fonte]Por meio da diazotização ou reações de transferência de grupo diazo, a anilina e seus derivados substituídos no anel reagem com ácido nitroso formando sais de diazônio. Através deles, o grupo -NH2 da anilina pode ser convenientemente convertido a -OH, -CN, ou um haleto via a as reações de Sandmeyer. É uma importante reação na produção de compostos chamados azo-compostos, incluindo muitos corantes, por sua vez, chamados corantes azóicos.
Outras reações
[editar | editar código-fonte]Anilina reage com nitrobenzeno produzindo fenazina na reação de Wohl-Aue.
Seu acetato é usado no teste do acetato de anilina para carboidratos, identificando pentoses por conversão a furfural.
Toxicologia
[editar | editar código-fonte]A DL50 em ratos é de 440 mg/kg. Tem absorção tanto dérmica, como oral e pulmonar.
Referências
- ↑ Infopédia. «anilina | Definição ou significado de anilina no Dicionário Infopédia da Língua Portuguesa». Infopédia - Dicionários Porto Editora. Consultado em 14 de outubro de 2021
- ↑ a b c Infopédia. «anilina | Definição ou significado de anilina no Dicionário Infopédia de Termos Médicos». Infopédia - Dicionários Porto Editora. Consultado em 14 de outubro de 2021
- ↑ «ANILINA → Para que Serve? Estraga o Cabelo? Onde Comprar?【2019】». Lugar da Mulher. 28 de janeiro de 2019. Consultado em 26 de março de 2019
- ↑ Thomas Kahl, Kai-Wilfrid Schröder, "Aniline"; Ullmann's Encyclopedia of Industrial Chemistry 2007; John Wiley & Sons: New York.
- ↑ Carl N. Webb (1941). «Benzanilide». Org. Synth.; Coll. Vol., 1


 French
French Deutsch
Deutsch