Fosfortrioxide
| Fosfortrioxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
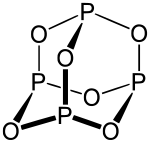 | ||||
Structuurformule van fosfortrioxide | ||||
| Algemeen | ||||
| Molecuulformule | P4O6 | |||
| IUPAC-naam | fosfortrioxide | |||
| Andere namen | tetrafosforhexaoxide, fosforsesquioxide | |||
| Molmassa | 109,946 g/mol | |||
| CAS-nummer | 1314-24-5 | |||
| Wikidata | Q411876 | |||
| Beschrijving | Kleurloze vloeistof of kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 2,13 g/cm³ | |||
| Smeltpunt | 23,8 °C | |||
| Kookpunt | 173 °C | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | monoklien | |||
| Dipoolmoment | 0 D | |||
| Evenwichtsconstante(n) | pKa = 9,2 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Fosfortrioxide is een ontvlambare anorganische verbinding van fosfor en zuurstof, met als brutoformule P4O6. Het komt voor als een kleurloze vloeistof of als kleurloze monokliene kristallen, die oplosbaar zijn in water.
Naamgeving[bewerken | brontekst bewerken]
De verbinding is veel eerder ontdekt en beschreven dan dat de mogelijkheden bestonden om de moleculaire structuur van de verbinding te bestuderen. Het gevolg is geweest dat de verbinding als anorganische stof puur op basis van zijn verhoudingsformule van een naam voorzien is: twee fosforatomen en drie zuurstofatomen levert als naam fosfortrioxide. Na vaststelling van de moleculaire structuur zou een naamsverandering op zijn plaats zijn. Verwarring is echter niet mogelijk, dus de noodzaak om de naam te wijzigen is niet groot.
Synthese[bewerken | brontekst bewerken]
Fosfortrioxide wordt gesynthetiseerd door reactie van witte fosfor met zuurstofgas:
Structuur[bewerken | brontekst bewerken]
Structureel is de vloeibare vorm verwant met adamantaan. De vaste vorm is kleurloos tot zilverwit, is extreem giftig en heeft een scherpe geur, vergelijkbaar met look. Het lage smeltpunt (voor een anorganische stof althans) geeft overigens aan dat ook in de vaste toestand de intermoleculaire krachten klein zijn. Dit wijst op het overwegend aannemen van een moleculaire kristalstructuur in plaats van een kristalrooster dat ten grondslag ligt aan de structuur van bepaalde zouten.
Eigenschappen en reacties[bewerken | brontekst bewerken]
Fosfortrioxide reageert met luchtzuurstof verder tot fosforpentoxide:
Bij een temperatuur van 210°C ontleedt de verbinding via een evenwichtsreactie in zuiver fosfor en fosfortetraoxide:
In water wordt fosfortrioxide omgezet naar fosforigzuur:
De reactie met zoutzuur leidt tot vorming van fosfortrichloride en fosforigzuur:


 French
French Deutsch
Deutsch




