Clausproces
Het clausproces is de belangrijkste manier om zwavelhoudende componenten uit industriële afvalgassen te verwijderen. De zwavel wordt uiteindelijk als moleculair zwavel (S8) verkregen. Hoewel het proces al in 1883 ontdekt werd, is het nog steeds een veel toegepaste methode in de industrie. Zwavel speelt in de chemische industrie een belangrijke rol. Het overgrote deel van de 71 miljoen ton die in 2007 wereldwijd geproduceerd werd, werd via het clausproces verkregen.[1][2] Zwavel wordt vervolgens omgezet in zwavelzuur of toegepast in geneesmiddelen, cosmetica, kunstmest en gevulkaniseerd rubber.
Geschiedenis[bewerken | brontekst bewerken]
Het clausproces is ontdekt en vernoemd naar Carl Friedrich Claus, een scheikundige die werkzaam was in Groot-Brittannië. In 1883 werd hem een patent verleend. De procedure is later aanmerkelijk verbeterd door de Duitse firma I.G.Farbenindustrie A.G.[3]
Scheikundige achtergrond[bewerken | brontekst bewerken]
Het clausproces is in essentie een meerstapsproces. De betreffende gasvormige zwavelverbinding is vooral waterstofsulfide, een onwelriekend en ontvlambaar toxisch gas. De gassen waaruit het verwijderd wordt zijn aardgas, raffinagefracties van ruwe aardolie of nevenproducten van de olieraffinage. Bij dit laatste moet dan gedacht worden aan afvalstoffen die ontstaan bij de chemische en fysische processen die gebruikt worden om benzine, diesel en dergelijke geschikt te maken voor gebruik in de verschillende motoren. Naast waterstofsulfide kunnen ook waterstofcyanide, koolwaterstoffen, zwaveldioxide en ammoniak in deze afvalgasmix voorkomen.
Waterstofsulfide ontstaat tijdens het raffineren van nafta en andere aardolieproducten. In het klassieke proces diende het waterstofsulfidegehalte van het gas minimaal 25% te bedragen. Later werd het mogelijk om het met behulp van zogenaamde split-flow-technieken (het vooraf verwarmen van gasstroom en gebruikte lucht) ook uit gasmengsels met een kleiner gehalte te isoleren.[4]
De brutoreactie van het clausproces betreft de partiële oxidatie van waterstofsulfide tot zwavel en water:[5]
Het eigenlijke proces verloopt in twee stappen. In eerste instantie wordt het waterstofsulfide volledig geoxideerd tot zwaveldioxide:
Deze reactie is sterk exotherm (ΔH = -1036,7 kJ/mol). Het ontstane zwaveldioxide wordt vervolgens met een overmaat waterstofsulfide gereduceerd tot zwavel:
In de eerste stap is controle van de hoeveelheid zuurstof belangrijk om in de tweede stap voldoende waterstofsulfide over te hebben.
Het proces[bewerken | brontekst bewerken]
In onderstaand schema is het stroomdiagram voor het clausproces weergegeven:[6]
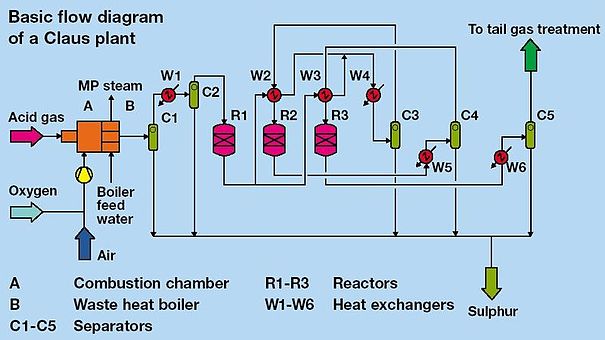
Het clausproces kan in twee stappen verdeeld worden: een thermische en een katalytische stap.
Thermische stap[bewerken | brontekst bewerken]
In de thermische stap reageert het waterstofsulfiderijke gas in een verbrandingsreactie met een stoichiometrische ondermaat zuurstofgas:
De aangewende temperatuur is hoger dan 850 °C.
Het gehalte waterstofsulfide en de hoeveelheden andere brandbare gassen (zoals koolwaterstoffen en ammoniak) bepalen op welke wijze de verbranding wordt uitgevoerd. Als clausgas ammoniak (dit wordt gebruikt bij het verwijderen van zuur gas uit afvalstromen) of koolwaterstoffen bevat dan is meer zuurstofgas nodig. De exacte hoeveelheid hangt dan af van de precieze samenstelling van het gebruikte gas. Essentieel voor de volgende stap is dat slechts een derde van het waterstofsulfide wordt omgezet in zwaveldioxide en water.
Om de reactie op een gecontroleerde manier te laten verlopen is het vaak nodig de verschillende soorten clausgassen apart te verbranden. Soms is het nodig de totale hoeveelheid gas te verkleinen of een hogere verbrandingstemperatuur te realiseren door in plaats van lucht pure zuurstof te gebruiken in de verbrandingsreactie.
Katalytische stap[bewerken | brontekst bewerken]
Het clausproces wordt voortgezet met de katalytische stap. Afhankelijk van de reactieomstandigheden verloopt deze stap ook al voor een deel tijdens het thermische gedeelte, meestal voor 60 tot 70%. De reactie tussen waterstofsulfide en zwaveldioxide wordt uitgevoerd met behulp van een vaste katalysator, doorgaans geactiveerd aluminiumoxide of titanium(IV)oxide.
Het hete gasmengsel wordt gekoeld waardoor het gevormde zwavel condenseert. Het grootste technische probleem in deze stap is enerzijds voldoende koeling realiseren en anderzijds voorkomen dat het gevormde zwavel als vaste stof neerslaat. Stoom ontstaat als bijproduct. Bovendien wordt vaak een deel van de gasstroom teruggevoerd naar het begin van het proces om het binnenkomende gas op de juiste reactietemperatuur te brengen.
Technische aspecten[bewerken | brontekst bewerken]
De omzetting van zwavelhoudende verbindingen in vaste zwavel wordt doorgaans in drie cycli uitgevoerd. Na één cyclus is er nog een te grote hoeveelheid zwavelhoudende verbindingen over, zoals zwaveldioxide, koolstofdisulfide en carbonylsulfide.
Hoewel de katalytische reactie bij lagere temperatuur verloopt dan de thermische, is de standaardtemperatuur voor dit proces nog steeds 315 °C tot 330 °C. Bij deze temperatuur worden carbonylsulfide en koolstofdisulfide omgezet. Deze twee stoffen ontstaan ook tijdens de verbrandingsreactie.
Bij lagere temperaturen (dan 315 °C) wordt wel een betere omzetting bereikt, maar het risico bestaat dat zwavel zal neerslaan op de katalysator, waardoor katalysatorvergiftiging optreedt en het productierendement daalt. Bovendien verloopt de reactie bij lagere temperatuur trager. Standaard werktemperaturen in het proces zijn 240 °C voor de tweede en 200 °C voor de derde cyclus.
In de zwavelcondensator wordt uiteindelijk de zwavel uit de gasstroom verwijderd. De condensatiewarmte en de restwarmte worden gebruikt om stoom te genereren. Voordat de ontstane zwavel wordt opgeslagen worden de laatste resten gas verwijderd, hetgeen vooral waterstofsulfide is.
Het gas dat uiteindelijk de reactor verlaat bevat nog steeds een aantal brandbare bestanddelen (zoals waterstofgas en koolstofmonoxide), evenals enkele zwavelhoudende verbindingen (waterstofsulfide en zwaveldioxide). Dit gas wordt verbrand of opnieuw gebruikt als invoer voor een volgende cyclus van het clausproces.
Procesefficiëntie[bewerken | brontekst bewerken]
Met twee katalytische stappen wordt doorgaans meer dan 97% van het zwavel uit de binnenkomende gasstroom verwijderd. Daarnaast wordt meer dan 2,6 ton stoom (ongeveer 140 m3) per ton zwavel geproduceerd. Om de procesefficiëntie te verhogen is het SCOT-proces (een acroniem voor het Engelse Shell Claus Off-gas Treating) ontwikkeld: hierbij worden de resterende hoeveelheden zwaveldioxide, koolstofdisulfide en carbonylsulfide met waterstofgas gereduceerd tot waterstofsulfide. De waterstofsulfide wordt in contact met een amine-oplossing gebracht en hierdoor wordt het waterstofsulfide geabsorbeerd door de oplossing. De amine-oplossing wordt in een regenerator geregenereerd. De schone amine-oplossing wordt weer naar de absorber gestuurd en het gas van de regenerator wordt naar het Clausproces gestuurd.
Als katalysator bij het SCOT-proces wordt kobalt-molybdeen op aluminiumoxide gebruikt. Het complete rendement van het Claus- en SCOT-proces bedraagt doorgaans 98 tot 99,9%.
Bronnen, noten en/of referenties
|


 French
French Deutsch
Deutsch


