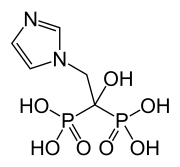
ゾレドロン酸
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ゾメタ, リクラスト |
| Drugs.com | monograph |
| MedlinePlus | a605023 |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | Intravenous |
| 薬物動態データ | |
| 血漿タンパク結合 | 22% |
| 代謝 | Nil |
| 半減期 | 146 hours |
| 排泄 | Renal (partial) |
| 識別 | |
| CAS番号 | 118072-93-8 |
| ATCコード | M05BA08 (WHO) |
| PubChem | CID: 68740 |
| IUPHAR/BPS | 3177 |
| DrugBank | DB00399 |
| ChemSpider | 61986 |
| UNII | 70HZ18PH24 |
| KEGG | D08689 en:Template:keggcite |
| ChEMBL | CHEMBL924en:Template:ebicite |
| PDB ligand ID | ZOL (PDBe, RCSB PDB) |
| 化学的データ | |
| 化学式 | C5H10N2O7P2 |
| 分子量 | 272.09 g/mol |
| |
| |
ゾレドロン酸(Zoledronic acid)またはゾレドロネート(Zoledronate)は、ビスホスホネート系製剤の1つであり白色の結晶性化合物。経静脈投与で使用される。骨粗鬆症や、悪性腫瘍の合併症としての高カルシウム血症などの治療に用いられる。日本での商品はリクラストまたはゾメタ[1]。
作用機序[編集]
ゾレドロン酸は骨吸収を抑制し、造骨細胞の骨再形成を促進する[2]。破骨細胞のアポトーシス誘導ならびにその機能喪失[3]が作用機序の本質であるとの見方もある[4]。
効能・効果[編集]
日本で承認されている効能・効果は、下記の3項目である[1][4]。
- 骨粗鬆症
- 悪性腫瘍による高カルシウム血症
- 多発性骨髄腫による骨病変および固形癌骨転移による骨病変
いずれの場合でも、点滴静脈注射に15分以上掛ける必要がある。急速な注入によって急性腎不全のリスクが上昇する。
悪性腫瘍の骨合併症[編集]
ゾレドロン酸は、多発性骨髄腫や前立腺癌などの悪性腫瘍による骨破壊を抑制する[5]。悪性腫瘍による高カルシウム血症の治療にも用いられ、骨転移に起因する癌性疼痛を改善する[6]。
骨転移を有する乳癌患者を対象とした臨床試験では、安全性と患者のQOL改善が確認されている[7]。日本で承認されている容量は4mg/回で、骨転移には1週間以上の間隔を置いて使用[8]、多発性骨髄腫には3-4週間隔で投与する[8]。
骨粗鬆症[編集]
ゾレドロン酸は、骨折リスクの上昇している男性および閉経後女性の骨粗鬆症治療薬として5mg点滴静注を年1回投与することができる。2007年、米国FDAは閉経後の骨粗鬆症の治療薬として承認した[9]。2016年9月、日本でも骨粗鬆症治療薬として製造販売承認された[10]。
日本国内の臨床試験では、2回の投与(24か月間)で、骨密度を平均8.6%改善する[10]。5回の投与(60か月)でもリスク・ベネフィットは逆転されないことが臨床試験で確認されている。臨床試験は、天然型ビタミンD400単位とカルシウム610mgを併用して実施されている。
ページェット病[編集]
骨ページェット病の治療にもゾレドロン酸5mg単回投与が用いられる[11]。
副作用[編集]
添付文書に記載されている重大な副作用は、
である[8]。
5%以上に発生する副作用は低リン酸血症、頭痛、嘔気、肝機能異常(AST(GOT)、ALT(GPT)、γ-GTP増加)、関節痛、骨痛、尿中β2-ミクログロブリン増加、発熱、倦怠感である。
そのほか、貧血、筋肉痛、足部浮腫などがある。初回投与後にインフルエンザ様症状が起こることが多いが、2回目以降の投与では発生しない。インフルエンザ様症状はヒトγδT細胞の活性化が原因であると思われる。
腎障害リスク(1%-10%未満)があるので、投与前の水分補給が重要である。またカルシウム値の低い患者に投与する前には充分量のカルシウムおよびビタミンD投与が必要である。骨ページェット病の場合は投与後10日間は経過観察すること。他の無機質の血中濃度異常にも気を付ける必要がある。顎骨壊死を起こさないため、侵襲的歯科処置を避ける[12]。
ゾレドロン酸は投与後速やかに腎臓から排泄されるので、腎機能が低下している患者や腎疾患を有する患者には推奨されない[13]。投与後は腎機能検査を実施して、機能低下が認められた場合には投与中止を検討する[4]:重要な基本的注意。急性腎不全で致死的な経過を辿った症例がある[14]。これを受けてEMAのCHMPは2011年12月に新たな禁忌を設定した。低カルシウム血症ならびにクレアチニンクリアランスが35mL/分未満の場合である[15]。
ビスホスホネートの稀な副作用として顎骨壊死がある。多発性骨髄腫をゾレドロン酸で治療した患者を抜歯した場合等に発生する[16]。
2009年7月の承認後、非定型骨折が発生した症例がいくつか報告された後に、EMAは全てのビスホスホネート系(ゾレドロン酸を含む)を対象として骨折のリスクについて検討した[17]。2008年、EMAの医薬品監視検討会(Pharmacovigilance Working Party (PhVWP))はアレンドロン酸が大腿骨の非外傷性の非定型骨折の可能性を増加させることを示した。2010年4月、PhVWPは、公表文献ならびに市販後の症例報告の双方から得られたさらなるデータが、非定型骨折がビスホスホネート系薬剤に共通の副作用であることを示していると指摘した。EMAはその後、文献および企業からの症例報告の双方から得られた、ビスホスホネートを投与された患者の疲労性骨折の症例全てを検討した。EMAは、ビスホスホネートを処方する医師は、特に骨粗鬆症の治療薬として長期投与されている場合は稀に大腿骨の非定型骨折が発生することがあることを認識し、特に5年以上継続した後は、投与継続の可否について繰り返し検討すべきであると推奨した[17]。
研究開発[編集]
ゾレドロン酸は、直接的な抗腫瘍効果を有し、骨肉腫細胞に対する他の抗腫瘍剤の効果を相乗的に増強することが見出されている[18]。
ゾレドロネートを骨粗鬆症患者に投与すると、3年間を超える投与で偽薬に対する有意な利益を示し、圧迫骨折の数が減少して、骨密度のマーカーを改善した[19][20]。股関節骨折の既往がある患者に毎年ゾレドロン酸を投与する事で、骨折再発を減少させることができた[21]。
非外傷性大腿骨頭壊死症患者を対象にゾレドロン酸の圧潰予防効果を検討した結果、予防効果は見られなかった[22]。
乳癌治療でのホルモンとの併用[編集]
閉経前女性の内分泌応答性早期乳癌に対する臨床試験(ABCSG-12試験)の結果、アナストロゾールとゾレドロン酸を併用した患者群で無病生存期間(Disease-Free Survival、DFS)が延長した[23]。AZURE試験のデータを後付解析した結果、特にエストロゲンが減少していた患者で、DFSが延長していた事が明らかにされた[24]。
アロマターゼ阻害薬関連骨量減少の予防を目的にゾレドロン酸を投与した臨床試験をメタ・アナリシスした結果、癌増悪の減少が観察された[25]。早期のホルモン受容体陽性乳癌のアジュバント療法についての臨床試験では、ホルモン治療中、特にゾレドロン酸を併用した場合に骨その他部位での疾患増悪が減少することを示した。多くの臨床試験、in vitro 非臨床試験、in vivo 前臨床試験で、ビスホスホネートの抗腫瘍活性とその作用機序の研究が進んでいる[26]。実施中の大規模臨床試験には、NSABP試験B-34[27]、NATAN試験[28]、SWOG-S0307試験[29]がある。2010年の米国のレビューでは、『閉経前女性のホルモン受容体陽性早期乳癌にゾレドロン酸を6ヶ月毎に4mgを点滴静注で追加投与することは、医療制度全体に有益な影響を与える』とした[30]。
禁忌[編集]
日本では、下記について禁忌とされている。
- 製剤成分または他のビスホスホン酸塩に対し、過敏症の既往歴のある患者
- 妊婦または妊娠している可能性のある婦人
日本以外で設定されている禁忌は、下記の通りである。
出典[編集]
- ^ a b 「リクラスト点滴静注液5mg」の国内製造販売承認取得について 2016年9月28日 旭化成ファーマ株式会社 2016年9月28日閲覧
- ^ Aclasta label- Australia
- ^ Jordão FM, Saito AY, Miguel DC, et al. (2011-05). “In vitro and in vivo antiplasmodial activities of risedronate and its interference with protein prenylation in Plasmodium falciparum.”. Antimicrob Agents Chemother. 55 (5): 2026–31. doi:10.1128/AAC.01820-10. PMID 21357292 2015年8月8日閲覧。.
- ^ a b c “ゾメタ点滴静注4mg/5mL 添付文書” (2016年5月). 2016年6月28日閲覧。
- ^ “Zoledronic acid (calcium and bone metabolism medicines)”. National Prescribing Service (2009年). 2015年8月8日閲覧。
- ^ Zomera prescribing information
- ^ Wardley, Davidson (2005-05-03). “Zoledronic acid significantly improves pain scores and quality of life in breast cancer patients with bone metastases: a randomised, crossover study of community vs hospital bisphosphonate administration.”. Br J Cancer. 92 (10): 1869–76. doi:10.1038/sj.bjc.6602551. PMID 15870721 2015年8月8日閲覧。.
- ^ a b c ゾメタ添付文書 ノバルティス製薬 2016年9月30日閲覧
- ^ “FDA Approves Reclast to Prevent Osteoporosis in Postmenopausal Women With Convenient Less Frequent Dosing”. Drug.com (2009年6月). 2015年8月8日閲覧。
- ^ a b リクラスト点滴静注液5mg 添付文書
- ^ “Paget's Disease of Bone”. 2015年7月9日閲覧。
- ^ ACLASTA Zoledronic acid Consumer Medicine Information
- ^ Zometa 4mg/5ml Concentrate for Solution for Infusion
- ^ Reclast (zoledronic acid): Drug Safety Communication - New Contraindication and Updated Warning on Kidney Impairment
- ^ http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000595/smops/Positive/human_smop_000319.jsp&mid=WC0b01ac058001d127
- ^ Durie BG, Katz M, Crowley J (2005). “Osteonecrosis of the jaw and bisphosphonates”. N. Engl. J. Med. 353 (1): 99–102; discussion 99–102. doi:10.1056/NEJM200507073530120. PMID 16000365.
- ^ a b http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/public_health_alerts/2011/04/human_pha_detail_000027.jsp&mid=WC0b01ac058001d126
- ^ Koto K, Murata H, Kimura S, et al. (July 2010). “Zoledronic acid inhibits proliferation of human fibrosarcoma cells with induction of apoptosis, and shows combined effects with other anticancer agents”. Oncol. Rep. 24 (1): 233–9. doi:10.3892/or_00000851. PMID 20514467.
- ^ Reid IR, Brown JP, Burckhardt P, Horowitz Z, Richardson P, Trechsel U, Widmer A, Devogelaer JP, Kaufman JM, Jaeger P, Body JJ, Brandi ML, Broell J, Di Micco R, Genazzani AR, Felsenberg D, Happ J, Hooper MJ, Ittner J, Leb G, Mallmin H, Murray T, Ortolani S, Rubinacci A, Saaf M, Samsioe G, Verbruggen L, Meunier PJ (2002). “Intravenous zoledronic acid in postmenopausal women with low bone mineral density”. N. Engl. J. Med. 346 (9): 653–61. doi:10.1056/NEJMoa011807. PMID 11870242.
- ^ Black et al.. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. NEJM 2007;356;18;1809-1822. Abstract
- ^ Lyles K, et al. (2007). “Zoledronic Acid and Clinical Fractures and Mortality after Hip Fracture”. N. Engl. J. Med. 357 (18): 1799–809. doi:10.1056/NEJMoa074941. PMID 17878149.
- ^ Lee YK, Ha YC, Cho YJ, et al. (2015-07-15). “Does Zoledronate Prevent Femoral Head Collapse from Osteonecrosis? A Prospective, Randomized, Open-Label, Multicenter Study.”. J Bone Joint Surg Am. 97 (14): 1142-8. doi:10.2106/JBJS.N.01157. PMID 26178889 2015年8月8日閲覧。.
- ^ PMID 19213681 Gnant, Mlineritsch. Endocrine therapy plus zoledronic acid in premenopausal breast cancer. N Engl J Med 2009; 360:679-691 February 12, 2009 Full Free Text [1]
- ^ Coleman RE, Winter MC, Cameron D, et al. (March 2010). “The effects of adding zoledronic acid to neoadjuvant chemotherapy on tumour response: exploratory evidence for direct anti-tumour activity in breast cancer”. Br. J. Cancer 102 (7): 1099–105. doi:10.1038/sj.bjc.6605604. PMC 2853093. PMID 20234364.
- ^ Brufsky A, Bundred N, Coleman R, et al. (May 2008). “Integrated analysis of zoledronic acid for prevention of aromatase inhibitor-associated bone loss in postmenopausal women with early breast cancer receiving adjuvant letrozole”. Oncologist 13 (5): 503–14. doi:10.1634/theoncologist.2007-0206. PMC 1069061. PMID 18515735.
- ^ Tonyali O, Arslan C, Altundag K (November 2010). “The role of zoledronic acid in the adjuvant treatment of breast cancer: current perspectives”. Expert Opin Pharmacother 11 (16): 2715–25. doi:10.1517/14656566.2010.523699. PMID 20977404.
- ^ Brufsky A, Bundred N, Coleman R, et al. (May 2008). “Integrated analysis of zoledronic acid for prevention of aromatase inhibitor-associated bone loss in postmenopausal women with early breast cancer receiving adjuvant letrozole”. Oncologist 13 (5): 503–14. doi:10.1634/theoncologist.2007-0206. PMC 1069061. PMID 18515735.
- ^ Phase III Postoperative Use of Zoledronic Acid in Breast Cancer Patients After Neoadjuvant Chemotherapy (NATAN)
- ^ http://www.cancer.gov/clinicaltrials/search/view?cdrid=437061&version=healthprofessional
- ^ Delea TE, Taneja C, Sofrygin O, Kaura S, Gnant M (August 2010). “Cost-effectiveness of zoledronic acid plus endocrine therapy in premenopausal women with hormone-responsive early breast cancer”. Clin. Breast Cancer 10 (4): 267–74. doi:10.3816/CBC.2010.n.034. PMID 20705558.
- ^ Vondracek, S. F. (2010). “Managing osteoporosis in postmenopausal women”. American Journal of Health-System Pharmacy 67 (7 Suppl 3): S9–19. doi:10.2146/ajhp100076. PMID 20332498.


 French
French Deutsch
Deutsch