シアノコバラミン
| シアノコバラミン | |
|---|---|
 | |
| 識別情報 | |
| CAS登録番号 | 68-19-9 |
| PubChem | 16212801 |
| EC番号 | 200-680-0 |
| KEGG | D00166 C02823 |
| 特性 | |
| 化学式 | C63H88CoN14O14P |
| モル質量 | 1355.38 g/mol |
| 外観 | 暗赤色固体 |
| 融点 | > 300 ℃ |
| 沸点 | > 300 ℃ |
| 水への溶解度 | Soluble |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS from Fisher Scientific |
| EU分類 | 無し |
| NFPA 704 | |
| Sフレーズ | S24/25 |
| 引火点 | N/A |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シアノコバラミン(cyanocobalamin)は、ヒドロキソコバラミンなどと共にビタミンB12とも呼ばれる代表的なコバラミンの一種であり、ビタミンの中で水溶性ビタミンに分類される生理活性物質である。コバルトを含むため赤色又はピンク色を呈する[1]。
名称[編集]
B群ビタミンのひとつだが、12は発見された順番を表す数字ではない。
生合成[編集]
シアノコバラミンは化合物を単離する際に得られる人工産物で、喫煙者などの特殊な場合(煙中のシアン化水素代謝産物が活性型ビタミンB12と結合しシアノコバラミンを生ずる。ただし活性型ビタミンB12の不足を招き有害[2]。)を除き、人間の体内ではシアノコバラミンは合成できない。草食動物は腸内細菌としてプロピオン酸生産菌(プロピオニバクテリウム属[3])等を保有し、これがビタミンB12を生産するので、これらの菌からビタミンB12を摂取している[4]。
アミノ酸や脂肪酸の代謝および葉酸の生合成に用いられる。これ自体に補酵素活性はなく、生体内で補酵素型であるメチルコバラミンおよびアデノシルコバラミンに変換される。
構造[編集]
ポルフィリン類似のコリン環とヌクレオチドの構造をもつ、コバルトの錯体である。
シアノコバラミンは合成が極めて困難であるため、現在は放線菌(プロピオニバクテリウム属[3])などの細菌の培養液から生産されている[5]。
機能[編集]

ビタミンB12は代謝に関与しており、特にDNA合成と調整に加え脂肪酸の合成とエネルギー産生に関与している。しかしながら、体内でビタミンB12が葉酸(ビタミンB9)の再生産に利用されているため、全てではないが多くのビタミンB12の機能は十分な量の葉酸によって代替される。チミンやプリン体の合成のための十分な量の葉酸が体内に存在しない場合にはDNA合成障害を引き起こし、その葉酸欠乏症状は悪性貧血症状や巨赤芽球性貧血を引き起こすため、ほとんどのビタミンB12欠乏症状は実際には葉酸欠乏症状である[6]。十分な量の葉酸が利用できる場合には、メチルマロン酸(MMA)を代謝するビタミンB12依存酵素であるメチルマロニルCoAムターゼ(MUT)やホモシステインを基質としてメチオニンを合成する酵素として知られている5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼ(MTR)を助けることになり、ビタミンB12欠乏症として知られるほとんどの症状は正常化される。
ビタミンB12補酵素の反応性の高いC-Co結合が3つの主な酵素反応に関連している。
1番目は異性化酵素反応である。1番目の置換基である水素原子と酸素原子、アルコール基、アミノ基などと、1番目の置換基と隣り合った2番目の置換基である炭素原子(X基)を直接移動させる再配置である。例として、メチルマロニルCoAをスクシニルCoAに変換する反応である。
2番目はメチル基転移反応である。メチル基が2つの分子間を移動する。例として5-メチルテトラヒドロ葉酸を脱メチル化してテトラヒドロ葉酸に変化させると同時に、ホモシステインをメチル化してメチオニンへ変換させる。
3番目は脱ハロゲン反応である。有機化合物からハロゲン原子が離脱される反応である。この種の酵素はヒトからは発見されていない。
ヒトにおいては、上記最初の2つの反応に対応した2つの主要なビタミンB12依存酵素が知られている。それらは次に示す2種類の酵素である。
第1の酵素[編集]
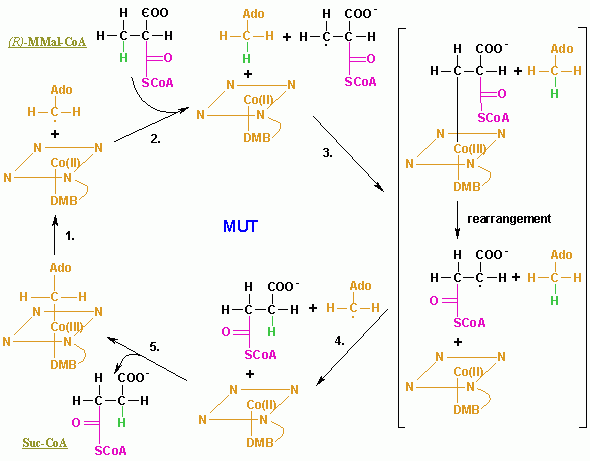
MUT(メチルマロニルCoAムターゼ)は、アデノシルコバラミン型と炭素骨格の再配置(X基は-COSCoA)を触媒する反応型1の異性化酵素である。MUTの反応は、メチルマロニルCoAをスクシニルCoAに変換し、タンパク質や脂肪からエネルギーを抽出する重要なステップを担っている。この機能はビタミンB12欠乏症により失われてしまい、その機能はメチルマロン酸血中濃度で医学的に測定することができる。ビタミンB12欠乏症患者の90-98%は、メチルマロン酸の濃度が増加する。このようにメチルマロン酸の濃度上昇はビタミンB12欠乏症に鋭敏に反応するが、メチルマロン酸の濃度上昇の原因がビタミンB12欠乏症のみに限らないことに注意が必要である。70歳を超える被験者の20-25%はメチルマロン酸の濃度が増加するが、それらの25-33%はビタミンB12欠乏症ではない。したがって高齢者にはメチルマロン酸濃度での判定は勧められない。しかし、メチルマロン酸値の上昇は、マロン酸値の上昇を伴う場合、見落とされがちな[7]代謝異常、マロン酸およびメチルマロン酸尿合併症(CMAMMA)を示すこともある[8]。ビタミンB12の欠乏が起こると体内組織は備蓄したビタミンB12を取り崩して血中濃度を維持するため、ビタミンB12欠乏症の黄金律試験は存在しないのである[9]。それゆえ欠乏症を示し始めるビタミンB12血中濃度が、必要最低限のビタミンB12の状態を示しているわけではない。ミエリン形成や中枢神経の働きに必要なビタミンB12依存酵素MUTの機能は葉酸摂取に影響を受けることはない。MTR(5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼ)機能障害に関連したDNA合成に関わるビタミンB12のその他の機能は葉酸摂取によって正常化することができるが、MTRによるメチオニンへ通常変換されるホモシステインの濃度上昇を正常化することはできない。
第2の酵素[編集]
MTR(5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼ)は、メチオニン合成酵素として知られており、ビタミンB12の一種であるメチルコバラミンを利用してホモシステインをメチオニンに変換する第2の種類の反応を触媒するメチル基転移酵素である[9]。 この転移機能はビタミンB12欠乏症で失われ、医学的にホモシステインの濃度の上昇で判定することができる。ビタミンB12は、葉酸の活性型であるテトラヒドロ葉酸(THF)の再生産を手助けしているため、葉酸欠乏症でもホモシステイン濃度の上昇が起こり得る。ビタミンB12なしではテトラヒドロ葉酸は5-メチルテトラヒドロ葉酸に変化してテトラヒドロ葉酸に戻ることができない。MTRはホモシステインの存在下で5-メチルテトラヒドロ葉酸と反応してメチオニンとTHFを生成し、それゆえ食事からの新たな葉酸の摂取の必要性が少なくなる。THFはホモシステインからメチオニンへの変換に伴って生成されるか、食事から得られることとなる。それはビタミンB12非依存のチミン合成に関わる5,10-メチレンテトラヒドロ葉酸(5,10-メチレン-THF)のプロセスによって変換される。5,10-メチレン-THFの利用の減少はDNA合成に障害をもたらし、血球や吸収を司る腸壁細胞のように回転率の高い細胞分裂で障害が生じる。血球細胞の合成障害は、かつて致死性の病として恐れられていた悪性貧血を引き起こす。悪性貧血の巨赤芽球性貧血を含めたすべてのDNA合成の影響は、十分な葉酸の存在により解決される。これは十分な葉酸があれば必要な5,10-メチレン-THFが残るからである。DNA合成、細胞分裂や悪性貧血に関連するビタミンB12の最もよく知られている機能は、効率的なDNA生成に必要な活性型の葉酸のビタミンB12による維持機能である[10]。その他のコバラミンを必要とするメチル基転移酵素は、バクテリア中のMメチル転移酵素(Me-H4-MPT)が知られている。
十分な葉酸存在下でのMUT及びMTR欠損疾患[編集]
十分な葉酸が存在している場合には、ヒトにおいてビタミンB12依存酵素であるMUT関連反応は神経系に最も特徴的な副次影響を示す。これは、葉酸の再生産に関連したメチル基転移型のMTR反応が、葉酸が十分存在している場合にはその欠乏の影響が明らかでなくなるためである。
1990年代後半から多くの国々で強化小麦粉として葉酸が添加され始めてから葉酸欠乏症は稀となった。同時に貧血と赤血球のサイズに関連したDNA合成感受性試験が小規模の医学試験所でも日常的に行われているため、ビタミンB12欠乏症に影響を受けるMTRはDNA合成障害による貧血のような古典的症状のように明らかでなく、血中や尿中のホモシステイン濃度の上昇のようにあまり明らかでない症状で判別されることになる。この症状は、動脈と(脳卒中や心臓発作に影響する)凝固系へ長期間にわたりダメージを与えるが、この影響はアテローム性動脈硬化症や老化と関連したその他の要因と分離するのが難しい。
ビタミンB12欠乏症の結果によるミエリンの損傷は、適切な量の葉酸やメチオニンの存在があっても、より特徴的で明確なビタミン欠乏の問題となる。これは、メチルマロニルCoAからスクシニルCoAへ代謝されるに際して絶対必要なMUTと関連した反応により最も直接的に結び付いている。この2番目の反応の障害はメチルマロン酸の濃度の上昇をもたらし、ミエリンの不安定さをもたらす。過剰なメチルマロン酸は、通常の脂肪酸合成に障害をもたらし、通常のマロン酸よりもより通常の脂肪酸合成に悪影響を与えている。異常な脂肪酸がミエリンに影響を与えているのなら、結果としてミエリンは脆くなり、ミエリンの崩壊が発生する。しかしながら正確なメカニズムは解明されていない。結果として亜急性の中枢神経と脊髄の複合した崩壊が引き起こされる[11]。たとえ葉酸が十分に存在して貧血が発生していなくとも、原因が何であれ、ビタミンB12欠乏症はニューロパチーを引き起こす。
ビタミンB12依存のMTR反応は、間接的なメカニズムではあるが神経に障害を与える影響を起こす。ミエリン鞘のリン脂質のメチル化に必要なS-アデノシルメチオニンを合成するには(もしビタミンB12によりホモシステインから再生産されない場合には、葉酸のように食事中から摂取しなければならないように)適切なメチオニンが必要である。S-アデノシルメチオニンの合成はビタミンB12に依存しないが、ビタミンB12は基質の原料となる必須アミノ酸のメチオニンの再利用を手助けしている。加えて、S-アデノシルメチオニンは神経伝達物質、カテコールアミンの合成や脳内の代謝に関わっている。これらの神経伝達物質は、気分を保つために重要で、ビタミンB12欠乏症が抑うつとなぜ関連しているかを説明しうるものである。葉酸を大量に摂取しない限り、ミエリン鞘のリン脂質のメチル化は、MTRの再利用に関係して適切な量の葉酸に依存するかもしれない。
類縁体[編集]
コバルト上のシアノ基をメチル基に置き換えたメチルコバラミン (methylcobalamin) や、5-デオキシアデノシル基に置き換えたアデノシルコバラミン (adenosylcobalamin) などが存在する。ヒドロキシ基に置き換えるとヒドロキソコバラミンになる。
CN基がヌクレオチドに置換されることによって、補酵素型であるコバミドとなる。
1964年、ドロシー・ホジキンらは、X線構造解析によってシアノコバラミンの構造決定を果たしノーベル化学賞を受賞した。
吸収メカニズム[編集]
ハプトコリンや内因子は、以下に述べるビタミンB12吸収メカニズムの一端を担っている[12]。
- ハプトコリンは、唾液腺から分泌され、Rタンパク質とも呼ばれている。
- 食事中のビタミンB12は、タンパク質と結び付いており、胃のペプシンがタンパク質を分解しビタミンB12が遊離される。
- 胃の中で遊離したビタミンB12はハプトコリンと強く結び付き、安定化し、胃内の強酸性下でのビタミンB12の分解を防いでいる。
- ビタミンB12とハプトコリンの結合体は、胃から十二指腸に移動し、ハプトコリンが膵液によって消化され、ビタミンB12が遊離し、胃で分泌された内因子と結び付く。
- このビタミンB12と内因子との結合体は回腸終端部の柔毛から腸上皮細胞に吸収される。
正常な胃の機能を有した(萎縮性胃炎などにより内因子の分泌障害のない)健康な成人での食事中のビタミンB12の吸収率は50%程度であると言われている[13][14]。ビタミンB12は内因子と結び付かないと腸から効果的に吸収されないため、内因子の分泌量が制約要因となり食事当たり2μg 程度でビタミンB12の吸収が飽和する[15][16]。このため、過剰のビタミンB12を摂取しても生理的には吸収されない。胃から分泌された内因子と結合して回腸から吸収されたビタミンB12は、輸送タンパク質であるトランスコバラミンと結合して血液中を運搬され、主に肝臓に貯蔵されることとなる。平均排泄量2. 5 μg/日のビタミンB12化合物が胆汁中に排泄され[17]、胆汁中に排泄されるビタミンB12の半数は内因子と結びついて腸肝循環により再吸収され、残りは糞便へ排泄される[18]。
医療[編集]
シアノコバラミンは眼精疲労の治療薬として市販される点眼薬に配合されているほか、医療用として参天製薬より「サンコバ点眼液0.02%」として販売されている。他にも補酵素型ビタミンB12のメチルコバラミンも医療用医薬品として販売されており、末梢神経障害や悪性貧血の治療に用いられる。
摂取源[編集]
海洋性食品である海苔、貝、動物性食品の肝に30-0µgと非常に多く含有される[19][20]。魚類には、0.5-30µgほど含まれる[19]。畜産食品では、肝臓と舌以外に、肉類は0.3-2.5µg、生卵は0.9µg、普通牛乳は0.3µgほどが含まれる[19]。
植物によるビタミンB12の摂取[編集]
ビタミンB12は、穀類、芋類、砂糖類、豆類、野菜類、果実にはほとんど含有されない[19]。例外的に、野菜ではビタミンB12の水溶液をかいわれに吸収させた「マルチビタミンB12かいわれ」が開発され、6.8µg含んでいる[21][22]。
また、ビタミンB12が不足しやすい菜食主義者に対して、海苔が摂取源として有効かどうかには議論がある。
文部科学省の発行する五訂増補日本食品標準成分表では海苔類はビタミンB12を含有するとされている[23]。五訂増補日本食品標準成分表に掲載されている海苔のビタミンB12含有量は、近年の主流となってきた化学発光免疫測定法に基づく自動分析法ではなく、測定精度が低く、なおかつ熟練を要する微生物法により測定された値である[24]。市販の複数の藻類のビタミンB12含有量を微生物法と化学発光法で測定した結果、スジアオノリやスサビノリ、クロレラが多量に含有するビタミンB12のほとんどが生理的に有効なビタミンB12であり、人間が対象ではないため参考データではあるが、ビタミンB12欠乏ラットを用いた実験ではこれらの海苔がビタミンB12供給源として有効であると報告されている[25][26]。
一方で、2002年に複数の文献を検査した海外のベジタリアンのサイトの報告によれば、生海苔を乾燥させた乾燥海苔はビタミンB12の供給源になるという結論を持った論文に対して、そのデータに対してそうではないとの見解を示し、テンペ、生海苔、円石藻類のみがビタミンB12源として確実な摂取源であるかさらに研究されるべきであるとする報告もある[27][28]。日本の研究者は、海外では藻類を食する文化がないため、適切でない乾燥方法を用いた藻類のビタミンB12が生理的に不活性になることがあるという報告があると指摘している[26]。
1995年に、鈴木英鷹が行った調査では、厳格な玄米菜食の菜食歴4~10年の7~14歳の子供6名を対象とした研究において、1日あたり2~4gの海苔を摂取した場合、コントロール群とビタミンB12値などに有意差がないために、厳格な玄米菜食を行う子供でも海苔を食べることによってビタミンB12の欠乏を防ぐことができると報告している[29]。この研究は血清ビタミンB12値とMCV(平均赤血球容積)だけの計測結果である。海外のベジタリアンのサイトの報告では、血清ビタミンB12値は、ビタミンB12欠乏症を悪化させる可能性のある有害なビタミンB12類似体もビタミンB12として計測されてしまうために、尿中メチルマロン酸を調査すべきで、海苔を食べることはビタミンB12の供給源であるという論文の結論に同意しないと主張し、その理由として統計上の有意差はないが改善もしていないためである[27][28]。
同じ鈴木英鷹が2003年に生後より厳格な玄米菜食をしている小中高生の菜食者6名(男4名、女2名)を対象にした研究において、1日あたり海苔を0~2グラム摂取していた2名は、体内ビタミンB12の減少を示す尿中メチルマロン酸の上昇を示したものの、1日あたり海苔を4グラム以上摂取していた4名は尿中メチルマロン酸の上昇を示さなかったことから、海苔を毎日4グラム以上摂取することで、ビタミンB12の供給源になることが示唆された[30]。
細菌[編集]
ビタミンB12は、特定の真正細菌及び古細菌による原核生物によってのみ天然に産生され、多細胞または単細胞の真核生物によって産生されたものではないと主張されている[31][32]。プロピオニバクテリウム属の菌種は、ビタミンB12の産生や同ビタミンによる代謝の関わりが深いプロピオン酸などの産生ができる[3]。ヒトや他の動物のいくつかの腸内細菌によって合成されるが、内因子と結びついたビタミンB12が吸収される回腸の部位からさらに遠位の大腸でビタミンB12が産生されているので、ヒトは大腸で作られたビタミンB12を十分に吸収することができない[33]。しかし、牛や羊のような反芻動物は細菌を第一胃と第二胃で培養し産生されたビタミンB12を小腸内で吸収することができる[33]。反芻動物の腸内細菌がビタミンB12を産生するには、動物は十分な量のコバルトを細菌に提供しなければならない[34]。
反芻動物以外の反芻胃を有さない草食の放牧動物はビタミンB12とそれを産生する細菌をそれらの動物が食べる植物の根に付着した土壌から摂取することになる[35]。
過剰症[編集]
ビタミンB12は水溶性なので、過多症の心配はないと考えられている。しかし、血漿中のビタミンB12濃度が高かった人ほど、血液学的な癌、喫煙関連癌、飲酒関連癌などの特定の癌を1年以内に発症するリスクが高かった旨のコホート研究による調査結果が報告されている[36]。ビタミンB12の食事摂取が多い人ほど、食道がんの罹患リスクが高い傾向が見られた[37]。
欠乏症[編集]
ビタミンB12欠乏症は、ビタミンの供給、吸収にかかわるタンパク質、このビタミンを利用する酵素の異常、など非常に複雑な要因が絡んで起こる。ビタミンB12の一日の必要量は極めて少なく(2.6µg)程度とされる。ビタミンB12の正常な成人の必要量は1.0µg/日で、吸収率を50%として必要な摂取量は2.0µg/日である。摂取推奨量は、1.2を乗じて2.4µg/日である[38]。
肝臓や筋肉に大量に貯蔵されているため、胃全摘術などによって吸収障害が起きても体内貯蔵分のシアノコバラミンによって充当されるので、欠乏症が出現するまでは3-5年を要する[39]。 胃全切除後では、ビタミンB12の吸収に必須の蛋白質である内因子の分泌能が恒久的に失われるのでビタミンB12欠乏症を発症しやすい。また、野菜・果物類にはほとんど含まれないので、極度の菜食主義でも欠乏症になることがある。
DNA合成障害による悪性貧血等[編集]
ビタミンB12あるいは葉酸が不足して、葉酸が触媒的に再生産されないとDNA合成に異常が起こり細胞の成熟が正常に行われなくなるのは巨赤芽球を呈する赤芽球だけではなく、顆粒球系や巨核球系、さらに他の細胞とくに増殖の盛んな上皮や精子など細胞にも同様の影響をあたえる[40][41]。ビタミンB12の吸収不足の原因となる萎縮性胃炎では大球性高色素性貧血 (平均赤血球容積(MCH)の高値)が認められることがある[42]。胃全摘や高度な萎縮性胃炎では、内因子が不足するためビタミンB12の吸収障害が起こる。赤血球のDNAの合成が阻害され大球性貧血(巨赤芽球性貧血)が起こることがあり、悪性貧血と呼ばれている[43]。
亜急性連合性脊髄変性症[編集]
亜急性連合性脊髄変性症(ICD-10:E53.8)は、脊髄の側索と後索が同時に障害される疾患である。側索と後索の髄鞘の形成が阻害される。同時に阻害される事から連合性と呼ばれる。
その他[編集]
ビタミンB12欠乏症は、潜在的に深刻で不可逆的な障害を脳と神経にもたらしうる。ビタミンB12欠乏症は、躁病や精神病、疲労、記憶障害、神経過敏、抑うつ、運動失調及び人格変化の症状を引き起こす可能性もある[44][45][46]。
オックスフォード大学が61歳から87歳の107人に対して行った研究によると、ビタミンB12濃度が最も低い群は脳収縮を引き起こす可能性が6倍高いと報告されている[47]。
治療[編集]
葉酸、ベタインなどとともに自閉症児へのサプリメンテーションが有効という報告があるが、シアノコバラミンは適切なビタミンB12ではない。補酵素型であるメチルコバラミンを使うのがよい[48]。
注射やパッチは、消化器からの吸収が不十分な場合に用いられるが、0.5から1mg以上の高容量の経口摂取であれば注射やパッチは必要ではないとの証拠もある。悪性貧血であっても経口投与で治療が十分に可能であるとも言われている[49][50][51]。このような主張があるものの、ビタミンB12は内因子と結び付かないと腸から効果的に吸収されないため、内因子の分泌量が制約要因となり食事当たり2μg 程度でビタミンB12の吸収が飽和する[15][16]。このため、ビタミンB12は胃から分泌される内因子を介した吸収機構が飽和すれば食事中から過剰に摂取しても吸収されない。また大量(500 μg 以上)のシアノコバラミンを経口投与した場合でも内因子は非依存的に投与量の1%程度が吸収されるのみである[38]。ピロリ菌感染等による萎縮性胃炎による内因子の分泌障害とそれに伴うビタミンB12の吸収不全が疑われる場合には、ビタミンB12の錠剤の舌下での服用と吸収も考えられる。
ビタミンB12に関連した遺伝子疾患[編集]
メチルマロン酸尿症[編集]
哺乳動物では、奇数鎖脂肪酸の代謝や一部のアミノ酸の代謝でプロピオン酸が生成される。このプロピオン酸とCoAが結び付いたプロピオニルCoAは、ビオチン依存性酵素であるプロピオニルCoAカルボキシラーゼによって(S)-メチルマロニルCoAに変換され、さらに(R)-メチルマロニルCoAに変換される。(R)-メチルマロニルCoAは、メチルマロニルCoAムターゼによってクエン酸回路で代謝されるスクシニルCoAに変換されるが、この酵素は炭素-炭素結合の移動を触媒するためのコバラミン(ビタミンB12)を要する。メチルマロニルCoAムターゼの欠如は、メチルマロン酸の蓄積をもたらし血液のpHが低下するメチルマロン酸血症を引き起こす[52]。新生児マススクリーニングの1つとなっている。
ホモシステイン尿症[編集]
必須アミノ酸の一つであるメチオニンの代謝経路において、中間生成物ホモシスチンの代謝酵素であるシスタチオニン-β合成酵素(シスタチオニン-β-シンターゼ)の先天的欠損によりホモシスチンがシスチンに変換されず、体内に多量に蓄積され尿中へ排出される先天性アミノ酸代謝異常症のひとつである。メチオニン代謝経路において、代謝不良によるメチオニン蓄積にあわせて、中間生成物ホモシスチンの一部がメチオニン合成酵素(メチオニンシンターゼ)によってメチオニンへと還元されることから血中メチオニン濃度が上昇するという特徴も併せ持つ。新生児マススクリーニングの1つとなっている。
安全性[編集]
ビタミンB12の高用量摂取は肺癌リスク上昇と関連している可能性がある。[53][54]
脚注[編集]
注釈[編集]
出典[編集]
- ^ 喜谷喜徳, 竹田勝彦, 小池久、「シアノコバラミン製剤の原子吸光分析法による定量条件の検討」 『分析化学』 1973年 22巻 6号 p.719-723, doi:10.2116/bunsekikagaku.22.719, 日本分析化学会
- ^ “たばこの害について”. www.hokenkai.or.jp. 2021年1月29日閲覧。
- ^ a b c Kiatpapan P., Murooka Y. Genetic manipulation system in propionibacteria. Journal of Bioscience and Bioengineering. 93 (1) (pp 1-8), 2002
- ^ 帝京科学大学生命環境学部生命科学科松岡研究室研究内容紹介
- ^ シアノコバラミン - らでぃっしゅぼーや・添加物大辞典
- ^ Argument for providing B12 with food fortification of folate, since otherwise folate will correct hematological symptoms while leaving neurological symptoms to progress
- ^ NIH Intramural Sequencing Center Group; Sloan, Jennifer L; Johnston, Jennifer J; Manoli, Irini; Chandler, Randy J; Krause, Caitlin; Carrillo-Carrasco, Nuria; Chandrasekaran, Suma D et al. (2011-09). “Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria” (英語). Nature Genetics 43 (9): 883–886. doi:10.1038/ng.908. ISSN 1061-4036. PMC 3163731. PMID 21841779.
- ^ de Sain-van der Velden, Monique G. M.; van der Ham, Maria; Jans, Judith J.; Visser, Gepke; Prinsen, Hubertus C. M. T.; Verhoeven-Duif, Nanda M.; van Gassen, Koen L. I.; van Hasselt, Peter M. (2016), Morava, Eva; Baumgartner, Matthias, eds., A New Approach for Fast Metabolic Diagnostics in CMAMMA, 30, Springer Berlin Heidelberg, pp. 15–22, doi:10.1007/8904_2016_531, ISBN 978-3-662-53680-3, PMC 5110436, PMID 26915364 2022年8月28日閲覧。
- ^ a b Banerjee RV, Matthews RG (1990). “Cobalamin-dependent methionine synthase”. The FASEB Journal 4 (5): 1450-9. PMID 2407589.
- ^ Wickramasinghe SN (1995). “Morphology, biology and biochemistry of cobalamin- and folate-deficient bone marrow cells”. Baillière's Clinical Haematology 8 (3): 441-59. doi:10.1016/S0950-3536(05)80215-X. PMID 8534956.
- ^ Naidich MJ, Ho SU (2005). “Case 87: Subacute combined degeneration”. Radiology 237 (1): 101-5. doi:10.1148/radiol.2371031757. PMID 16183926.
- ^ 渡辺文雄「ビタミンB12 の基礎」Modern physician 2007; 27: 1213‒5
- ^ Food and Nutrition Board, Institute of Medicine. Vitamin B12. In: Institute of Medicine, ed. Dietary reference intakes: for thiamin, riboflavin, niacin, vitamin B6, folate, vitamin B12, pantothenic acid, biotin, and choline. National Academy Press, Washington D.C., 1998: 306‒56.
- ^ Watanabe F. Vitamin B12 sources and bioavalilability. Exp Biol Med 2007; 232: 1266‒74.
- ^ a b Scott JM (January 1997). “Bioavailability of vitamin B12”. Eur J Clin Nutr 51 Suppl 1: S49-53. PMID 902348.
- ^ a b Berlin H, Berlin R, Brante G (October 1968). “Oral treatment of pernicious anemia with high doses of vitamin B12 without intrinsic factor”. Acta Med Scand 184 (4): 247-58. PMID 5751528.
- ^ el Kholty S, Gueant JL, Bressler L, et al. (November 1991). “Portal and biliary phases of enterohepatic circulation of corrinoids in humans”. Gastroenterology 101 (5): 1399-408. PMID 1936810.
- ^ ビタミンB12解説 - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- ^ a b c d 五訂増補日本食品標準成分表(文部科学省)
- ^ 鈴木英鷹 「完全菜食とビタミンB_12欠乏 : 完全菜食において海苔はビタミンB_12の供給源として有効である」『大阪ソーシャルサービス研究』Vol.4(20031220)、pp19-25
- ^ 国内初のビタミンB12含有野菜「マルチビタミンB12かいわれ」の量産化に成功、出荷を開始 (スプラウト王国、2004年6月16日報道関係資料)
- ^ 「広島大学と(株)村上農園がビタミンB12入りカイワレ大根を共同開発 (広島大学 2004年1月22日)
- ^ 五訂増補日本食品標準成分表 (文部科学省)
- ^ 柴田克己 日本人の水溶性ビタミン必要量に関する基礎的研究 (平成13年度厚生科学研究費)
- ^ 阿部捷男「食品中のビタミンB12の新規な定量法の開発とビタミンB12の栄養評価」『大阪府立大学学報』、号外第1号、2001年3月27日、pp30-33
- ^ a b 渡辺文雄「食用藻類に含まれるビタミンB12の特性と栄養評価」『ビタミン』76巻4号、2002年2月、pp246-248
- ^ a b Jack Norris (2002年5月). “Vitamin B12: Are You Getting It?”. Vegan Outreach. 2003年4月15日時点のオリジナルよりアーカイブ。2017年1月24日閲覧。 その解説個人サイト、海藻とビタミンB12
- ^ a b Jack Norris (Registered Dietitian Director, Vegan Outreach) (2015年10月). “B12 in Tempeh, Seaweeds, Organic Produce, and Other Plant Foods”. VeganHealth.org. 2017年1月24日閲覧。
- ^ 鈴木英鷹「厳格な玄米菜食児における血清ビタミンB12値」『Journal if Nutritional Science and Vitaminolgy』41巻6号、1995年12月、pp587-594
- ^ 鈴木英鷹「鈴木英鷹 完全菜食とビタミンB12欠乏(完全菜食において海苔はビタミンB12の供給源として有効である)」『大阪ソーシャルサービス研究』2003年12月20日、pp.19-25
- ^ Moore, SJ; Warren, MJ (1 June 2012). “The anaerobic biosynthesis of vitamin B12.”. Biochemical Society transactions 40 (3): 581–6. doi:10.1042/BST20120066. PMID 22616870.
- ^ Graham, Ross M.; Deery, Evelyne; Warren, Martin J. (2009). “18: Vitamin B12: Biosynthesis of the Corrin Ring”. In Warren, Martin J.; Smith, Alison G.. Tetrapyrroles Birth, Life and Death. New York, NY: Springer-Verlag New York. p. 286. doi:10.1007/978-0-387-78518-9_18. ISBN 978-0-387-78518-9
- ^ a b Gille, D; Schmid, A (February 2015). “Vitamin B12 in meat and dairy products.”. Nutrition reviews 73 (2): 106–15. doi:10.1093/nutrit/nuu011. PMID 26024497.
- ^ McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition. (2nd ed.). Hoboken: John Wiley & Sons. pp. 525, 539. ISBN 9780470376683
- ^ Rooke, Jennifer (2013年10月30日). “Do carnivores need Vitamin B12 supplements?”. Baltimore Post Examiner
- ^ Arendt JF, et al. "Elevated plasma vitamin B12 levels as a marker for cancer: a population-based cohort study." Journal of the National Cancer Institute; 2013 Dec 4;105(23): p 1799-805. DOI: 10.1093/jnci/djt315, PMID 24249744
- ^ 国立研究開発法人 国立がん研究センター 社会と健康研究センター 予防研究グループ、「ビタミンB12、ビタミンB6、葉酸およびメチオニンの食事摂取と食道がんのリスクとの関連について」、2022年6月6日閲覧
- ^ a b 「ビタミンB12」『日本人の食事摂取基準」(2010年版)』pp159-161
- ^ 『メルクマニュアル医学百科』「ビタミンB12」
- ^ 浅野茂隆、池田康夫、内山卓 監修『三輪血液病学』文光堂、2006年、ISBN 4-8306-1419-6、p.974
- ^ 小川聡 総編集『内科学書』Vol.6 改訂第7版、中山書店、2009年、ISBN 978-4-521-73173-5、p.72
- ^ 松田晃、「2. 巨赤芽球性貧血」 『日本内科学会雑誌』 2006年 95巻 10号 p.2010-2015, doi:10.2169/naika.95.2010
- ^ 栗山貴久子, 内藤岳史, 橋田哲夫 ほか、12歳で発症した若年性悪性貧血II型の1例 『日本小児血液学会雑誌』 1998年 12巻 5号 p.359-363, doi:10.11412/jjph1987.12.359
- ^ “Neurological Manifestations Of Vitamin B-12 Deficiency”. The Internet Journal of Nutrition and Wellness 2 (1). (2005). doi:10.5580/5a9.
- ^ “Cobalamin-responsive psychosis as the sole manifestation of vitamin B12 deficiency”. The Israel Medical Association Journal 3 (9): 701–703. (Sep 2001). PMID 11574992.
- ^ “Pernicious anemia: MedlinePlus Medical Encyclopedia”. National Institutes of Health: National Library of Medicine. 2013年12月29日閲覧。
- ^ Going veggie shrinks the brain (The Courier-Mail, September 12 2008)
- ^ 宮尾益知監修『アスペルガー症候群 治療の現場から』出版館ブック・クラブ、2009年、81ページ。
- ^ Bolaman Z, Kadikoylu G, Yukselen V, Yavasoglu I, Barutca S, Senturk T (2003). “Oral versus intramuscular cobalamin treatment in megaloblastic anemia: a single-center, prospective, randomized, open-label study”. Clin Ther 25 (12): 3124-34. doi:10.1016/S0149-2918(03)90096-8. PMID 14749150.
- ^ Lane LA, Rojas-Fernandez C (2002). “Treatment of vitamin b(12)-deficiency anemia: oral versus parenteral therapy”. Ann Pharmacother 36 (7-8): 1268-72. doi:10.1345/aph.1A122. PMID 12086562.
- ^ Butler CC et al. (2006). “Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: a systematic review of randomized controlled trials”. Fam Pract 23 (3): 279-85. doi:10.1093/fampra/cml008. PMID 16585128.
- ^ “メチルマロン酸血症”. 厚生労働省難治性疾患克服研究班報告. 難病医学研究財団/難病情報センター. 2010年10月31日閲覧。
- ^ “Cancer incidence and mortality after treatment with folic acid and vitamin B12”. Journal of the American Medical Association 302 (19). (2009). doi:10.1001/jama.2009.1622. PMID 19920236.
- ^ “Long-Term, Supplemental, One-Carbon Metabolism–Related Vitamin B Use in Relation to Lung Cancer Risk in the Vitamins and Lifestyle (VITAL) Cohort”. Journal of Clinical Oncology 35 (30). (2017). doi:10.1200/JCO.2017.72.7735. PMID 28829668.
関連項目[編集]
外部リンク[編集]
- Vitamin B12 シアノコバラミン - (オレゴン州大学・ライナス・ポーリング研究所)
- ビタミンB12解説 - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- ビタミンB12 (シアノコバラミン) - 同
- 日本人の食事摂取基準(2010年版)
- merckmanual、ビタミンB12(MSD)


 French
French Deutsch
Deutsch


