Reazione di Michael
La reazione di Michael, descritta per la prima volta nel 1887 dal chimico statunitense Arthur Michael, è una reazione di chimica organica appartenente alla classe delle addizioni coniugate. È uno dei metodi principali per la formazione di legami C-C in condizioni sperimentali non troppo spinte e se ne conoscono molte varianti asimmetriche.[1][2]

Nello schema, la molecola nera è nucleofila e rappresenta il cosiddetto donatore di Michael mentre l'alchene attivato (in rosso) è elettrofilo ed è definito accettore di Michael. La molecola nucleofila è resa tale dalla deprotonazione del gruppo metilenico operata da un'opportuna base (in figura, B:). Per stabilizzare il carbanione che si forma è necessario che i sostituenti R e R' siano gruppi elettron-attrattori come ad esempio gruppi carbonilici e derivati (aldeidi, chetoni, esteri, ammidi per esempio). L'alchene accettore ha come sostituente R'' un gruppo carbonilico (chetone, aldeide) o derivati carbossilici, tipicamente esteri ma anche nitrili.
Definizione[modifica | modifica wikitesto]
La reazione, come originariamente definita dallo stesso Michael,[3][4] consiste nell'addizione nucleofila di anioni enolato di un derivato metilenico a composti carbonilici α-β insaturi, e precisamente al carbonio β, definiti accettori di Michael, come gli enoni e gli enali per esempio. Una definizione successiva, avanzata da Kohler,[5] è l'addizione 1,4 di un carbonio nucleofilo doppiamente stabilizzato ad un composto carbonilico α,β-insaturo. Alcuni esempi di nucleofili includono i beta-chetoesteri, i malonati e i beta-cianoesteri. Il prodotto risultante contiene un utilissimo composto 1,5-diossigenato.
Esempi classici di reazione di Michael sono le reazioni tra dietil malonato e il dietil fumarato (accettore di Michael),[6] quella del ossido mesitile e il dietil malonato,[7] quella tra dietil malonato e il metil crotonato,[8] quella del 2-nitropropano ed il metil acrilato,[9] quella dell'etil fenilcianoacetato e l'acrilonitrile[10] e quella del nitropropano con il metil vinil chetone.[11]
Tali trasformazioni richiedono quale catalizzatore uno ione come lo OH-. Qualora la reazione avvenga sotto controllo termodinamico, e cioè in condizioni di equilibrio, essa si ottiene più facilmente se l'enolato deriva da composti con protoni piuttosto acidi (pKA<14). Se la reazione si verifica invece sotto il controllo cinetico gli accettori di Michael possono reagire con molte tipologie di ioni enolato.
L'addizione di Michael è un importante metodo di formazione di legami C-C diastereoselettivi ed enantioselettivi. Una classica sequenza tandem di Michael e di addizione aldolica è l'anellazione di Robinson.
Meccanismo[modifica | modifica wikitesto]
Nel meccanismo di reazione schematizzato qui sotto, i gruppi R possono essere considerati come alcossidi facenti parte del gruppo estereo. I due gruppi esterei rendono gli H metilenici della molecola 1 molto acidi:
La deprotonazione di 1 da parte della base (che è anche il solvente in molti casi) fornisce un carbanione 2 stabilizzato dalla risonanza (2A-2C). Il nucleofilo quindi reagisce con l'alchene elettrofilo 3 formando l'intermedio 4, in un'addizione coniugata, ovvero un'addizione nucleofila 1,4. La base protonata cede quindi il protone all'intermedio dando il prodotto finale 5.
Reazione asimmetrica di Michael[modifica | modifica wikitesto]
Sono stati fatti studi approfonditi sulle reazioni asimmetriche della reazione di addizione di Michael. Il protocollo più comune coinvolge un sale d'ammonio quaternario chirale derivato dall'alcaloide Cinconina, od un catalizzatore organometallico, che usa una enammina o uno ione imminio per lo stato intermedio d'attivazione della reazione attraverso una ammina secondaria, come la prolina.
Esempio: il cicloesanone e il nitrostirene reagiscono per mezzo della prolina derivatizzata da un acido protico come l'acido p-toluensolfonico[12]. L'addizione di tipo syn è favorita in questo caso del 99%.
Addizione di Mukaiyama-Michael[modifica | modifica wikitesto]
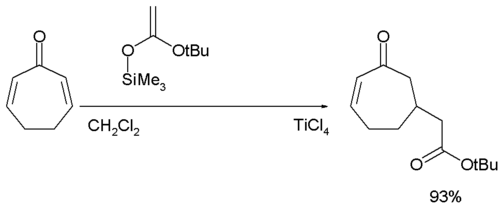
Nella reazione di addizione di Mukaiyama-Michael il nucleofilo è un silil etere ed il catalizzatore generalmente impiegato è il tetracloruro di titanio:[13][14]
Note[modifica | modifica wikitesto]
- ^ Ian Hunt, Chapter 18: Enols and Enolates — The Michael Addition reaction, su chem.ucalgary.ca, University of Calgary.
- ^ Clayden et al, Organic Chemistry
- ^ Arthur Michael, Ueber die Addition von Natriumacetessig- und Natriummalonsäureäthern zu den Aethern ungesättigter Säuren, in Journal für Praktische Chemie, vol. 35, n. 1, 1887, pp. 349-356, DOI:10.1002/prac.18870350136.
- ^ Arthur Michael, Ueber die Addition von Natriumacetessig- und Natriummalonsäureäther zu den Aethern ungesättigter Säuren, in Journal für Praktische Chemie, vol. 49, n. 1, 1894, pp. 20-29, DOI:10.1002/prac.18940490103.
- ^ Kohler. J. Am. Chem. Soc., 1907, 37, 385; ibid., 1935, 57, 1316.
- ^ H. T. Clarke and T. F. Murray, 1,1,2,3-Propanetetracarboxylic acid, tetraethyl ester, vol. 1, 1941. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ R. L. Shriner and H. R. Todd, 1,3-Cyclohexanedione, 5,5-dimethyl-, vol. 2, 1943. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ James Cason, β-Methylglutaric anhydride, vol. 4, 1963. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ R. B. Moffett, Methyl γ-Methyl-γ-nitrovalerate, vol. 4. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ E. C. Horning and A. F. Finelli, α-Phenyl-α-carbethoxyglutaronitrile, vol. 4, 1963. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ Conversion of Nitro to Carbonyl by Ozonolysis of Nitronates: 2,5-Heptanedione, vol. 6, 1988. URL consultato il 21 luglio 2008 (archiviato dall'url originale il 5 giugno 2011).
- ^ Sunil V. Pansare and Keyur Pandya, Simple Diamine- and Triamine-Protonic Acid Catalysts for the Enantioselective Michael Addition of Cyclic Ketones to Nitroalkenes, in J. Am. Chem. Soc., vol. 128, n. 30, 2006, pp. 9624-9625, DOI:10.1021/ja062701n.
- ^ Mukaiyama, T., Titanium Tetrachloride in Organic Synthesis [New synthetic methods (21)], in Angew. Chem., Int. Ed. Engl., vol. 16, 1977, pp. 817-826, DOI:10.1002/anie.197708171.
- ^ Alex R. Lippert, Juthanat Kaeobamrung, and Jeffrey W. Bode, Synthesis of Oligosubstituted Bullvalones: Shapeshifting Molecules Under Basic Conditions, in J. Am. Chem. Soc., vol. 128, n. 46, 2006, pp. 14738-14739, DOI:10.1021/ja063900+.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Reazione di Michael
Wikimedia Commons contiene immagini o altri file su Reazione di Michael
| Controllo di autorità | GND (DE) 4169763-7 |
|---|


 French
French Deutsch
Deutsch