Cirrosi epatica
| Cirrosi epatica | |
|---|---|
 | |
| Specialità | gastroenterologia e epatologia |
| Eziologia | alcolismo, epatite, Cirrosi infantile indiana, epatite autoimmune, colangite sclerosante primitiva, emocromatosi ereditaria e malattia di Wilson |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 571 |
| MeSH | D008103 |
| MedlinePlus | 000255 |
| eMedicine | 185856 e 366426 |
La cirrosi epatica è una patologia epatica cronica e progressiva, caratterizzata dal sovvertimento diffuso e irreversibile della struttura del fegato, conseguente a danni di varia natura (infettiva, alcolica, tossica, autoimmune) accumulatisi per un lungo periodo. La cirrosi epatica rappresenta quindi il quadro terminale della compromissione anatomo-funzionale dell'organo.[1]
Il termine "cirrosi" deriva dal greco κίρρωσις, composto di κιρρός, kirrhòs, che significa "giallastro", e -ωσις, -osis, che significa "condizione", una parola che descrive l'aspetto di un fegato cirrotico.
Alcune delle sue cause scatenanti principali sono l'abuso di alcol, le epatiti croniche virali o di altra natura.
Il sovvertimento strutturale della cirrosi epatica è il risultato della necrosi del parenchima epatico, causata dal danno protratto, e dei conseguenti processi riparativi, ovvero la rigenerazione nodulare per iperplasia (proliferazione cellulare) e la formazione di ponti fibrosi cicatriziali che sostituiscono il parenchima necrotico e si dispongono sia all'interno sia tra i lobuli, le unità elementari che costituiscono il fegato. Questo disordine architetturale conduce non solo a un malfunzionamento del fegato dal punto di vista metabolico (catabolico e sintetico), ma anche a gravi ripercussioni sulla circolazione portale (ipertensione portale).[1][2] Il termine cirrosi è talvolta utilizzato per estensione anche per descrivere processi patologici fortemente sclerotici a carico di organi diversi dal fegato, quali lo stomaco, i reni e i polmoni, quando questi vanno incontro a degenerazione con necrosi cellulare seguita da fibrosi.[3]
Durante gli esordi della malattia, spesso non si presentano sintomi, ma con il progredire della condizione il paziente può accusare, insieme a sintomi aspecifici (stanchezza, dispepsia), prurito, edema agli arti inferiori, colorito giallo delle sclere (subittero) o della cute (ittero), raccolta di liquido nella cavità peritoneale (ascite) o sviluppare un angioma stellare (delle "macchie" rossastre simili a ragnatele) sulla cute.[1] Le principali complicanze includono encefalopatia epatica, sanguinamento dalle varici esofagee e tumore del fegato.[1] L'encefalopatia epatica provoca confusione mentale e può portare a perdita di coscienza.[1] L'accumulo di liquidi nell'addome può diventare spontaneamente infetto.[1]
La cirrosi è più comunemente causata da un abuso di alcol, dall'epatite B, dall'epatite C e dalla steatosi epatica non alcolica ("fegato grasso").[1][4] In genere, per la cirrosi alcolica occorre assumere più di due o tre bevande alcoliche al giorno per alcuni anni.[1] La steatosi epatica non alcolica conta una serie di cause, tra cui il sovrappeso, l'obesità, il diabete, alti livelli di grassi nel sangue e ipertensione.[1] Alcune cause meno frequenti della cirrosi possono essere l'epatite autoimmune, la colangite biliare primitiva, l'emocromatosi, la malattia di Wilson, l'assunzione di alcuni farmaci e la presenza di calcoli biliari.[1]
La diagnosi si basa sull'esame obiettivo, sulle analisi del sangue, sulle tecniche di imaging biomedico e sulla biopsia epatica.[1]
Alcune cause di cirrosi, come l'epatite B, possono essere prevenute grazie alla vaccinazione. Evitare di assumere alcol è raccomandato in tutti i casi di cirrosi. L'epatite B e C possono essere curate con farmaci antivirali. L'epatite autoimmune può essere trattata con farmaci steroidei.[1] Altri farmaci possono essere utili per fronteggiare le complicazione, come il gonfiore addominale o quello delle gambe, l'encefalopatia epatica e o la dilatazione delle vene esofagee. Nei casi gravi di cirrosi può essere preso in considerazione un trapianto di fegato.[1]
Storia[modifica | modifica wikitesto]
La lettera riporta la descrizione del caso clinico di un nobile veneziano e la sua autopsia: "Ab inferioribus autem oedema se producebat per dorsum ad scapulas usque. Venter habuit copiam aquae foetidae ex viridi flavae quantam maximam praeter omnem modum distentus habere potuit. In ea frusta quaedam, omenti opinor, natabant quasi ex mucilagine purulenta. Jecur durum, intus et extra totum constans e tuberculis, id est glandulosis lobulis evidentissimis et evidetissime distinctis, nec tamen naturali majus".
Dagli arti inferiori progrediva, invece, un edema attraverso il dorso, fino alle scapole. Il ventre conteneva quanta più grande quantità di liquido fetido dal verdastro al giallastro, disteso oltre ogni limite possibile. In esso, era sospesa, senza ragione, qualche materia, suppongo dell'omento, come derivata da mucillagine purulenta. Il fegato, duro, consistente internamente ed esternamente di tubercoli, si presenta con evidentissimi lobuli ghiandolari, nettamente distinti, né tuttavia più grande del naturale.


La prima descrizione clinica della cirrosi epatica di cui si abbia notizia risale al medico greco Ippocrate, vissuto nel V secolo a.C.[5] Nell'antichità è stata considerata per lo più un fenomeno di carattere suppurativo, come la descrive nel II secolo d.C. il medico Areteo di Cappadocia nell'opera De causis et signis diuturnorum morborum (Liber I, Cap. XIII): "In verità, se un flemmone del fegato non suppura, non vi sarà dubbio per alcuno che la tumefazione dura, consolidata, si trasformerà e si assesterà in scirro".
Una osservazione peculiare e del tutto occasionale si deve ad Andrea Vesalio (1514-1564) che ha riferito del caso di un uomo di legge, da lungo sofferente, che aveva concordato con il grande medico di assistere all'indomani a una sua lezione di anatomia sull'addome. Inaspettatamente il giurista morì poche ore dal colloquio. All’esame del cadavere, la vena porta era lacerata e la cavità addominale ripiena di sangue, mentre il fegato appariva biancastro, cosparso di tubercoli e duro come pietra.[6]
L'aspetto anatomopatologico della cirrosi epatica è stato invece descritto per la prima volta dall'inglese John Brown (1642-1700) e dall'italiano Giovanni Battista Morgagni (1682-1771) nel suo trattato del 1761 De sedibus, et causis morborum per anatomen indagatis.[7] Benjamin Rush, nell'opera Effects of Ardent Spirits upon the Human Body and Mind (1785), e poi Matthew Baillie (1761-1823) hanno prospettato l'associazione di questa patologia con il consumo di alcol.[8]
Il termine cirrosi fu coniato da René Laennec (come descritto nella sua Segnalazione XXV, dell'auscultazione mediata pubblicata nel 1819), volgarizzando i termini greci Skirròs che significa duro, fibroso e Kirrhós', che significa giallo, dal colore che il fegato assume nella cirrosi detta oggi di Morgagni-Laennec.[9]
Nel 1963 Thomas Starzl compie il primo trapianto di fegato su di un bambino, una procedura che successivamente verrà utilizzata anche nei pazienti con cirrosi epatica quando la funzionalità del fegato è irrimediabilmente compromessa.[10]
Epidemiologia[modifica | modifica wikitesto]

nessun dato
<50
50-100
100-200
200-300
300-400
400-500
500-600
600-700
700-800
800-900
900-1 000
>1 000

9-44
45-68
69–88
89–104
105–122
123–152
153–169
170–204
205–282
283–867
Nel 2015 la cirrosi ha coinvolto circa 2,8 milioni di persone causando 1,3 milioni di morti nel mondo.[12][13] Di questi, l'alcol è stato responsabile di 348 000 casi, l'epatite C di 326 000 e l'epatite B di 371 000.[13] In Italia si registrano circa 30-60 casi di cirrosi per 100 000 abitanti/anno, equivalenti a 26 000 nuovi casi ogni anno.[14]
La cirrosi e le malattie epatiche croniche nel 2001 sono state la 10ª causa di morte per gli uomini e la 12ª per le donne negli Stati Uniti d'America, dove la malattia uccide circa 27 000 persone ogni anno:[15] si ritiene che negli USA muoiano più uomini rispetto a donne per cirrosi.[1] Anche in Italia, nel 2014, la cirrosi e le malattie epatiche croniche sono state la 10ª causa di morte, con circa 6 000 decessi, venendo a rappresentare circa l'1% di tutte le cause di morte, sia pure in diminuzione del 48% rispetto al 2003.[16]
La cirrosi ha una mortalità a 10 anni del 34-66%. La sopravvivenza dipende in gran parte dalla sua causa: la cirrosi alcolica ha una prognosi peggiore rispetto alla cirrosi biliare primaria e alla cirrosi causata da epatite virale.[17] L'alcol è responsabile del 3,8% della mortalità totale nel mondo e la cirrosi epatica costituisce il 15% di tutte le morti dovute al consumo di alcol.[18]
L'attesa di vita corretta per disabilità (disability-adjusted life year o DALY) è una misura della gravità globale di una malattia, espressa dalla combinazione degli anni di vita persi per morte prematura più quelli persi a causa della malattia, ovvero dalla combinazione di disabilità e morte prematura.[19] La cirrosi costituisce l'1,2% del DALY globale (contro l'11,8% delle malattie cardiovascolari, il 7,6% delle neoplasie e il 4,7% delle malattie respiratorie croniche).[20] Si calcola che l'intera patologia da alcol incida per il 4,6% della DALY, ma in Europa queste percentuali sono molto più alte che in qualsiasi altro continente (rispettivamente 6,5% e 11,6%).[21]
Il costo della cirrosi in termini di sofferenza umana, costi ospedalieri e perdita di produttività è molto alto.[22]
Eziologia[modifica | modifica wikitesto]
Attualmente, nel mondo occidentale la prima causa di cirrosi (60-70%) è rappresentata dalla steato-epatite cronica conseguente ad abuso di alcol; meno comune è invece la cirrosi conseguente a epatiti dai virus dell'epatite B (HBV) e C (HBC) (10%) o a malattie delle vie biliari (5-10%); causa relativamente rara è l'emocromatosi primitiva, seguita da malattie genetiche come la malattia di Wilson e il deficit di alfa 1-antitripsina.[23][24] Infine, in circa il 10% dei casi non è possibile risalire alla malattia che ha dato origine alla cirrosi, la quale è pertanto definita "criptogenetica".[2]
Anche se l'alcolismo può portare di per sé alla cirrosi alcolica, ancora più frequentemente esso rappresenta una concausa aggravante preesistenti (spesso non conosciute) infezioni croniche da HBV o da HCV. Infatti, l'abuso di alcol è capace di dimezzare il tempo di insorgenza della cirrosi in un paziente già affetto da epatite virale cronica (da circa 20-30 anni a 10-15 anni).[25]
Poco è noto sui modulatori di rischio di cirrosi, oltre alle malattie che provocano direttamente danno epatico (quale la combinazione di malattia epatica alcolica ed epatite virale cronica, che possono agire sinergicamente nella progressione verso la cirrosi). Alcuni studi hanno, invece, recentemente suggerito che il consumo di caffè possa offrire un fattore protettivo, particolarmente contro la cirrosi alcolica.[26]
Alcol[modifica | modifica wikitesto]
Secondo l'Organizzazione mondiale della sanità (OMS), nel 2005 il consumo individuale medio annuale di alcol nel mondo è stato pari a 6 litri (L) di alcol puro, con un minimo di 0,02 L in Afghanistan e un massimo di 18 L nella Repubblica di Moldavia. L'Europa ha il più alto consumo di alcol nel mondo, con media pro capite negli adulti di 10 L nel 2014: esso si posiziona intorno o al di sopra di 12 L in Austria, Belgio, Bulgaria, Croazia e Lituania, mentre agli ultimi posti, con un consumo inferiore a 8 L, si ritrovano Italia, Grecia, Svezia, Norvegia e Albania; in Turchia è <2 L.[27] In Europa, l'alcol è il 3º fattore di rischio per mortalità, dopo tabacco e ipertensione e a esso possono essere attribuiti il 7,6% delle morti nei maschi e il 4% nelle femmine.[27][28]
Fortunatamente in Italia dal 1975 si registra una costante flessione nel consumo di alcol.[29] In particolare, dal 2007 al 2015 si è verificato un calo dei consumatori abituali di alcol dal 30,6% al 23% negli uomini e dal 12,6 al 9% nelle donne; è invece in aumento il consumo occasionale, soprattutto come binge drinking ("abbuffata di alcol").[30][31]

L'introito di alcol si misura in mL di alcol puro (10 mL = 7,9 g di alcol) o in drink standard (1 drink = 12 g), considerando che una birra (da 330 mL), un bicchiere di vino (da 125 mL) e un bicchierino di superalcolico (da 40 mL) hanno all'incirca lo stesso contenuto di alcol (10 grammi).[32]
Dalla letteratura risulta una relazione positiva tra consumo di alcol e cirrosi, con un possibile effetto soglia. Un importante studio prospettico su oltre 13 000 soggetti adulti, seguiti per 12 anni, ha valutato potenzialmente dannosa un'assunzione di più di 50 g di alcol al giorno per più anni.[33] Tuttavia una metanalisi (1998) di 15 studi ha riportato un aumento di rischio di cirrosi per un consumo giornaliero di alcol >25 g.[34] In modo simile, la metanalisi di Rehm (2010) ha rilevato un aumento di mortalità per cirrosi quando l'introito di alcol è >12-24 g/die.[35] Il consumo ottimale è di 3-5 g/die: una piccola quantità di alcol apparentemente riduce la mortalità cardio-vascolare.[36]
Il 15% degli europei assume un'elevata quantità giornaliera di alcol (>40 g/die per gli uomini e >20 g/die per le donne).[18] Il consumo di >40 g/die di alcol comporta un rischio di cirrosi del 30% nei soggetti con steatosi epatica e del 37% in quelli con fibrosi epatica, mentre la steatosi alcolica si osserva nel 60% per un introito >60 g/die.[18] Un eccessivo consumo di alcol è associato anche a morti traumatiche e accidentali, malattie neurodegenerative, malattie cardio-vascolari (ipertensione, cardiomiopatie, aritmie e ictus emorragico) e alcuni tipi di tumore, in almeno quattro di essi (oro-faringe, esofago, colon-retto e mammella) il rischio aumenta per un consumo >10 g/die.[37][38]
Poiché la cirrosi epatica insorge soltanto in una parte, sia pur molto consistente, di individui esposti abitualmente all'alcol, si ritiene che altri fattori predispongano o concorrano al danno epatico prodotto dall'alcol: fattori genetici, epatite cronica da virus B o C, fumo, sovraccarico di ferro, diabete e obesità.[39][40]
Infezioni virali[modifica | modifica wikitesto]
Le epatiti virali croniche sono un'altra frequente causa di cirrosi epatica. Queste sono dovute per la massima parte ai virus HBV e HCV, agenti patogeni a trasmissione prevalentemente parenterale. Entrambi i virus possono provocare un'infiammazione del fegato e un conseguente danno variabile all'organo che, nel corso di decenni, può portare allo sviluppo della cirrosi.[41][42]
Nei paesi occidentali una pregressa infezione da HBV (presenza di antigene HBsAg e/o di anticorpi anti-HBs) è riscontrabile in <20% della popolazione,[43][44] mentre l'infezione cronica (portatori cronici) da HBV (presenza di HBsAg) ha una prevalenza di 0,2-1% ed è causa di <10% delle malattie epatiche croniche.[45][46] Secondo Kaslow (2014), in Australia, USA ed Europa occidentale, la prevalenza degli anticorpi anti-HBs è del 4-7%, mentre quella dell'antigene HBsAg è <1%; nei paesi ad alto rischio (Cina, Sud-est asiatico) la prevalenza è, rispettivamente, 95% e 20%.[47]
L'evoluzione dell'infezione cronica da HBV in cirrosi può raggiungere il 30-40% dei pazienti non trattati.[48] Nei pazienti HBsAg-positivi, l'evoluzione annua verso la cirrosi è del 2-6% in caso di positività per l'antigene HBeAg e dell'8-10% in caso di sua negatività, poiché la negatività di HBeAg indica una malattia epatica di lunga durata, a più bassa attività.[49] Dei decessi attribuiti al virus HBV nel mondo, il 40% è dovuto alla cirrosi, il 43% al carcinoma epatico e il 17% all'epatite acuta: in questo modo HBV costituisce la 15ª causa di morte.[50]
La prevalenza dell'infezione da HCV nel mondo è di circa il 2-3%/100 000 abitanti, ma varia da <1% nel Nord Europa a >2,9% in Nord Africa: la più bassa prevalenza si registra nel Regno Unito e nei paesi scandinavi (0,01%-0,1%) e la più alta in Egitto (15%), mentre nell'Europa mediterranea è intorno al 2-3%.[51][52] Fino al 75% dei pazienti con epatite acuta da HCV evolve verso l'epatite cronica.[53] È stato riscontrato che il 20-30% dei pazienti con epatite C cronicizzata svilupperà cirrosi[54][55] e il 25% epatocarcinoma.[51] La cirrosi da epatite C, insieme a quella da alcol, sono le più frequenti ragioni che portano a un trapianto di fegato.[56]
L'epatite D è un'epatite virale che si sviluppa in presenza dell'epatite B (co-infezione) e accelera lo sviluppo della cirrosi.[57]
Altre cause[modifica | modifica wikitesto]
La cirrosi epatica può essere conseguenza di numerose altre condizioni che comportano un danno secondario al fegato. Queste possono essere, ad esempio, a eziologia autoimmune, genetica o a seguito di un'intossicazione o di una malattia sistemica.
La colangite sclerosante primitiva (PSC, Primary Sclerosing Cholangitis) è una patologia relativamente rara, in cui i dotti biliari vengono colpiti da un processo autoimmune.[58] L'obliterazione e la perdita dei dotti biliari per effetto della reazione fibrosa conduce prima a fibrosi portale, e poi a cirrosi.[48] Negli USA e in Europa, la prevalenza della malattia, nonostante essa non sia inclusa nella classificazione ICD 10, si aggira intorno a 10/100 000 abitanti ed è maggiore nell'Europa del Nord rispetto a quella del Sud.[48][58][59] La colangite sclerosante primitiva è una malattia progressiva colestatica in cui i pazienti possono presentarsi asintomatici o provare affaticamento, prurito, iperpigmentazione della pelle non itterica, steatorrea, malassorbimento intestinale con carenza di vitamine liposolubili, malattia ossea metabolica e epatomegalia. Gli esami ematochimici rilevano un elevato aumento della fosfatasi alcalina, nonché incrementi del colesterolo, della bilirubina e, solitamente, positività agli anticorpi anti mitocondrio. Esiste una forte correlazione con la malattia infiammatoria intestinale (IBD, inflammatory bowel disease) e in particolare con la colite ulcerosa.[54][60] Al momento della diagnosi la IBD si ritrova in circa la metà dei pazienti con PSC, per raggiungere l'80% dopo 10 anni.[48] Dagli studi epidemiologici risulta che i pazienti sono prevalentemente non fumatori (5% di fumatori contro il 25% dei controlli) e che il consumo di caffè possa avere un qualche effetto preventivo.[48]
Nel caso dell'epatite autoimmune, fattori ambientali variabili (virus, sostanze tossiche, farmaci) e non identificati scatenano una risposta autoimmune contro gli epatociti: i linfociti attaccano il fegato causando infiammazione e infine cicatrici e cirrosi.[61] L'epatite autoimmune ha una prevalenza di 10/100 000 individui, maggiore nel Nord Europa, dove fino al 30% dei pazienti si presentano con cirrosi al momento della diagnosi; l'epatite autoimmune è causa del 4% dei trapianti di fegato nel Regno Unito e in USA e del 10% in Europa.[48] Le analisi del sangue rivelano aumenti delle globuline sieriche, specialmente delle gammaglobuline.[54] Sulla base del panel anticorpale, si differenziano due tipi della malattia: nel tipo 1 prevalgono gli anticorpi antinucleari (ANA), anti-antigene epatico solubile (LSA) e anti-antigene epato-pancreatico (LA); nel tipo 2, anticorpi anti-microsomiali epato-renali di tipo 1 (LKM-1) e anti-citosol 1 (LC-1).[48]
L'emocromatosi ereditaria (HH, Hereditary Hemochromatosis)[62] è la più comune malattia ereditaria autosomica recessiva del Nord Europa, USA e Australia, con una prevalenza di 1/200-400 individui.[63] Essa è legata nella quasi totalità dei casi a un deficit di produzione dell'ormone epatico epcidina, la cui carenza aumenta l'assorbimento intestinale del ferro della dieta.[48] I pazienti con HH presentano una storia familiare di cirrosi epatica, iniziale epatomegalia (95%), iperpigmentazione cutanea, diabete mellito (15-25%), artropatia o pseudogotta (20-60%) o cardiomiopatia con dispnea da sforzo, tutti segni dovuti a un sovraccarico di ferro.[48][54][64] La cirrosi epatica si osserva nel 4-6% dei pazienti con HH, mentre la sola fibrosi nel 10-25%; i pazienti che consumano alcol (≥ 60g/die) hanno un rischio nove volte superiore di sviluppare cirrosi.[62] La cirrosi dell'emocromatosi è parzialmente reversibile con i salassi.[62]
La malattia di Wilson è una malattia autosomica recessiva conseguente a deficit di eliminazione biliare di rame e caratterizzata da bassa ceruloplasmina sierica e aumento del rame nel fegato. La malattia ha una prevalenza di 2-3/100 000 individui e si manifesta con sintomi neurologici, stato mentale alterato e il tipico anello di Kayser-Fleischer nella cornea, che si riscontra nel 95% dei pazienti con sintomi neurologici e nel 50% di quelli senza.[65][66] Nella maggioranza dei pazienti non trattati il danno epatico progredisce verso la fibrosi e la cirrosi epatica e in circa il 50% di essi la cirrosi è già presente al momento della diagnosi.[66]
Un deficit di alfa 1-antitripsina (a1-AT) è un disordine genetico, anch'esso a trasmissione autosomica recessiva, nel quale si ravvisa una diminuzione della proteina alfa 1-antitripsina nel sangue, nel fegato e nei polmoni.[54] La funzione dell'alfa 1-antitripsina è quella di inibire le proteasi liberate in eccesso dai neutrofili durante le risposte infiammatorie, limitando così i danni indotti dagli enzimi leucocitari. L'incidenza dello stato omozigote è di 1/3 000 nati negli USA, ma nel Nord Europa e nei Paesi scandinavi l'incidenza è più alta (1,6-1/2 000).[48] I pazienti presentano spesso a 1-2 mesi ittero ed epatomegalia, tuttavia la distensione addominale, l'epatomegalia e l'innalzamento delle transaminasi possono rivelarsi anche nell'adolescenza; tosse, infezioni respiratorie ricorrenti e dispnea fanno la loro comparsa successivamente, in genere verso la terza decade, ed evolvono verso la COPD (chronic obstructive pulmonary disease).[48] Nell'importante studio epidemiologico di Sverger,[67] l'11% dei neonati con a1-AT aveva ittero alla nascita, il 6,3% segni di epatopatia senza ittero, il 4% era deceduto entro 8 anni e il 2,4% presentava cirrosi epatica all'autopsia. Negli studi retrospettivi negli adulti con deficit a1-AT la prevalenza della cirrosi epatica all'autopsia è del 12-37% ed essa è causa di morte nel 10-13%.[68]
La cirrosi infantile indiana è una forma di colestasi neonatale caratterizzata dal deposito di rame nel fegato.[69]
Altre condizioni patologiche che possono, seppur raramente, sviluppare una cirrosi epatica secondaria sono la galattosemia[70][71], la malattia di Andersen (o malattia da deposito di glicogeno, tipo 4)[72] e la fibrosi cistica.[54] Un'insufficienza cardiaca destra può causare cirrosi cardiaca che, a sua volta, può portare alla congestione del fegato.[54] Infine, la cirrosi epatica può comparire anche a seguito dell'assunzione di farmaci epatotossici o altre sostanze epatotossiche.[73]
Patogenesi[modifica | modifica wikitesto]


La persistenza del processo infiammatorio indotto dall'azione protratta dell'agente eziologico è causa del prolungato danno epatico e si accompagna alla produzione di citochine (IL2, IL6, TNF alfa, PDGF, TGF beta) da parte delle cellule infiammatorie, delle cellule di Kupffer (ovvero i macrofagi residenti a livello epatico) e delle piastrine.[74][75] Uno dei principali effetti delle citochine è la trasformazione delle cellule stellate di Ito (cellule lipofile presenti a livello epatico che normalmente hanno lo scopo di accumulare lipidi e vitamina A) in miofibroblasti, ovvero in cellule contrattili (grazie all'actina) che producono collagene di tipo I e III, fibronectina e proteoglicani.[76][77]

Tali prodotti di sintesi si depositano inizialmente solo a livello dello spazio di Disse, tra epatociti e sinusoidi. Questa alterazione strutturale compromette le caratteristiche fenestrature dell'endotelio, rendendo i sinusoidi epatici simili ai capillari ("capillarizzazione" dei sinusoidi). Come conseguenza della deposizione di collagene, risulta ostacolato lo scambio di sostanze attraverso i sinusoidi; ciò comporta alterazioni metaboliche degli epatociti, in particolare si riduce la secrezione di proteine (es. albumina), lipoproteine e fattori della coagulazione, responsabile delle principali manifestazioni cliniche della cirrosi (ascite, malnutrizione, disordini della coagulazione del sangue).[2]
Successivamente il collagene e le altre sostanze della matrice connettivale prodotte si depositano a ponte fra gli spazi porto-portali e porto-cavali, concorrendo a formare i noduli di epatociti. Le fibre collagene di tipo I e III, che nel fegato normale si trovano quasi esclusivamente negli spazi portali e nell'avventizia della vena terminale epatica (vena centro-lobulare), nel fegato cirrotico formano setti di vario spessore, depositandosi in tutte le porzioni dei lobuli. La fibrosi nella cirrosi può portare non solo ad alterazione dei sinusoidi e dello spazio di Disse, ma anche delle altre strutture vascolari, aumentando la resistenza al flusso di sangue nel fegato e conducendo a ipertensione portale, che dà luogo a manifestazioni cliniche nel 60% dei pazienti.[54][78]
Anche la vascolarizzazione epatica si modifica in seguito alla neoformazione, all'interno dei setti, di vasi che mettono direttamente in comunicazione il sistema portale con le vene epatiche terminali, escludendo il parenchima e quindi bypassando la funzione degli epatociti.[79]
Anatomia patologica[modifica | modifica wikitesto]
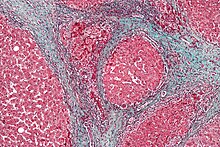


Macroscopicamente il fegato appare ingrandito nelle prime fasi, ma tende a ridursi in dimensioni durante la progressione della malattia. La sua superficie è granulosa o irregolare (a seconda della maggiore o minore omogeneità dei noduli epatocitari), la consistenza è soda e il colore è spesso giallo (specie se associato a steatosi).
A seconda della dimensione dei noduli di rigenerazione, vi sono tre tipologie macroscopiche di cirrosi epatica: micronodulare, macronodulare e misto. Nella forma micronodulare (cirrosi di Laennec o cirrosi portale) i noduli sono <3 mm, mentre in quella macronodulare (cirrosi post-necrotica) sono >3 mm. La cirrosi mista consiste in una varietà di noduli con dimensioni diverse.[80]
Sotto l'aspetto microscopico la cirrosi viene definita in base a:
- presenza di noduli di rigenerazione degli epatociti;
- presenza di fibrosi (deposizione di tessuto connettivo) tra questi noduli.
La fibrosi può essere parzialmente reversibile, se il processo sottostante che l'ha causata è stato risolto, e una cirrosi micronodulare può trasformarsi in una forma macronodulare, grazie soprattutto alle proteasi che degradano le proteine del connettivo.[81][82]
Esistono diverse classificazioni istologiche della fibrosi epatica.[83] Nella classificazione di Laennec, la cirrosi corrisponde allo stadio 4, che risulta distinto in base allo spessore dei setti fibrosi in tre sottotipi a gravità crescente: 4a (≤1 setto fibroso ampio), 4b (≥2 setti ampi o <50% di noduli minuti) e 4c (≥1 setto molto ampio o >50% di noduli minuti), in cui il setto molto ampio mostra uno spessore superiore a quello dei micronoduli.[84][85]
Alcune caratteristiche istologiche della cirrosi sono causa-specifiche e sono legate al diverso tipo di danno che l'agente eziologico produce. Per esempio, nell'epatite B cronica vi è infiltrazione del parenchima epatico con linfociti;[78] nella cirrosi cardiaca vi sono eritrociti e una maggiore quantità di fibrosi nel tessuto circostante le vene epatiche;[86] nella cirrosi biliare primaria vi è fibrosi intorno al dotto biliare, presenza di granulomi e addensamenti di bile;[87] nella cirrosi alcolica vi è infiltrazione del fegato di neutrofili.[78]
Manifestazioni cliniche[modifica | modifica wikitesto]
Durante lo stadio iniziale della malattia la cirrosi è spesso asintomatica: si parla in questo caso di cirrosi compensata. È possibile che passino diversi anni senza accorgersi dei danni che il fegato sta subendo. Ciò è dovuto al fatto che la pressione sanguigna della vena porta non è ancora eccessivamente alta e al fatto che esiste ancora un buon numero di epatociti capaci di svolgere le loro funzioni in modo adeguato. Se durante questo periodo non viene cominciata alcuna terapia e non viene eliminata la causa della malattia, la pressione della vena porta continua ad aumentare e sempre un minor numero di epatociti potrà sopperire a quelli inizialmente già distrutti.[88]
I primi sintomi avvertibili dopo una continua degenerazione epatica sono: perdita di appetito, di peso e di massa muscolare. Negli stadi avanzati della malattia, durante la cosiddetta cirrosi scompensata, con insufficienza epatica cronica, compaiono ittero, aumento di volume dell'addome per ascite, sviluppo di varici esofagee, edemi agli arti inferiori da ipoalbuminemia (edema e linfedema con perdita di linfa), prurito, piastrinopenia con alterazioni della coagulazione e facili sanguinamenti (ecchimosi e petecchie), quindi predisposizione alla flebotrombosi e alla trombosi venosa profonda delle gambe (segni di trombosi venosa sono vene varicose e ulcere venose, cioè lesioni con perdita liquida e sanguinamento).[89] Nelle condizioni più gravi, il paziente può andare incontro a una situazione di malnutrizione e cachessia generale, dovuta alle alterazioni nel catabolismo e nell'immagazzinamento di glucosio e di colesterolo nel fegato.[90]
Possibili sono anche problemi alla cute (eritemi palmari, angiomi), angiomi stellari, ginecomastia nell'uomo, rarefazione dei peli: questi effetti sono dovuti all'eccesso di estrogeni, che il fegato cirrotico non è più capace di metabolizzare.[89]
Complicanze[modifica | modifica wikitesto]

Nonostante gli importanti progressi degli ultimi anni nella prevenzione e nel trattamento delle complicanze comuni della cirrosi, esse rappresentano ancora una delle sfide più importanti nel trattamento della malattia. L'insorgenza delle complicanze definisce la cirrosi epatica "scompensata".[88] Le complicanze più rilevanti sono:
- Ipertensione portale (aumento delle resistenze intraepatiche): il sovvertimento dell’architettura lobulare e la formazione di tessuto connettivo parasinusoidale provoca un ostacolo al normale decorso dei vasi e, di conseguenza, una maggior difficoltà nel deflusso del sangue, che determina un aumento della pressione nel sistema venoso portale e nei circoli collaterali che anastomizzano il sistema venoso portale con la circolazione venosa sistemica (vene cave) a vari livelli: gastro-esofageo, emorroidario, ombelicale; queste anastomosi divengono congeste (es. caput medusae) e, in particolare le prime, possono dar luogo a emorragie.[91]
- Ascite. Si manifesta in oltre il 50% dei pazienti cirrotici in corso di malattia e consiste nell'accumulo di liquido a livello della cavità peritoneale (l'addome) dovuto a presenza di ipertensione portale. Può divenire recidivante (detta anche refrattaria, ovvero che non si risolve o la cui ricomparsa non è prevenuta dai comuni presidi dietetico-comportamentali e dall'impiego di diuretici ad alte dosi). Se fosse necessario ridurre rapidamente il volume è possibile ricorrere alla paracentesi, una procedura che consiste nell'introduzione di un tubo nella cavità peritoneale per drenare il liquido.[92]
- Peritonite batterica spontanea. Infezione del liquido ascitico per traslocazione batterica di microrganismi di origine enterica (Escherichia coli, enterobacteriaceae).[93]
- Emorragia gastrointestinale. Un'emorragia digestiva può determinarsi nel paziente cirrotico per rottura delle varici esofagee (60% dei casi), ma può anche avere origine da altre sedi come le varici gastriche, la gastropatia congestizia o lesioni erosive o ulcerose gastrointestinali. Può causare shock ipovolemico e scompenso cardiaco acuto, in pazienti cardiopatici conduce facilmente all'aritmia e all'arresto cardiaco improvviso.[94]
- Encefalopatia epatica. È una sindrome neurologica che si manifesta con confusione mentale e sonnolenza, negli ultimi stadi può condurre fino al coma.[95]
- Sindrome epatorenale. Caratterizzata da un'insufficienza renale che insorge nel paziente cirrotico con ascite in assenza di cause identificabile di danno renale (per esempio in assenza di shock, utilizzo di farmaci nefrotossici e infezioni). Si distinguono due tipi di sindrome epatorenale: il tipo 1, rapidamente progressivo che porta a insufficienza renale in meno di due settimane, e il tipo 2 con un decorso più lento (da settimane a mesi).[96]
- Epatocarcinoma. È un tumore primario del fegato comune nei soggetti con cirrosi. Coloro che soffrono di cirrosi cronica vengono spesso sottoposti a screening per tentare di identificare i primi segni di questa neoplasia; ciò ha permesso di migliorarne la prognosi.[97]
- Trombosi della vena porta. Può essere parziale o completa e si osserva con discreta frequenza nei pazienti cirrotici e in particolare in quelli con concomitante epatocarcinoma; porta a un aumento della pressione a livello della vena porta con possibile rottura di varici esofagee e ascite.[98]
- Sindrome da risposta infiammatoria sistemica. Si ritiene che la patogenesi di questa condizione, spesso correlata alla cirrosi, possa essere dovuta a una maggiore traslocazione batterica dall'intestino, una funzione immunitaria compromessa e un eccessivo rilascio di citochine proinfiammatorie.[99]
Diagnosi[modifica | modifica wikitesto]

Oltre a una prima visita medica, il gold standard per la diagnosi di cirrosi è la biopsia epatica, per via percutanea, transgiugulare, laparoscopica o tramite ago detto di Menghini.[100] La biopsia non è necessaria se la clinica, gli esami di laboratorio e le indagini radiologiche suggeriscono cirrosi, tanto più che vi è un piccolo ma significativo rischio per la biopsia epatica.[101] La presenza di ascite, bassa conta piastrinica e angioma a ragno sono utili riscontri fisici.[102] Molto utile e di facile esecuzione l'ecografia mono o bidimensionale, in grado di mettere in rilievo eventuali alterazioni anatomiche, solitamente come iperecogenicità diffusa e setti fibrosi che si insinuano fra i noduli rigenerativi. Molto usate anche la tomografia computerizzata (TC), per evidenziare anomalie dell'asse venoso portale e per la stadiazione della patologia, e la risonanza magnetica (RM).
Visita medica[modifica | modifica wikitesto]
La base per la valutazione di una condizione cirrotica epatica è una visita medica accurata del paziente comprendente la sua storia clinica (anamnesi). Fondamentali sono le informazioni riguardo all'assunzione presente o passata di alcol o di alcolismo e all'uso di sostanze stupefacenti, in particolare di quelle iniettabili per endovena in quanto a rischio di contrarre il virus dell'epatite C. È necessario valutare anche i farmaci assunti, per individuare quelli che possono potenzialmente danneggiare il fegato.[103] Per coloro che accusano una cirrosi avanzata, l'abuso e l'assunzione di alcol possono essere causa di diniego a un trapianto di fegato.
Una scrupolosa osservazione del paziente (esame obiettivo) può dare importanti informazioni: un deperimento generale può essere suggestivo di cirrosi avanzata, mentre la presenza di ittero sclerale indica alti livelli di bilirubina sierica e quindi l'essersi instaurata una condizione di cirrosi compensata. La palpazione dell'addome permette di avere una prima stima delle dimensioni del fegato e dell'eventuale presenza di ascite.[104]
Un'attenta valutazione dell'anamnesi del paziente può permettere di identificare comorbilità che possono influire sullo sviluppo e il decorso della malattia, come l'HIV, l'epatite B, il diabete, l'obesità, e la steatosi epatica. Essendo le persone obese più a rischio di sviluppare la cirrosi, è consigliato calcolare l'indice di massa corporea.[103] È stato dimostrato che la presenza di una depressione maggiore sia correlata con una più limitata sopravvivenza e dunque si rende necessaria un'analisi della salute mentale del paziente.[105]
Biopsia[modifica | modifica wikitesto]

La biopsia epatica, nonostante sia una procedura invasiva, è considerata il gold standard per la diagnosi di cirrosi, per la classificazione istologica e per la valutazione della progressione. Vi sono diverse metodiche per effettuarla: accesso per via percutanea con guida fluoroscopica, per via transgiugulare o tramite laparoscopia. L'utilizzo di aghi di grosse dimensioni è correlato con una maggiore probabilità di emorragia.
L'esecuzione di una biopsia comporta alcune possibili complicanze che, nel 2-3% dei casi, richiedono un ricovero ospedaliero. Il 60% delle complicanze, più frequentemente dolore o ipotensione, si riscontra entro due ore dalla biopsia e il 96% entro 24 ore. La mortalità della procedura, solitamente conseguente a gravi emorragie, è di circa un caso su 10 000 pazienti sottoposti. Nel caso che si sia optato per l'approccio transgiugulare o laparoscopico, oppure quando la conta delle piastrine scende sotto i 70 000/mL o il tempo di protrombina si prolunga oltre i quattro secondi è necessario provvedere a una trasfusione. Prima di procedere con la biopsia, il paziente deve sospendere i farmaci antipiastrinici, come l'aspirina.[23]
I risultati della biopsia epatica risentono di una considerevole variabilità dovuta al campionamento del tessuto. Nonostante ciò, questa metodica risulta necessaria per confermare la diagnosi di cirrosi nei pazienti con funzionalità epatica conservata e per determinarne l'eziologia. La biopsia epatica è sconsigliata quando si riscontrano chiari segni che indicano una cirrosi, quali ascite, coagulopatia, o fegato nodulare.[23]
La comunità scientifica raccomanda la messa a punto di test affidabili e non invasivi come alternativa alla biopsia per i pazienti con epatiti croniche. Test non invasivi per la fibrosi epatica, nelle malattie epatiche alcoliche, e virali, sono destinati a diventare sempre più utilizzati.[106] La biopsia epatica probabilmente rimarrà particolarmente importante nella diagnosi di malattie del fegato inspiegabili.
Esami di laboratorio[modifica | modifica wikitesto]
Gli esami ematochimici sono molto utilizzati per la diagnosi della cirrosi epatica. Tra i risultati più significativi vi è una conta piastrinica inferiore a 160 000/mm3 e un punteggio di Bonacini superiore a 7 (calcolato come somma dei punteggi per conta piastrinica, rapporto ALT/AST e tempo di protrombina come si può vedere dalla tabella di fianco).[107]
L'ipertensione portale e l'ipersplenismo associato, l'alterazione nei fattori che stimolano il midollo osseo (es. deficit di trombopoietina) e la soppressione di quest'ultimo indotta da virus, alcol e tossine, il sanguinamento dalle varici sono le cause principali delle anormalità ematologiche (piastrinopenia, leucopenia e anemia) che si riscontrano frequentemente nei pazienti cirrotici.[108]
Riassumendo, i seguenti parametri di esami di laboratorio sono alterati in presenza di cirrosi[109]:
| Punteggio | Conta piastrinica x109 | Rapporto ALT/AST | PT |
|---|---|---|---|
| 0 | >340 | >1,7 | <1,1 |
| 1 | 280-340 | 1,2-1,7 | 1,1-1,4 |
| 2 | 220-279 | 0,6-1,19 | >1,4 |
| 3 | 160-219 | <0,6 | ... |
| 4 | 100-159 | ... | ... |
| 5 | 40-99 | ... | ... |
| 6 | <40 | ... | ... |
- Aminotransferasi - gli enzimi AST e ALT appaiono moderatamente elevati, con AST>ALT. Tuttavia, transaminasi normali non escludono la cirrosi.[57]
- Fosfatasi alcalina - conseguentemente alla disfunzione epatica, solitamente tale valore appare moderatamente elevato.[111]
- Gammaglutammiltransferasi - in genere molto più elevata nella malattia epatica cronica da alcol.[109]
- Bilirubina - aumenta come conseguenza dell'emolisi e appare molto elevata con la progressione della cirrosi. Elevati livelli sono responsabili dell'ittero: colorito giallo della cute.[112]
- Albumina - i livelli calano poiché viene sintetizzata esclusivamente dal fegato che perde questa funzione.[112]
- Tempo di protrombina - aumenta in quanto il fegato sintetizza fattori di coagulazione.[107]
- Globuline - aumentano a causa dell'allontanamento degli antigeni batterici dal fegato al tessuto linfoide.
- Sodio sierico - ipernatriemia a causa dell'incapacità di espellere l'acqua libera risultante da elevati livelli di ADH e di aldosterone.[113]
- Leucopenia e neutropenia - a causa di splenomegalia (ingrossamento della milza) con emarginazione splenica dovuta all'ipertensione portale, per la stimolazione delle colonie di macrofagi e granulociti e per la soppressione del midollo osseo mediata da tossine (alcol, epatite B e C).[108]
- Difetti di coagulazione - il fegato produce la maggior parte dei fattori di coagulazione e quindi vi è una correlazione tra coagulopatia e il peggioramento della malattia epatica.[108]
Attualmente vi è una combinazione convalidata e brevettata di sei di questi marcatori come indice non invasivo della fibrosi (e quindi di cirrosi). Questa combinazione è chiamata FibroTest.[114]
Altri studi di laboratorio eseguiti per formulare diagnosi di cirrosi possono includere:
- Sierologia per i virus dell'epatite, anticorpi antinucleo (ANA, anti-muscolo liscio, anti-mitocondrio, anti-LKM).
- Ferritina e saturazione della transferrina (marcatori di sovraccarico del ferro), rame e ceruloplasmina (marcatori di sovraccarico di rame).
- Può riscontrarsi anemia in seguito dell'aumento dell'emolisi e del verificarsi di emorragie.[108]
- Livelli di immunoglobuline (IgG, IgM, IgA) - è stata dimostrata la presenza di diverse immunoglobuline (anticorpi) nella cirrosi: queste non sono specifiche, ma possono aiutare a distinguerne le varie cause. Alcune di esse sono comuni nell'epatite autoimmune, nella cirrosi biliare primitiva o nella colangite sclerosante primitiva, nonché nelle epatiti virali, da farmaci e alcolica, nella steatosi epatica non alcolica. Altre possono avere un significato clinico nella valutazione del decorso della condizione. Alcuni studi hanno rivelato la stretta correlazione tra stress ossidativo e la produzione di immunoglobuline nelle malattie del fegato.[115]
- Colesterolo e glucosio, il fegato svolge un ruolo importante nella sintesi, nella secrezione, nel catabolismo e nell'immagazzinamento dei lipidi e delle lipoproteine, pertanto la sua disfunzione comporta valori alterati di esse nel sangue.[116] Identica cosa si può dire riguardo al glucosio, le cui alterazioni metaboliche comportano un quadro clinico simile alla malnutrizione e di cachessia.[90]
- Alfa 1-antitripsina, questa glicoproteina viene principalmente prodotta dagli epatociti, le cellule del fegato. È stata proposta la correlazione tra la sua scarsità nel sangue e la presenza di cirrosi epatica.[117]
Diagnostica per immagini[modifica | modifica wikitesto]


L'uso delle diverse tecniche di imaging nella patologia cirrotica non ha valenza diagnostica (che è clinica e istologica), ma è utile per una valutazione morfologica, vascolare e di screening per l'epatocarcinoma.[118] I segni di cirrosi comunemente riscontrabili tramite l'imaging sono: presenza di noduli epatici, parenchima epatico eterogeneo, epatomegalia, aumento del diametro dell'arteria epatica e diminuzione di quello della vena epatica, dilatazione delle vene portale, splenica e mesenterica superiore, splenomegalia, presenza di ascite, shunt spontaneo spleno-renale o gastro-renale.[119]
Ecografia[modifica | modifica wikitesto]
Le tecniche ultrasonografiche sono esami di primo livello, a basso costo e veloci[120], in grado di dare una buona valutazione morfologica e volumetrica, valutare il circolo e rilevare lesioni nodulari sospette. L'ecografia è in grado di mostrare le alterazioni epatiche: fegato con lobo destro ipotrofico (con induzione di ipertrofia compensatoria nei lobi sinistro e caudato); margini irregolari e "bozzoluti"; disomogeneità strutturale con noduli iperecogeni: lesioni superiori a 1 cm necessitano di ulteriore approfondimento con mezzo di contrasto per escludere il rischio neoplastico.
Con le tecniche eco-doppler si effettuano valutazioni del circolo epatico, valutazioni finalizzate in particolare alla ricerca di ipertensione portale o sindrome di Budd-Chiari.[121] Segni caratteristici sono: anomalie di diametro, flusso e decorso della vena porta, dislocazione dei vasi intraepatici e trombosi; altri reperti ricercabili che pongono il sospetto di ipertensione sono un ingrossamento della milza (splenomegalia) e l'ascite.[122][123]
L'ecografia effettuata con mezzo di contrasto adeguato è in grado di rilevare con maggior precisione dell'eco-doppler le alterazioni vascolari ed emodinamiche intraepatiche e sistemiche, tuttavia questa è una metodica più costosa e necessita di personale con maggior esperienza.[119]
A partire dai primi anni del 2000, si è assistito allo sviluppo dell'elastografia epatica (nome commerciale FibroScan), un promettente strumento non invasivo per la valutazione della patologia epatica cronica che utilizza gli ultrasuoni per determinare la rigidità del fegato, producendo un punteggio basato sulla scala METAVIR. Il test è molto più veloce di una biopsia (solitamente termina in 2,5-5 minuti) ed è completamente indolore.[124] Esso mostra correlazione ragionevole con la gravità della cirrosi.[125] Al 2016, tale tecnica risulta una pratica comune e accettata a livello internazionale, tuttavia alcuni studi hanno rilevato la possibilità che i risultati possano essere non del tutto accurati per via della presenza di alcuni fattori confondenti, come infiammazione, colestasi, obesità o ascite.[118]
Esami di secondo livello[modifica | modifica wikitesto]

La tomografia computerizzata (TC) con o senza mezzo di contrasto e la risonanza magnetica (RM) sono esami di secondo livello, riservati a casi di dubbio diagnostico. La TC, in particolare può completare con più precisione le valutazioni architetturali e vascolari, mentre la RM, grazie all'accumulo di ferro nei noduli, è indicata per la valutazione più specifica dei noduli sospetti. Uno svantaggio della TC, oltre a quello di esporre il paziente a radiazioni ionizzanti (l'ecografia e la RM non comportano questo problema), è quello di non essere sufficientemente sensibile a rilevare una condizione patologica allo stato iniziale e quindi il suo ruolo è relegato quasi ed esclusivamente a una valutazione di una malattia avanzata.[119] Uno studio effettuato nel 2017 ha dimostrato che l'esecuzione di una TC con mezzo di contrasto iodato è in grado di valutare un'ipertensione portale con una sensibilità e una specificità pari a, rispettivamente, 94% e 100%.[126]
A differenza della TC, la risonanza magnetica appare in grado di identificare precocemente le mutazioni morfologiche del fegato proprie della cirrosi e molte sequenze sono state introdotte per perseguire questo scopo. Miglioramenti in tal senso possono essere ottenuti mediante la somministrazione per via endovenosa di mezzi di contrasto basati sul gadolinio, che rende il tessuto fibrotico iperintenso nelle immagini pesate in T1 con un enhancement progressivo.[119] L'RM con somministrazione di mezzo di contrasto con gadolinio e acido gadoxetico disodico (Gd-EOB-DTPA) è una metodica, al 2017, emergente che permette di caratterizzare la funzione degli epatociti in fase epatobiliare,[127] rilevando e differenziando la natura delle lesioni focali del fegato. Questa tecnica appare utile per la valutazione della funzionalità epatica nei pazienti cirrotici al fine di determinare la tempistica ottimale per eseguire una resezione epatica, una procedura di TIPS o per un trapianto di fegato.[119][128][129]
Alcune tecniche particolari, come la DWI-RM (Diffusion Weighted Imaging RM), vengono frequentemente utilizzate per ottenere risposte più accurate e una corretta diagnosi differenziale.[130][131] La risonanza magnetica di perfusione permette di valutare alcune alterazione emodinamiche tipiche della cirrosi, come la diminuzione della velocità del flusso sanguigno del parenchima epatico e del circolo portale o la formazione di shunt intraepatici.[132] Ciò nonostante, lo studio della perfusione può essere influenzato da numerosi fattori sistemici, per di più l'esame in sé richiede molto tempo, sia per l'acquisizione delle immagini sia per la loro refertazione, oltre che necessitare, talvolta, di più di una iniezione di mezzo di contrasto.[119] La risonanza magnetica colangiopancreatografica permette di studiare in modo più approfondito i dotti biliari.[133]

Similmente a quanto detto per l'elastografia epatica a ultrasuoni, agli inizi del XXI secolo si è affermata anche la risonanza magnetica elastografica. L'elaborazione dei dati ottenuti permette di ottenere un elastogramma, un diagramma tridimensionale in colori convenzionali che rappresenta l'elasticità del fegato. Un fegato sano è tendenzialmente molto elastico, a differenza di uno cirrotico che assume una consistenza alquanto compatta.[134][135] In sintesi, l'elastografia RM è una metodica decisamente accurata per la diagnosi della cirrosi e, a differenza di quella basata sugli ultrasuoni, può essere utilizzata proficuamente anche sui pazienti obesi o con ascite. Tuttavia, il suo utilizzo appare limitato per via dell'alto costo, del lungo tempo necessario per eseguire l'indagine e per la limitata diffusione delle apparecchiature RM, oltre che per la necessità di collaborazione da parte del paziente durante l'esame. I suoi risultati possono essere influenzati nei casi di sovraccarico epatico di ferro, di steatosi epatica, congestione vascolare o colestasi.[119]
Nel campo della medicina nucleare, la scintigrafia con radiocolloide (tecnezio-99m zolfo colloidale o TC-99m SC) evidenzia la ridotta captazione epatica e irregolarità di distribuzione del radiofarmaco, associate a splenomegalia e aumentata captazione nella milza e nel midollo osseo per l'attivazione macrofagica vicariante.[136] In particolare, uno studio ha evidenziato uno spostamento del colloide radioattivo nell'84% dei pazienti cirrotici rispetto ai controlli sani e una riduzione dell'assorbimento epatico nel 59% contro il 20% dei controlli. In definitiva, si è dimostrato che il ricorso alla scintigrafia con TC-99m SC può essere un'ottima metodica non invasiva complementare, utile nel differenziamento clinico della cirrosi dalla fibrosi periportale non cirrotica.[137]
La tomografia a emissione di positroni può essere utile per indagare sui casi di encefalopatia epatica, una conseguenza neurologica della cirrosi.[138]
Endoscopia[modifica | modifica wikitesto]
La gastroscopia (esame endoscopico di esofago, stomaco e duodeno) viene eseguita in pazienti con cirrosi per escludere la presenza di varici esofagee. Se queste vengono trovate, si applica una terapia profilattica (scleroterapia o banding) e può essere cominciato il trattamento betabloccante.[139] Si stima che, a seguito di tale procedura, il rischio di incorrere in gravi complicanze sia di un caso su 500, mentre la probabilità di esito infausto sia di 1 su 10 000. Tali rischi aumentano se l'esofagogastroduodenoscopia viene eseguita in modalità d'urgenza, in pazienti poco collaboranti (frequente nel caso di encefalopatia epatica) e di età avanzata, con emorragia gastrointestinale in atto o con predisposizione alle emorragie. La più comuni complicanze sono l'emorragia, una perforazione gastrointestinale e lo sviluppo di infezioni.[140]
Classificazione[modifica | modifica wikitesto]
La gravità della cirrosi è comunemente classificata con la classificazione di Child-Pugh. Questo punteggio considera i valori di bilirubina, albumina, INR, la presenza e la gravità di ascite ed encefalopatia per classificare i pazienti nelle classi A, B o C; la classe A ha una prognosi favorevole, mentre la classe C è ad alto rischio di morte. La scala è stata proposta nel 1964 da Child e Turcotte e modificata nel 1973 da Pugh et al.[141]
Scale più moderne, utilizzate per la decisione sui trapianti di fegato, ma anche in altri contesti, sono la Model for End-Stage Liver Disease (scala MELD)[142][143] e la sua controparte pediatrica, la Pediatric end-stage liver disease (scala PELD).[144]
Il gradiente di pressione venosa epatica, cioè la differenza di pressione fra il sangue venoso afferente ed efferente al fegato, determina anche la gravità della cirrosi, benché ciò sia difficile da misurare. Un valore pari o superiore a 16 millimetri di mercurio comporta un rischio notevolmente alto di morte.[145]
Terapia[modifica | modifica wikitesto]
Non esiste una cura per la cirrosi, ma è possibile trattare sintomi e complicanze, rallentando così la sua progressione.[146] La terapia si basa sull'allontanamento dei fattori di rischio e degli agenti eziologici (astensione dall'alcol, terapia anti-virale per i virus B e C) e in una dieta equilibrata che aiuti la rigenerazione del fegato e prevenga la malnutrizione, in particolar modo il deficit di zinco, vitamina B1 (in caso di consumo cronico di alcol) e vitamine liposolubili A, D, E e K, mentre le proteine vanno limitate. È prevista una dieta giornaliera contenente 35-40 kcal e 1,2-1,5 g di proteine per chilogrammo di peso corporeo.[147] Gli esperti consigliano uno spuntino ricco di proteine in tarda serata per evitare un effetto catabolico sulla muscolatura e una conseguente sarcopenia.
Occorre anche una terapia farmacologica che riduca il rischio di complicanze. In casi particolarmente gravi e selezionati è necessario procedere con un trapianto di fegato.
Terapia antalgica[modifica | modifica wikitesto]

La gestione del dolore nei pazienti cirrotici è una sfida clinica difficile e vi sono pochi studi prospettici a supporto. Al 40,5% dei pazienti cirrotici viene prescritta una terapia antalgica.[148]
I farmaci anti-infiammatori non steroidei (FANS), che risultano i più prescritti (82,7% dei pazienti), sono controindicati per il loro effetto negativo sulla microcircolazione renale, la quale è spesso già compromessa in pazienti con ipertensione portale. L'unica eccezione è l'aspirina a basso dosaggio, indicata nei pazienti cardiopatici con alto rischio di infarto o con terapia antiaggregante. I farmaci oppioidi sono da usare con molta cautela a causa della potenziale esacerbazione di un'encefalopatia epatica.[149]
Il paracetamolo è consigliato come farmaco antidolorifico nei pazienti affetti da cirrosi di origine non-alcolica, con un dosaggio che non supera i 2 g giornalieri. Per i pazienti con cirrosi epatica alcolica, il paracetamolo è invece controindicato. Il paracetamolo viene prescritto mediamente nel 64,5% dei casi di pazienti sotto terapia antalgica.[149]
Alimentazione e attività fisica[modifica | modifica wikitesto]
Spesso, i pazienti con cirrosi epatica accusano una situazione di malnutrizione e di scarsa attività fisica. Tutto ciò può portare all'insorgenza di una perdita di massa muscolare, una condizione nota come sarcopenia. Poiché questa condizione è correlata con un peggioramento della prognosi, si consiglia, oltre a una dieta appropriata, un regolare esercizio fisico. Quando le condizioni cliniche del paziente lo consentono, l'esercizio fisico può essere utile sia per aumentare la forza muscolare sia per migliorare la resistenza all'insulina.[150] Per coloro che presentano obesità è necessario diminuire l'assunzione di calorie e di alimenti ricchi di proteine. Sia per i pazienti obesi sia normopeso sono indicati integratori alimentari con amminoacidi ramificati (leucina, valina, isoleucina).
Trattamento delle complicanze[modifica | modifica wikitesto]
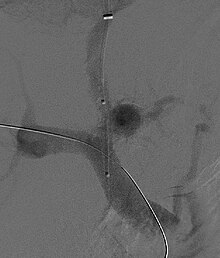
Quando nella cirrosi sopraggiungono delle complicanze, si parla di cirrosi scompensata. Queste complicanze comprendono: emorragia gastrointestinale, encefalopatia epatica, ittero e ascite. Nella cirrosi stabile, le complicanze possono verificarsi per varie cause, come stitichezza, infezione (di qualsiasi origine), assunzione di alcol o di farmaci, sanguinamento da varici esofagee o disidratazione.[151][152]
Molto spesso, i pazienti che presentano complicanze necessitano di ricovero in ospedale dove è possibile procedere con un attento monitoraggio del bilancio dei liquidi e dello stato mentale e con un'adeguata alimentazione. Il trattamento farmacologico in regime ospedaliero generalmente consiste nella somministrazione di diuretici, antibiotici, lassativi, tiamina e occasionalmente steroidi, acetilcisteina e pentossifillina.[153]
L'ascite viene normalmente trattata con diuretici e restrizione di sodio (< 2g al giorno); nei casi refrattari, l'aspirazione e l'analisi dell'aspirato sono consigliati. In seguito, al paziente viene somministrata albumina endovena. Una peritonite batterica spontanea, caratterizzata da ascite e stato setticemico, richiede un'immediata paracentesi e l'utilizzo di cefalosporine di 3ª generazione.[151]
Al fine di limitare il rischio di emorragia da varici esofagee oppure per prevenire una sua recidiva, si utilizzano farmaci betabloccanti per ridurre la pressione del sangue nelle varici.[154] Tuttavia, in caso di sanguinamento è necessaria la loro legatura per via endoscopica. Inoltre, si è consolidato l'utilizzo di sostanze analoghe alla somatostatina (octreotide) o alla vasopressina (terlipressina), le quali diminuiscono la pressione portale e quella nella circolazione collaterale. Spesso, per trattare l'ipertensione portale è necessario realizzare uno shunt portosistemico intraepatico transgiugulare, una procedura di radiologia interventistica che consiste nella creazione di una comunicazione artificiale all'interno del fegato tra la vena porta e la vena epatica. L'effetto collaterale di questa procedura è l'aggravarsi dell'encefalopatia epatica.[151]
La terapia medica dell'encefalopatia epatica include principalmente il lattulosio e la rifaximina. Il primo è uno disaccaride non riassorbibile che modifica la bioflora e il pH intestinale, diminuendo la quantità intraintestinale di ammoniaca. Analogamente, la rifaximina ha proprietà antibiotiche che vanno a ridurre la bioflora intestinale e conseguentemente la produzione di ammoniaca.[152]
Trapianto di fegato[modifica | modifica wikitesto]
In casi selezionati, se le complicanze della cirrosi non possono essere controllate oppure quando la funzionalità del fegato è irrimediabilmente compromessa, è necessario ricorrere a un trapianto di fegato. A partire dagli anni 1990, il tasso di sopravvivenza a cinque anni dal trapianto è migliorata arrivando, negli anni 2010, all'80%. Il tasso di sopravvivenza dipende in gran parte dalla gravità della malattia e da altri fattori di rischio presenti nel ricevente.[155] Negli Stati Uniti, il punteggio MELD viene utilizzato per stabilire la priorità dei pazienti nella graduatoria per il trapianto.[156] Tale intervento richiede l'assunzione di immunosoppressori (ciclosporina o tacrolimus).
Cure palliative[modifica | modifica wikitesto]
Molte persone che si trovano in uno stadio avanzato di cirrosi epatica non riusciranno a ottenere un trapianto di fegato o dovranno attendere molto tempo, sia perché non eleggibili all'intervento, sia per mancanza di donatori idonei. Una condizione di fegato cirrotico grave comporta grandi difficoltà nella vita quotidiana, dovute alla considerevole quantità di sintomi che si presentano e alla necessità di numerosi ricoveri e trattamenti necessari.[157] I pazienti, quindi, vanno incontro a difficoltà sia fisiche sia psicosociali.[158] Per attenuare i gravi disagi di questa situazione, i paesi con i sistemi sanitari più avanzati hanno messo a punto una serie di iniziative volte a fornire delle cure palliative atte a soddisfare il più possibile le molteplici e interdisciplinari esigenze dei pazienti. L'accesso precoce a tali trattamenti può migliorare il controllo sui sintomi e, quindi, la qualità della vita del paziente e di quella dei famigliari.[159]
Le cure palliative sono finalizzate anche ad aumentare nei pazienti la consapevolezza della propria condizione e del decorso e, poiché la cirrosi epatica non è curabile senza trapianto, ciò può aiutare nelle discussioni riguardanti i desideri della persona in merito alla procura sanitaria e l'eventuale ammissione in un hospice.[160] Nonostante questi comprovati benefici, raramente gli individui con grave cirrosi epatica vengono indirizzati verso i trattamenti palliativi.[161]
Prognosi[modifica | modifica wikitesto]
La prognosi della cirrosi è differente in base allo stadio scompensato (ovvero in presenza di ascite, encefalopatia portosistemica, emorragia digestiva dovuta a ipertensione portale, peritonite batterica spontanea, sindrome epatorenale, epatocarcinoma), oppure compensato (in assenza delle sopracitate complicanze). Esiste poi un indice prognostico, ovvero il punteggio di Child Pugh, che comprende tre diverse classi A (5, 6 punti), B (7, 8, 9 punti), C (10, 11, 12, 13, 14, 15 punti) a ciascuna delle quali è associata una prognosi più o meno favorevole: la classe A ha la prognosi più favorevole.[162] L'inclusione in ciascuna classe è calcolabile facendo la somma dei singoli punteggi associati ai valori o al grado di ognuno dei parametri presi in considerazione.[162][163]
| Parametro | 1 punto | 2 punti | 3 punti |
|---|---|---|---|
| Bilirubina (totale) | < 2,0 | 2,0 - 3,0 | > 3,0 mg/dL |
| Albumina sierica | > 3,5 | 2,8 - 3,5 | < 2,8 g/dL |
| Tempo di protrombina (I.N.R.) | < 1,7 | 1,7- 2,3 | > 2,3 |
| Ascite | assente | scarsa | moderata |
| Encefalopatia epatica | assente | Stadio I - II | Stadio III - IV |
Prevenzione[modifica | modifica wikitesto]
La prevenzione della cirrosi epatica consiste nell'evitare comportamenti che possono portare al suo sviluppo. La più importante accortezza è evitare il cronico abuso di bevande alcoliche attenendosi ai limiti consigliati di circa 14 unità alcoliche a settimana. Nel caso in cui la cirrosi si sia già sviluppata, è necessario interrompere completamente qualsiasi assunzione di alcol per evitare una più rapida progressione della malattia. Fondamentale è anche difendersi dalle infezioni da epatite C e B, praticando sesso sicuro, usando siringhe monouso se si fa uso di droghe/farmaci iniettabili ed evitando di entrare in contatto con il sangue di persone contagiate. Al 2018 è disponibile un vaccino antiepatite B mentre non esiste un analogo per l'epatite C. Per ridurre il rischio di sviluppare una steatosi epatica non alcolica che può degenerare in cirrosi è necessario mantenere un indice di massa corporea adeguato, alimentandosi correttamente e svolgendo una regolare attività fisica.[146]
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h i j k l m n (EN) Cirrhosis, su National Institute of Diabetes and Digestive and Kidney Diseases, 23 aprile 2014. URL consultato il 19 maggio 2015 (archiviato il 9 giugno 2015).
- ^ a b c Robbins e Cotran, Le basi patologiche delle malattie (7ª edizione), Torino - Milano, Elsevier Masson, 2008, pp. 1000-1003, ISBN 978-88-85675-53-7.
- ^ Cirrosi, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ (EN) Collaborators GBD 2013 Mortality and Causes of Death, Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013., in Lancet, vol. 385, n. 9963, 17 dicembre 2014, pp. 117-71, DOI:10.1016/S0140-6736(14)61682-2, PMC 4340604, PMID 25530442.
- ^ (EN) Steven T. Brower, Elective general surgery : an evidence-based approach, New York, McGraw-Hill Medical, 2012, p. 36, ISBN 978-1-60795-109-4 (archiviato l'8 settembre 2017).
- ^ G. Levi, Enciclopedia delle scienze mediche, vol. 2, 1842, p. 320.
- ^ Libro III, Delle malattie del ventre, Lettera XXXVIII, Dell'Idropisia ascite, della Timpanite, dell'Idropisia del peritoneo e di altre idropisie dette saccate
- ^ (EN) J.M. Duffin, Why does cirrhosis belong to Laennec? (PDF), in CMAJ, vol. 137, 1987, pp. 393-396, PMID 3304599.
- ^ (EN) Roguin A, Rene Theophile Hyacinthe Laënnec (1781–1826): The Man Behind the Stethoscope, in Clinical medicine & research, vol. 4, n. 3, 2006, pp. 230-5, DOI:10.3121/cmr.4.3.230, PMC 1570491, PMID 17048358.
- ^ (EN) Meirelles Júnior RF, Salvalaggio P, Rezende MB, Evangelista AS, Guardia BD, Matielo CE, Neves DB, Pandullo FL, Felga GE, Alves JA, Curvelo LA, Diaz LG, Rusi MB, Viveiros Mde M, Almeida MD, Pedroso PT, Rocco RA, Meira Filho SP, Liver transplantation: history, outcomes and perspectives, in Einstein (Sao Paulo), vol. 13, n. 1, 2015, pp. 149-52, DOI:10.1590/S1679-45082015RW3164, PMC 4977591, PMID 25993082.
- ^ (EN) WHO Disease and injury country estimates, su World Health Organization, 2009. URL consultato l'11 novembre 2009.
- ^ (EN) Collaborators. GBD 2015 Disease and Injury Incidence and Prevalence, Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015., in Lancet, vol. 388, n. 10053, 8 ottobre 2016, pp. 1545-1602, DOI:10.1016/S0140-6736(16)31678-6, PMC 5055577, PMID 27733282.
- ^ a b (EN) Collaborators. GBD 2015 Mortality and Causes of Death, Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015., in Lancet, vol. 388, n. 10053, 8 ottobre 2016, pp. 1459-1544, DOI:10.1016/s0140-6736(16)31012-1, PMC 5388903, PMID 27733281.
- ^ Servizio Sanitario Regionale dell'Emilia Romagna, Cirrosi epatica, su asmn.re.it. URL consultato il 2 novembre 2018 (archiviato dall'url originale il 26 novembre 2018).
- ^ (EN) Anderson RN, Smith BL, Deaths: leading causes for 2001 (PDF), in National Vital Statistics Reports, vol. 52, n. 9, Centers for Disease Control and Prevention, 2003, pp. 1-85, PMID 14626726.
- ^ Report ISTAT, L'evoluzione della mortalità per causa: le prime 25 cause di morte (PDF), 2017.
- ^ (EN) Sørensen HT, Thulstrup AM, Mellemkjar L, et al., Long-term survival and cause-specific mortality in patients with cirrhosis of the liver: a nationwide cohort study in Denmark, in Journal of Clinical Epidemiology, vol. 56, n. 1, 2003, pp. 88-93, DOI:10.1016/S0895-4356(02)00531-0, PMID 12589875.
- ^ a b c (EN) European Association for the Study of Liver, EASL clinical practical guidelines: management of alcoholic liver disease, in J. Hepatol., vol. 57, 2012, pp. 399-420, PMID 22633836.
- ^ (EN) C.J. Murray, The global burden of disease in 1990: summary results, sensitivity analysis and future directions, in Bull. World Health Organ., vol. 72, 1994, pp. 495-509, PMID 8062404.
- ^ (EN) C.J. Murray, Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010 (abstract), in Lancet, vol. 380, 2012, pp. 2197-2223, PMID 23245608.
- ^ (EN) J. Rehm, Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders (abstract), in Lancet, vol. 373, 2009, pp. 2223-2233, PMID 19560604.
- ^ Neff GW, Duncan CW, Schiff ER, The current economic burden of cirrhosis, in Gastroenterol Hepatol (N Y), vol. 7, n. 10, ottobre 2011, pp. 661-71, PMC 3265008, PMID 22298959.
- ^ a b c (EN) Schuppan D, Afdhal NH, Liver cirrhosis, in Lancet, vol. 371, n. 9615, marzo 2008, pp. 838-51, DOI:10.1016/S0140-6736(08)60383-9, PMC 2271178, PMID 18328931.
- ^ (EN) Detlef Schuppan e Nezam Afdhal, Hepatic Cirrhosis, su ncbi.nlm.nih.gov. URL consultato il 30 luglio 2019.
- ^ Mueller S, Millonig G, Seitz HK, Alcoholic liver disease and hepatitis C: a frequently underestimated combination, in World J. Gastroenterol., vol. 15, n. 28, luglio 2009, pp. 3462-71, DOI:10.3748/wjg.15.3462, PMC 2715970, PMID 19630099.
- ^ (EN) Klatsky AL, Morton C, Udaltsova N, Friedman GD, Coffee, cirrhosis, and transaminase enzymes, in Archives of Internal Medicine, vol. 166, n. 11, 2006, pp. 1190-5, DOI:10.1001/archinte.166.11.1190, PMID 16772246.
- ^ a b (EN) OECD/EU (2016), Health at a Glance: Europe 2016, Health at a Glance: Europe 2016, Paris, 2016, ISBN 978-92-64-26559-2.
- ^ World Health Organization, Global status report on alcohol and health (PDF), su who.int. URL consultato il 28 luglio 2019.
- ^ (EN) J. Neuberger, Alcohol abuse and liver disease, Chichester, Wiley Blackwell, 2015, ISBN 978-1-118-88728-8.
- ^ Istituto Superiore di Sanità, Epidemiologia e monitoraggio alcol-correlato in Italia e nelle regioni, in ISTISAN, 2017.
- ^ Osservatorio nazionale alcol, su epicentro.iss.it. URL consultato il 28 luglio 2019.
- ^ Ministero della salute, Guida utile all'identificazione e alla diagnosi dei problemi alcol-relati (PDF), su salute.gov.it. URL consultato il 28 luglio 2019.
- ^ (EN) U. Becker, Prediction of risk of liver disease by alcohol intake, sex, and age: a prospective population study (abstract), in Hepatology, vol. 23, 1996, pp. 1025-1029, PMID 8621128.
- ^ (EN) G. Corrao, Meta-analysis of alcohol intake in relation to risk of liver cirrhosis (abstract), in Alcohol Alcohol, vol. 33, 1998, pp. 381-392, PMID 9719397.
- ^ (EN) J. Rehm, Alcohol as a risk factor for liver cirrhosis: a systematic review and meta-analysis (abstract), in Drug Alcohol Rev., vol. 29, 2010, pp. 437-445, PMID 20636661.
- ^ (EN) Piano MR, Alcohol's Effects on the Cardiovascular System, in Alcohol Res, vol. 38, n. 2, 2017, pp. 219-241, PMC 5513687, PMID 28988575.
- ^ (EN) European Association for the Study of the Liver, EASL Clinical Practice Guidelines: Management of alcohol-related liver disease, in J. Hepatology, vol. 69, luglio 2018, pp. 154-181, DOI:10.1016/j.jhep.2018.03.018.
- ^ (EN) V. Bagnardi, Alcohol consumption and site-specific cancer risk: a comprehensive dose–response meta-analysis, in British J. Cancer, vol. 112, 2015, pp. 580-593, PMID 25422909.
- ^ (EN) E.S. Orman, Alcoholic liver disease: Pathogenesis, management, and novel targets for therapy, in J. Gastroentero.l Hepatol., vol. 28, 2013, pp. 77-84, PMID 23855300.
- ^ (EN) E.J. Raff, Diabetes Mellitus Predicts Occurrence of Cirrhosis and Hepatocellular Cancer in Alcoholic Liver and Non-alcoholic Fatty Liver Diseases, in J. Clin. Transl. Hepatol., vol. 3, 2015, pp. 9-16, PMID 26356325.
- ^ Toshikuni N, Arisawa T, Tsutsumi M, Hepatitis C-related liver cirrhosis - strategies for the prevention of hepatic decompensation, hepatocarcinogenesis, and mortality, in World J. Gastroenterol., vol. 20, n. 11, marzo 2014, pp. 2876-87, DOI:10.3748/wjg.v20.i11.2876, PMC 3961980, PMID 24659879.
- ^ KASL clinical practice guidelines: management of chronic hepatitis B, in Clin Mol Hepatol, vol. 22, n. 1, marzo 2016, pp. 18-75, DOI:10.3350/cmh.2016.22.1.18, PMC 4825166, PMID 27044762.
- ^ (EN) M. Feldman, Hepatitis B, in Sleisenger and Fordtran's gastrointestinal and liver disease, vol. 2, 10ª ed., Philadelphia, Elsevier-Saunders, 2016, ISBN 978-1-4557-4692-7.
- ^ (EN) M.J. Alter, Epidemiology of hepatitis B in Europe and worldwide, in J. Hepatol., vol. 39, Suppl.1, 2003, pp. 64-69, DOI:10.1016/S0168-8278(03)00141-7, PMID 14708680.
- ^ (EN) D.K. Podolsky, Chronic hepatitis B viral infection, in Yamada's textbook of gastroenterology, vol. 2, 6ª ed., Chichester, Wiley-Blackwell, 2016, ISBN 978-1-118-51206-7.
- ^ (EN) J. Hou, Epidemiology and Prevention of Hepatitis B Virus Infection, in Int. J. Med. Sci., vol. 2, 2005, PMID 15968340.
- ^ (EN) R.A. Kaslow, cap. 32: Hepatitis viruses, in Viral infections in humans, 5ª ed., Springer, 2014, ISBN 978-1-4899-7447-1.
- ^ a b c d e f g h i j k (EN) E.R. Schiff, Schiff's Diseases of the liver, 12ª ed., Chichester, Wiley-Blackwell, 2018, ISBN 978-1-119-25122-4.
- ^ (EN) K. Shetty, Chronic viral hepatitis, Humana Press, 2009, p. 216, ISBN 978-1-934115-81-7.
- ^ (EN) J.H. MacLachlan, Hepatitis B Virus Epidemiology, in Cold Spring Harb. Perspect. Med., vol. 5, 2015, p. a021410, PMID 25934461.
- ^ a b (EN) M.J. Alter, Epidemiology of hepatitis C virus infection, in World J. Gastroenterol., vol. 13, 2007, pp. 2436-2441, PMID 17552026.
- ^ (EN) E.R. Schiff, Schiff’s Diseases of the Liver, 12ª ed., Wiley Blackwell, 2018, p. 643, ISBN 978-1-119-25122-4.
- ^ (EN) B. Hajarizadeh, Epidemiology and natural history of HCV infection (abstract), in Nature Rev. Gastroenterol. Hepatol., vol. 10, 2013, pp. 553-562, PMID 23817321.
- ^ a b c d e f g h (EN) ed. Dan L. Longo, Harrison's principles of internal medicine., 18th, New York, McGraw-Hill, 2012, pp. Chapter 308. Cirrhosis and Its Complications, ISBN 978-0-07-174889-6.
- ^ (EN) Kingsmore SF, Lindquist IE, Mudge J, Gessler DD, Beavis WD, Genome-wide association studies: progress and potential for drug discovery and development, in Nat Rev Drug Discov, vol. 7, n. 3, marzo 2008, pp. 221-30, DOI:10.1038/nrd2519, PMC 2853477, PMID 18274536.
- ^ (EN) ed. Dan L. Longo, Harrison's principles of internal medicine., 18th, New York, McGraw-Hill, 2011, p. Liver Transplantation, ISBN 978-0-07-174889-6.
- ^ a b (EN) Friedman LS, Current medical diagnosis and treatment 2014., [S.l.], Mcgraw-Hill, 2014, pp. Chapter 16. Liver, Biliary Tract, & Pancreas Disorders, ISBN 978-0-07-180633-6.
- ^ a b (EN) T.H. Karlsen, Primary sclerosing cholangitis, in J. Hepatol., vol. 67, dicembre 2017, pp. 1298-1323, DOI:10.1016/j.jhep.2017.07.022.
- ^ (EN) K. Boonstra, Epidemiology of primary sclerosing cholangitis and primary biliary cirrhosis, in J. Hepatol., vol. 56, maggio 2012, pp. 1181-1188, DOI:10.1016/j.jhep.2011.10.025.
- ^ (EN) T. Nakazawa, Inflammatory bowel disease of primary sclerosing cholangitis: a distinct entity?, in World J. Gastroenterol., vol. 20, 2014, pp. 3245-3254, PMID 24696608.
- ^ (EN) European Association for the Study of the Liver, EASL Clinical Practice Guidelines: Autoimmune hepatitis (PDF), in J. Hepatol., vol. 63, 2015, pp. 971-1004, PMID 26341719.
- ^ a b c (EN) A. Siddique, Review article: the iron overload syndromes, in Aliment. Pharmacol. Ther., vol. 35, 2012, pp. 876-893, PMID 22385471.
- ^ (EN) M. Franchini, Hereditary iron overload: Update on pathophysiology, diagnosis, and treatment, in Am. J. Hematol., vol. 81, 2006, pp. 202-209, PMID 16493621.
- ^ (EN) CQ Edwards e Kushner, JP, Screening for hemochromatosis., in The New England Journal of Medicine, vol. 328, n. 22, 3 giugno 1993, pp. 1616-20, DOI:10.1056/NEJM199306033282208, PMID 8110209.
- ^ (EN) Ala A, Walker AP, Ashkan K, Dooley JS, Schilsky ML, Wilson's disease, in Lancet, vol. 369, n. 9559, 2007, pp. 397-408, DOI:10.1016/S0140-6736(07)60196-2, PMID 17276780.
- ^ a b (EN) European Association, EASL Clinical Practice Guidelines: Wilson’s disease (PDF), in J. Hepatol., vol. 56, 2012, pp. 671-685, PMID 22340672. URL consultato il 25 novembre 2018 (archiviato dall'url originale il 23 novembre 2018).
- ^ (EN) T. Sveger, The natural history of liver disease in alpha 1-antitrypsin deficient children (abstract), in Acta Paediatr. Scand., vol. 77, 1988, pp. 847-851, PMID 2905108.
- ^ (EN) M.F. Dawwas, Prevalence and Risk Factors for Liver Involvement in Individuals with PiZZ-related Lung Disease, in Am. J. Respir. Crit. Care Med., vol. 187, 2013, PMID 23262512.
- ^ (EN) MS Tanner, Role of copper in Indian childhood cirrhosis., in The American Journal of Clinical Nutrition, vol. 67, 5 Suppl, maggio 1998, pp. 1074S-1081S, PMID 9587155.
- ^ (EN) Medline A, Medline NM, Galactosemia: early structural changes in the liver, in Can Med Assoc J, vol. 107, n. 9, novembre 1972, pp. 877-8, PMC 1940825, PMID 4653934.
- ^ (DE) Vogt M, Gitzelmann R, Allemann J, [Decompensated liver cirrhosis caused by galactosemia in a 52-year-old man], in Schweiz Med Wochenschr, vol. 110, n. 47, novembre 1980, pp. 1781-3, PMID 7455652.
- ^ ANDERSEN DH, Familial cirrhosis of the liver with storage of abnormal glycogen, in Lab. Invest., vol. 5, n. 1, 1956, pp. 11-20, PMID 13279125.
- ^ (EN) Björnsson ES, Hepatotoxicity by Drugs: The Most Common Implicated Agents, in Int J Mol Sci, vol. 17, n. 2, febbraio 2016, p. 224, DOI:10.3390/ijms17020224, PMC 4783956, PMID 26861310.
- ^ (EN) R. Bataller, Liver fibrosis, in J. Clin. Inv., vol. 115, 2005, pp. 209-218, PMID 15690074.
- ^ (EN) G.O. Elpek, Cellular and molecular mechanisms in the pathogenesis of liver fibrosis: An update, in World J Gastroenterol., vol. 20, 2014, pp. 7260-7276, PMID 24966597.
- ^ (EN) E. El-Ahwany, New insights in the roadmap of liver fibrosis pathogenesis (PDF), in Egyptian J. Hosp. Med., vol. 54, 2014, pp. 71-87, DOI:10.12816/0002433.
- ^ (EN) S.L. Friedman, Hepatic stellate cells: Protean, multifunctional, and enigmatic cells of the liver, in Physiol. Rev., vol. 88, 2008, pp. 125-172, PMID 18195085.
- ^ a b c (EN) David Brenner, Richard A. Rippe, Pathogenesis of Hepatic Fibrosis, in Tadataka Yamada (a cura di), Textbook of Gastroenterology, vol. 2, 4th, Lippincott Williams & Wilkins, 2003, ISBN 978-0-7817-2861-4.
- ^ Zhou WC, Zhang QB, Qiao L, Pathogenesis of liver cirrhosis, in World J. Gastroenterol., vol. 20, n. 23, giugno 2014, pp. 7312-24, DOI:10.3748/wjg.v20.i23.7312, PMC 4064077, PMID 24966602.
- ^ (EN) Giles W. Boland, Gastrointestinal Imaging: The Requisite, Elsevier Health Sciences, 2013, p. 232, ISBN 978-0-323-10199-8.
- ^ (EN) Y.K. Jung, Reversal of liver cirrhosis: current evidence and expectations, in Korean J. Intern. Med., vol. 32, 2017, pp. 213-228, PMID 28171717.
- ^ (EN) H. Ebrahimi, New concepts on reversibility and targeting of liver fibrosis; a review article, in Middle East J. Dig. Dis., vol. 10, 2018, pp. 133-148, PMID 30186577.
- ^ (EN) Z. Almpanis, Evaluation of liver fibrosis: “Something old, something new…”, in Ann. Gastroenterol., vol. 29, 2016, pp. 445-453, PMID 27708509.
- ^ (EN) M.Y. Kim, Histological subclassification of cirrhosis using the Laennec fibrosis scoring system correlates with clinical stage and grade of portal hypertension (abstract), in J. Hepatol., vol. 55, 2011, pp. 1004-1009, PMID 21354227.
- ^ (EN) C.L. Regina, Histopathological evaluation of liver fibrosis and cirrhosis regression, in Clin. Mol. Hepatol., vol. 23, 2017, pp. 302-307, PMID 29281870.
- ^ (EN) Giallourakis CC, Rosenberg PM, Friedman LS, The liver in heart failure, in Clin Liver Dis, vol. 6, n. 4, novembre 2002, pp. 947–67, viii–ix, DOI:10.1016/S1089-3261(02)00056-9, PMID 12516201.
- ^ (EN) Heathcote EJ, Primary biliary cirrhosis: historical perspective, in Clin Liver Dis, vol. 7, n. 4, novembre 2003, pp. 735-40, DOI:10.1016/S1089-3261(03)00098-9, PMID 14594128.
- ^ a b (EN) Karla Thornton, Evaluation and Prognosis of Patients with Cirrhosis, su hepatitisc.uw.edu. URL consultato il 2 novembre 2018.
- ^ a b (EN) Cirrhosis, su mayoclinic.org, Mayo Clinic. URL consultato il 25 settembre 2018.
- ^ a b (EN) Nolte W, Hartmann H, Ramadori G, Glucose metabolism and liver cirrhosis, in Exp. Clin. Endocrinol. Diabetes, vol. 103, n. 2, 1995, pp. 63-74, DOI:10.1055/s-0029-1211331, PMID 7553077.
- ^ (EN) Sauerbruch T, Schierwagen R, Trebicka J, Managing portal hypertension in patients with liver cirrhosis, in F1000Res, vol. 7, 2018, DOI:10.12688/f1000research.13943.1, PMC 5934688, PMID 29780579.
- ^ (EN) Moore KP, Aithal GP, Guidelines on the management of ascites in cirrhosis, in Gut, 55 Suppl 6, Suppl 6, ottobre 2006, pp. vi1–12, DOI:10.1136/gut.2006.099580, PMC 1860002, PMID 16966752.
- ^ (EN) Arroyo V, Navasa M, Rimola A, Spontaneous bacterial peritonitis in liver cirrhosis: treatment and prophylaxis, in Infection, 22 Suppl 3, 1994, pp. S167–75, PMID 7843826.
- ^ (EN) Odelowo OO, Smoot DT, Kim K, Upper gastrointestinal bleeding in patients with liver cirrhosis, in J Natl Med Assoc, vol. 94, n. 8, agosto 2002, pp. 712-5, PMC 2594284, PMID 12152928.
- ^ (EN) Sundaram V, Shaikh OS, Hepatic encephalopathy: pathophysiology and emerging therapies, in Med. Clin. North Am., vol. 93, n. 4, luglio 2009, pp. 819–36, vii, DOI:10.1016/j.mcna.2009.03.009, PMID 19577116.
- ^ (EN) Ginés P, Arroyo V, Quintero E, Comparison of paracentesis and diuretics in the treatment of cirrhotics with tense ascites. Results of a randomized study, in Gastroenterology, vol. 93, n. 2, 1987, pp. 234-41, PMID 3297907.
- ^ (EN) Singal AG, Pillai A, Tiro J, Early detection, curative treatment, and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis: a meta-analysis, in PLoS Med, vol. 11, n. 4, 2014, pp. e1001624, DOI:10.1371/journal.pmed.1001624, PMC 3972088, PMID 24691105.
- ^ (EN) von Köckritz L, De Gottardi A, Trebicka J, Praktiknjo M, Portal vein thrombosis in patients with cirrhosis, in Gastroenterol Rep (Oxf), vol. 5, n. 2, maggio 2017, pp. 148-156, DOI:10.1093/gastro/gox014, PMC 5421355, PMID 28533912.
- ^ (EN) Riordan SM, Williams R, The intestinal flora and bacterial infection in cirrhosis, in J. Hepatol., vol. 45, n. 5, novembre 2006, pp. 744-57, DOI:10.1016/j.jhep.2006.08.001, PMID 16979776.
- ^ Lynn P. Manuale di tecniche e procedure infermieristiche di Taylor; II Edizione; Piccin 2010 - Padova.
- ^ (EN) A Grant, Neuberger J, Guidelines on the use of liver biopsy in clinical practice, in Gut, vol. 45, Suppl 4, 1999, pp. 1-11, DOI:10.1136/gut.45.2008.iv1, PMC 1766696, PMID 10485854.
- ^ (EN) JA Udell, Wang, CS, Tinmouth, J, FitzGerald, JM, Ayas, NT, Simel, DL, Schulzer, M, Mak, E, Yoshida, EM, Does this patient with liver disease have cirrhosis?, in JAMA: the Journal of the American Medical Association, vol. 307, n. 8, 22 febbraio 2012, pp. 832-42, DOI:10.1001/jama.2012.186, PMID 22357834.
- ^ a b (EN) Hepatits C Online, Evaluation and Prognosis of Patients with Cirrhosis, su hepatitisc.uw.edu. URL consultato il 2 novembre 2018.
- ^ (EN) de Bruyn G, Graviss EA, A systematic review of the diagnostic accuracy of physical examination for the detection of cirrhosis, in BMC Med Inform Decis Mak, vol. 1, 2001, p. 6, PMC 64783, PMID 11806763.
- ^ (EN) Adinolfi LE, Nevola R, Rinaldi L, Romano C, Giordano M, Chronic Hepatitis C Virus Infection and Depression, in Clin Liver Dis, vol. 21, n. 3, agosto 2017, pp. 517-534, DOI:10.1016/j.cld.2017.03.007, PMID 28689590.
- ^ (EN) Manning DS, Afdhal NH, Diagnosis and quantitation of fibrosis, in Gastroenterology, vol. 134, n. 6, maggio 2008, pp. 1670-81, DOI:10.1053/j.gastro.2008.03.001, PMID 18471546.
- ^ a b (EN) JA Udell, Wang, CS, Tinmouth, J, FitzGerald, JM, Ayas, NT, Simel, DL, Schulzer, M, Mak, E e Yoshida, EM, Does this patient with liver disease have cirrhosis?, in JAMA: The Journal of the American Medical Association, vol. 307, n. 8, 22 febbraio 2012, pp. 832-42, DOI:10.1001/jama.2012.186, PMID 22357834.
- ^ a b c d (EN) Qamar AA, Grace ND, Abnormal hematological indices in cirrhosis, in Can. J. Gastroenterol., vol. 23, n. 6, giugno 2009, pp. 441-5, PMC 2721814, PMID 19543577.
- ^ a b (EN) edited by Eugene R. Schiff, Michael F. Sorrell & Willis C. Maddrey, Schiff's diseases of the liver., 11th ed. / edited by Eugene R. Schiff, Willis C. Maddrey, Michael F. Sorrell., Chichester, West Sussex, UK, John Wiley & Sons, 1999, pp. Evaluation of the Liver A: Laboratory Test, ISBN 978-0-470-65468-2.
- ^ (EN) Monika Gudowska, Ewa Gruszewska, Anatol Panasiuk, Bogdan Cylwik, Magdalena Świderska, Robert Flisiak, Maciej Szmitkowski e Lech Chrostek, Selected Noninvasive Markers in Diagnosing Liver Diseases, in Laboratory Medicine, vol. 47, n. 1, 2016, pp. 67-72, DOI:10.1093/labmed/lmv015, ISSN 0007-5027.
- ^ (EN) Jaiswal G, Deo V, Bhongade M, Jaiswal S, Serum alkaline phosphatase: a potential marker in the progression of periodontal disease in cirrhosis patients, in Quintessence Int, vol. 42, n. 4, aprile 2011, pp. 345-8, PMID 21516281.
- ^ a b (EN) Johnston DE, Special considerations in interpreting liver function tests, in Am Fam Physician, vol. 59, n. 8, aprile 1999, pp. 2223-30, PMID 10221307.
- ^ (EN) Warren SE, Mitas JA, Swerdlin AH, Hypernatremia in hepatic failure, in JAMA, vol. 243, n. 12, marzo 1980, pp. 1257-60, PMID 7359682.
- ^ (EN) Halfon P, Munteanu M, Poynard T, FibroTest-ActiTest as a non-invasive marker of liver fibrosis, in Gastroenterol Clin Biol, vol. 32, n. 6, settembre 2008, pp. 22-39, DOI:10.1016/S0399-8320(08)73991-5, PMID 18973844.
- ^ (EN) Himoto T, Nishioka M, Autoantibodies in liver disease: important clues for the diagnosis, disease activity and prognosis, in Auto Immun Highlights, vol. 4, n. 2, agosto 2013, pp. 39-53, DOI:10.1007/s13317-013-0046-7, PMC 4389052, PMID 26000142.
- ^ (EN) Chrostek L, Supronowicz L, Panasiuk A, Cylwik B, Gruszewska E, Flisiak R, The effect of the severity of liver cirrhosis on the level of lipids and lipoproteins, in Clin. Exp. Med., vol. 14, n. 4, novembre 2014, pp. 417-21, DOI:10.1007/s10238-013-0262-5, PMC 4213382, PMID 24122348.
- ^ (EN) Al-Jameil N, Hassan AA, Buhairan A, Hassanato R, Isac SR, Al-Otaiby M, Al-Maarik B, Al-Ajeyan I, Genotyping diagnosis of alpha-1 antitrypsin deficiency in Saudi adults with liver cirrhosis, in Medicine (Baltimore), vol. 96, n. 6, febbraio 2017, pp. e6071, DOI:10.1097/MD.0000000000006071, PMC 5313019, PMID 28178162.
- ^ a b (EN) Giunta M, Conte D, Fraquelli M, Role of spleen elastography in patients with chronic liver diseases, in World J. Gastroenterol., vol. 22, n. 35, settembre 2016, pp. 7857-67, DOI:10.3748/wjg.v22.i35.7857, PMC 5028802, PMID 27672283.
- ^ a b c d e f g (EN) Jiang H, Zheng T, Duan T, Chen J, Song B, Non-invasive in vivo Imaging Grading of Liver Fibrosis, in J Clin Transl Hepatol, vol. 6, n. 2, giugno 2018, pp. 198-207, DOI:10.14218/JCTH.2017.00038, PMC 6018309, PMID 29951365.
- ^ (EN) Hennedige T, Venkatesh SK, Imaging of hepatocellular carcinoma: diagnosis, staging and treatment monitoring, in Cancer Imaging, vol. 12, febbraio 2013, pp. 530-47, DOI:10.1102/1470-7330.2012.0044, PMC 3666429, PMID 23400006.
- ^ (EN) Martens P, Nevens F, Budd-Chiari syndrome, in United European Gastroenterol J, vol. 3, n. 6, dicembre 2015, pp. 489-500, DOI:10.1177/2050640615582293, PMC 4669515, PMID 26668741.
- ^ (EN) Iranpour P, Lall C, Houshyar R, Helmy M, Yang A, Choi JI, Ward G, Goodwin SC, Altered Doppler flow patterns in cirrhosis patients: an overview, in Ultrasonography, vol. 35, n. 1, gennaio 2016, pp. 3-12, DOI:10.14366/usg.15020, PMC 4701371, PMID 26169079.
- ^ (EN) Maruyama H, Yokosuka O, Ultrasonography for Noninvasive Assessment of Portal Hypertension, in Gut Liver, vol. 11, n. 4, luglio 2017, pp. 464-473, DOI:10.5009/gnl16078, PMC 5491080, PMID 28267700.
- ^ (EN) Vergniol J, Foucher J, Terrebonne E, Bernard PH, le Bail B, Merrouche W, Couzigou P, de Ledinghen V, Noninvasive tests for fibrosis and liver stiffness predict 5-year outcomes of patients with chronic hepatitis C, in Gastroenterology, vol. 140, n. 7, giugno 2011, pp. 1970–9, 1979.e1–3, DOI:10.1053/j.gastro.2011.02.058, PMID 21376047.
- ^ (EN) Foucher J, Chanteloup E, Vergniol J, et al., Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study, in Gut, vol. 55, n. 3, 2006, pp. 403-8, DOI:10.1136/gut.2005.069153, PMC 1856085, PMID 16020491.
- ^ (EN) Talakić E, Schaffellner S, Kniepeiss D, Mueller H, Stauber R, Quehenberger F, Schoellnast H, CT perfusion imaging of the liver and the spleen in patients with cirrhosis: Is there a correlation between perfusion and portal venous hypertension?, in Eur Radiol, vol. 27, n. 10, ottobre 2017, pp. 4173-4180, DOI:10.1007/s00330-017-4788-x, PMC 5579174, PMID 28321540.
- ^ (EN) Van Beers BE, Pastor CM, Hussain HK, Primovist, Eovist: what to expect?, in J. Hepatol., vol. 57, n. 2, agosto 2012, pp. 421-9, DOI:10.1016/j.jhep.2012.01.031, PMID 22504332.
- ^ (EN) Cho SH, Kang UR, Kim JD, Han YS, Choi DL, The value of gadoxetate disodium-enhanced MR imaging for predicting posthepatectomy liver failure after major hepatic resection: a preliminary study, in Eur J Radiol, vol. 80, n. 2, novembre 2011, pp. e195–200, DOI:10.1016/j.ejrad.2011.08.008, PMID 21908121.
- ^ (EN) Yamada A, Hara T, Li F, Fujinaga Y, Ueda K, Kadoya M, Doi K, Quantitative evaluation of liver function with use of gadoxetate disodium-enhanced MR imaging, in Radiology, vol. 260, n. 3, settembre 2011, pp. 727-33, DOI:10.1148/radiol.11100586, PMID 21712472.
- ^ (EN) Mathew RP, Venkatesh SK, Imaging of Hepatic Fibrosis, in Curr Gastroenterol Rep, vol. 20, n. 10, agosto 2018, p. 45, DOI:10.1007/s11894-018-0652-7, PMID 30159792.
- ^ (EN) Keller S, Sedlacik J, Schuler T, Buchert R, Avanesov M, Zenouzi R, Lohse AW, Kooijman H, Fiehler J, Schramm C, Yamamura J, Prospective comparison of diffusion-weighted MRI and dynamic Gd-EOB-DTPA-enhanced MRI for detection and staging of hepatic fibrosis in primary sclerosing cholangitis, in Eur Radiol, luglio 2018, DOI:10.1007/s00330-018-5614-9, PMID 30014204.
- ^ (EN) Faria SC, Ganesan K, Mwangi I, Shiehmorteza M, Viamonte B, Mazhar S, Peterson M, Kono Y, Santillan C, Casola G, Sirlin CB, MR imaging of liver fibrosis: current state of the art, in Radiographics, vol. 29, n. 6, ottobre 2009, pp. 1615-35, DOI:10.1148/rg.296095512, PMID 19959511.
- ^ (EN) Wallner BK, Schumacher KA, Weidenmaier W, Friedrich JM, Dilated biliary tract: evaluation with MR cholangiography with a T2-weighted contrast-enhanced fast sequence, in Radiology, vol. 181, n. 3, dicembre 1991, pp. 805-8, DOI:10.1148/radiology.181.3.1947101, PMID 1947101. URL consultato il 12 marzo 2018.
- ^ (EN) Venkatesh SK, Talwalkar JA, When and how to use magnetic resonance elastography for patients with liver disease in clinical practice, in Am. J. Gastroenterol., vol. 113, n. 7, luglio 2018, pp. 923-926, DOI:10.1038/s41395-018-0012-0, PMID 29487410.
- ^ (EN) Manduca A, Oliphant TE, Dresner MA, Mahowald JL, Kruse SA, Amromin E, Felmlee JP, Greenleaf JF, Ehman RL, Magnetic resonance elastography: non-invasive mapping of tissue elasticity, in Med Image Anal, vol. 5, n. 4, dicembre 2001, pp. 237-54, PMID 11731304.
- ^ (EN) Sheth SG, Amarapurkar DN, Chopra KB, Mehta PJ, Significance of radioisotope bone marrow uptake on 99m technetium sulphocolloid scan in portal hypertension, in J Assoc Physicians India, vol. 44, n. 5, maggio 1996, pp. 310-2, PMID 9282577.
- ^ (EN) Chakraborty D, Sunil HV, Mittal BR, Bhattacharya A, Singh B, Chawla Y, Role of Tc99m sulfur colloid scintigraphy in differentiating non-cirrhotic portal fibrosis from cirrhosis liver, in Indian J Nucl Med, vol. 25, n. 4, ottobre 2010, pp. 139-42, DOI:10.4103/0972-3919.78247, PMC 3109819, PMID 21713221.
- ^ (EN) Lockwood AH, Positron emission tomography in the study of hepatic encephalopathy, in Metab Brain Dis, vol. 17, n. 4, dicembre 2002, pp. 431-5, PMID 12602518.
- ^ (EN) Krystallis C, Masterton GS, Hayes PC, Plevris JN, Update of endoscopy in liver disease: more than just treating varices, in World J. Gastroenterol., vol. 18, n. 5, febbraio 2012, pp. 401-11, DOI:10.3748/wjg.v18.i5.401, PMC 3272639, PMID 22346246.
- ^ (EN) Simon K, Orłowska I, Pazgan-Simon M, The risk of complications of endoscopic procedures in patients with liver cirrhosis, in Clin Exp Hepatol, vol. 3, n. 3, settembre 2017, pp. 135-140, DOI:10.5114/ceh.2017.70284, PMC 5649487, PMID 29062903.
- ^ (EN) Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R, Transection of the oesophagus for bleeding oesophageal varices, in Br J Surg, vol. 60, n. 8, 1973, pp. 646-9, DOI:10.1002/bjs.1800600817, PMID 4541913.
- ^ (EN) M. Malinchoc, PS. Kamath; FD. Gordon; CJ. Peine; J. Rank; PC. ter Borg, A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts., in Hepatology, vol. 31, n. 4, aprile 2000, pp. 864-71, DOI:10.1053/he.2000.5852, PMID 10733541.
- ^ (EN) PS. Kamath, WR. Kim, The model for end-stage liver disease (MELD)., in Hepatology, vol. 45, n. 3, marzo 2007, pp. 797-805, DOI:10.1002/hep.21563, PMID 17326206.
- ^ (EN) MELD/PELD Calculator Documentation (PDF), su unos.org, 28 gennaio 2009, pp. 1-4. URL consultato il 23 ottobre 2018 (archiviato dall'url originale il 9 febbraio 2020).
- ^ (EN) Patch D, Armonis A, Sabin C, et al., Single portal pressure measurement predicts survival in cirrhotic patients with recent bleeding, in Gut, vol. 44, n. 2, 1999, pp. 264-9, DOI:10.1136/gut.44.2.264, PMC 1727391, PMID 9895388.
- ^ a b (EN) National Health Service, Overview - Cirrhosis, su nhs.uk. URL consultato il 2 novembre 2018.
- ^ (EN) J. Dooley, Sherlock's diseases of liver and biliary system, 13ª ed., Oxford, Wiley Blackwell, 2018, p. 120, ISBN 978-1-119-23754-9.
- ^ (EN) Chandok N, Watt KD, Pain management in the cirrhotic patient: the clinical challenge, in Mayo Clin. Proc., vol. 85, n. 5, maggio 2010, pp. 451-8, DOI:10.4065/mcp.2009.0534, PMC 2861975, PMID 20357277.
- ^ a b (EN) Hong YM, Yoon KT, Heo J, Woo HY, Lim W, An DS, Han JH, Cho M, The Prescription Pattern of Acetaminophen and Non-Steroidal Anti-Inflammatory Drugs in Patients with Liver Cirrhosis, in J. Korean Med. Sci., vol. 31, n. 10, ottobre 2016, pp. 1604-10, DOI:10.3346/jkms.2016.31.10.1604, PMC 4999403, PMID 27550489.
- ^ (EN) Toshikuni N, Arisawa T, Tsutsumi M, Nutrition and exercise in the management of liver cirrhosis, in World J. Gastroenterol., vol. 20, n. 23, giugno 2014, pp. 7286-97, DOI:10.3748/wjg.v20.i23.7286, PMC 4064074, PMID 24966599.
- ^ a b c (EN) Nusrat S, Khan MS, Fazili J, Madhoun MF, Cirrhosis and its complications: evidence based treatment, in World J. Gastroenterol., vol. 20, n. 18, maggio 2014, pp. 5442-60, DOI:10.3748/wjg.v20.i18.5442, PMC 4017060, PMID 24833875.
- ^ a b (EN) Perri GA, Khosravani H, Complications of end-stage liver disease, in Can Fam Physician, vol. 62, n. 1, gennaio 2016, pp. 44-50, PMC 4721840, PMID 26796834.
- ^ (EN) NC Chavez-Tapia, T Barrientos-Gutierrez, FI Tellez-Avila, K Soares-Weiser e M Uribe, Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding., in The Cochrane Database of Systematic Reviews, n. 9, 8 settembre 2010, pp. CD002907, DOI:10.1002/14651858.CD002907.pub2, PMID 20824832.
- ^ (EN) Moctezuma-Velazquez C, Kalainy S, Abraldes JG, Beta-blockers in patients with advanced liver disease: Has the dust settled?, in Liver Transpl., vol. 23, n. 8, agosto 2017, pp. 1058-1069, DOI:10.1002/lt.24794, PMID 28590564.
- ^ (EN) E-medicine liver transplant outlook and survival rates, su emedicinehealth.com, 9 giugno 2009. URL consultato il 6 settembre 2009 (archiviato il 14 luglio 2009).
- ^ (EN) Kamath PS, Kim WR, The model for end-stage liver disease (MELD), in Hepatology, vol. 45, n. 3, marzo 2007, pp. 797-805, DOI:10.1002/hep.21563, PMID 17326206.
- ^ (EN) Low JTS, Rohde G, Pittordou K, Candy B, Davis S, Marshall A, Stone P, Supportive and palliative care in people with cirrhosis: International systematic review of the perspective of patients, family members and health professionals, in J. Hepatol., settembre 2018, DOI:10.1016/j.jhep.2018.08.028, PMID 30243996.
- ^ (EN) Kimbell B, Murray SA, What is the patient experience in advanced liver disease? A scoping review of the literature, in BMJ Support Palliat Care, vol. 5, n. 5, dicembre 2015, pp. 471-80, DOI:10.1136/bmjspcare-2012-000435, PMID 24644180.
- ^ (EN) Baumann AJ, Wheeler DS, James M, Turner R, Siegel A, Navarro VJ, Benefit of Early Palliative Care Intervention in End-Stage Liver Disease Patients Awaiting Liver Transplantation, in J Pain Symptom Manage, vol. 50, n. 6, dicembre 2015, pp. 882–6.e2, DOI:10.1016/j.jpainsymman.2015.07.014, PMID 26303186.
- ^ (EN) W Sanchez e JA Talwalkar, Palliative care for patients with end-stage liver disease ineligible for liver transplantation., in Gastroenterology clinics of North America, vol. 35, n. 1, marzo 2006, pp. 201-19, DOI:10.1016/j.gtc.2005.12.007, PMID 16530121.
- ^ (EN) Z Poonja, A Brisebois, SV van Zanten, P Tandon, G Meeberg e CJ Karvellas, Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management., in Clinical Gastroenterology and Hepatology, vol. 12, n. 4, aprile 2014, pp. 692-8, DOI:10.1016/j.cgh.2013.08.027, PMID 23978345.
- ^ a b (EN) E Cholongitas, Papatheodoridis, GV, Vangeli, M, Terreni, N, Patch, D e Burroughs, AK, Systematic review: The model for end-stage liver disease--should it replace Child-Pugh's classification for assessing prognosis in cirrhosis?, in Alimentary Pharmacology & Therapeutics, vol. 22, n. 11-12, dicembre 2005, pp. 1079-89, DOI:10.1111/j.1365-2036.2005.02691.x/full, PMID 16305721.
- ^ (EN) RN. Pugh, IM. Murray-Lyon; JL. Dawson; MC. Pietroni; R. Williams, Transection of the oesophagus for bleeding oesophageal varices., in Br J Surg, vol. 60, n. 8, agosto 1973, pp. 646-9, PMID 4541913.
Bibliografia[modifica | modifica wikitesto]
- Robbins e Cotran, Le basi patologiche delle malattie (7ª edizione), Torino - Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7.
- (EN) David Brenner, Richard A. Rippe, Pathogenesis of Hepatic Fibrosis, in Tadataka Yamada (a cura di), Textbook of Gastroenterology, vol. 2, 4th, Lippincott Williams & Wilkins, 2003, ISBN 978-0-7817-2861-4.
- (EN) Friedman LS, Current medical diagnosis and treatment 2014., [S.l.], Mcgraw-Hill, 2014, Chapter 16. Liver, Biliary Tract, & Pancreas Disorders, ISBN 978-0-07-180633-6.
- (EN) ed. Dan L. Longo, Harrison's principles of internal medicine., 18th, New York, McGraw-Hill, 2012, Chapter 310. Liver Transplantation, ISBN 978-0-07-174889-6.
- (EN) ed. Dan L. Longo, Harrison's principles of internal medicine., 18th, New York, McGraw-Hill, 2012, Chapter 308. Cirrhosis and Its Complications, ISBN 978-0-07-174889-6.
- (EN) Giles W. Boland, Gastrointestinal Imaging: The Requisite, Elsevier Health Sciences, 2013, ISBN 978-0-323-10199-8.
- (EN) Steven T. Brower, Elective general surgery : an evidence-based approach, New York, McGraw-Hill Medical, 2012, ISBN 978-1-60795-109-4.
- (EN) OECD/EU (2016), Health at a Glance: Europe 2016, Health at a Glance: Europe 2016, Paris, 2016, ISBN 978-92-64-26559-2.
- (EN) J. Neuberger, Alcohol abuse and liver disease, Chichester, Wiley Blackwell, 2015, ISBN 978-1-118-88728-8.
- (EN) M. Feldman, Hepatitis B, in Sleisenger and Fordtran's gastrointestinal and liver disease, vol. 2, 10ª ed., Philadelphia, Elsevier-Saunders, 2016, ISBN 978-1-4557-4692-7.
- (EN) D.K. Podolsky, Chronic hepatitis B viral infection, in Yamada's textbook of gastroenterology, vol. 2, 6ª ed., Chichester, Wiley-Blackwell, 2016, ISBN 978-1-118-51206-7.
- (EN) R.A. Kaslow, cap. 32: Hepatitis viruses, in Viral infections in humans, 5ª ed., Springer, 2014, ISBN 978-1-4899-7447-1.
- (EN) E.R. Schiff, Schiff's Diseases of the liver, 12ª ed., Chichester, Wiley-Blackwell, 2018, ISBN 978-1-119-25122-4.
- (EN) K. Shetty, Chronic viral hepatitis, Humana Press, 2009, p. 216, ISBN 978-1-934115-81-7.
- (EN) Eugene R. Schiff, Schiff's diseases of the liver., 11th ed. / edited by Eugene R. Schiff, Willis C. Maddrey, Michael F. Sorrell., Chichester, West Sussex, UK, John Wiley & Sons, 1999, ISBN 978-0-470-65468-2.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni di o su cirrosi epatica
Wikiquote contiene citazioni di o su cirrosi epatica Wikizionario contiene il lemma di dizionario «cirrosi epatica»
Wikizionario contiene il lemma di dizionario «cirrosi epatica» Wikimedia Commons contiene immagini o altri file su cirrosi epatica
Wikimedia Commons contiene immagini o altri file su cirrosi epatica
Collegamenti esterni[modifica | modifica wikitesto]
- cirrosi, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) cirrhosis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Associazione Italiana per lo Studio del Fegato, AISF, su webaisf.org.
| Classificazione e risorse esterne (EN) | ICD-9-CM: 571.5; ICD-10-CM: K74.60; MeSH: D008103; DiseasesDB: 2729; |
| Controllo di autorità | Thesaurus BNCF 20788 · LCCN (EN) sh85077754 · GND (DE) 4034948-2 · BNE (ES) XX527815 (data) · BNF (FR) cb119712154 (data) · J9U (EN, HE) 987007533601205171 · NSK (HR) 000237193 · NDL (EN, JA) 00564898 |
|---|


 French
French Deutsch
Deutsch