Carbonio
| Carbonio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | carbonio, C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | non metalli | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 14 (IVA), 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 2267 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 0,5 (grafite) 10,0 (diamante) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica |  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 3P0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 12,0107 u[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 70 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 75 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio di van der Waals | 170 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [He]2s22p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 4, 3[3], 2, 1[4], 0, −1, −2, −3, −4[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido (non magnetico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 3773 K (3499,85 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 5 100 K (4 827 °C)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 5,29×10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 355,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | sublima | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 0 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 18350 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 2,55 (scala di Pauling)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 710 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 0,061×10−6 /m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 129 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 1 086,454 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 2 352,631 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 4 620,471 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 6 222,716 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quinta ionizzazione | 37 830,648 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di sesta ionizzazione | 47 277,174 kJ/mol[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il carbonio è l'elemento chimico della tavola periodica degli elementi che ha numero atomico 6 e simbolo C.[8] È il primo elemento del gruppo 14 del sistema periodico, facente parte del blocco p. È un elemento non metallico, tetravalente (e raramente bivalente),[9] insolubile nei comuni solventi,[10] inodore e insapore.[10] Le sue differenti forme (o più precisamente allotropi) includono uno dei più morbidi (grafite) e dei più duri (diamante) materiali conosciuti. Altre forme allotropiche del carbonio sono il carbonio amorfo e i fullereni.
Inoltre ha una grande affinità per i legami chimici con atomi di altri elementi a basso peso atomico (tra cui il carbonio stesso) e le sue piccole dimensioni lo rendono in grado di formare legami multipli. Queste proprietà permettono l'esistenza di circa 10 milioni di composti del carbonio.[11] I composti del carbonio formano le basi della vita sulla Terra. Il carbonio si trova in tutte le forme di vita organica[10] ed è la base della chimica organica.[9] Il ciclo del carbonio-azoto fornisce parte dell'energia prodotta dalle stelle.
Assieme agli altri principali elementi può formare composti importanti biologicamente e scientificamente: unito all'ossigeno forma il diossido di carbonio, che è assolutamente vitale per la crescita delle piante, mentre unito all'idrogeno forma vari composti chiamati "idrocarburi", che sono essenziali per l'industria per la produzione di combustibili fossili e per la sintesi di tantissimi altri prodotti, tra cui materie plastiche.
Sebbene l'isotopo più comune sia il carbonio-12 (il cui nucleo è formato da 6 protoni e 6 neutroni), l'isotopo carbonio-14 è di fondamentale importanza per le sue applicazioni pratiche, essendo comunemente usato per la datazione radiometrica di antichi reperti.[12]
Il termine "carbonio" è utilizzato spesso anche impropriamente per indicare l'anidride carbonica, soprattutto nell'ambito dell'ecologia, come nel caso delle espressioni "impronta di carbonio", "tassa sul carbonio" e "cattura e sequestro del carbonio".
Storia[modifica | modifica wikitesto]
Il carbonio (dal latino carbo che significa "carbone")[2] era già conosciuto dalle popolazioni antiche, che lo producevano bruciando materiale organico con poco ossigeno. In particolare il carbonio sotto forma di carbone veniva prodotto in epoca romana con la stessa chimica di oggi, riscaldando il legno in una piramide ricoperta di argilla per escludere l'aria.[13] Secondo Plinio il vecchio, il nerofumo (atramentum) veniva utilizzato nella produzione di inchiostri.[14][15] I diamanti erano invece conosciuti probabilmente già nel 2500 a.C. in Cina.[16]
Nel XVIII secolo Lavoisier lo riconobbe come sostanza semplice (cioè costituita da atomi dello stesso elemento chimico).[14] Successivamente venne determinato il suo peso atomico da Berzelius.[14] Nel 1779 Carl Wilhelm Scheele mostrò che la grafite, che si pensava fosse una forma di piombo (plumbago, in latino),[17][18] in realtà era identica al carbone, ma con una piccola aggiunta di ferro, e che dava "acido aereo" (cioè anidride carbonica) quando ossidata con acido nitrico.[19][20] Nel 1786 gli scienziati francesi Claude Louis Berthollet, Gaspard Monge e C. A. Vandermonde confermarono che la grafite era principalmente carbonio ossidandola in ossigeno più o meno allo stesso modo in cui Lavoisier aveva fatto con il diamante.[21] Nella loro pubblicazione proposero il nome "carbone" per l'elemento che si sprigionava sotto forma di gas bruciando la grafite.
Sebbene fosse conosciuto dall'antichità, il diamante fu identificato come una forma allotropica del carbonio solo nel 1796, grazie alle ricerche del chimico inglese Smithson Tennant, che provò che la combustione del diamante produceva semplicemente anidride carbonica (CO2).[2] La tetravalenza del carbonio fu appurata nel 1858 da Friedrich August Kekulé von Stradonitz.[22]
Nel 1961 il carbonio-12 venne introdotto come riferimento dalla International Union of Pure and Applied Chemistry (IUPAC) per la definizione dei pesi atomici.[23]
Il fullerene (allotropo del carbonio) venne scoperto come sottoprodotto di esperimenti con i raggi molecolari nel 1985. I suoi scopritori (Robert Curl, Harold Kroto e Richard Smalley) hanno ricevuto il Premio Nobel per la chimica nel 1996.[24] Negli anni a seguire varie altre forme di carbonio, sempre facenti parte della categoria dei fullereni, sono state scoperte. Il conseguente rinnovato interesse per nuove forme ha portato alla scoperta di ulteriori allotropi esotici, incluso il carbonio vetroso, e alla realizzazione che il "carbonio amorfo" in realtà non è propriamente amorfo.[25]
Isotopi[modifica | modifica wikitesto]
Il carbonio ha tre isotopi naturali e disponibili in natura. I due più abbondanti sono stabili: il 12C (98,93%) e il 13C (1,07%). Il terzo, 14C, conosciuto anche con il nome di "radiocarbonio", è un radioisotopo con tempo di dimezzamento di 5570 anni,[7] che viene utilizzato per la datazione del legno e di altri materiali di origine biologica nei siti archeologici.
Nel 1961 l'Unione internazionale di chimica pura e applicata (IUPAC) ha adottato l'isotopo carbonio-12 come base per la misura del peso atomico.
Isotopi vicini[modifica | modifica wikitesto]
Nella tabella seguente, le caselle colorate in arancione corrispondono ad isotopi stabili.
| 12O | 13O | 14O | 15O | 16O | 17O | 18O | 19O | |||
| 10N | 11N | 12N | 13N | 14N | 15N | 16N | 17N | 18N | ||
| 8C | 9C | 10C | 11C | 12C | 13C | 14C | 15C | 16C | 17C | |
| 6B | 7B | 8B | 9B | 10B | 11B | 12B | 13B | 14B | 15B | 16B |
| 5Be | 6Be | 7Be | 8Be | 9Be | 10Be | 11Be | 12Be | 13Be | 14Be | 15Be |
Allotropi[modifica | modifica wikitesto]


a) Diamante
b) Grafite
c) Lonsdaleite
d) Buckminsterfullerene
e) Fullerene C540
f) Fullerene C70
g) Carbonio amorfo
h) Nanotubo
Il carbonio ha molte forme allotropiche standard, più una forma allotropica esotica:
- diamante: ibridazione sp³, durissimo, 10 nella scala di Mohs, con modulo di comprimibilità 442 GPa;
- grafite: ibridazione sp², una delle sostanze più morbide, 0,5-2 nella scala di Mohs;
- grafene: materiale costituito da un unico strato grafitico di atomi di carbonio;
- grafino:[27] esagoni di C sp², come nel grafene, connessi tra loro in ogni vertice da una o più unità acetileniche −C≡C−, C sp;
- lonsdaleite o diamante esagonale: ibridazione sp³, con durezza 7-8 nella scala di Mohs;
- fullerite: fullereni e nanotubi di carbonio ibridazione sp², molecole di scala nanometrica, cave con superficie grafitica;
- nanoschiuma di carbonio: allotropo a bassissima densità, ferromagnetico;
- nanorod, aggregati di carbonio o ACNR o ADNR: la più dura e meno comprimibile sostanza nota (dal 2005), con 491 GPa di modulo;
- carbonio vitreo: ibridazione sp², usato per elettrodi e crogioli per alte temperature;
- forma a catena lineare di atomi di C uniti da legami tripli e singoli alternati, [−C≡C−]n,[28] ossia un poliino; viene detta "carbonio sp" o "carbyne" (in inglese); è una forma esotica metastabile ottenuta per ora solo in laboratorio con sofisticate tecniche fisiche di fasci molecolari supersonici in condizioni di vuoto ultra-spinto;
- carbonio amorfo (non esattamente un allotropo).
Il carbonio può inoltre presentare tipi di ibridazione differente all'interno della stessa forma allotropica; esempi di allotropi di questo tipo sono i film nanostrutturati cluster assembled e le schwarziti.
Carbonio amorfo[modifica | modifica wikitesto]
Nella sua forma amorfa, il carbonio presenta un certo ordine della sua struttura atomica a corto raggio, ma minore di quello presente nella grafite e nel diamante.[29] Può presentarsi sotto forma di polvere di carbone o fuliggine.
- Carbone amorfo
- Struttura del carbone amorfo
Grafite[modifica | modifica wikitesto]
Il termine "grafite" è stato introdotto nel 1789 da Abraham Gottlob Werner come Graphit, derivato dal greco γράφω (gràpho, "disegnare/scrittura", perché lascia un segno se strofinata su carta e quindi poi per il suo utilizzo nelle matite).[30] Si tratta della forma allotropica più comune del carbonio. Nella grafite ogni atomo è legato ad altri tre in un piano composto di anelli esagonali fusi assieme, come quelli degli idrocarburi aromatici. Le due forme conosciute di grafite, alfa (esagonale) e beta (romboidale), hanno identiche proprietà fisiche, ad eccezione della struttura cristallina. La grafite che si trova in natura contiene fino al 30% della forma beta, mentre la grafite prodotta sinteticamente contiene solo la forma alfa. La forma alfa può essere convertita in forma beta attraverso un trattamento meccanico e la forma beta si ritrasforma in forma alfa quando è riscaldata sopra i 1000 °C.
La grafite conduce elettricità, a causa della delocalizzazione degli elettroni π obbligati a muoversi sopra e sotto i piani dell'atomo di carbonio. Questi elettroni sono liberi di muoversi, quindi sono in grado di condurre elettricità. L'elettricità è condotta unicamente lungo il piano degli strati. Il diamante invece non conduce elettricità perché la banda degli HOMO è completamente riempita e la successiva banda vuota è distante in energia circa 5,5 eV,[31] maggiore rispetto a quella del silicio che, con struttura perfettamente analoga e con banda piena, ha un band gap di soli 1,12 eV.[32] Come il silicio, il diamante può divenire semiconduttore se drogato, ma questa operazione è più difficile da svolgere.
Nella grafite, ogni atomo di carbonio utilizza solo 3 dei suoi 4 elettroni del livello energetico esterno nel legarsi covalentemente ad altri tre atomi di carbonio. Ciascun atomo di carbonio contribuisce un elettrone ad un sistema delocalizzato di elettroni che è quindi una parte del legame chimico. Gli elettroni delocalizzati sono liberi di muoversi in tutto il piano. Per questo motivo la grafite conduce elettricità lungo i piani di atomi di carbonio, ma non conduce in direzione ortogonale rispetto al piano.
A differenza del diamante, la grafite è un conduttore elettrico e per tale motivo può essere utilizzata, ad esempio, come elettrodo di lampade ad arco elettrico. In condizioni standard è la forma più stabile del carbonio e pertanto è utilizzato in termochimica come stato standard per la definizione del calore di formazione di composti di carbonio. Grafite in polvere viene utilizzata come lubrificante a secco. Anche se si potrebbe pensare che questa proprietà industrialmente importante sia interamente dovuta alla sfaldatura degli strati della struttura, in realtà in un ambiente sotto vuoto (come nelle tecnologie per l'uso nello spazio), la grafite è risultata essere un pessimo lubrificante. Questo fatto ha portato alla scoperta che la grafite ha proprietà lubrificanti grazie all'assorbimento di aria e acqua tra uno strato e l'altro e dunque, nel vuoto, in mancanza di materiale da assorbire, non presenta questa proprietà. Quando un grande numero di difetti cristallografici legano insieme più piani della struttura, la grafite perde le sue proprietà di lubrificazione e diventa ciò che è noto come "carbonio pirolitico", un materiale utile in impianti a contatto con il sangue, come le protesi valvolari cardiache.
La grafite è l'allotropo più stabile di carbonio. Contrariamente a quanto si possa pensare, l'elevata purezza non permette alla grafite di bruciare, neppure a temperature elevate. Per questo motivo è ottima per i reattori nucleari e per i crogioli di fusione dei metalli. A temperature e pressioni elevate (circa 2000 °C e a pressione di 5 GPa), la grafite si trasforma in diamante. A pressioni molto alte il carbonio forma un allotropo chiamato "diamante", nel quale ogni atomo è legato ad altri quattro. I diamanti hanno la stessa struttura cubica del silicio e del germanio e, grazie alla forza del legame chimico carbonio-carbonio, è assieme al nitruro di boro la sostanza più dura in termini di resistenza allo sfregamento. La transizione alla grafite, a temperatura ambiente, è così lenta da risultare inosservabile. Sotto determinate circostanze, il carbonio cristallizza come lonsdaleite, una forma simile al diamante ma a struttura esagonale.[7]
Grafiti naturali e cristalline non sono spesso utilizzati in forma pura come materiali strutturali per le loro shear-aerei[non chiaro], fragilità e incoerenti proprietà meccaniche. Nelle forme sintetiche di consistenza vetrosa, la grafite pirolitica e le fibre di grafite sono estremamente forti, resistente al calore (fino a 3000 °C). La sfaldabilità della grafite è dovuta alle deboli forze di van der Waals che tengono uniti i piani.
Il peso specifico della grafite è di 2,3, il che la rende più leggero del diamante. È leggermente più reattiva di diamante, perché i reagenti sono in grado di penetrare tra gli strati esagonali di atomi di carbonio. Non è influenzata da solventi ordinari, acidi diluiti o alcali fusi. Tuttavia l'acido cromico ossida la grafite a biossido di carbonio (CO2).
- Grafite nativa ritrovata a Maduroga (in Sri Lanka) e conservata al Bristol City Museum and Art Gallery
- Struttura cristallina della grafite
Diamante[modifica | modifica wikitesto]
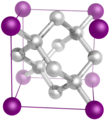
Il diamante è una delle tante forme allotropiche in cui può presentarsi il carbonio. È costituito da un reticolo cristallino di atomi di carbonio disposti secondo una struttura tetraedrica. I diamanti possono essere formati dalla grafite sottoponendola a condizioni di elevata pressione e temperatura.[7] La struttura del diamante è metastabile in condizioni standard[7] e si trasforma in grafite per riscaldamento a 2000 K.[7]
- Diamante grezzo da 18,7 carati ritrovato nella miniera di Kimberley, in Sudafrica
- Diamanti con taglio a brillante
- Reticolo cristallino del diamante (cubico a facce centrate)
Fullereni[modifica | modifica wikitesto]
I fullereni hanno una struttura simile alla grafite, ma, invece della configurazione esagonale, contengono anche formazioni pentagonali o eptagonali di atomi di carbonio, che piegano i fogli in sfere, ellissi o cilindri. Le proprietà dei fullereni non sono ancora state analizzate completamente. Il loro nome è stato dedicato a Buckminster Fuller, l'ideatore della cupola geodetica, la cui geometria ricorda quella dei fullereni.
Composti del carbonio[modifica | modifica wikitesto]
Il carbonio si combina facilmente con tutte le tipologie di elementi (metalli, non metalli e idrogeno).[9]
Il legame del carbonio di gran lunga prevalente con altri elementi è di tipo covalente. Rispetto agli altri elementi chimici, il carbonio ha invece una scarsa tendenza a formare legami ionici,[9] tranne quando si trova ad essere ibridato sp come atomo terminale, ad esempio nei cianuri (come KCN) e negli acetiluri (come CaC2).
L'atomo di carbonio nei composti con altri elementi o con sé stesso può presentarsi in uno dei tre noti tipi di ibridazione: sp³, sp² ed sp. Con essi il carbonio è in grado di legare a sé, rispettivamente, 4, 3 e 2 altri atomi con angoli di legame approssimativamente di 109,5°, 120° e 180°. A seconda poi della simmetria delle autofunzioni molecolari complessive delle coppie di atomi che partecipano al legame, si avranno legami singoli, doppi o tripli.
Lo ione C4- è probabilmente presente in alcuni carburi salini di metalli molto reattivi (ad esempio: Be2C, Mg2C, Al4C3); questi si idrolizzano in acqua svolgendo metano, mentre con il litio forma Li4C3, formalmente derivato dal propadiene.[33] I carburi dei metalli meno reattivi, segnatamente quelli di transizione, sono di tipo cristallino covalente, non sempre stechiometrici, a volte sono i cosiddetti carburi interstiziali.[33] Come ione monopositivo lo si trova solo in carbocationi (ad esempio: R3C+, carbonio sp²), che sono intermedi reattivi in chimica organica.
Composti inorganici[modifica | modifica wikitesto]

Il principale ossido del carbonio è il biossido di carbonio, CO2. Esso è un componente minore dell'atmosfera terrestre, prodotto e utilizzato dalle creature viventi. Nell'acqua forma tracce di acido carbonico (H2CO3), ma come molti composti con più atomi di ossigeno legati a un atomo di carbonio, è instabile. Alcuni importanti minerali sono carbonati, particolarmente la calcite e il disolfuro di carbonio, CS2.
Altri ossidi sono il monossido di carbonio (CO) e il meno comune subossido di carbonio (C3O2). Il monossido di carbonio si forma da una combustione incompleta ed è un gas inodore e incolore. Ogni molecola contiene un legame doppio e risulta abbastanza polarizzata, tende quindi a legarsi permanentemente alle molecole di emoglobina, rendendo questo gas velenoso. Il cianuro (CN−) ha una struttura e un comportamento simile a un alogenuro.
Con i metalli duri il carbonio forma carburi (C−) o acetilati (C2−2); questi sono associati al metano e all'acetilene o etino, entrambi acidi estremamente deboli. Con un'elettronegatività di 2,55, il carbonio tende a formare legami covalenti. Alcuni carburi sono solidi cristallini covalenti come il carburo di silicio (SiC), conosciuto anche con il nome di "carborundum". Il carburo di silicio ha una struttura simile a quella del diamante, in cui gli atomi di C e Si sono tetraedricamente circondati da quattro atomi di altro tipo. Sotto il nome di carborundum, è usato come attrezzo di taglio o come abrasivo.
Composti organici[modifica | modifica wikitesto]

Per definizione, sono detti "organici" i composti a base di carbonio in cui questo ha numero di ossidazione inferiore a +4. Una particolarità del carbonio è la capacità di formare catene di atomi di varia lunghezza, anche cicliche. Tali catene sono alla base degli idrocarburi e di tutti composti organici. Nel caso degli idrocarburi, al crescere del numero di atomi che compongono le catene si passa dagli oli volatili, agli oli pesanti, alle cere paraffiniche.
Abbondanza e disponibilità[modifica | modifica wikitesto]


Il carbonio è un componente vitale di tutti i sistemi viventi conosciuti e senza di esso la vita come la conosciamo non esisterebbe. Esistono quasi dieci milioni di composti di carbonio conosciuti[11] e molte migliaia di questi sono essenziali per i processi vitali e importanti per le reazioni a base organica.
Il carbonio è il tredicesimo elemento più abbondante sulla Terra.[7] Si trova in abbondanza anche nel Sole, nelle stelle, nelle comete e nell'atmosfera della maggior parte dei pianeti. Alcuni meteoriti contengono diamanti microscopici[2] (lonsdaleite[7]), che si formarono quando il sistema solare era ancora un disco protoplanetario. Il carbonio non è stato creato nel Big Bang a causa del fatto che occorre una tripla collisione di particelle alfa (nuclei di elio) per essere prodotto. L'universo inizialmente si espanse e si raffreddò troppo velocemente perché ciò accadesse. È comunque prodotto all'interno delle stelle che trasformano i nuclei di elio in carbonio tramite il processo triplo alfa.
In combinazione con altri elementi, il carbonio si trova nell'atmosfera terrestre e disciolto in tutti i bacini d'acqua. Assieme a piccole quantità di calcio, magnesio e ferro, è uno dei principali componenti di carbonati, rocce, calcari e marmi. Combinato con l'idrogeno forma una moltitudine di composti collettivamente chiamati "idrocarburi", che sono i componenti principali di petrolio, carbone e gas naturale.
La grafite si trova in grandi quantità negli Stati Uniti, Russia, Messico, Groenlandia e India. I diamanti naturali si trovano nei minerali di kimberlite che stanno all'interno di antichi camini vulcanici. La maggior parte dei giacimenti di diamanti si trovano in Africa, soprattutto in Sudafrica, Namibia, Botswana, Repubblica del Congo e Sierra Leone. Altri giacimenti si trovano in Canada, Artico russo e Australia (occidentale e settentrionale).
Ciclo del carbonio[modifica | modifica wikitesto]

Il ciclo del carbonio è il ciclo biogeochimico attraverso il quale il carbonio viene scambiato tra la geosfera (all'interno della quale si considerano i sedimenti e i combustibili fossili), l'idrosfera (mari e oceani), la biosfera (comprese le acque dolci) e l'atmosfera della Terra. Tutte queste porzioni della Terra sono considerabili a tutti gli effetti riserve di carbonio (carbon sinks). Il ciclo è infatti solitamente inteso come l'interscambio dinamico tra questi quattro distretti. La crosta terrestre contiene la maggior riserva di carbonio presente sulla Terra.
Le piante presenti nella biosfera utilizzano il carbonio atmosferico (sotto forma di anidride carbonica, CO2) attraverso la fotosintesi clorofilliana, che utilizza l'energia solare, rilasciando ossigeno (O2).[9] Le sostanze prodotte dalle piante vengono successivamente utilizzate da altri organismi viventi (tra cui gli animali e l'uomo), dai quali il carbonio viene restituito all'atmosfera sotto forma di CO2[9] oppure viene accumulato nei depositi geologici sotto forma di combustibili fossili (carbone e petrolio).[9]
Applicazioni[modifica | modifica wikitesto]
Il principale uso commerciale del carbonio è in forma di idrocarburi, principalmente combustibili fossili (gas metano e petrolio).[2] Il petrolio è utilizzato nelle raffinerie per produrre combustibili attraverso un processo di distillazione frazionata, dalla quale si ottengono, tra gli altri, benzina, gasolio e cherosene. Il petrolio è inoltre impiegato come materia prima nell'industria petrolchimica per la produzione di molte sostanze sintetiche, tra cui le materie plastiche, fibre, solventi e vernici.[2]
Altri usi del carbonio sono:
- L'isotopo 14C scoperto il 27 febbraio 1940 è usato nella datazione al radiocarbonio e come tracciante radioisotopico.
- La grafite è usata nelle matite da disegno, nelle spazzole di motori elettrici e come rivestimento refrattario nei forni.[2]
- I diamanti sono usati per scopi ornamentali e anche come punte perforanti e in altre applicazioni che sfruttano la loro durezza.[2]
- Il carbonio viene aggiunto in basse percentuali al ferro per produrre l'acciaio. Sempre legato al ferro, ma in percentuali superiori al 2%, si ottiene la ghisa che ha ottima colabilità e resistenza all'usura.
- In forma di carbone è usato per il riscaldamento e come materiale adsorbente (carbone attivo)[34][35][36][37] nell'industria chimica e come rimedio omeopatico.
- Diverse ricerche scientifiche hanno evidenziato la possibilità di utilizzare il carbonio come catalizzatore o supporto per catalizzatore[38][39] e come elettrocatalizzatore.[40][41]
- È utilizzato anche come materiale primario, o come fibra di rinforzo, unito al kevlar, nella produzione di articoli sportivi[2] (tra cui mazze da hockey su prato, racchette da tennis, sci, canne da pesca), negli aeroplani[2] e nei rivestimenti (interni o esterni) delle auto sportive o di quelle da corsa, sia per la sua resistenza che per la sua leggerezza.
- Il carbonio è utilizzato nelle barre di controllo delle centrali nucleari sotto forma di carburo di boro, e come moderatore per rallentare i neutroni veloci fino ad energie dell'ordine del centesimo di elettronvolt.
- La fibra di carbonio viene utilizzata per la fabbricazione di muscoli artificiali, attuati da corrente elettrica [42].
Le proprietà chimiche e strutturali dei fullereni, in forma di nanotubi di carbonio, hanno un promettente uso potenziale nel campo nascente delle nanotecnologie.
- Mina in grafite
- Lama al diamante
- Carbonio attivo usato come carminativo e lassativo
- Materiale plastico rinforzato con fibre di carbonio
- Utensili in carburo di tungsteno
Precauzioni[modifica | modifica wikitesto]

Il carbonio è poco tossico, se in granulometria circa millimetrica, ingeribile sotto forma di grafite o carbone (carbone attivo farmacologico). È resistente alla dissoluzione chimica, anche nel tratto digestivo acido, e utilizzato per adsorbire eventuali particolari composti tossici.
L'inalazione di polvere di carbone o di fuliggine (nerofumo) in grandi quantità può essere pericolosa, irritante per i tessuti polmonari e causare l'antracosi. Analogamente la polvere di diamante, usata come abrasivo. Microparticelle di carbonio sono presenti nei gas di scarico dei motori a scoppio e possono accumularsi nei polmoni. Gli effetti nocivi possono derivare dalla contaminazione delle particelle di carbonio, fortemente adsorbenti, con i prodotti chimici organici o metalli pesanti, piuttosto che dal carbonio stesso.
Si stanno studiando potenziali effetti dannosi, analoghi a quelli di altre fibre minerali (pneumoconiosi), derivanti dalle fibre di carbonio, eventualmente respirate o ingerite. Analoghi studi vengono fatti a proposito delle strutture nanometriche come fullereni e nanotubi di carbonio.
Il carbonio può anche bruciare vigorosamente in presenza di aria a temperature elevate, come nell'incendio della centrale nucleare di Windscale, a Sellafield (Windscale fire), che è stato causato da improvvisa liberazione di energia (effetto Wigner, dallo scopritore Eugene Wigner consistente in uno dislocamento atomico nel reticolo cristallino ad opera di neutroni veloci e a un successivo ritorno con liberazione dell'energia relativa accumulata) nella grafite usata come moderatore e quindi sottoposta a bombardamento neutronico.
Grandi accumuli di carbone, che sono rimasti inerti per centinaia di milioni di anni in assenza di ossigeno, possono spontaneamente bruciare quando esposti all'aria.
Composti[modifica | modifica wikitesto]
I composti del carbonio coprono una vasta gamma di azioni tossiche ed, essendo la base dei composti biologici, benefiche. Il monossido di carbonio, CO, presente nei gas di scarico dei motori a combustione, e il cianuro, CN−, che a volte inquina le miniere, sono estremamente tossici per i vertebrati. Molti altri composti non sono assolutamente tossici ma sono anzi essenziali per la vita. Gas organici come etilene (CH2=CH2), acetilene (HC≡CH), metano (CH4) e molte altre molecole sono infiammabili ed esplosivi se miscelati con l'aria in certe proporzioni.
Note[modifica | modifica wikitesto]
- ^ (EN) National Institute of Standards and Technology - carbon (archiviato dall'url originale il 19 ottobre 2017).
- ^ a b c d e f g h i j k l m n o p q r Royal Society of Chemistry - Carbon, su rsc.org. URL consultato il 25 novembre 2015 (archiviato il 6 settembre 2015).
- ^ Fourier Transform Spectroscopy of the System of CP (PDF), su bernath.uwaterloo.ca. URL consultato il 6 dicembre 2007 (archiviato dall'url originale il 16 febbraio 2008).
- ^ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical (PDF), su bernath.uwaterloo.ca. URL consultato il 6 dicembre 2007 (archiviato dall'url originale il 16 febbraio 2008).
- ^ Carbon: Binary compounds, su webelements.com. URL consultato il 6 dicembre 2007 (archiviato il 25 novembre 2007).
- ^ (EN) National Institute of Standards and Technology - carbon, Phase change data (archiviato dall'url originale il 9 dicembre 2020).
- ^ a b c d e f g h i j Vohler, cap. 1.
- ^ (EN) IUPAC Gold Book, "carbon", su goldbook.iupac.org. URL consultato il 6 luglio 2012 (archiviato il 9 settembre 2012).
- ^ a b c d e f g sapere.it - carbonio, su sapere.it. URL consultato il 24 novembre 2015 (archiviato il 25 novembre 2015).
- ^ a b c la Repubblica.it - carbonio, su dizionari.repubblica.it. URL consultato il 24 novembre 2015 (archiviato il 25 novembre 2015).
- ^ a b Chemistry Operations, Carbon, su periodic.lanl.gov, Los Alamos National Laboratory, 15 dicembre 2003. URL consultato il 21 novembre 2007.
- ^ Corriere della Sera - carbonio, su dizionari.corriere.it. URL consultato il 24 novembre 2015 (archiviato il 25 novembre 2015).
- ^ van der Krogt, Peter, Carbonium/Carbon at Elementymology & Elements Multidict, su elements.vanderkrogt.net. URL consultato il 6 gennaio 2010 (archiviato dall'url originale il 23 gennaio 2010).
- ^ a b c Carbonio, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ Plinio il Vecchio, Naturalis Historia: Libro 35, Paragrafi 01-71, pag 3, su Perungiorno.it, 9 ottobre 2017. URL consultato il 25 luglio 2023.
- ^ Chinese made first use of diamond, in BBC News, 17 maggio 2005. URL consultato il 21 marzo 2007 (archiviato dall'url originale il 20 marzo 2007).
- ^ piombàggine in Vocabolario - Treccani, su treccani.it. URL consultato il 23 luglio 2023.
- ^ (EN) Graphite | Properties, Uses, Structure | Britannica, su britannica.com, 11 luglio 2023. URL consultato il 23 luglio 2023.
- ^ Carbon, su canadaconnects.ca, Canada Connects. URL consultato il 7 dicembre 2010 (archiviato dall'url originale il 27 ottobre 2010).
- ^ Senese, Fred, Who discovered carbon?, su antoine.frostburg.edu, Frostburg State University, 9 settembre 2000. URL consultato il 24 novembre 2007 (archiviato dall'url originale il 7 dicembre 2007).
- ^ Giolitti, Federico, The Cementation of Iron and Steel, McGraw-Hill Book Company, inc, 1914.
- ^ La scoperta del Carbonio tetraedrico, su ilB2B.it. URL consultato il 28 marzo 2021 (archiviato dall'url originale il 5 settembre 2012).
- ^ (EN) Thermopedia, "Carbon" (archiviato dall'url originale il 16 febbraio 2018).
- ^ The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes", su nobelprize.org. URL consultato il 21 dicembre 2007 (archiviato dall'url originale l'11 ottobre 2007).
- ^ Harris, PJF, Fullerene-related structure of commercial glassy carbons (PDF), in Philosophical Magazine, vol. 84, n. 29, 2004, pp. 3159–3167, Bibcode:2004PMag...84.3159H, DOI:10.1080/14786430410001720363. URL consultato il 6 luglio 2011 (archiviato dall'url originale il 19 marzo 2012).
- ^ J.H. Eggert, Melting temperature of diamond at ultrahigh pressure, in Nature Physics, vol. 6, Nov 8, 2009, pp. 40–43, DOI:10.1038/nphys1438.
- ^ (EN) Andrey N. Enyashin e Alexander L. Ivanovskii, Graphene allotropes, in physica status solidi (b), vol. 248, n. 8, 2011, pp. 1879-1883, DOI:10.1002/pssb.201046583. URL consultato il 2 dicembre 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) Ray H. Baughman, Dangerously Seeking Linear Carbon, in Science, vol. 312, n. 5776, 19 mai 2006, pp. 1009-1110. URL consultato il 18 novembre 2012. DOI: 10.1126/science.1125999
- ^ (EN) IUPAC Gold Book, "amorphous carbon", su goldbook.iupac.org. URL consultato il 1º agosto 2015 (archiviato il 24 giugno 2015).
- ^ grafite: definizioni, etimologia e citazioni nel Vocabolario Treccani, su treccani.it. URL consultato il 23 luglio 2023.
- ^ (EN) Jerry L. Hudgins, Wide and narrow bandgap semiconductors for power electronics: A new valuation, in Journal of Electronic Materials, vol. 32, n. 6, 2003-06, pp. 471-477, DOI:10.1007/s11664-003-0128-9. URL consultato il 2 dicembre 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) Safa Kasap, Springer Handbook of Electronic and Photonic Materials, Springer Science & Business Media, 2006, ISBN 978-0-387-29185-7. URL consultato il 2 dicembre 2020 (archiviato il 3 febbraio 2021).
- ^ a b N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, pp. 297-299.
- ^ (EN) IUPAC Gold Book, "activated carbon", su goldbook.iupac.org. URL consultato il 1º agosto 2015 (archiviato il 4 marzo 2016).
- ^ (EN) P. González-García, Activated carbon from lignocellulosics precursors: A review of the synthesis methods, characterization techniques and applications, in Renewable and Sustainable Energy Reviews, vol. 82, 1º febbraio 2018, pp. 1393-1414, DOI:10.1016/j.rser.2017.04.117. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) Pavani Dulanja Dissanayake, Siming You e Avanthi Deshani Igalavithana, Biochar-based adsorbents for carbon dioxide capture: A critical review, in Renewable and Sustainable Energy Reviews, 26 novembre 2019, p. 109582, DOI:10.1016/j.rser.2019.109582. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) A. A. Abdulrasheed, A. A. Jalil e S. Triwahyono, Surface modification of activated carbon for adsorption of SO2 and NOX: A review of existing and emerging technologies, in Renewable and Sustainable Energy Reviews, vol. 94, 1º ottobre 2018, pp. 1067-1085, DOI:10.1016/j.rser.2018.07.011. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) Ádám Prekob, Viktória Hajdu e Gábor Muránszky, Application of carbonized ion exchange resin beads as catalyst support for gas phase hydrogenation processes, in Reaction Kinetics, Mechanisms and Catalysis, 2 novembre 2019, DOI:10.1007/s11144-019-01694-7. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) Emőke Sikora, Adrienn Kiss e Zsuzsa H. Göndör, Fine-tuning the catalytic activity by applying nitrogen-doped carbon nanotubes as catalyst supports for the hydrogenation of olefins, in Reaction Kinetics, Mechanisms and Catalysis, 14 dicembre 2019, DOI:10.1007/s11144-019-01705-7. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ Electrochemical synthesis of hydrogen peroxide from water and oxygen, in Nature Reviews Chemistry, vol. 3. URL consultato il 1º febbraio 2020 (archiviato il 13 giugno 2020).
- ^ (EN) Weijian Duan, Ge Li e Zhenchao Lei, Highly active and durable carbon electrocatalyst for nitrate reduction reaction, in Water Research, vol. 161, 15 settembre 2019, pp. 126-135, DOI:10.1016/j.watres.2019.05.104. URL consultato il 1º febbraio 2020 (archiviato il 3 febbraio 2021).
- ^ (EN) C Lamuta, S Messelot e S Tawfick, Theory of the tensile actuation of fiber reinforced coiled muscles, in Smart Materials and Structures, vol. 27, n. 5, 20 aprile 2018, pp. 055018, DOI:10.1088/1361-665x/aab52b. URL consultato il 5 luglio 2022.
Bibliografia[modifica | modifica wikitesto]
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
- Francesco Neve, Carbonio. Storia di un materiale del futuro, Roma, Aracne editrice, 2011, ISBN 978-88-548-3855-0. URL consultato il 3 febbraio 2021 (archiviato dall'url originale il 28 marzo 2021).
- (EN) Otto Vohler, Gabriele Nutsch, Gerd Collin, Ferdinand von Sturm, Carbon [collegamento interrotto], in Ullmann's Encyclopedia of Industrial Chemistry, 2002, DOI:10.1002/14356007.a05_095.
Voci correlate[modifica | modifica wikitesto]
- Carbonati
- Carbone attivo
- Carbonio vitreo
- Carborani
- Carburi
- Carbonia (composto)
- Carbino
- Cattura e sequestro del carbonio
- Chaoite
- Ciclo del carbonio
- Detonazione del carbonio
- Fase di fissazione del carbonio
- Fibra di carbonio
- Glucidi
- Metodo del carbonio-14
- Nanoschiuma di carbonio
- Nanotubo di carbonio
- Pianeta di carbonio
- Processo di fusione del carbonio
- Stella al carbonio
- Total organic carbon
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni sul carbonio
Wikiquote contiene citazioni sul carbonio Wikizionario contiene il lemma di dizionario «carbonio»
Wikizionario contiene il lemma di dizionario «carbonio» Wikimedia Commons contiene immagini o altri file sul carbonio
Wikimedia Commons contiene immagini o altri file sul carbonio
Collegamenti esterni[modifica | modifica wikitesto]
- carbonio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) carbon, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Wolfram Aplha LLC, Carbon-12 - WolframAlpha Computational Knowledge Engine, su wolframalpha.com. URL consultato il 2 luglio 2011.
| Controllo di autorità | Thesaurus BNCF 18855 · LCCN (EN) sh85020090 · GND (DE) 4164538-8 · BNE (ES) XX526055 (data) · BNF (FR) cb11976417k (data) · J9U (EN, HE) 987007283488605171 · NDL (EN, JA) 00572686 |
|---|


 French
French Deutsch
Deutsch