Parvovirus B19 — Wikipédia
Primate erythroparvovirus 1
| Realm | Monodnaviria |
|---|---|
| Règne | Shotokuvirae |
| Embranchement | Cossaviricota |
| Classe | Quintoviricetes |
| Ordre | Piccovirales |
| Famille | Parvoviridae |
| Sous-famille | Parvovirinae |
| Genre | Erythroparvovirus |
- Human parvovirus B19
- B19 virus
Primate erythroparvovirus 1, le parvovirus B-19 (PVB-19) ou Erythrovirus B19 est une espèce de virus de la famille des Parvoviridae et de la sous-famille des Parvovirinae en raison de sa structure et de sa capacité à infecter les cellules du sang. C’est un très petit virus, d’où son nom, du mot latin « parvum » qui signifie petit, à simple brin d’ADN avec une capside icosaédrique. Il est non enveloppé et n'est pathogène que pour les humains.
Histoire[modifier | modifier le code]
Le parvovirus fut d’abord trouvé aux environs de 1975 par la biologiste australienne Yvonne Cossart et son équipe[2],[3],[4], au cours d’un dépistage sanguin normal de l’antigène de surface de l’hépatite B. D’ailleurs son nom provient de la boite de Petri dans laquelle le virus fut trouvé : Boite numéro B-19. Plus tard, en 1983 le parvovirus B-19 fut reconnu comme responsable du mégalérythème épidémique.
Structure[modifier | modifier le code]
Le génome simple brin du parvovirus B19 contient 5596 nucléotides dont 4 830 servent de séquence codante interne et le reste sert de séquences répétées terminales. Celles-ci sont palindromiques et capables d'assumer une configuration en épingle à cheveux, servant d'amorces pour la synthèse du brin complémentaire. Comme dans la plupart des parvovirus animaux, le génome B19 a deux grands cadres ouverts de lecture, avec la protéine non structurale unique (NS1) codée par des gènes d’un côté du génome et les deux protéines de capside (VP1 et VP2)[5] par des gènes de l’autre côté. Le promoteur est le P6 et il est à l’une des extrémités du génome.
La capside du virus est composée de 60 sous-unités dont environ 95 % proviennent de VP2 (58 kDa). La particule virale fait alors un diamètre entre 22 et 24 nm et prend une forme icosaédrique.
Un virion mature possède un poids moléculaire de 5,6 x 106. Le gêne NS1 est très bien conservé considérant le fait qui est important à la propagation du virus alors que VP1 et VP2 possèdent des régions qui peuvent occasionnellement varier. Il n’y a néanmoins pas de corrélation entre les maladies et les variantes de B19.
L’absence d’enveloppe et la petite quantité d’ADN de son génome font du parvovirus B19, un virion très résistant. Il peut rester à 56 degrés Celsius pendant 60 minutes sans se dénaturer et il est insensible aux solvants de lipides (détergents)[6].
Il existe trois génotypes dont la répartition diffère de par le monde[7].
Cycle viral[modifier | modifier le code]
Comme tous les virus ADN non-enveloppés, le cycle du PvB19 va comme suit :
- la fixation du virus à l'hôte récepteur cellulaire
- l'intériorisation
- la translocation du génome dans le noyau hôte
- réplication de l'ADN
- transcription de l'ARN
- l'assemblage des capsides et de l'emballage du génome
- lyse des cellules avec la libération des virions matures
L’antigène P[modifier | modifier le code]
L’antigène P est suspecté d’être la porte d’accès au parvovirus B19[8] car il fut démontré en laboratoire que des cellules de tissus en culture avec soit un excès d'antigène P ou anti-P anticorps monoclonal peut protéger les progéniteurs érythroïdes de l'infection par le B19. De plus, les personnes qui ont génétiquement une absence d'antigène P (1 sur 200 000 personnes) sont naturellement résistantes à l'infection à B19. Cependant, bien que l’antigène P est exprimé sur les progéniteurs érythroïdes, il l’est aussi sur les mégacaryocytes, les cellules endothéliales et les myocytes fœtaux qui eux n’ont pas été montrés comme pouvant être permissifs pour la réplication B19. Il y a supposition alors d’un corécepteur.
Épidémiologie et mode de transmission[modifier | modifier le code]
Le parvovirus B19 est plutôt rare dans l’environnement. Strictement humain, il est transmissible principalement par les voies respiratoires et par contact direct comme des mains jusqu’à la bouche. Il peut se transmettre par perfusion sanguine et passage transplacentaire.
Cette infection est très contagieuse, et les primo-infections de l'enfant surviennent le plus souvent lors de son entrée en collectivité, notamment lors d'épidémie de mégalérythème en milieu scolaire, plutôt à la fin de l'hiver et au début du printemps en climat tempéré[9],[10],[11].
L'infection est courante et la moitié des personnes de plus de 15 ans ont été au contact du virus, avec une augmentation du taux d'immunoglobulines G (Ig G) spécifiques apportant une protection de longue durée[12] avec 85 % des personnes âgées présentant ces IgG spécifiques[10].
Maladie[modifier | modifier le code]
Le parvovirus B19 a deux caractéristiques : il infecte préférentiellement (tropisme) les globules rouges (hématies) et entraîne chez le patient une immunité qui le protègera indéfiniment.
Chez l'enfant[modifier | modifier le code]
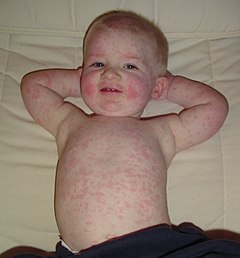
Le parvovirus B19 provoque le plus souvent une éruption cutanée infantile bénigne, le mégalérythème épidémique aussi appelé la cinquième maladie.
Chez l'adulte[modifier | modifier le code]
Il arrive très souvent que des gens infectés soient asymptomatiques ou sinon, les symptômes pourront se faire sentir comme ceux d’une légère grippe avec fièvre, douleurs musculaires et maux de tête. Après deux semaines peuvent survenir une éruption cutanée et des douleurs articulaires, typiquement bilatérales et symétriques. L'ADN viral est retrouvé de façon inconstante au niveau des articulations[13].
La maladie peut être compliquée d'une anémie aiguë, d'origine centrale (défaut de production d'hématie par la moelle osseuse) mais qui reste le plus souvent modérée[14].
Une présentation rare est celle d'un œdème généralisé[15], dont le mécanisme n'est pas univoque. En l'absence d'atteinte cardiaque ou rénale, il pourrait être secondaire à une hyperperméabilité au niveau des vaisseaux capillaires[16].
Chez la femme enceinte[modifier | modifier le code]
Selon le moment de la grossesse où la femme est infectée, les conséquences peuvent avoir différents impacts. Le risque d'atteinte du fœtus est d'environ 8 à 10 % et l'atteinte fœtale est plus fréquente avant la 20e semaine d'aménorrhée. Une infection lors du premier trimestre a de grandes chances d’entraîner un avortement. En théorie une femme contractant c'est-à-dire se faisant infecter par le parvovirus B19 entre la 10e et la 20e semaine aurait 0,5 % de risque d'avoir un fœtus atteint et 5 % de faire un avortement.
Au cours du deuxième et du troisième trimestre, ce type d'infection est susceptible d'entraîner ce que l'on appelle une anasarque c'est-à-dire la survenue d'œdème et ou une anémie aiguë chez le fœtus se caractérisant par une évolution péjorative pour le fœtus avec en particulier la survenue d'une infection virale du myocarde (muscle cardiaque).
Dans environ un quart des cas les complications concernant le fœtus (anasarque) disparaissent spontanément. Dans trois quarts des cas, si aucun traitement n'est mis en place, l'évolution est péjorative pour le fœtus.
Chez le drépanocytaire[modifier | modifier le code]
Chez les malades atteints de drépanocytose, le virus peut provoquer une érythroblastopénie aiguë.
Chez l'immunodéficient[modifier | modifier le code]
Les troubles sont plus graves chez les personnes immunodéprimées par absence de réponse immunitaire suffisante pour éliminer le virus. L'infection persiste en se traduisant par une érythroblastopénie chronique.
Autres rôles en discussion[modifier | modifier le code]
Le parvovirus B19 a été impliqué dans de nombreuses autres maladies ou syndromes, mais ce rôle est plutôt incertain (coïncidence, co-infection, lien causal non confirmé…)[4],[9].
En sus des maladies déjà décrites (lien étiologique avéré), le parvovirus B19 a été signalé lors d'autres hémopathies, d'encéphalites et autres neuropathies, de maladies cardio-vasculaires, d'hépatites… comme dans le syndrome de fatigue chronique et diverses maladies auto-immunes (lupus érythémateux disséminé, vascularites, néphropathies…) en particulier la polyarthrite rhumatoïde dont le lien causal a été suggéré dans les années 1980-1990, mais qui n'a pas été confirmé[9],[10].
Diagnostic[modifier | modifier le code]
C’est par un prélèvement de sang que l’on peut mettre en évidence une anémie et la présence du parvovirus B19 dans le sang. L’analyse du sang cherchera à trouver la présence d'anticorps c'est-à-dire des IgG et des IgM spécifiques qui apparaissent environ deux semaines après la contamination et persistent 3 ou 4 mois. Les IgG, quant à eux, apparaissent environ sept jours après les IgM et sont présents durant une longue période. On considère que la présence d'IgG constitue une protection contre la maladie. Il est également possible de mettre en évidence les parvovirus B19 grâce à une technique portant le nom de technique EID. Celle-ci est particulièrement sensible entre le 7e et le 12e jour après le contact avec le virus responsable de l'infection.
Lorsque le résultat s'avère négatif cela veut dire que la femme n'est pas immunisée. Lorsque le résultat est positif cela veut donc dire que la femme est immunisée.
Traitement[modifier | modifier le code]
Il n’existe aucun traitement préventif (absence de vaccination) ni curatif spécifique pour guérir du parvovirus B19, il faut que la guérison s’effectue par leur propre système immunitaire. Un traitement antalgique est utile en cas, notamment, d'atteinte articulaire.
Les personnes immunodéficientes peuvent nécessiter des injections intraveineuses d’immunoglobulines.
Chez la femme enceinte[modifier | modifier le code]
Quand on constate une contamination durant la grossesse et si un diagnostic de confirmation a été établi avec certitude, la patiente doit être hospitalisée dans un centre spécialisé en obstétrique et en infectiologie pour être surveillée grâce à des échographies hebdomadaires[17], de façon à mettre en évidence l'éventuelle survenue d'œdème chez le fœtus. Le traitement consiste à faire des transfusions au fœtus de manière répétitive à raison de 10 à 100 ml dans la veine ombilicale en utilisant du sang de donneur. L'évolution est le plus souvent satisfaisante et la guérison est obtenue dans la majorité des cas.
Notes et références[modifier | modifier le code]
- ICTV. International Committee on Taxonomy of Viruses. Taxonomy history. Published on the Internet https://talk.ictvonline.org/., consulté le 14 février 2021
- Cossart YE, Field AM, Cant B, Widdows D, Parvovirus-like particles in human sera, Lancet, 1975;1:72-73
- « Cossart, Yvonne - Faculty of Medicine Online Museum and Archive », sur www.sydney.edu.au (consulté le )
- David Germanaud, « Le parvovirus B19 : ou de l'importance du terrain dans l'expression cilnique d'une infection fréquente », La Revue du Praticien, vol. 57, , p. 1049-1055.
- Kaufmann B, Simpson AA, Rossmann MG, The structure of human parvovirus B19, Proc Natl Acad Sci U S A, 2004;101:11628–11633
- Brown KE, Variants of B19, Dev Biol (Basel), 2004;118:71-7
- Servant-Delmas A, Lefrère JJ, Morinet F, Pillet S, Advances in human B19 erythrovirus biology, J Virol, 2010;19:9658-9665
- Heegaard ED, Brown KE, Human Parvovirus B19, Clin Microbiol Rev, 2002;15:485-505
- Jianming Qiu, Maria Söderlund-Venermo et Neal S. Young, « Human Parvoviruses », Clinical Microbiology Reviews, vol. 30, no 1, , p. 43–113 (ISSN 1098-6618, PMID 27806994, PMCID 5217800, DOI 10.1128/CMR.00040-16, lire en ligne, consulté le )
- Erik D. Heegaard et Kevin E. Brown, « Human parvovirus B19 », Clinical Microbiology Reviews, vol. 15, no 3, , p. 485–505 (ISSN 0893-8512, PMID 12097253, DOI 10.1128/CMR.15.3.485-505.2002, lire en ligne, consulté le )
- SPF, « Une épidémie de mégalérythème épidémique à Tours », sur www.santepubliquefrance.fr (consulté le )
- Young NS, Brown KE, Parvovirus B19: mechanisms of disease, N Engl J Med, 2004;350:586-597
- Moore TL, Parvovirus-associated arthritis, Curr Opin Rheumatol, 2000;12:289-294
- Anderson MJ, Higgins PG, Davis LR et al. Experimental parvoviral infection in humans, J Infect Dis, 1985;152:257-265
- Nakazawa T, Machi T, Kitagawa S, Miyamori H, Saitoh Y, Parvovirus infection and generalized edema in adults, Intern Med, 1995;34:163-165
- Wiggli B, Imhof E, Meier CA, Laifer G, Water, water, everywhere, Lancet, 2013;381:776
- Crane J et al. Infection au parvovirus B19 en cours de grossesse, septembre 2002
Référence biologique[modifier | modifier le code]
- (en) Référence ICTV : Primate erythroparvovirus 1 (consulté le )


 French
French Deutsch
Deutsch