Cyanate — Wikipédia
| ion cyanate | ||
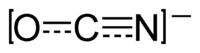 | ||
 | ||
| Structure de l'ion cyanate | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| Propriétés chimiques | ||
| Formule | [OCN]− | |
| Masse molaire[1] | 42,016 8 ± 0,001 3 g/mol C 28,59 %, N 33,34 %, O 38,08 %, | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 11,76 ± 0,01 eV (gaz)[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
L'ion cyanate est un anion composé dans l'ordre d'un atome d'oxygène, d'un atome de carbone et d'un atome d'azote, [OCN]− . Il possède une unité de charge négative, portée principalement par l'atome d'azote. En chimie organique, le groupe cyanate est un groupe fonctionnel.
La structure du cyanate peut être considérée comme une structure de résonance entre deux formes canoniques :
La structure hybride résultante peut être représentée comme suit :
L'ion cyanate est isoélectrique avec le dioxyde de carbone et présente ainsi la même forme linéaire.
Les cyanates sont des sels ou des esters de l'acide cyanique, comme le cyanate de potassium (KOCN) ou le cyanate de méthyle, CH3OCN. Les isocyanates, comme l'isocyanate de méthyle, sont des isomères des cyanates. Ils se lient à leur radical par l'atome d'azote tandis que les cyanates se lient par l'atome d'oxygène.
L'ion cyanate est relativement moins toxique que les cyanures.
L'ion fulminate, ONC− comme dans le fulminate de mercure, possède la même formule chimique, mais sa structure est différente : c'est un isomère de structure du cyanate. Ce sont Justus von Liebig et Friedrich Wöhler qui le constatèrent à Francfort sur des sels d'argent[3].
Voir aussi[modifier | modifier le code]
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Liebig avait préparé du fulminate d'argent et Wöhler du cyanate d'argent. C'est Jöns Jacob Berzelius qui introduisit la notion d'isomérie.


 French
French Deutsch
Deutsch