Cinnamate d'éthyle — Wikipédia
| Cinnamate d'éthyle | ||
 | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 3-phénylprop-2-énoate d'éthyle | |
| No CAS | ||
| No ECHA | 100.002.822 | |
| No CE | 203-104-6 | |
| No RTECS | GD9010000 | |
| PubChem | 637758 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore | |
| Propriétés chimiques | ||
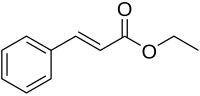
| Formule | C11H12O2 [Isomères] | |
| Masse molaire[1] | 176,211 8 ± 0,010 2 g/mol C 74,98 %, H 6,86 %, O 18,16 %, | |
| Propriétés physiques | ||
| T° fusion | 6 °C[2] | |
| T° ébullition | 271 °C (1,013 bar)[2] | |
| Solubilité | pratiquement insoluble dans l'eau[2] | |
| Masse volumique | 1,05 g·cm-3 (20 °C[2] | |
| Point d’éclair | > 110 °C (coupelle fermée)[2] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,558[3] | |
| Précautions | ||
| Directive 67/548/EEC[2] | ||
| Transport[2] | ||
non-soumis à régulation | ||
| Écotoxicologie | ||
| DL50 | 4 g·kg-1 (souris, oral)[4] | |
| LogP | 2,99[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
Le cinnamate d'éthyle est l'ester de l'acide cinnamique et de l'éthanol. Il est naturellement présent dans l'huile essentielle de cannelle et dans la Kaempferia galanga[5],[6]
Principalement existant dans la nature sous forme trans ((E) cinammate d'éthyle), il se présente sous la forme d'un liquide incolore et sa forme pure a « une odeur fruitée et balsamique, rappelant la cannelle avec une note d'ambre »[7].
Synthèse[modifier | modifier le code]
La façon la plus simple de produire le cinnamate d'éthyle est évidemment l'estérification de l'acide cinnamique par l'éthanol.
Il est également possible de le produire par réaction entre l'acide cinnamique, le chlorure de thionyle (créant alors un intermédiaire chlorure de cinnamoyle) et d'éthanol[8].
Enfin, il est également possible de le produire par condensation de Claisen entre le benzaldéhyde et l'acétate d'éthyle.
Dérivés[modifier | modifier le code]
Le dérivé p-methoxylé du cinnamate d'éthyle a été rapporté comme étant un inhibiteur de la monoamine oxydase[9].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Ethyl cinnamate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 juin 2011 (JavaScript nécessaire)
- Fiche Sigma Aldrich, consultée le 6 juin 2011
- Voprosy Pitaniya. Problems of Nutrition. Vol. 33(5), Pg. 48, 1974
- (en) K. C. et al. Wong, K. S. Ong et C. L. Lim, « Compositon of the essential oil of rhizomes of kaempferia galanga L. », Flavour and Fragrance Journal, vol. 7, no 5, , p. 263–266 (DOI 10.1002/ffj.2730070506)
- (en) R. et al. Othman, H Ibrahim, MA Mohd, MR Mustafa et K Awang, « Bioassay-guided isolation of a vasorelaxant active compound from Kaempferia galanga L. », Phytomedicine, vol. 13, nos 1 - 2, , p. 61–66 (PMID 16360934, DOI 10.1016/j.phymed.2004.07.004)
- (en) Budavari, Susan, « Merck Index 13th Ed. », Merck & co., Inc,
- Autorengemeinschaft: Organikum, 15e édition, VEB Deutscher Verlag der Wissenschaften, Berlin 1976, S. 527.
- (en) Noro T, Miyase T, Kuroyanagi M, Ueno A, Fukushima S., « Monoamine oxidase inhibitor from the rhizomes of Kaempferia galanga L. », Chem Pharm Bull (Tokyo)., vol. 31, no 8, , p. 2708–11 (PMID 6652816)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Ethyl » (voir la liste des auteurs) et en allemand « Zimtsäureethylester » (voir la liste des auteurs).


 French
French Deutsch
Deutsch