Évolution des stratégies de locomotion — Wikipédia
L'évolution des stratégies de locomotion est le processus d’apparition de l'ensemble des moyens et techniques développées par les êtres vivants pour se mouvoir, ou plus largement, pour se déplacer d'une manière active ou non d'un lieu à un autre.
Ces stratégies sont apparues par mutations et ont été sélectionnées via la sélection naturelle, en répondant à des pressions de sélections. Au fil de la diversification des êtres vivants et de la colonisation de nouveaux milieux, les organismes ont développé de nouveaux moyens et de nouvelles techniques de locomotion pour s'adapter à leurs nouveaux environnements. Néanmoins la présence de certaines contraintes dans les milieux permet d'observer des phénomènes de convergence évolutive en faveur de certaines stratégies.
Concepts d’évolution et de sélection naturelle[modifier | modifier le code]
La sélection naturelle est un concept développé par Charles Darwin (1809-1882) selon lequel les espèces évoluent au cours du temps pour optimiser leur accès aux ressources naturelles de leur milieu ou pour avoir accès à d’autres milieux et ainsi à d’autres ressources, dans le but d'augmenter leur fitness. Au cours de l’évolution et au fil de la sélection naturelle, de nouvelles techniques de locomotion ont vu le jour et se sont répandues.
Les débuts de la locomotion, le milieu liquide[modifier | modifier le code]
Aussi loin que nous sommes en mesure de remonter (LUCA) la vie s’est dans un premier temps développée dans l’eau, il est donc légitime de penser que les premières stratégies de locomotion y ont également vu le jour.
La locomotion passive[modifier | modifier le code]
Dans la mesure où la vie était présente sous forme d’espèces unicellulaires vivant dans l’eau, les premiers mouvements étaient principalement dus au mouvement brownien. En effet ces premières cellules ne devaient pas être en mesure d’engendrer un mouvement volontaire, ce ne sont donc que les mouvements du substrat lui-même qui ont permis aux cellules de se déplacer.
Les premiers mouvements volontaires[modifier | modifier le code]
C’est dans ce contexte que sont apparus les premiers organes permettant aux premières cellules de se déplacer dans leur milieu et ainsi de maximiser leurs chances de trouver leurs ressources.
Les cils[modifier | modifier le code]
L'utilisation de cils vibratiles est probablement la stratégie de locomotion la plus ancienne que connaissent les êtres vivants. On ne les retrouve aujourd'hui que chez des protozoaires (Ciliés, Paramécies), en oscillant ils permettent à la cellule de nager dans son milieu. Chez les organismes pluricellulaires les cils de certaines cellules sont sensitifs ou servent à faire circuler le milieu extérieur à la surface des cellules et des épithelia, ils n’entrent pas dans les processus de locomotion[1].
Chez les eucaryotes les cils sont des structures mesurant jusqu’à 10µm de long et moins de 0,5µm de large. Ils sont constitués de doublets de microtubules (neuf doublets) agencés autour d’une paire de microtubules, le tout formant un axonème. Les cils sont capables de faire deux mouvements, le battement de poussée et le battement de récupération, c’est l’association de ces deux mouvements qui permet à la cellule de bouger. Ces mouvements sont dus à l’action de moteurs moléculaires tels que les dynéines[1].
Les flagelles[modifier | modifier le code]
Un flagelle est une excroissance de la membrane plasmique dans laquelle on retrouve une architecture, semblable à celle des cils, de protéines, microtubules ou flagellines, et qui procure de la mobilité à la cellule. Ils sont toutefois généralement moins nombreux et plus longs que les cils vibratiles (bien que pour certains ces deux éléments sont suffisamment semblables pour ne pas être différenciés)[2],[1].
Il en existe de différents types, en effet les flagelles procaryotes eucaryotes ou celui des archées ne sont pas complètement identiques, le nombre de flagelles sur la cellule peut également varier. Le flagelle en lui-même est composé d’un rotor ainsi que d’un stator. C’est la rotation du rotor sur le stator grâce à une force proton-motrice qui fait osciller le flagelle, et c’est cette oscillation du flagelle qui propulse la cellule.
Les nageoires[modifier | modifier le code]

Dans le milieu liquide, si les premiers êtres vivants pluricellulaires devaient se mouvoir à la manière d’un flagelle géant comme des anguilles, les nageoires ont très rapidement fait leur apparition et se sont répandues dans le monde aquatique.

Une nageoire est un membre ou un appendice porté par certains animaux pour se mouvoir efficacement dans le milieu liquide. Il en existe aujourd’hui de très grandes variantes, en fonction de leur position sur le corps de l’animal, et leur organisation anatomique (présence de squelette, os, épines, rayons).
Le terme de nageoire est devenu tellement vaste qu’il regroupe aussi bien les membres des pinnipèdes que les ailettes des céphalopodes en passant par les palettes natatoires des tortues, mais également les ailes de certains oiseaux (manchot).
Colonisation de nouveaux milieux, passage de l'eau à la terre[modifier | modifier le code]
L'origine des tétrapodes est couplée à l'apparition de la locomotion terrestre et l'évolution des membres[3]. C'est le passage des organismes de l'eau à la terre, un développement clé dans l'évolution des vertébrés[3]. On estime que la conquête de la terre ferme se serait faite grâce à l'évolution de poissons du dévonien, qui s'apparenteraient à des dipneustes.
Les premiers tétrapodes étaient exclusivement aquatiques et dateraient du dévonien ( -385 et -360 millions d’années)[3]. Ils possédaient des nageoires et des poumons pour respirer hors de l'eau. Des poissons du Dévonien, de la famille des Panderichthys pourraient ainsi représenter les parents les plus proches d'un tétrapode ancestral.
Les raisons du passage des organismes de l'eau à la terre sont encore incertaines. Des hypothèses font penser que certaines espèces ont commencé à développer des membres leur permettant la locomotion terrestre pour échapper à des prédateurs présents dans l'eau ou tout simplement pour accéder à des ressources alimentaires présentes sur terre[3].
Adaptations à la sortie des eaux[modifier | modifier le code]
Passer de l'eau à la terre ferme a exigé l'apparition de nouveaux comportements et de structures appendiculaires de soutien. Des poumons sont apparus et les membres ont évolué chez certains poissons du dévonien[3].
La plasticité phénotypique est la capacité d'adaptation de la morphologie, du comportement, de la physiologie et de la biochimie d'un organisme en fonction de l'environnement dans lequel il se trouve. Si ces adaptations sont bénéfiques pour la survie et la fitness d'un organisme dans ces nouveaux environnements, les traits peuvent devenir héritables par assimilation génétique et ainsi, fixer une gamme réduite de plasticité phénotypique en diminuant la sensibilité environnementale d'un trait[3].
Cette plasticité joue donc un rôle important dans l’apparition de traits complexes. Celle des poissons sarcoptérygien dévoniens en réponse aux environnements terrestres a pu faciliter l'évolution des traits terrestres chez les tétrapodes[3].
Au fil des années, se sont développées, dans les nageoires, des structures osseuses articulées soutenues par des muscles eux-mêmes plus développés pour supporter le poids du corps des premiers tétrapodes terrestres. Les nouvelles articulations ont permis l'extension et la flexion de ces nouveaux membres.
Évolution du squelette[modifier | modifier le code]
Lors de leur sortie des eaux les premiers tétrapodes rampaient sur le sol, des adaptations se sont produites pour relever le corps de ces animaux et ainsi réduire les frottements entre le corps et le sol.
Pour commencer, chez les ancêtres des tétrapodes, les nageoires pectorales se sont rapprochées de la ligne médiane de l'organisme ce qui a permis la levée de la partie antérieure du corps[3].
Au cours de l'évolution, l'exosquelette dermique encombrant mais protecteur s'est réduit permettant un gain de souplesse, l'endosquelette s'est quant à lui élargi.
Les ceintures articulaires se sont développées pour supporter le poids du corps des tétrapodes hors de l'eau.
La cage thoracique est devenue elle aussi plus robuste permettant aux tétrapodes de ne pas écraser leurs poumons sous leur propre poids.
Le membre antérieur s'articulant au niveau de la ceinture scapulaire, pour marcher sur terre les ancêtres des tétrapodes ont vu la flexibilité au niveau de cette ceinture et de l'opercule augmenter[3].
Des études faites chez Polypterus ont démontré que chez les poissons Sarcoptérygiens dévonien qui sont à l'origine des premiers tétrapodes, la clavicule, le cleithrum et le supracleithrum de la ceinture pectorale créaient une attelle de soutien qui liait la tête au corps pendant la locomotion[3]. La clavicule servait donc de support structurel pour le cou et la ceinture pectorale.
Au cours de l'évolution, les clavicules se sont allongées et l'emboîtement plus étroit avec le cleithrum a renforcé l'attelle ventrale, ce qui a permis d'aider à l'alimentation, la locomotion et le soutien du corps dans un environnement terrestre[3]. C'était l'ébauche du cou.
Le cou articulé est apparu par la dissociation de la ceinture scapulaire du crâne, puis par la réduction progressive et la perte du supracleithrum et des os extrascapulaires ainsi que d'une spécialisation des vertèbres cervicales. Tiktaalik était le premier sarcoptérygien à en posséder un[3].
La ceinture pelvienne des poissons qui était restée libre, est venu s'attacher petit à petit à la colonne vertébrale des premiers tétrapodes.
Tous ces remaniements au niveau des ceintures articulaires vont permettre une évolution et de grands changements au niveau des membres.
Évolution de l'expression du génome[modifier | modifier le code]
Passer des nageoires aux membres authentiques des tétrapodes, c'est-à-dire munis de doigts, a été possible grâce à l'expression différente de certains gènes (HoxA et HoxD) entre les poissons et les tétrapodes[4]. L'étude comparative des mécanismes moléculaires de la morphogenèse des membres montre que des variations minimales faites sur ces systèmes moléculaires ont été de riches sources d'évolution morphologique[4].
Chez les tétrapodes, la morphogenèse du membre suit une progression proximo-distale, débutant par la production du stylopode (le bras chez l'homme), suivie par le zeugopode (l'avant-bras chez l'homme) pour se terminer par l'autopode (la main chez l'homme)[4]. Chez les poissons, tant cartilagineux qu'osseux, le développement des nageoires paires semble être contrôlé par des mécanismes voisins[4]. Le squelette des nageoires se construit à partir de deux composantes très différentes: d'une part, un endosquelette proximal, d'origine mésodermique, d'autre part, un squelette dermique plus ou moins flexible[4]. Plus aucune structure homologue du squelette dermique des nageoires n'existe chez les tétrapodes[4]. Il apparait donc que la transition nageoire-membre implique la perte complète du squelette dermique et que l’étendue de l'endosquelette chez les tétrapodes résulte d'une prolifération du compartiment mésodermique lors du développement des membres, alors que cette prolifération ne se fait pas chez les poissons. Cette différence s'explique par une expression différentes des gènes Hox[4].
Les gènes HoxA et HoxD sont essentiels pour la morphogénèse des membres. Ces gènes contrôlent la présence et l'organisation de certaines structures[4]. Lors du développement des membres chez les tétrapodes, l'expression du gène HoxA est restreinte au niveau du zeugopode et de l'équivalent du poignet. L'expression de HoxD est postérieure chez les poissons et le reste, alors que chez les tétrapodes, l'expression de HoxD est d’abord postérieure et devient par la suite distale[4]. C'est cette rotation des domaines d'expression des gènes Hox pendant le développement de l'organisme qui est à l'origine du développement des extrémités des membres[4] et donc de l'évolution des nageoires en membres.
Les membres chiridiens ressemblent donc à des nageoires (membres ptérygiens) comportant des parties distales supplémentaires, les autopodes. Des patrons d'expression des gènes architectes différents sont la source de ces modifications et illustrent la complexité croissante des morphologies[4].
Exemple : Le Tiktaalik, entre poisson sarcoptérygien et tétrapode[modifier | modifier le code]

Tiktaalik était un poisson de la classe des sarcoptérygiens qui a vécu il y a 375 millions d'années. Il possédait des nageoires lobés lui permettant de maintenir sa tête hors de l'eau ainsi que de se mouvoir sur le sol. C'est un tétrapodomorphe, tout comme l'était l’ancêtre des tétrapodes.
Il possédait des caractéristiques de transition entre l'organisme aquatique et terrestre. En effet, les nageoires pectorales de Tiktaalik étaient composées d'un squelette robuste, osseux, et articulé, il avait également une cage thoracique très robuste qui pouvait supporter son poids hors de l'eau. Son exosquelette dermique était réduit et son endosquelette élargi contrairement aux autres poissons tétrapodomorphes. La ceinture scapulaire n'était pas en contact du crâne, ce qui signifie qu'il possédait un cou flexible. La série d'os extrascapulaire, le suboperculum et l'opercule sont donc absents.
La gamme de joints dans la nageoire distale est fonctionnellement similaire aux multiples joints transversaux qui caractérisent les articulations du carpe, métacarpophalangiennes et interphalangiennes de la main des tétrapodes. Ses nageoires pouvaient donc réaliser des mouvements diversifiés d'extension et de flexion compatibles avec une fonction de soutien du corps. L'endosquelette distal de Tiktaalik invite donc à des comparaisons directes avec les poignets et les doigts des tétrapodes. De plus, ses nageoires étaient composées d'un humérus prolongé par deux os, le radius et l'ulna[5]. Ses épaules et ses coudes étaient flexibles. Il possédait donc des traits d'amélioration de performance pour la locomotion terrestre bien qu'on pense qu'il ne sortait jamais ou rarement de l'eau, mais que ces évolutions se sont faites car il vivait dans des zones d'eaux peu profondes et donc peu oxygénées, ce qui peut expliquer l'apparition de poumons et de membres lui permettant de se maintenir sur une surface solide afin de tenir sa tête hors de l'eau.
La découverte de cet intermédiaire entre les poissons et les premiers tétrapodes montre que la conquête de la terre ferme s'est faite par une série d'évolutions progressives et d'acquisitions de caractères nouveaux.
Locomotions terrestres[modifier | modifier le code]
Les contraintes de la locomotion terrestre sont différentes de celles en milieu marin : alors que la sélection naturelle avait tendance à privilégier les individus offrant le moins de résistance à la friction dans l’eau, sur terre c’est en prenant en compte la pesanteur que la sélection naturelle sélectionne les adaptations locomotives.
La reptation[modifier | modifier le code]
Elle apparaît peut-être sur terre avec les premiers annélides au Silurien mais cette question fait débat. Au Carbonifère s'effectue la sortie des eaux des mollusques (en particulier des gastéropodes) lesquels se déplacent en rampant, il s'agit là des premiers pulmonés terrestres.
Différentes manières de ramper vont ensuite faire leur apparition au cours de l’évolution.
L’exemple des mollusques[modifier | modifier le code]
La reptation des mollusques a assez peu évolué depuis leur sortie des eaux, leur corps est terminé par un pied qui leur sert à se déplacer par création de vagues successives et sécrétion d’un mucus permettant adhésion à l’environnement et protection contre celui-ci.
La reptation chez les tétrapodes[modifier | modifier le code]
Chez les serpents il ne s’agit pas de reptation à proprement parler, ils utilisent leurs écailles pour créer assez de frottements avec le sol puis pour se projeter en avant grâce à des muscles puissants. Ils sont classés parmi les tétrapodes mais ont perdu leurs membres chiridiens au cours de l’évolution. Il reste cependant des membres postérieurs vestigiaux chez les pythons et les boas qui sont des groupes primitifs de serpents[6].
Les Phocidés regroupant 18 espèces actuelles de phoques et éléphants de mer utilisent une sorte de reptation pour se déplacer sur la glace ou la terre ferme.
La marche[modifier | modifier le code]


Présente autant chez les arthropodes que chez les vertébrés lors de leur sortie des eaux, c’est un des premiers moyens de locomotion animale hors de l’eau[7] avec la reptation des mollusques (plus particulièrement des gastéropodes).
Les organismes terrestres utilisent leurs membres pour se déplacer de trois manières différentes : la marche, la course et le saut. Ils peuvent également occasionnellement servir à la nage.
Évolution des membres locomoteurs[modifier | modifier le code]
Les arthropodes[modifier | modifier le code]
Ils possèdent 6 appendices ou plus. Leur diversité est très grande, en plus des appendices locomoteurs il existe des appendices sensoriels, préhenseurs, masticateurs, reproducteurs, etc.
Les tétrapodes[modifier | modifier le code]
Les tétrapodes possèdent lors de leur sorties des eaux des membres chiridiens composés de trois segments :
- Le stylopode : humérus/fémur
- Le zeugopode : radius/ulna pour les membres antérieurs et tibia /fibula pour les membres postérieurs
- L’autopode : carpe/métacarpe/phalanges de la main ou tarse/métatarse/phalanges du pied
Si à la fin du Dévonien, ces membres sont juste assez puissants pour permettre de se hisser sur la berge à la manière de phoques (Ichthyostega en serait le parfait exemple), ce n’est que 10 à 15 millions d’années plus tard, au Carbonifère, que les tétrapodes peuvent se déplacer sur terre grâce aux structures anatomiques nouvelles permettant l’extension du coude et la flexion du poignet et de la cheville.
Cette organisation se retrouve encore aujourd’hui chez les tétrapodes ayant conservé leur membres, on ne la retrouve plus ou alors en traces vestigiales chez certains serpents par exemple. Notons la présence de cette organisation particulière chez les siréniens et cétacés actuels dont les ancêtres ont effectué un retour à la mer. En effet contrairement aux poissons, ces mammifères possèdent des « palettes natatoires » ayant l’organisation osseuse des membres chiridiens[8].

Un paradigme très répandu dans la communauté scientifique voudrait que les organismes aient évolué de membres horizontaux aux membres dressés para-sagittaux en passant par une position transverse[9]. Pour autant cette théorie ne fait pas consensus au sein des chercheurs car les crocodiliens modernes peuvent se déplacer à la fois de façon étendue (membres horizontaux) et érigée (membres dressés para-sagittaux)[10].
Il existe une grande variété de taille de membres locomoteurs chez les tétrapodes. Cette taille est adaptée aux niches écologiques de ces espèces en termes d’accès à la nourriture ou de résistance aux contraintes environnementales. Pourtant alors que le principal but de ces membres est de se déplacer, malgré les différentes distances journalières parcourues chez différents organismes, cette caractéristique ne semble pas avoir d’impact notable sur l’économie d’énergie et donc la fitness[11].
La bipédie[modifier | modifier le code]


Elle caractérise certains dinosaures ainsi que les oiseaux, certains marsupiaux comme les kangourous. Elle se retrouve également occasionnellement chez des organismes quadrupèdes comme les suricates ou les ours. Dans ces cas là il s'agit plus d'une posture d'observation que de locomotion. Certains primates sont capables de l’adopter par moments, l’humain, lui l’acquiert au cours de sa croissance. L’origine de la bipédie humaine ne fait pas consensus et reste encore assez obscure, une trentaine de théories ont été émises depuis le XXe siècle. Si la théorie la plus largement admise avant les années 2000 était que l’ancêtre de l’Homme s’était redressé afin de s’adapter à la savane dans laquelle il vivait, elle est maintenant largement considérée comme fausse[12].
Le retour au milieu aquatique[modifier | modifier le code]
Des reptiles seraient retournés vivre en mer lors du Trias il y a environ 240 millions d’années.

Alors que le retour à la mer de certains mammifères donnant les futurs cétacés se serait fait lors de l’Eocène il y a 55 millions d’années, notons la découverte de Ambulocetus dont l’ancêtre serait semblable à Pakicetus, mammifère terrestre. Selon les apparences Ambulocetus aurait une vie exclusivement marine mais conserverait des caractéristiques terrestres comme les moignons de membres postérieurs ou la respiration pulmonaire[13],[14]. Ambulocetus est lui-même probablement semblable à l’ancêtre du Basilosaurus, cétacé carnivore, proche parent de l'ancêtre commun des baleines[15].
Vers la fin de l’Eocène aurait eu lieu le retour à la mer de mammifères donnant les futurs siréniens dont le Prorastomus qui serait le plus ancien sirénien connu de prédominance terrestre[16].
Spécificités des mammifères marins[modifier | modifier le code]
Il existe chez les mammifères marins de nombreuses différences adaptatives avec les poissons.
Ils restent très proche en termes d’évolution des mammifères terrestres : leurs organismes sont moins adaptés à la respiration sous-marine puisqu'ils sont dotés de poumons ne leur permettant pas de respirer sous l’eau par exemple. On retrouve cependant de nombreuses convergences évolutives physiques avec les poissons, les nageoires des poissons se retrouvent sous forme de « palettes natatoires » chez les mammifères dont les os ont gardé la même organisation que ceux des mammifères terrestres.
Exemple des Dauphins[modifier | modifier le code]
Les dauphins possèdent un nombre de phalanges supérieur à la normale chez les mammifères, ce qui leur permet d’allonger la longueur de la palette natatoire. On retrouve la présence de cartilage qui immobilise ses os, formant une nageoire dont seule l’articulation de l’épaule est fonctionnelle. Les membres postérieurs sont absents, la propulsion est assurée par une nageoire caudale horizontale.
Apparition du vol[modifier | modifier le code]
Le vol est la dernière stratégie de locomotion à apparaître dans le règne animal. Le vol permet de parcourir des distances bien plus rapidement que tout autre moyen de locomotion, mais le coût énergétique et les adaptations nécessaires à l’acquisition de ce type de déplacement sont considérables.
Cette stratégie est issue d'une convergence évolutive puisqu'on la retrouve chez de nombreuses espèces clairement distinctes les unes des autres.
Le vol chez les insectes[modifier | modifier le code]

Les insectes sont les premiers êtres vivants et les seuls parmi les invertébrés ayant acquis la faculté de voler activement.
Les plus anciens fossiles d’insectes volants trouvés, datant du Carbonifère, permettent de penser que cette adaptation remonterait au Dévonien. Les fossiles ne permettent cependant pas de remonter la trace de l’évolution des structures élaborées nécessaires au vol. L’observation des ailes, et notamment des nervures, suggère une origine commune à tous les insectes ailés : les organes et la fonction sont apparus en une seule fois dans l’histoire évolutive du groupe[17],[18].
Hypothèses de l’apparition du vol[modifier | modifier le code]
Première hypothèse[modifier | modifier le code]
L’ancêtre commun des insectes volants avait des ailes très réduites lui servant à la thermorégulation. Une étude menée par Kingsolver et Koehl montre que la taille sélectionnée pour la thermorégulation serait inférieure à la taille nécessaire pour le vol. Cependant une hypothèse est émise selon laquelle un brusque changement de taille aurait permis l’augmentation suffisante de la surface des ailes pour que, aérodynamiquement, le vol puisse apparaître[19].
Seconde hypothèse[modifier | modifier le code]
Elle vient de James Marden. Il avance que les proto-ailes de l’ancêtre commun aux insectes volants auraient servi en premier lieu à glisser sur le milieu aquatique. En effet, une étude s’appuie sur les mouches de pierre (plécoptère). Ces insectes « primitifs » dont on retrouve des fossiles datant du Carbonifère se servent parfois de leurs ailes pour glisser à la surface de l’eau telles les voiles d’un bateau ou pour « ramer » à la surface de l’eau. L’hypothèse qu’émet Marden est que les proto-ailes apporteraient un avantage sélectif pour échapper aux prédateurs, rencontrer un plus grand nombre de partenaires… Plus les proto-ailes seraient grandes, plus elles permettraient d’accélérer la locomotion et donc apporteraient un avantage sélectif important, jusqu’à ce qu’elles deviennent suffisamment grandes pour permettre le vol.
Cette seconde hypothèse permet de révéler un chemin évolutif possible pour l’acquisition des organes (muscles, ailes, nerfs) nécessaires au vol. Elle est de plus étayée par l’observation de soies repoussant l’eau sur une partie des ailes et sur les pattes des plécoptères.
L’avantage supplémentaire des proto-ailes viendrait de l’augmentation de la taille de la végétation terrestre. Tout mécanisme permettant de planer jusqu’au sol permettrait d’avoir un avantage évolutif certain.
Les proto-ailes viendraient quant à elles de tergites servant par exemple à la thermorégulation. Cependant une étude plus récente basée sur l’étude des larves d’éphémères suggèrerait que les proto-ailes dérivent de branchies dorso-latérales articulées ressemblant à des ailes miniatures[18],[20],[21].
Adaptations des muscles et des ailes[modifier | modifier le code]
Évolutions musculaires[modifier | modifier le code]
Le vol est un moyen de locomotion spécial et pour le réaliser il est nécessaire d’avoir une structure musculaire particulière, notamment chez les petits insectes. En effet, plus un être a des ailes petites, plus il doit en battre rapidement pour décoller (Nombre de Reynolds). Ainsi, certains insectes peuvent battre des ailes jusqu’à une fréquence de 1000Hz.
C’est pourquoi on retrouve un système particulier de régulation mécanique du calcium, nécessaire à la contraction musculaire, dans des muscles asynchrones plutôt qu'une régulation chimique comme dans les autres muscles squelettiques. Les contractions n’étant plus liées à la diffusion calcique, les neurones moteurs de ces muscles peuvent émettre des signaux en continu à un niveau plus faible que la normale.
De plus, les muscles doivent chauffer pour atteindre un niveau de battement aussi rapide. Des techniques pour chauffer les muscles ont donc été sélectionnées pour qu'ils se réchauffent rapidement en cas de basse température. Nous pouvons citer le « frétillement » musculaire qui permet de faire travailler les muscles sans fournir d’effort pour le vol, ce qui permet de transformer la plus grande partie de ce travail en chaleur[19],[22]. On observe aussi l’absorption de la chaleur solaire par les ailes, qui agissent alors comme des panneaux solaires. Cette dernière adaptation est à l’origine de la théorie sur l’apparition des proto-ailes pour la thermorégulation.


On peut distinguer une évolution dans l’attache des muscles responsables du vol chez les insectes. Tout d’abord, « le vol direct », c’est-à-dire que les muscles squelettiques sont directement rattachés aux ailes. Ce caractère primitif est commun à tous les paléoptères (odonates et éphémères) et serait la première forme de vol. Les insectes de ce taxon ne peuvent pas replier les ailes sur leur dos.
Le « vol indirect » serait apparu ultérieurement. Les muscles ne sont pas attachés aux ailes, ce qui permet de les remplier sur le dos. Il fut acquis par l’ancêtre commun aux néoptères et le point de départ de l’évolution des ailes chez ces derniers[23].
Évolution des ailes[modifier | modifier le code]

Les modifications les plus importantes des ailes chez les insectes sont apparues après le passage au vol indirect et donc au repliement des ailes sur les flancs ou le dos.
On peut ainsi distinguer les élytres qui sont des solidifications de la paire d’ailes antérieures de l’insecte. Elles servent notamment de protection et ne peuvent plus assurer le rôle du vol. On les trouve chez les Coléoptères. Dans une moindre mesure, chez de nombreuses autres espèces, on retrouve des ailes antérieures plus ou moins solidifiées assurant la protection des ailes plus fragiles en dessous.

On peut aussi remarquer des haltères chez les Diptères notamment. De cette évolution résulte une diminution des ailes postérieures ou antérieures (Strepsiptères) pour servir à l’équilibre de l’animal.
Enfin, certaines espèces ont perdu le vol de façon secondaire ou répugnent à l’utiliser. Cependant, certaines continuent d’utiliser un vol passif, se laissant porter par les courants d’air comme les pucerons par exemple[22].
Vol passif : « Ballooning »[modifier | modifier le code]
De nombreuses espèces d'invertébrés tels que des araignées, des acariens, ou des lépidoptères se servent de leur aptitude à former de la soie pour se mouvoir. Ces espèces tissent un fil de soie qui leur permet d’être portées par le vent. Le ballooning est bien une stratégie de locomotion volontaire, les animaux sont bien initiateurs de leur mouvement bien que ce soit le vent qui les porte.
Le vol chez les vertébrés[modifier | modifier le code]

Le vol chez les oiseaux et les mammifères apparaît au Mésozoïque, chez des espèces quadrupèdes comme chez les espèces bipèdes. Cette stratégie de locomotion est une convergence évolutive, elle est apparue indépendamment dans les différents taxons. On distingue deux principales formes de vol : la première, le vol plané, est une hypothèse d’état intermédiaire entre la locomotion terrestre (quadrupédie ou bipédie) et le vol ; la seconde, le vol battu[24].
Le vol plané[modifier | modifier le code]
Le vol plané est un vol passif où l’animal se maintient dans l’air sans mouvement d’ailes. L’animal monte aux arbres, se jette de l’arbre et plane[25]. Ce vol s’effectue grâce à une structure particulière : le patagium. Le patagium est une membrane étendue liant le cou, les membres et la queue de l’animal[26]. Il ressemble à une paire d’ailes symétriques et supporte le poids de l’animal lui permettant de générer le mouvement du vol[27]. Ce vol passif nécessite toutefois une locomotion arboricole, permettant à l’animal d’atteindre une altitude suffisante avant d’effectuer un vol plané[27]. Le vol plané existe chez de nombreuses espèces : certains mammifères (écureuils volants, colugos) mais aussi chez certains reptiles : les serpents.
Les écureuils volants rassemblent les rongeurs capables d’effectuer un vol plané. Les colugos sont surnommés lémuriens volants. Ce surnom est dû à leur apparence, bien que les colugos ne soient pas des lémuriens, ils sont toutefois génétiquement proches des humains[28].
Les serpents volants sont une exception. Ils ne possèdent aucune structure spécialisée dans le vol. Ils réussissent à contrôler leur trajectoire par leurs ondulations et l’aplatissement de leur "ventre". Un changement de posture entraîne un changement de trajectoire[29]. Néanmoins, cette stratégie de locomotion ne permet pas de parcourir de très longues distances ni de se trouver à haute altitude, contrairement au vol battu, effectué par les oiseaux et les chauves-souris.
Le vol battu[modifier | modifier le code]
Le vol battu est un vol principalement actif, avec des mouvements d’ailes. La phase ascendante est active (vol battu), la phase descendante est passive (vol plané)[30].
Les oiseaux[modifier | modifier le code]
Les oiseaux sont des Théropodes. Les Théropodes regroupent les dinosaures et les oiseaux. Au Mésozoïque, la majorité des oiseaux adoptèrent cette stratégie de locomotion. Certains oiseaux sont capables d’atteindre 9000 mètres d’altitude et de parcourir des centaines voir des milliers de kilomètres[31].
Évolutions morphologiques[modifier | modifier le code]
D’importants changements morphologiques ont eu lieu chez les oiseaux. Ces modifications importantes leur ont permis de survivre à la massive crise d’extinction Crétacé-Tertiaire, contrairement aux dinosaures[32].

Tout d’abord, les oiseaux ont subi une réduction de leur taille et un allègement de leur masse corporelle.
Le nombre de plumes a augmenté. Les plumes existaient chez les dinosaures sous forme de filaments : on parle de proto-plumes[25],[31]. Les proto-plumes servaient à la thermorégulation ainsi qu’à la couvaison des œufs. Chez les oiseaux, les plumes possèdent un rôle de plus, elles représentent une surface portante pour le vol[31].
La taille de la queue diminue. La très longue queue des dinosaures était un ornement, elle possédait un rôle important pour la sélection sexuelle. La queue permet de stabiliser le vol. Un os supportant les plumes de la queue apparaît : le pygostyle.
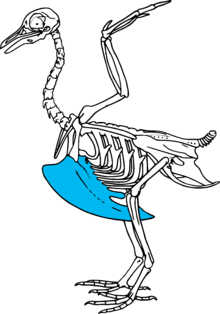
La queue est indépendante des ailes chez les oiseaux[33] de même que les pattes arrière[34].
Le bréchet, prolongation du sternum, soutient toute la musculature indispensables au vol.
On observe une évolution des centres locomoteurs. Les dinosaures quadrupèdes possédaient un seul centre locomoteur constitué des membres avant et arrière. Les dinosaures bipèdes possédaient aussi un seul centre locomoteur constitué des membres arrière et de la queue. Les oiseaux possèdent trois centres locomoteurs indépendants : les membres avant (les ailes), les membres arrière et la queue[25].
Hypothèses du passage au vol[modifier | modifier le code]
Ces modifications se sont réalisées graduellement, il existe trois hypothèses relatives à l’apparition du vol.
- L’hypothèse arboricole. Le vol battu s’est développé à partir du vol plané[25].
- L’hypothèse terrestre. Les éléments de base nécessaires au vol se sont développés à partir des comportements alimentaires et des comportements de prédation des espèces fouisseuses[25].
- WAIR (wing-assisted incline running). Pour monter des pentes fortement inclinées (angle > 45°), les oiseaux utilisent à la fois leurs pattes arrière et leurs ailes. Les battements d’ailes produisent des forces aérodynamiques. La course sur les pattes arrière permet d’augmenter leur action et force de traction. Le corps de l’oiseau se trouve à la verticale avec un mouvement vers l’avant, tout comme pendant le vol[35].
Le vol battu n’existe pas uniquement chez les oiseaux. On l’observe également chez les chauves-souris qui combinent des caractéristiques morphologiques des oiseaux et des espèces à vol plané.
Les chauves-souris[modifier | modifier le code]
Elles possèdent toutes un même ancêtre terrestre[36] il semblerait qu’il était quadrupède, et bon escaladeur[24].
Évolutions morphologiques[modifier | modifier le code]

Il y a 65 millions d’années, l’évolution de muscles spécifiques a permis aux chauves-souris de voler[33]. La taille des pattes arrière a diminué[24] et la taille corporelle a augmenté, tout comme la taille des ailes qui a elle aussi augmenté. Les ailes des chauves-souris, le patagium, sont constituées de matériaux vivants, contrairement aux ailes des oiseaux. La peau est fine, ce qui diminue la masse des ailes. Les ailes contiennent de nombreuses fibres élastiques et des senseurs de muscles spécifiques, ce qui permet un contrôle précis de la forme de l’aile selon la vitesse du vol[33]. L’avant-bras (radius et ulna) ainsi que les os de la main (métacarpes et phalanges) se sont agrandis. Cet agrandissement a continué après l’apparition du vol. *5 Leurs doigts allongés couvrent toute la surface des ailes. Les senseurs et les longs doigts permettent un contrôle du vol unique chez les espèces volantes[33].
La plupart des espèces de chauves-souris possèdent une queue, permettant d'augmenter la manœuvrabilité. Le patagium lie le cou, les membres (pattes antérieures et postérieures) et la queue, ce qui assure un contrôle très précis lors du vol[33].
Les chauves-souris alternent vol battu et vol plané. Cette alternance est moins coûteuse énergétiquement que de réaliser uniquement du vol battu.
Hypothèses du passage au vol[modifier | modifier le code]
Les chauves-souris sont dotées d’un système d’écholocalisation qui est leur principal moyen d'orientation lors des phases de vol, mais qui a toutefois un très fort coût énergétique. C'est pourquoi les hypothèses d'acquisition du vol sont toutes reliées à cette particularité.
- Apparition du vol après l’acquisition du système d’écholocalisation. Le couplage des deux mécanismes a permis la réduction du coût de l’écholocalisation[24].
- Évolution en tandem de ces deux mécanismes[24].
Locomotions atypiques[modifier | modifier le code]
Parasitisme et modification de la locomotion[modifier | modifier le code]

Certains parasites évoluent et voient une modification, une réduction ou une perte de leur locomotion propre puisqu'une fois sur leur hôte ils n’ont plus l’utilité de se mouvoir. Généralement cette perte ou cette modification de locomotion s’accompagne d’une spécialisation dans la fixation à leur hôte.
Comme le montre Trypanosoma brucei qui se fixe à la surface des cellules épithéliales des glandes salivaires de la mouche tsé-tsé par l’intermédiaire d’un flagelle modifié[37].
La sangsue ou Hirudinea (Annélide), est aussi un parasite dont la locomotion a changé au cours de l’évolution, en effet, elle ne possède ni parapodes ni soies, qui sont pourtant des synapomorphies des annélides, c’est sa ventouse qui lui permet de se fixer à l’hôte et de se déplacer par arpentage.
Déplacement en roulant[modifier | modifier le code]
La roue ne semble pas avoir été sélectionnée par l’évolution, on ne trouve aucune espèce animale se déplaçant grâce à des roues, c’est pourtant un moyen de locomotion extrêmement économe en énergie.
Il existe de rares cas d’espèces utilisant la rotation comme moyen de déplacement mais il s’agit généralement d'un moyen de fuite utilisant la totalité du corps en formant une boucle et non pas des petites parties tournant indépendamment du reste du corps.
On peut donner l’exemple du pangolin, de certaines salamandres et d’une araignée : Carparachne aureoflava. Il est à noter que toutes ces espèces ne roulent que de manière passive, utilisant la gravité.
La rotation active se retrouve cependant chez quatre espèces de chenilles connues : Tyria jacobaea, Pleurotya ruralis, Cacoecimorpha pronubana et Cucullia verbasci ainsi que chez Nannosquilla decemspinosa, une espèce de Stomatopode. En formant une boucle avec leur corps elles peuvent s’échapper sur quelques centimètres en atteignant une vitesse bien plus élevée que leur vitesse de déplacement classique.
La rotation malgré la faible énergie qu’elle consomme n’est adaptée qu’à une très faible quantité de terrain (terrain peu accidenté, avec peu d’obstacles) ce qui explique peut-être sa relative absence dans la nature[38],[39].
Locomotion cellulaire au sein d’un organisme pluricellulaire[modifier | modifier le code]
Au sein d’un organisme pluricellulaire on retrouve des cellules douées de capacités de locomotion, que ce soit passivement via les fluides qui circulent dans l’individu, ou que ce soit activement grâce au cytosquelette de la cellule.
La locomotion cellulaire se fait en plusieurs étapes, dans un premier temps il y a extension d’un lamellipode ou d’un pseudopode, puis par cette extension la cellule se fixe au support et par un écoulement cytosolique le corps cellulaire se rapproche de l’extrémité de l’extension[40].
Ce type de déplacement est relativement lent mais fonctionne bien à l'échelle cellulaire.
Articles connexes[modifier | modifier le code]
- Sélection naturelle
- Évolution (biologie)
- Ancêtre commun
- Convergence évolutive
- Niches écologiques
- Sortie des eaux
- Carbonifère
- Dévonien
- Mésozoïque
- Vol de l'insecte
- Nageoires
- Membre (anatomie)
- Histoire évolutive du vivant
- Histoire évolutive des mammifères
- Histoire évolutive des oiseaux
- Histoire évolutive des cétacés
- Histoire évolutive des siréniens
- Histoire évolutive des lépidoptères
- Histoire évolutive des primates
- Histoire évolutive des homininés
- Histoire évolutive des sarcoptérygiens
- Histoire évolutive des Équidés
- Histoire évolutive des poissons cartilagineux
- Histoire évolutive des gastéropodes
- Histoire évolutive des hippopotamidés
Notes et références[modifier | modifier le code]
- (fr) Cathy Fisch, Pascale Dupuis-Williams, L’ultrastructure des cils et des flagelles : le renouveau, The rebirth of the ultrastructure of cilia and flagella, Biologie Aujourd'hui, 205 (4), 245-267 (2011)
- (en) Dawe et al. « Centriole/basal body morphogenesis and migration during ciliogenesis in animal cells » Journal of cell science 2007;120, 7-15
- (en) Emily M. Standen, Trina Y. Du & Hans C. E. Larsson, Development plasticity and the origin of tetrapods, Nature, 513, 54–58, 04 September 2014.
- (fr) Denis Duboule, Paolo Sordino, Des nageoires aux membres: l'apport de la génétique moléculaire du développement dans l'étude de l'évolution des morphologies chez les vertébrés, Médecine/Sciences, 12, 147-54, 1996.
- (en) Neil H. Shubin, Edward B. Daeschler and Farish A. Jenkins, Jr, The pectoral fin of Tiktaalik roseae and the origin of the tetrapod limb, Nature 440, 764-771, 6 April 2006.
- (en) Lars Bejder and Brian K. Hall, Limb in whales and limbless in other vertebrates - mechanisms of evolutionary and developmental transformation and loss, Evolution & Development, 4:6, 445-458, 2002.
- (en) P. Ward et al., Confirmation of ROER’s Gap as a low oxygen interval constraining the timing of initial arthropod and vertebrate terrestialization, PNAS, vol. 103, no.45, 16818-16822, 7 novembre 2006.
- (fr) M. Laurin et al., Données microanatomiques sur la conquête de l'environnement terrestre par les vertébrés, C. R. Palevol , 5, 603-618, 2006.
- (en) Masaya Iijima and Yoshitsugu Kobayashi, Convergences and trends in the evolution of the archosaur pelvis, Paleobiology, 40(4), p. 608-624, 2014.
- (en) S. M. Reilly & al., Locomotion in alligator mississippiensis : kinematic effects of speed and posture and their relevance to the sprawling-to-erect, The Journal of Experimental Biology 201, 2559-2574, 1998.
- (en) Herman Pontzer, Relating ranging ecology, limb length, and locomotor economy in terrestrial animals, Journal of Theoretical Biology, 296, 6-12, 2012.
- (en) Carsten Niemitz, The evolution of the upright posture and gait – a review and a new synthesis, Naturwissenschaften, 97:241-263, 2010.
- (en) J. G. M. Thewissen & al., Skeletons of terrestrial cetaceans and the relationship of whales to artiodactyls, Nature, vol.413, 277-281, 20 septembre 2001.
- (en) J. G. M. Thewissen & al., Fossil evidence for the origin of aquatic locomotion in Archaeocete Whales, Science, New Series, vol.263, no.5144, p. 210-212, 14 janvier 1994.
- (en) Philip D. Gingerich & al., Hind limbs of Eocene Basilosaurus : Evidence of feet in whales, Science, vol.249, 154-157, 13 July 1990.
- (en) D. P. Domning, The earliest known fully quadrupedal sirenian, Nature, vol.413, 625-627, 11 Oct. 2011.
- (en) Michael Dickinson, Insect flight, Current Biology, vol. 16, No 9, 9 May 2006.
- (en) Jocelyn Kaiser, A New Theory of Insect Wing Origins Takes Off, Science, New Series, Vol. 266, No. 5184, p. 363, Oct. 21, 1994.
- (en) Roger Lewin, On the Origin of Insect Wings, Science, New Series, Vol. 230, No. 4724, p. 428-429, 25 Oct. 1985.
- (en) Averof, M. & Cohen, S.M., 1997. Evolutionary origin of insect wings from ancestral gills. Nature (London), 385: 627-630, 1993.
- (en) James H. Marden and Melissa G. Kramer, Surface-Skimming Stoneflies: A Possible Intermediate Stage in Insect Flight Evolution, Science, New Series, Vol. 266, No. 5184, p. 427-430, 21 Oct. 1994.
- (en) Michael Dickinson, Insect flight, Current Biology Vol 16 No 9, 9 May 2006.
- (en) Shefa Gordon and Michael H. Dickinson, Role of Calcium in the Regulation of Mechanical Power in Insect Flight, Proceedings of the National Academy of Sciences of the United States of America, Vol. 103, No. 11, p. 4311-4315, 14 mars 2006.
- (en) Nancy B. Simmons, Kevin L. Seymour, Jörg Habersetzer, Gregg F. Gunnell, Primitive early Eocene bat from Wyoming and the evolution of flight and echolocation, Nature 451, 818-821, 14 February 2008.
- (en) Julia Clarke et Kevin Middleton, Bird evolution, Current biology, Volume 16, Issue 10, Pages R350–R354, 23 May 2006.
- (en) Richard W. Thorington, Flying squirrels are monophyletic, Science, 225(4666): 1048-105, 1984.
- (en) Jin Meng, Yaoming Hu, Yuanqing Wang, Xiaolin Wang, Chuankui Li, A Mesozoic gliding mammal from northeastern China, Nature 444, 889-893, 14 December 2006.
- (en) Michael Hopkin, Flying lemurs’ are primates’ closest kin, Nature, 1 November 2007.
- (en) John J. Socha, Kinematics : gliding flight in the paradise tree snake, Nature 418, 603-604, 8 August 2002.
- (en) R. McNeill Alexander, Three kinds of flying in animals. Nature 321: 113-114. 1986.
- (en) Stephen L. Brusatte, Kingmai K. O’Connor, Erich D. Jarvis, The origin and diversification of birds, Current biology, Volume 25, Issue 19, Pages R888–R898, 5 October 2015.
- (en) Daniel T. Ksepka, Evolution : a rapid flight towards birds, Current Biology Volume 24, Issue 21, Pages R1052–R1055, 3 November 2014.
- (en) Anders Hedenström et L. Christoffer Johansson, Bat flight, Current biology, Volume 25, Issue 10, pR399–R402, 18 May 2015.
- (en) Vivian Allen, Karl T. Bates, Zhiheng Li et John R. Hutchinson,Linking the evolution of body shape and locomotor biomechanics in bird-line archosaurs, Nature, 2013
- (en) Kenneth P. Dial, Wing-assisted Incline Running and the evolution of flight, Science, Vol. 299 no. 5605 pp. 402-404, 17 January 2003
- (en) Michael Dickinson, Animal locomotion : a new spin on bat flight, Current biology, Volume 18, Issue 11, pR468–R470, 3 June 2008.
- (en) L. Tetley, K. Vickerman, Differentiation in Trypanosoma-brucei –host-parasite cell-junctions and their persistence during acquisition of the variable antigen coat, Journal of cell science, vol 74, p1-p. 19, mars 1985
- (en) John Brackenbury, Fast locomotion in caterpillars, Journal of Insect Physiology, 45, 525-533, 1999.
- (en) R. Full & al., Locomotion like a wheel, Nature, vol.365, 495, 7 Oct. 1993.
- Mr Harvey Lodish, Mr Arnold Berk, Paul Matsudaira, James Darnell, Biologie moléculaire de la cellule, De Boeck Supérieur, 15 Mar, 2005


 French
French Deutsch
Deutsch