عوارض ناخواسته دارویی - ویکیپدیا، دانشنامهٔ آزاد
| عوارض ناخواسته دارویی | |
|---|---|
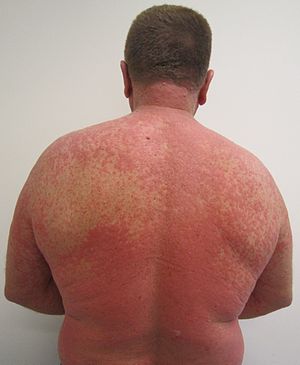 | |
| راش پوستی ناشی از واکنش دارویی | |
| طبقهبندی و منابع بیرونی |
عوارض ناخواسته دارویی (ADR) آسیب دیدگی ناشی از مصرف داروی شیمیایی است. ADR ممکن است به دنبال مصرف یک دوز یا تجویز طولانی مدت یک دارو یا در نتیجه ترکیب دو یا چند دارو رخ دهد. معنی این اصطلاح با اصطلاح "اثر جانبی" متفاوت است، زیرا اثرات جانبی می توانند هم مفید و هم مضر باشند.[۱] مطالعه ADRها موضوع مورد مطالعه در حوزه مراقبت های دارویی است. یک رویداد ناخواسته دارویی (ADE) به هرگونه آسیب دیدگی در زمان مصرف دارو گفته میشود، خواه علت آن آسیب باشد یا خیر. ADR نوع خاصی از ADE است که در آن رابطه علت و معلولی را می توان نشان داد. ADRها تنها یک نوع از آسیب های مرتبط با دارو هستند، زیرا آسیب می تواند ناشی از عدم مصرف داروهای مشخص نیز باشد.[۲]
طبقه بندی[ویرایش]
ADR ها ممکن است براساس علت و شدت طبقه بندی شوند.
علت[ویرایش]
- نوع A: عوارض دارویی فزونی یافته - وابسته به دوز و قابل پیش بینی
- عوارض نوع A ، که تقریباً 80٪ از عوارض ناخواسته دارویی را تشکیل می دهند، معمولاً نتیجه اثر اولیه دارو هستند (به عنوان مثال خونریزی هنگام استفاده از داروی ضد انعقاد وارفارین) یا شاخص درمانی پایین دارو (به عنوان مثال حالت تهوع از دیگوکسین)، بنابراین قابل پیش بینی هستند. آنها مربوط به دوز بوده و معمولاً خفیف هستند، اگرچه ممکن است جدی یا حتی کشنده باشند (به عنوان مثال خونریزی داخل جمجمه ناشی از وارفارین) چنین عوارضی معمولاً به دلیل دوز نامناسب است، به ویژه هنگامی که دفع دارو معیوب باشد. اصطلاح "عوارض جانبی" اغلب برای عوارض جزئی نوع A به کار میرود
- نوع B : عوارض دارویی ویژه
انواع A و B در دهه 1970 ارائه شدند،[۳] و انواع دیگر هنگامی ارائه شدند که دو مورد اول برای طبقه بندی ADR کافی نبودند.[۴]
.نوعc:اثرات مزمن
.نوعD:اثرات تاخیری
.نوعE:اثرات پایان درمان
.نوع F:اثرات شکست درمان
جدی بودن[ویرایش]
طبق تعریف سازمان غذا و داروی آمریکا یک رویداد ناخواسته جدی شامل موارد زیر است:[۵]
- کلیه موارد منجر به مرگ
- کلیه موارد تهدید کننده حیات
- کلیه موارد منجر به بستری شدن در بیمارستان (اولیه یا طولانی مدت)
- کلیه موارد منجر به ناتوانی-قابل توجه، مزمن یا تغییر دائمی، اختلال، آسیب یا اختلال در عملکرد/ ساختار بدن بیمار، فعالیت های بدنی یا کیفیت زندگی بیمار.
- کلیه موارد منجر به ناهنجاری مادرزادی
- کلیه موارد نیازمند مداخله برای جلوگیری از اختلال دائمی یا آسیب
شدت یک نقطه در مقیاس دلخواه از رویداد ناخواسته مورد بحث است. اصطلاحات "شدید" و "جدی"، اگر برای رویدادهای ناخواسته به کار روند، از نظر فنی بسیار متفاوت هستند. آنها به راحتی با هم اشتباه می شوند، اما نباید به جای هم استفاده شوند و این امر نیاز به دقت در استفاده دارد.
سردرد در صورت ایجاد درد زیاد، شدید است. مقیاس هایی مانند "مقیاس آنالوگ بصری" وجود دارد که به پزشکان کمک می کند تا شدت را ارزیابی کنند. از طرف دیگر، سردرد معمولاً جدی نیست (اما ممکن است در صورت خونریزی زیر عنکبوتیه، خونریزی زیر دورال، حتی میگرن ممکن است موقتاً اینگونه باشد)، مگر اینکه با معیارهای جدی ذکر شده در بالا نیز مطابقت داشته باشد.
محل[ویرایش]
عوارض جانبی ممکن است موضعی باشد، یعنی محدود به یک مکان خاص، یا سیستمیک باشد، جایی که دارو باعث اثرات سوء در کل دستگاه گردش خون شده است .
به عنوان مثال، برخی از داروهای ضد فشار خون چشم باعث ایجاد اثرات سیستمیک می شوند، اگرچه به صورت قطره های چشمی به صورت محلی تجویز می شوند، زیرا بخشی از آن به دستگاه گردش خون فرار می کند.
مکانیسم ها[ویرایش]
از آنجا که تحقیقات بیوشیمی مصرف دارو را بهتر توضیح می دهد، ADR های کمتری نوع B بوده و بیشتر نوع A هستند مکانیسم های معمول عبارتند از:
- فارماکوکینتیک غیرطبیعی به دلیل
- عوامل ژنتیکی
- حالات چندابتلایی
- اثرات هم افزایی بین هر دو
- یک دارو و یک بیماری
- دو دارو
- اثرات تضاد بین هر دو
- یک دارو و یک بیماری
- دو دارو
گزارش[ویرایش]
وزارت بهداشت ایران دستورالعملی به منظور ثبت عوارض و خطاهای دارویی در تاریخ 1385/11/21 به شماره 20008 منتشر نموده است. در حال حاضر ارسال گزارش عوارض ناخواسته دارویی و اشتباهات مرتبط با مصرف فراورده های سلامت از طرق زیر امکان پذیر است:
1- سامانه برخط گزارش دهی عوارض ناخواسته داروها و فراورده های سلامت از طریق صفحه اصلی سایت سازمان غذا و دارو و یا لینک مستقیم بایگانیشده در ۲۵ مارس ۲۰۱۸ توسط Wayback Machine
2- تکمیل فرم زرد
منابع[ویرایش]
- ↑ Nebeker JR, Barach P, Samore MH (May 2004). "Clarifying adverse drug events: a clinician's guide to terminology, documentation, and reporting". Annals of Internal Medicine. 140 (10): 795–801. doi:10.7326/0003-4819-140-10-200405180-00017. PMID 15148066. S2CID 32296353.
- ↑ Bose KS, Sarma RH (October 1975). "Delineation of the intimate details of the backbone conformation of pyridine nucleotide coenzymes in aqueous solution". Biochemical and Biophysical Research Communications. 66 (4): 1173–9. doi:10.1016/0006-291X(75)90482-9. PMID 2.
- ↑ Rawlins MD, Thompson JW. Pathogenesis of adverse drug reactions. In: Davies DM, ed. Textbook of adverse drug reactions. Oxford: Oxford University Press, 1977:10.
- ↑ Aronson JK. Drug therapy. In: Haslett C, Chilvers ER, Boon NA, Colledge NR, Hunter JAA, eds. Davidson's principles and practice of medicine 19th ed. Edinburgh: Elsevier Science, 2002:147-
- ↑ "MedWatch - What Is A Serious Adverse Event?". Archived from the original on 29 September 2007. Retrieved 2007-09-18.


 French
French Deutsch
Deutsch