ایدز - ویکیپدیا، دانشنامهٔ آزاد
| HIV/AIDS | |
|---|---|
| نامهای دیگر | بیماری HIV، عفونت HIV[۱][۲] |
 | |
| روبان سرخ نمادی است برای همبستگی برای افراد مبتلا به اچآیوی و افرادی که با ایدز زندگی میکنند.[۳] | |
| تخصص | بیماری عفونی، ایمنیشناسی |
| نشانهها | اولیه: بیماری شبیه آنفولانزا[۴] بعدی: لنفادنوپاتی، تب، کمبود وزن[۴] |
| عوارض | عفونتهای فرصتطلب، نئوپلاسم[۴] |
| دورهٔ بیماری | کل عمر[۴] |
| علت | HIV[۴] |
| عوامل خطر | عمل جنسی مقعدی یا واژنی محافظتنشده، داشتن یک بیماری آمیزشی دیگر، در اشتراک قرار دادن سوزن، فرایندهای پزشکی که مرتبط با برش یا نفوذ غیر استریل باشند و تجربه نیدلاستیک[۴] |
| روش تشخیص | آزمایشهای خون[۴] |
| پیشگیری | رابطه جنسی امن، برنامه تعویض سرنگ، ختنه، پیشگیری پیش از در معرض قرارگرفتن، پیشگیری پس از در معرض قرارگرفتن[۴] |
| مدیریت | درمان اچآیوی/ایدز[۴] |
| پیشآگهی | در صورت درمان، امید به زندگی نزدیک به نرمال ۱۱[۵][۶] سال امید به زندگی بدون درمان[۷] |
| فراوانی | در مجموع ۶۴٫۸ تا ۱۱۳ میلیون[۸] ۱٫۳ میلیون مورد جدید (۲۰۲۲)[۸] ۳۹ میلیون نفر که با ابتلا به اچآیوی زندگی میکنند(۲۰۲۲)[۸] |
| مرگها | در مجموع ۴۰٫۴ میلیون نفر[۸] ۶۳۰٬۰۰۰ در سال ۲۰۲۲[۸] |
| طبقهبندی و منابع بیرونی | |
| پیشنت پلاس | HIV/AIDS |
ایدز (به انگلیسی: AIDS) یا سندرم نقص ایمنی اکتسابی (به انگلیسی: Acquired immune deficiency syndrome)، نوعی بیماری است که با ورود ویروس و حمله به دستگاه ایمنی توسط ویروس نقص ایمنی انسانی (HIV) ایجاد میشود.[۹] بیماری ناشی از ویروس HIV دارای سه مرحله اصلی است. در مرحله اول (عفونت حاد)، فرد ممکن است برای مدت کوتاهی بیماری شبه آنفلوآنزایی را تجربه کند (با این حال در همه افراد رخ نمیدهد)، به همین دلیل معمولاً بیماری تا یک دوره طولانی بدون هیچ علائم بهخصوصی دنبال میشود که به این مرحله از بیماری، دوره نهفتگی گفته میشود. هر چقدر که بیماری پیشرفت کند، دستگاه ایمنی بدن ضعیفتر شده و افراد به عفونتهای بیشتری مانند عفونت و سرطانهای فرصتطلب و تومور دچار میشوند. البته معمولاً در افرادی که دستگاه ایمنی آنها به خوبی عمل میکند، بروز کمتری نشان میدهد. در نهایت بیماری زمانی وارد مرحله سوم یا ایدز خواهد شد که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر میرسد.
HIV عمدتاً از طریق آمیزش جنسی (از جمله مقعدی و حتی دهانی) محافظت نشده، انتقال خون آلوده و سرسوزن آلوده و از مادر به فرزند در طول بارداری، زایمان یا شیردهی منتقل میگردد. بعضی از مایعات بدن مانند بزاق و اشک قادر به انتقال HIV نیستند. پیشگیری از عفونت HIV، عمدتاً از طریق آمیزش جنسی امن و تعویض سرنگ، راه حلهایی برای جلوگیری از گسترش این بیماری محسوب میشوند. البته این ویروس با خشک شدن خون آلوده بهطور کامل از بین میرود و دلیل انتقال آن با سرنگ این است که در داخل و سر آن از فاکتورهای ضد انعقادی استفاده شدهاست و همین موضوع سبب میشود خونی که در این بخشهای سرنگ وجود دارند خشک نشده و تازه بماند و مانع از بین رفتن ویروس بشود. در صورت استفادهٔ فرد بیمار از داروهای لازم و بکارگیری روشهای درمانی استاندار احتمال انتقال بیماری حتی از طریق رابطهٔ جنسی بسیار کاهش مییابد.
هیچگونه درمان قطعی یا واکسن وجود ندارد؛ اگر چه درمان ضدویروسی میتواند باعث کاهش دوره بیماری و بازگشت زندگی تقریباً به حالت طبیعی گردد. با وجود این که درمان ضدویروسی خطر مرگ و عوارض ناشی از این بیماری را کاهش میدهد، اما این داروها گرانقیمت بوده و ممکن است با عوارض جانبی همراه باشند.
پژوهشهای ژنتیکی نشان میدهند که HIV در اصل در اوایل قرن بیستم میلادی در غرب آفریقا جهش یافته و پدید آمدهاست. ایدز اولین بار در سال ۱۹۸۱ توسط مرکز کنترل و پیشگیری بیماری (CDC) شناخته شد، در حالی که عامل آن (عفونت HIV) در اوایل آن دهه شناخته شده بود.[۱۰] از زمان کشف آن تا سال ۲۰۰۹، ایدز باعث مرگ ۳۰ میلیون نفر شدهاست. تا سال ۲۰۲۲ حدود ۳۹ میلیون نفر به ایدز مبتلا بودهاند. ایدز به عنوان همهگیری جهانی شناخته میشود که در حال حاضر حوزه شیوع آن بسیار وسیع و در حال گسترش است.
ایدز چه به عنوان یک بیماری و چه به عنوان عاملی برای تبعیض و یا انگ اجتماعی. تأثیر بسیار زیادی بر روی جوامع داشتهاست. همچنین تاثیرات اقتصادی قابل توجهی را در کشورهای درگیر با این بیماری پدید آوردهاست. تصورهای نادرست بسیاری در رابطه با ایدز همچون انتقال ایدز از طریق زندگی روزمره با افراد مبتلا به HIV وجود دارد. این بیماری همچنین موضوع مجادله ادیان بودهاست.
مؤسسه ملی سلامت (NIH) و بنیاد بیل و ملیندا گیتس بودجهٔ ۲۰۰ میلیون دلاری را به برای توسعه جهانی درمان ایدز اختصاص دادند.[۱۱] در حالی که هیچ درمانی یا واکسن اچآیوی وجود ندارد، درمان ضد رتروویروسی میتواند سیر بیماری را کند کرده و منجر به امید به زندگی تقریباً طبیعی شود.[۵][۶] توصیه میشود که این درمان به محض تشخیص بیماری آغاز گردد.[۱۲]
علائم و نشانهها[ویرایش]
عفونت HIV دارای سه مرحله اصلی است: عفونت حاد، دوره نهفتگی و ایدز.[۱۳][۱]
عفونت حاد[ویرایش]
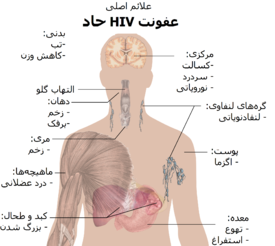
دوره اولیه HIV، عفونت حاد HIV یا سندرم حاد «رترو ویروسی» نامیده میشود.[۱۳][۱۴] بسیاری از افراد ۲ تا ۴ هفته پس از در معرض قرار گرفتن این بیماری، دچار بیماریهایی مانند شبه-آنفلوآنزا یا شبه-مونونوکلئوز میشوند و برخی دیگر هم هیچ نشانه قابل توجهی در آنها دیده نمیشود.[۱۵][۱۶] علائم در ۴۰ تا ۹۰ درصد موارد رخ میدهد و معمولاً شامل تب، لنفادنوپاتی، فارنژیت، خارش پوست، سردرد و/یا زخم دهان و اندام تناسلی میشود.[۱۴][۱۶] خارش پوست که در ۲۰ تا ۵۰ درصد موارد رخ میدهد، خود را بر روی بالاتنه نشان میدهد و به شکل ماکولوپاپولر میباشد.[۱۷] همچنین در این مرحله برخی از افراد دچار عفونتهای فرصتطلب میشوند.[۱۴] ممکن است در دستگاه گوارش علائمی مانند تهوع، استفراغ یا اسهال رخ دهد، و همچنین علائم عصبی نوروپاتی محیطی یا سندرم گیلان-باره نیز محتمل هستند.[۱۶] طول دوره این علائم متفاوت است، اما معمولاً یک یا دو هفته میباشد.[۱۶]
با توجه به اینکه این علائم آنچنان خاص نیستند، اغلب به عنوان نشانههایی از عفونت HIV شناخته نمیشوند. حتی مواردی که توسط یک خانوادگی یا یک بیمارستان دیده میشود اغلب با بسیاری از بیماریهای شایع عفونی با علائمی مشترک با آن اشتباه میشود. بنابراین شایستهاست که عفونت HIV در بیمارانی که دارای عوامل مستعدکننده هستند، مد نظر باشد.[۱۶]
دوره نهفتگی[ویرایش]
پس از علائم اولیه، بیمار وارد مرحلهای به نام دوره نهفتگی یا HIV بینشانه یا HIV مزمن میشود.[۱] این مرحله از HIV میتواند بدون هیچ گونه درمانی از حدود سه سال[۱۸] تا بیش از ۲۰ سال[۱۹] (بهطور متوسط حدود هشت سال)[۲۰] به طول بینجامد که مدت زمان نهفتگی به میزان قدرت سیستم دفاعی فرد دارد. اگرچه معمولاً در ابتدای بیماری هیچ علائمی مشاهده نمیشود یا علامتهای خیلی کمی دیده میشود، اما در نزدیکی پایان این مرحله بسیاری از افراد دچار تب، کاهش وزن، مشکلات گوارشی و دردهای عضلانی میشوند.[۱] همچنین ۵۰ تا ۷۰ درصد از افراد دچار لنفادنوپاتی ماندگار میشوند، بهطوریکه چند گروه از غدد لنفاوی (به جز در کشاله ران) به مدت بیش از سه تا شش ماه بدون هیچ درد و بهطور توجیهناپذیری بزرگ میشود.[۱۳]
اگرچه بسیاری از مبتلایان HIV-1، قابل تشخیص هستند و در صورت عدم درمان نهایتاً سیر بیماری به ایدز منجر خواهد شد، ولی درصد کمی از آنها (حدود ۵٪) سطح بالای سلولهای CD4+ T خود را بدون هیچ درمان ضدویروسی تا بیش از ۵ سال حفظ میکنند.[۱۶][۲۱] این افراد به عنوان کنترلکنندههای HIV طبقهبندی میشوند، و آنهایی که مقدار کم یا نامحسوسی از ویروس را بدون درمان ضدویروسی در بدن خود نگه میدارند به عنوان «کنترلکنندگان ممتاز» یا «سرکوبگران ممتاز» شناخته میشوند.[۲۱]
سندرم نقص ایمنی اکتسابی[ویرایش]

سندرم (نشانگان) نقص ایمنی اکتسابی (ایدز) زمانی معنی پیدا میکند که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد یا بیماریهای خاص مرتبط با عفونت HIV رخ دهد.[۱۶] در غیاب درمان، حدود نیمی از افراد مبتلا به HIV در عرض ده سال مبتلا به بیماری ایدز میشوند.[۱۶] رایجترین وضعیتهایی که هشداری بر وجود ایدز هستند پنومونی ناشی از پنوموسیستیس (۴۰٪)، نزاری به شکل سندرم اتلاف اچآیوی (۲۰٪) و کاندیدیاز مری میباشند. سایر علائم شایع شامل عفونتهای دستگاه تنفسی در یک دوره زمانی معین میشود.[۱۶]
عفونت فرصتطلب ممکن است توسط باکتری، ویروس، قارچ و انگل به وجود بیاید که معمولاً توسط دستگاه ایمنی بدن کنترل میشود.[۲۲] اینکه کدام عفونت رخ میدهد تا حدودی به این بستگی دارد که چه عواملی در محیط اطراف فرد قرار دارد.[۱۶] این عفونت تقریباً میتواند هر دستگاهی از بدن را تحت تأثیر قرار دهد.[۲۳]
افراد مبتلا به ایدز خطر آلودگی به ویروسهای سرطانی مختلفی را دارند از جمله: سارکوم کاپوزی، لنفوم بورکیت، لنفوم اولیه دستگاه عصبی مرکزی، و سرطان گردن رحم.[۱۷] سارکوم کاپوزی، شایعترین سرطانی است که در ۱۰ تا ۲۰ درصد از افراد مبتلا به HIV اتفاق میافتد.[۲۴] پس از آن لنفوم شایعترین سرطان است و علت مرگ نزدیک به ۱۶ درصد از افراد مبتلا به ایدز میباشد و در ۳ تا ۴ درصد از موارد، اولین نشانه ایدز است. هر دوی این سرطانها با ویروس هرپس ۸ انسانی همراه هستند.[۲۴] خیلی اوقات مبتلایان به ایدز به دلیل ارتباطی که با ویروس پاپیلوم انسانی (HPV) دارد، دچار سرطان گردن رحم میشوند.[۲۴] سرطان ملتحمه (لایهای که قسمت داخلی پلکها و قسمت سفید چشم را میپوشاند) نیز در مبتلایان به HIV شایعتر است.[۲۵]
علاوه بر این، آنها بهطور مکرر دچار علائمی مانند تب طولانی، تعریق شبانه، تورم غدد لنفاوی، لرز، ضعف، و کاهش وزن میشوند.[۲۶] اسهال یکی دیگر از علائم شایعی است که ۹۰٪ از افراد مبتلا به ایدز دچار آن میشوند.[۲۷] این افراد همچنین میتوانند تحت تأثیر علائم روانی و عصبی مختلف مستقل از عفونتها و سرطانهای فرصت طلب قرار گیرند.[۲۸]
اختلالات مرتبط[ویرایش]
اختلالات شناختی مرتبط با ایدز/اچایوی[ویرایش]
اختلالات شناختی دستهای از اختلالات روانی است که بر تواناییهای شناختی از جمله یادگیری، حافظه، درک، تمرکز و حل مسئله تأثیر میگذارد.[۲۹] در افراد مبتلا به بیماری ایدز، سلولها بهطور گسترده با HIV آلوده شده و شروع به ترشح نوروتوکسین فعال میکنند؛ در نتیجه، با نفوذ مونوسیتها و ماکروفاژها به سیستم عصبی مرکزی (CNS)، گلیوز، آسیب دیدگی غلاف میلین، ناهنجاریهای سلولهای دندریتیک و تخریب نورونها شکل میگیرد.[۳۰][۳۱] آسیب به سیستم عصبی مرکزی سبب میشود طیفی از اختلالات ذهنی با شدتهای گوناگون مانند اختلال در تمرکز، حافظه، دقت، هماهنگی، حرکت، یادگیری، گفتار و تصمیمگیری تا اختلالات پیشرونده عصبی یا «دمانس ایدز» ایجاد گردد.[۳۲][۳۳] این اختلالات گاهی با مشکل انسوفالوپاتی متابولیکی، ناشی از عفونت HIV نیز همراه است.[۳۴]
اختلالات شناختی مرتبط با ایدز با افزایش عفونت، سطوح پایین سلولهای CD4+ T و بار ویروسی بالا در پلاسما همراه است و گاهی اوقات به عنوان اولین علامت ابتلا به ایدز شناخته میشود.[۳۵]
راههای انتقال[ویرایش]
| طریق انتقال | احتمال سرایت | |||
|---|---|---|---|---|
| انتقال خون | ۹۰%[۳۶] | |||
| زایمان (فرزند) | ۲۵%[۳۷] | |||
| تزریق با سرنگ مشترک | ۰.۶۷%[۳۶] | |||
| فرو رفتن سرسوزن در بدن | ۰.۳۰%[۳۸] | |||
| رابطه جنسی مقعدی (دهنده)* | ۰.۰۴–۳.۰%[۳۹] | |||
| رابطه جنسی مقعدی (واردکننده)* | ۰.۰۳%[۴۰] | |||
| رابطه جنسی آلت-واژن (دهنده)* | ۰.۰۵–۰.۳%[۳۹][۴۱] | |||
| رابطه جنسی آلت-واژن (واردکننده)* | ۰.۰۱–۰.۳۸%[۳۹][۴۱] | |||
| رابطه جنسی دهانی (دهنده)*§ | ۰–۰.۰۴%[۳۹] | |||
| رابطه جنسی دهانی (واردکننده)*§ | ۰–۰.۰۰۵%[۴۲] | |||
| * با فرض عدم استفاده از کاندوم § منبع به رابطه جنسی دهانی انجام شده روی یک مرد اشاره دارد | ||||
HIV از سه طریق اصلی انتقال مییابد:
- تماس جنسی
- قرار گرفتن در معرض خون یا بافت آلوده
- از مادر به فرزند در دوران بارداری، زایمان، یا تغذیه با شیر مادر (که با نام انتقال عمودی شناخته میشود)[۴۳]
هیچ گونه خطر انتقال ویروس از طریق مدفوع، ترشحات بینی، بزاق، خلط، عرق، اشک، ادرار، یا استفراغ وجود ندارد مگر اینکه با خون آلوده شده باشند.[۳۸] همچنین در موارد فرد ممکن است با بیش از یک سویه HIV آلوده شود که به عنوان ابر عفونت HIV شناخته میشود.[۴۴]
تماس جنسی[ویرایش]
شایعترین حالت انتقال HIV از طریق تماس جنسی با فرد آلودهاست.[۴۳] با این حال، یک فرد HIV مثبت که در نتیجه درمان طولانی مدت دارای بار ویروسی غیرقابل شناسایی است، عملاً هیچ خطری برای انتقال HIV از طریق رابطه جنسی ندارد.[۴۵][۴۶] وجود افراد اچآیوی مثبت غیرمسری که از نظر عملکردی تحت درمان ضد رتروویروسی قرار میگیرند، در بیانیه سوئیس در سال ۲۰۰۸ مورد مناقشه قرار گرفت و از آن زمان از نظر منابع معتبر پزشکی پذیرفته شد.[۴۷] از سال ۲۰۱۷، بیشترین انتقال این بیماری در ایالات متحده در میان مردانی بود که با مردان رابطه جنسی داشتند[۴۸][۴۹] (۸۲٪ از تشخیصهای جدید HIV در میان مردان ۱۳ سال به بالاتر و ۷۰٪ از کل تشخیصهای جدید)[۵۰]
در مورد تماس محافظت نشده با جنس مخالف، تخمین خطر انتقال HIV در هر عمل جنسی در کشورهای کم درآمد چهار تا ده برابر بیشتر نسبت به کشورهای با درآمد بالا است.[۴۱] در کشورهای با درآمد کم، خطر ابتلاء از زن به مرد انتقال به ۰٫۳۸٪ در هر بار نزدیکی و از مرد به زن ۰٫۳۰٪ در هر بار نزدیکی تخمین زده شدهاست. این تخمین برای کشورهای با درآمد بالا، ۰٫۰۴٪ در هر بار نزدیکی برای انتقال از زن به مرد و ۰٫۰۸٪ در هر بار نزدیکی از مرد به زن میباشد.[۴۱] خطر انتقال از مقاربت مقعد بیشتر است، و ۱٫۴ تا ۱٫۷ درصد در هر بار نزدیکی با جنس مخالف یا موافق تخمین زده شدهاست.[۴۱] اگرچه خطر ابتلاء از طریق آمیزش جنسی دهانی نسبتاً کم است، اما این احتمال وجود دارد.[۵۱] خطر انتقال از طریق رابطه دهانی «نزدیک به صفر» توصیف شدهاست،[۵۲] اگر چه چند موردی گزارش شدهاست.[۵۳] خطر ابتلاء از طریق سکس دهانی صفر تا ۰٫۰۴ درصد تخمین زده شدهاست.[۳۹] در محیطهایی عمومی مانند روسپیها، خطر انتقال از زن به مرد ۲٫۴٪ در هر بار نزدیکی و از مرد به زن ۰٫۰۵ درصد در هر بار نزدیکی تخمین زده شدهاست.[۴۱]
خطر انتقال در حضور بیماریهای آمیزشی[۵۴] و زخم تناسلی[۴۱] افزایش مییابد. به نظر میرسد زخم تناسلی خطر ابتلاء را تا حدود پنج برابر افزایش میدهد.[۴۱] بیماریهای مقاربتی دیگر مانند سوزاک، کلامیدیا، تریکوموناو واژینوز باکتریال، به نسبت کمتری خطر انتقال را افزایش میدهند.[۳۹]
بار ویروسی از فرد آلوده نیز عامل مهمی است که در انتقال از طریق تماس جنسی (و همچنین از طریق مادر به فرزند) نقش دارد.[۵۵] در طول ۲٫۵ ماه اول از عفونت، میزان سرایت به دلیل بار زیاد ویروسی، ۱۲ برابر بیشتر است.[۳۹] در مراحل آخر عفونت فرد، میزان انتقال در حدود هشت برابر بیشتر است.[۴۱]
رابطه جنسی خشن میتواند یکی از عوامل مؤثر در افزایش خطر انتقال باشد.[۵۶] همچنین گفته میشود تجاوز جنسی خطر انتقال HIV را افزایش میدهد چرا که در این حالت به ندرت از کاندوم استفاده میشود، آسیب فیزیکی واژن یا مقعد محتمل است، و ممکن است خطر بیشتری برای انتقال همزمان عفونتهایجنسی وجود داشته باشد.[۵۷]
خون[ویرایش]

دومین عامل شایع انتقال HIV، از طریق خون و فراوردههای خونی است.[۴۳] از راههایی که ممکن است این بیماری توسط خون منتقل گردد، میتوان استفاده از سرنگ مشترک برای مواد مخدر تزریقی نظیر هروئین، زخم در اثر فرورفتن سرسوزن، انتقال خون آلوده یا فراوردههای خونی، یا تزریقهایی که با استفاده از تجهیزات پزشکی استریل نشده انجام میشود را نام برد. خطر سرنگ مشترک در حین تزریق مواد مخدر بین ۰٫۶۳ و ۲٫۴ درصد و بهطور متوسط ۰٫۸٪ در هر عمل میباشد.[۵۸] خطر انتقال از فرورفتن سرسوزن یک فرد آلوده ۰٫۳٪ در هر عمل (حدود ۱ در ۳۳۳) و خطر آلودگی غشاء مخاطی به خون آلوده ۰٫۰۹٪ در هر عمل (حدود ۱ در ۱۰۰۰) تخمین زده میشود.[۳۸] در ایالات متحده، مصرفکنندگان مواد مخدر تزریقی ۱۲٪ از مبتلایان به HIV در سال ۲۰۰۹ را تشکیل میدادند[۵۹] و در برخی مناطق بیش از ۸۰٪ از افرادی که تزریق مواد انجام میدهد دارای HIV هستند.[۴۳]
در ۹۳٪ موارد استفاده از خون آلوده در انتقال خون، انتقال عفونت خواهد بود.[۵۸] در کشورهای توسعه یافته خطر ابتلاء به HIV از طریق انتقال خون بسیار پایین است (کمتر از یک در پانصد هزار) و در آنها آزمایش HIV بر روی خون اهداکننده انجام میشود.[۴۳] در انگلیس، خطر انتقال یک در پنج میلیون گزارش شدهاست.[۶۰] با این حال، در کشورهای با درآمد پایین، تنها نیمی از خون مورد استفاده برای انتقال ممکن است بهطور مناسب آزمایش شود (در سال ۲۰۰۸).[۶۱] تخمین زده شدهاست که HIV در این مناطق تا ۱۵٪ از طریق انتقال خون آلوده و فراوردههای خونی سرایت مییابد، که نمایانگر ۵٪ تا ۱۰٪ از عفونتهای سرتاسر دنیا است.[۴۳][۶۲]
تزریق غیربهداشتی نقش مهمی در گسترش HIV در کشورهای جنوب صحرای آفریقا دارد. در سال ۲۰۰۷، بین ۱۲ تا ۱۷ درصد از عفونتهای این منطقه به دلیل استفاده از سرنگ نسبت داده شد.[۶۳] سازمان بهداشت جهانی خطر انتقال از طریق تزریق در آفریقا را ۱٫۲٪ تخمین زدهاست.[۶۳]
افرادی که خالکوبی، سوراخکاری و زخمآرایی انجام میدهند از لحاظ نظری در معرض خطر سرایت هستند، اما تاکنون هیچ مورد مستندی مشاهده نشدهاست.[۶۴] پشه و سایر حشرهها قادر به انتقال HIV نیستند.[۶۵]
مادر به فرزند[ویرایش]
انتقال HIV از مادر به فرزند میتواند در دوران بارداری، هنگام زایمان یا از راه شیر مادر انجام شود.[۶۶][۶۷] این راه سومین طریق شایع انتقال HIV در دنیا میباشد.[۴۳] در صورت عدم درمان، خطر انتقال قبل یا در حین تولد حدود ۲۰ درصد و در کسانی که شیر هم بدهند ۳۵ درصد است.[۶۶] در سال ۲۰۰۸، حدود ۹۰٪ موارد HIV کودکان ناشی از انتقال عمودی محاسبه شد.[۶۶] با درمان مناسب خطر ابتلاء به عفونت از مادر به فرزند میتواند به حدود ۱٪ کاهش یابد.[۶۶] درمان از طریق پیشگیری شامل مصرف داروهای ضد ویروسی توسط مادر در دوران بارداری و زایمان، عمل سزارین در زمان مناسب (و نه اضطراری)، عدم تغذیه شیر مادر، و تجویز داروهای ضد ویروسی به نوزاد میشود.[۶۸] با این حال بسیاری از این امکانات در کشورهای در حال توسعه در دسترس نیست.[۶۸] اگر در دوران دندان آوردن، مواد غذایی به خون آلوده شود، میتواند خطر انتقال را افزایش دهد.[۶۴]
ویروسشناسی[ویرایش]

ویروس HIV عامل گسترهای از بیماریها است که با نام ایدز شناخته میشوند. HIV نوعی ویروس پسگرد است که عمدتاً به اجزای دستگاه ایمنی انسان مانند سلولهای CD4+ T، درشتخوارها و سلولهای دندریت سرایت میکند و به صورت مستقیم یا غیرمستقیم سلولهای CD4+ T را از بین میبرد.[۶۹]
HIV عضوی از سرده ویروسهای آهستهگستر،[۷۰] و بخشی از خانواده ویروسان پسگرد است.[۷۱] ویروسهای آهستهگستر خصوصیات ریختشناسی و زیستشناسی مشترک بسیاری دارند. گونههای بسیاری از پستانداران مبتلا به ویروس آهستهگستر میشوند، که مشخصاً دلیل بیماریهای طولانیمدت با دوره کمون طولانی هستند.[۷۲] ویروسهای آهستهگستر به شکل تک رشته، حس مثبت، ویروس آرانای غلافدار منتقل میشوند. پس از ورود به سلول هدف، ژنوم آرانای ویروس توسط آنزیم وارونویس ویروسی که همراه با ژنوم ویروسی در ذرات ویروسی منتقل شده، به یک دیانای دو رشته استاندارد تبدیل میشود. سپس DNA ویروسی وارد هسته سلول میشود و کل DNAهای سلولی را توسط اینتگراز ویروسی فرا میگیرد.[۷۳] وقتی فرا گرفته شد، ویروس ممکن است پنهان شود و این به ویروس و سلولهای میزبانش این امکان را میدهد تا توسط دستگاه ایمنی بدنی شناسایی نشوند.[۷۴] همچنین این ویروس میتواند تکثیر شود و ژنومهای RNA جدیدی تولید کند و پروتئینهای ویروسی که توسط سلول به عنوان هستههای سلولی جدید شدهاند را در چرخهای از نو پدیدآورد.[۷۵]
دو ویروس نوع ایدز تاکنون مشخص شدهاست: HIV-1 و HIV-2.
HIV-1 ویروسی بود که در ابتدا شناخته شد (و در ابتدا به عنوان LAV یا HTLV-III شناخته میشد). هر چه بیشتر بدخیم باشد، بیشتر عفونی میشود.[۷۶] عفونت ضعیفترHIV-2 در مقایسه با HIV-1 افرادی که در معرض HIV-2 هستند کمتر مبتلا به HIV-2 میشوند. از آنجا که HIV-2 توانایی ضعیفی در انتقال دارد، تا حد زیادی محدود به آفریقای غربی میباشد.[۷۷]

اچآیوی، یا ویروس نقص (کمبود) ایمنی و دفاع آدمی، ویروسی دارای پوشش، علاوه بر کپسید، است که اندازهای برابر با ۱۲۵ نانومتر دارد و برای همانندسازی در گلبولهای سفید دستگاه ایمنی بدن انسان مستقر میشود.[۷۸]
نتیجهٔ یک پژوهش عمده از سوی گروهی از پژوهشگران دانشگاه آکسفورد انگلستان نشان میدهد که ویروس اچآیوی در روند فرگشتی (تکاملی) خود، دچار جهش و تحول شده و در مقایسه با گذشته، از میزان خطر، مرگبار بودن و مسری بودن آن کاسته شدهاست. بر اساس این مطالعه، ویروس اچآیوی در حال هماهنگی و تطبیق خود با دستگاه ایمنی بدن انسان بوده و درجهٔ خطر آن در حال کاهش است. بر اساس گزارش منتشر شده از این پژوهش، اکنون فاصلهٔ زمانی بین آلودگی به ویروس و بروز بیماری ایدز بیشتر شده و ممکن است تغییرات تکاملی ایجاد شده در ویروس اچآیوی به نتیجه بخشی اقدامات و تلاشها برای مهار همهگیری گسترده و گسترش ابتلاء به بیماری ایدز یاری رساند. از سوی دیگر، بنا بر یافتههای این پژوهش، داروهای ضد رتروویروس در تضعیف و تحلیل ویروس اچآیوی دارای سهم بودهاند؛ البته اکنون، ضعیفترین نمونههای ویروسی هم کاملاً خطرناک هستند.[۷۹][نیازمند منبع پزشکی] با این حال تحقیقات بیشتر برای بررسی نتایج آن مورد نیاز است.[۴۷]
پاتوفیزیولوژی[ویرایش]

پس از ورود ویروس به بدن، یک دوره سریع تکثیر ویروسی وجود داشته و منجر به بالا رفتن تعداد ویروس در خون اطراف خود خواهد شد. در طی عفونت اولیه، سطح HIV ممکن است به چند میلیون ذره ویروس در هر میلی لیتر خون برسد.[۸۰] این واکنش با کاهش قابل توجهی در تعداد سلولهای در گردش CD4+ T همراه است. این ویروس خونی حاد تقریباً همواره با فعالیت سلولهای CD8+ T در ارتباط است که سلولهای آلوده به HIV را از بین میبرد و سپس آنتیبادی تولید میکند. به نظر میرسد که واکنش سلول CD8+ T در کنترل سطح ویروس مهم باشد، که به اوج رسیده و سپس کاهش مییابد، تا شمار سلولهای CD4+ T به مقدار قبل بازگردد. واکنش یک سلول CD8+ T سالم هر چند که ویروس را از بین نمیبرد اما باعث میشود بیماری با سرعت کمتری پیشرفت کند و بهتر بتوان بیماری را شناسایی کرد.[۸۱]
پاتوفیزیولوژی بیماری ایدز پیچیدهاست.[۸۲] در نهایت، HIV با به تحلیل بردن سلولهای CD4+ T منجر به ایدز شده و باعث تضعیف دستگاه ایمنی بدن و عفونت فرصتطلب میشود. وجود سلولهای T برای واکنش ایمنی ضروری است و بدون آنها، بدن نمیتواند با عفونتها مقابله کند یا سلولهای سرطانی را از بین ببرد. عملکرد کاهش سلولهای CD4+ T در وضعیت حاد و مزمن متفاوت است.[۸۳] در حین وضعیت حاد، سلولهای HIV ناشی از سلولهای عفونی تحلیل رفته و کشته شده توسط سلولهای سمی T، عامل کاهش سلولهای CD4+ T هستند، اگر چه عامل دیگر میتواند مرگ برنامهریزیشده یاخته باشد. در حین وضعیت مزمن، به نظر میرسد که عواقب ناشی از فعالیت کلی دستگاه ایمنی بدن همراه با از دست دادن تدریجی توانایی دستگاه ایمنی بدن برای تولید سلولهای جدید T عامل کاهش تدریجی تعداد سلولهای CD4+ T باشد.[۸۴]
اگر چه علائم نقص دستگاه ایمنی توسط ایدز تا چند سال بعد از عفونت در فرد ظاهر نخواهد شد، ولی کمبود سلولهای CD4+ T در طول هفته اول عفونت، به خصوص در مخاط روده، که منبع اکثریت لنفوسیتهای موجود در بدن است، اتفاق میافتد.[۸۵] دلیل اصلی از دست رفتن سلولهای مخاطی CD4+ T این است که اکثر سلولهای مخاطی CD4+ T نشان دهنده پروتئین CCR5 هستند که HIV از آنها برای دستیابی به سلولها استفاده میکند، در حالی که تنها بخش کوچکی از سلولهای CD4+ T در جریان خون این کار را انجام میدهند.[۸۶]
ویروس HIV به دنبال CCR5 نشانگر CD4+ T میگردد و آنها را از بین میبرد.[۸۷] در نهایت، واکنش شدید دستگاه ایمنی عفونت را کنترل میکند و مرحله نهفتگی بالینی آغاز میگردد. سلولهای CD4+ T در بافت مخاطی باقی میمانند.[۸۷] تکثیر مداوم HIV از وضعیت کلی فعالیت ایمنی حاصل میشود.[۸۸] فعالیت دستگاه ایمنی که نمایانگر افزایش فعالیت سلولهای ایمنی و التهاب سیتوکین است، از فعالیت چندین محصول ژن HIV و واکنش دستگاه ایمنی به تکثیر HIV حاصل میشود. همچنین از کار افتادن دستگاه ایمنی گوارشی به وسیله تکثیر سلولهای مخاطی CD4+ T در طی مرحله عفونی بیماری به این موضوع مربوط میشود.[۸۹]
تشخیص بیماری[ویرایش]

بیماری ایدز و HIV با توجه بروز علایم و نشانههای بیمار، از طریق آزمایش و بررسی آن در آزمایشگاه مورد تشخیص قرار میگیرد.[۱۴] آزمایش HIV به افراد در معرض خطر این بیماری، افراد مبتلا به هر نوع بیماری آمیزشی و زنان باردار توصیه میشود.[۱۷][۹۰] در بسیاری از مناطق دنیا، یک سوم حاملان HIV زمانی متوجه بیماری خود میشوند که در مرحله پیشرفتهای از این بیماری قرار دارند و به AIDS یا نقص شدید دستگاه ایمنی مبتلا شدهاند.[۱۷]
آزمایش HIV[ویرایش]
| آزمایش خون | تعداد روزها |
|---|---|
| آزمایش آنتیبادی (آزمایش سریع، الایزا نسل سوم) | ۲۳–۹۰ |
| آزمایش آنتیبادی و آنتیژن پی۲۴ (الایزا نسل چهارم) | ۱۸–۴۵ |
| پیسیآر | ۱۰–۳۳ |
بهطور کلی برای تشخیص ابتلا به اچآیوی/ایدز، سه گروه اصلی آزمایش وجود دارد.[۹۲][۹۳] این سه نوع، عبارتند از آزمون آنتیبادی (پادتن)، آزمون آنتیژن و آزمون سنجش مقدار. در آزمون آنتیبادی، وجود آنتیبادی یا پادتن تولید شده و ترشح شده در خون توسط گلبولهای سفید دستگاه ایمنی بررسی میشود. در آزمون آنتیژن، خون از نظر حضور خود ویروس مورد بررسی قرار میگیرد. آزمایش آنتیبادی یا پادتن دو گونهٔ اصلی است که عبارتند از «الیزا» (Elisa) و وسترن بلات (Western blot). اگر در آزمایش «الیزا»، نتیجهٔ مثبت بدست آید، برای اطمینان و نتیجهٔ قطعی، باید آزمون وسترن بلات هم انجام شود. در مجموعهٔ آزمایشهای آنتیبادی، آزمایش سریع یا رپید تست (Rapid test) نیز وجود دارد که نتیجهٔ آن در ۱۰ تا ۲۰ دقیقه آماده میشود و برای اطمینان، باید دو بار انجام شود و یک نتیجهٔ مثبت یا منفی، دو بار به دست آید. آزمایشهای آنتیژن نیز دو گروه هستند: RT-PCR و P24. آزمایش «پی.سی. آر»، ژنوم ویروس در خون فرد را مورد بررسی قرار میدهد و اندکی گرانتر است و امکان جواب کاذب نیز در آن وجود دارد.[۹۴]
در اکثر افراد آلوده به HIV، در طول سه تا دوازده هفته پس از عفونت اولیه، یک سری آنتیبادیهای خاص ایجاد میگردد.[۱۶] تشخیص اولیه HIV قبل از تغییر آنتیبادی، با اندازهگیری اچآیوی-آرانای یا آنتیژن P24 انجام میشود.[۱۶] نتایج مثبت به دست آمده توسط آنتیبادی یا آزمایش واکنش زنجیرهای پلیمراز (PCR)، توسط PCR یا توسط آنتیبادی دیگری تأیید میشوند.[۱۴] بهطور معمول پس از گذشت سه ماه (و گاه در برخی موارد نادر، حتی تا شش ماه) از آخرین رویدادی که مشکوک به انتقال ویروس به بدن فرد است، با این حال آزمایش دومی نیز بعد از سهماهه دوم نیاز است تا نتیجهٔ منفی اطمینانآور باشد.[۹۵][۹۶]
آزمایش آنتیبادی در کودکان کمتر از ۱۸ ماه، به دلیل وجود مداوم آنتیبادیهای مادری معمولاً نتیجه درستی نمیدهد.[۹۷] بنابراین عفونت HIV تنها توسط آزمایش PCR مربوط به HIV RNA یا DNA یا از طریق آزمایش آنتیبادی P24 قابل تشخیص است.[۱۴] در اکثر نقاط دنیا دسترسی به آزمایش PCR قابل اعتماد وجود ندارد و افراد باید تا زمانی صبر کنند که علائم پیشرفت کند یا سن کودک به اندازه کافی باشد و آزمایش آنتیبادی درستی نتیجه دهد.[۹۷] در کشورهای جنوب صحرای آفریقا در بین سالهای ۲۰۰۷ و ۲۰۰۹، بین ۳۰ تا ۷۰ درصد افراد، از وضعیت HIV خود آگاه بودهاند.[۹۸] در سال ۲۰۰۹، بین ۳٫۶ تا ۴۲ درصد مردان و زنان کشورهای مختف جهان مورد آزمایش قرار گرفتند که کمترین میزان آزمایش (۳٫۶ درصد) متعلق به جمعیت مردان ماداگاسکار و بیشترین آن (۴۲ درصد) جمعیت متعلق به زنان لسوتو بودهاست.[۹۸] این ارقام نشان دهنده افزایش قابل توجهی نسبت به ده سال گذشتهاست.[۹۸]
طبقهبندی عفونت HIV[ویرایش]
از دو طبقهبندی اصلی برای مرحلهبندی HIV و ایدز استفاده میشود، یکی توسط سازمان بهداشت جهانی[۱۴] (WHO) و دیگر توسط مرکز کنترل و پیشگیری بیماری[۹۹] (CDC). برنامه CDC بیشتر در کشورهای توسعهیافتهاستفاده میشود. از آنجا که برنامه WHO احتیاجی به آزمایش ندارد، بیشتر مناسب کشورهای در حال توسعهاست که با کمبود لوازم روبرو هستند. علیرغم تفاوتهای که این دو با هم دارند، اما میتواند هر دوی آنها را از لحاظ آماری مقایسه نمود.[۱۳][۱۴][۹۹]
سازمان بهداشت جهانی برای اولین بار در سال ۱۹۸۶ تعریفی برای ایدز ارائه نمود.[۱۴] از آن زمان به بعد، مرحلهبندی WHO برای چندین بار تغییر کرده و گسترش یافت، که نسخهٔ اخیر آن که در سال ۲۰۰۷ منتشر شدهاست.[۱۴] ردهبندی مراحل تعیین شده توسط WHO به شکل زیر است:
- عفونت اولیه HIV: که یا بدون علامت است یا همراه با سندرم حاد ویروسی است.[۱۴]
- مرحله ۱: عفونت HIV بدون علامت با تعداد سلولهای CD4 بیش از ۵۰۰ در هر میکرولیتر. ممکن است شامل بزرگ شدن گرههای لنفاوی نیز باشد.[۱۴]
- مرحله ۲: علائم خفیف که ممکن است تغییر جزئی غشاء مخاطی و عود عفونت دستگاه تنفسی فوقانی را شامل شود و تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر است.[۱۴]
- مرحله ۳: علائم پیشرفته که ممکن است شامل اسهال مزمن و غیرعادی برای بیش از یک ماه شود، به همراه عفونتهای باکتریایی شدید از جمله سل ریوی و همچنین تعداد سلولهای CD4 کمتر از ۳۵۰ در هر میکرولیتر.[۱۴]
- مرحله ۴ یا ایدز: علائم شدیدی شامل توکسوپلاسموز مغز، کاندیدیاز مری، نای، نایژه یا شش و سارکوم کاپوزی. تعداد سلولهای CD4 به کمتر از ۲۰۰ در هر میکرولیتر میرسد.[۱۴]
مرکز کنترل و پیشگیری بیماری آمریکا نیز ایجاد یک سیستم طبقهبندی برای HIV ارائه نموده و آخرین بار آن را در سال ۲۰۰۸ به روزرسانی کردهاست.[۹۹] در این سیستم عفونت HIV بر اساس شمارش CD4 و علائم بالینی میباشد،[۹۹] عفونت را در سه مرحله توصیف میکند:
- مرحله ۱: تعداد سلولهای CD4 بیشتر از ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۲: تعداد سلولهای CD4 بین ۲۰۰ تا ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۳: تعداد سلولهای CD4 کمتر از ۲۰۰ در هر میکرولیتر یا وجود علائمی از ایدز
- نامعلوم: اگر اطلاعات کافی برای هر یک از مراحل فوق در دسترس باشد
اگر پس از درمان، تعداد سلولهای CD4 خون به بیش از ۲۰۰ در هر میکرولیتر افزایش یابد یا بیماری دیگری به جز ایدز احتمال رود یا حتی درمان گردد هنوز هم تشخیص اینکه بیماری ایدز بوده باشد پابرجا خواهد بود.[۱۳]
پیشگیری[ویرایش]

تماس جنسی[ویرایش]
استفاده همیشگی از کاندوم در طولانی مدت، حدوداً ۸۰ درصد خطر انتقال HIV را کاهش میدهد.[۱۰۰] هنگامی که از بین زن و مرد، یکی از طرفین مبتلا شود، در صورتی که بهطور مداوم از کاندوم استفاده شود، احتمال ابتلاء به HIV برای فرد غیرآلوده در هر سال زیر ۱٪ است.[۱۰۱] برخی از شواهد نشان میدهد که کاندوم زنانه هم میتواند در همان سطح از انتقال بیماری محافظت کند.[۱۰۲] به نظر میرسد استفاده از ژل واژینال حاوی تنوفوویر بلافاصله قبل از رابطه جنسی، میزان ابتلاء را تا حدود ۴۰ درصد در میان زنان آفریقایی کاهش میدهد.[۱۰۳] در مقابل، استفاده از اسپرمکش نونوکسینول-۹، به دلیل ایجاد سوزش در واژن و «رکتوم» میتواند خطر انتقال را افزایش دهد.[۱۰۴]ختنه در آفریقای سیاه، خطر ابتلاء به HIV توسط مردان دگرجنسگرا را بین ۳۸٪ و ۶۶٪ در بیش از ۲۴ ماه کاهش میدهد.[۱۰۵] بر پایه این مطالعات، سازمان جهانی بهداشت و UNAIDS، ختنه مرد را به عنوان یکی از روشهای پیشگیری انتقال HIV از زن به مرد در سال ۲۰۰۷ توصیه کردهاند.[۱۰۶] در این که آیا این کار باعث محافظت انتقال بیماری مرد به زن نیز میشود[۱۰۷][۱۰۸] یا اینکه که به نفع کشورهای توسعهیافته و در میان مردانی که با همجنس خود رابطه برقرار میکنند نیز مؤثر است، مناقشه وجود دارد.[۱۰۹][۱۱۰][۱۱۱] زنانی که مورد ختنه قرار میگیرند، بیشتر در معرض خطر انتقال HIV قرار دارند.[۱۱۲]
به نظر نمیرسد که برنامههایی که پرهیز جنسی را تشویق میکنند بتوانند در مقابل خطر HIV مؤثر باشند.[۱۱۳] شواهد نشان میدهند که آموزش دوطرفه به همان اندازه ضعیف است.[۱۱۴] همچنین آموزش مسائل جنسی در مدارس نیز میتواند رفتار پرخطر را کاهش دهد.[۱۱۵] اقلیت قابل توجهی از جوانان با اینکه نسبت به خطرات HIV و ایدز آگاه هستند، اما با این حال همچنان دست به کارهایی میزدند که پرخطر محسوب میشوند.[۱۱۶] بررسیها نشان داده مشاوره داوطلبانه و آزمایش اچآیوی، بر رفتار پرخطرافرادی که آزمایش آنها منفی است تأثیر نمیگذارد، اما استفاده از کاندوم را در افرادی که آزمایش آنها مثبت شدهاست، افزایش میدهد.[۱۱۷] به نظر میرسد افزایش خدمات مشاوره خانواده احتمال استفاده زنان مبتلا به HIV از راههای پیشگیری از بیماری را افزایش میدهد.[۱۱۸]م شخص نیست که آیا درمان سایر بیماریهای مقاربتی در پیشگیری از HIV مؤثر باشد یا خیر.[۵۴]
پیش از در معرض قرار گرفتن[ویرایش]
درمان زودهنگام افراد مبتلا به HIV با ضدویروس، تا ۹۶ درصد از سرایت شریک آنها جلوگیری میکند.[۱۱۹][۱۲۰] درمان ضد رتروویروسی در میان افراد مبتلا به HIV که تعداد CD4 آنها کمتر از ۵۵۰ سلول در میکرولیتر بوده، یک راه بسیار مؤثر برای جلوگیری از عفونت HIV شریک زندگی آنها است (راهبردی که به عنوان درمان به هدف پیشگیری یا TASP شناخته میشود).[۱۲۱] TASP با کاهش ۱۰ تا ۲۰ برابری خطر انتقال این ویروس همراه است.[۱۲۲] پیشگیری پیش از در معرض قرارگرفتن با دوز معینی در روز از داروی تنوفوویر به همراه یا بدون امتریسیتابین، در افراد در معرض خطر از جمله مردانی که با مردان رابطه جنسی دارند، زوجهایی که یکی از آنها HIV مثبت است و دگرجنسگرایان جوان در آفریقا مؤثر است.[۱۰۳][۱۲۳] همچنین یک مطالعه نشان داد این روش ممکن است خطر ابتلا در مصرفکنندگان مواد مخدر داخل وریدی را ۰٫۷ تا ۰٫۴ در هر ۱۰۰ نفر سال کاهش دهد.[۱۲۴] USPSTF، در سال ۲۰۱۹، پیش معرض قرارگیری را به افرادی که در معرض خطر ابتلا هست توصیه کرد.[۱۲۵]
به نظر میرسد اقدامات احتیاطی جهانی در محیط مراقبتهای بهداشتی بر روی کاهش خطر HIV مؤثر است.[۱۲۶] اعتیاد به مواد مخدر تزریقی عامل مهم دیگری است و راهبردهای کاهش آسیب مانند تعویض سرنگ و درمانهای جایگزین موادمخدر ظاهراً در کاهش خطر انتقال مؤثر بودهاند.[۱۲۷][۱۲۸]
پس از در معرض قرار گرفتن[ویرایش]
پیشگیری پس از در معرض قرارگرفتن، دوره استفاده از آنتی «رتروویرال» (ضدویروس-آنتی «رترو ویروس») است که در طول ۴۸ تا ۷۲ ساعت پس از در معرض قرار گرفتن خون یا ترشحات تناسلی آلوده به HIV تجویز شده باشد.[۱۲۹][۱۳۰] استفاده از زیدوودین به تنهایی خطر ابتلاء به عفونت HIV از طریق تزریق سرنگ را تا پنج برابر کاهش میدهد.[۱۳۰] این درمان بعد از تجاوز جنسی و هنگامی که فرد متجاوز به عنوان مبتلا به HIV شناخته شده توصیه میشود، جای بحث دارد. اما در مواقعی که وضعیت HIV نامعلوم است،[۱۳۱] برنامههای درمانی فعلی معمولاً از لپیناویر/ریتوناویر و لمیودین/زیدوودین یا تنوفوویر/امتریسیتابین برای درمان استفاده میکنند و میتواند خطر را به میزان بیشتری کاهش دهند.[۱۳۰] طول دوره درمان معمولاً چهار هفته است[۱۳۲] و اغلب با عوارض جانبی (در حدود ۷۰٪ از موارد زیدوودین که شامل ۲۴٪ تهوع، ۲۲٪ خستگی، ۱۳ درصد روانپریشی و ۹٪ سردرد میشود) همراه هستند.[۳۸]
مادر به فرزند[ویرایش]
برنامههای جلوگیری از انتقال HIV از مادر به فرزند میتواند سرعت انتقال را به اندازه ۹۲ تا ۹۹ درصد کاهش دهند.[۶۶][۱۲۷] این دوره اساساً شامل استفاده از داروهای ضدویروسی به صورت ترکیبی در دوره حاملگی و بعد از زایمان در بچه میشود و ترجیحاً باید به جای شیردهی از شیشه شیر استفاده شود.[۶۶][۱۳۳] اگر تغذیه جایگزین قابل قبول، امکانپذیر، مقرون به صرفه، پایدار و ایمن باشد، مادران باید از شیردهی به نوزادان خود خودداری کنند، با این حال در صورتی که موردی نباشد، شیر مادر در ماههای اول بسیار توصیه میشود.[۱۳۴] اگر تغذیه شیر فقط توسط مادر انجام شود، دوره پیشگیری طولانی مدت ضد ویروسی به نوزاد خطر انتقال را کاهش میدهد.[۱۳۵]
واکسیناسیون[ویرایش]
تاکنون (اول آوریل سال ۲۰۱۹) هیچ گونه واکسن مؤثری برای ایدز کشف نشدهاست.[۱۳۶][۱۳۷]اگرچه در سالهای اخیر، پیشرفتهایی در طراحی، تولید اولیه و آزمایشهای نخستینِ واکسنهایی برای پیشگیری از ابتلا به اچآیوی/ایدز حاصل شدهاست، اما هنوز واکسن تأیید شده، تضمینی و دارای پشتوانهٔ کافی حاصل از کارآزمایی بالینی و پژوهشهای اطمینانبخش، برای اچآیوی/ایدز وجود ندارد، و نمونههای تولید شده در مراحل اولیه آزمایش و کارآزمایی هستند و تا اخذ تأییدیههای نهایی و ورود به بازار، راه درازی در پیش دارند.[۱۳۸][۱۳۹][۱۴۰][۱۴۱][۱۴۲][۱۴۳][۱۴۴][۱۴۵][۱۴۵][۱۴۶][۱۴۷][۱۴۸][۱۴۹][۱۵۰] در واکسن آزمایشی RV 144 که در سال ۲۰۰۹ منتشر شد کاهش جزئی تقریباً ۳۰٪ در خطر انتقال مشاهده شد، که باعث ایجاد امیدی در جامعه تحقیقای برای یک واکسن مؤثر شد.[۱۵۱] آزمایشهای بیشتری بر روی واکسن RV 144 در حال انجام است.[۱۵۲][۱۵۳]
بتازگی مرکز پیشگیری و کنترل بیماریهای آمریکا اعلام کرد که داروی تراوادا (Truvada) به عنوان یکی از داروهای پیشگیری از ویروس HIV، مرحله آزمایشی خود را با موفقیت پشت سر گذاشت. این دارو در مراحل آزمایشگاهی خود توانستهاست خطر ابتلا به عفونت HIV را در افرادی که در معرض خطر این ویروس قرار داشتند، تا ۹۲ درصد کاهش دهد.[۱۵۴][۱۵۵]
درمان[ویرایش]
در حال حاضر هیچ نوع درمان یا واکسن اچآیوی مؤثری برای این بیماری ساخته نشدهاست. معالجه شامل درمان از طریق مقابله با بازگشت ویروس (HAART) است که روند پیشروی بیماری را کند میکند.[۱۵۶] از سال ۲۰۱۰ بیش از ۶٫۶ میلیون نفر در کشورهای با درآمد پایین یا متوسط مبتلا به این بیماری شدهاند.[۱۵۷] همچنین درمان این بیماری شامل درمانهای پیشگیرانه و مداوم برای عفونتهای مترصد است.
درمان از طریق مقابله با ویروس[ویرایش]
گزینههای فعلی HAART ترکیبی (یا «امتزاجی») از حداقل سه دارو است که دست کم دو نوع، یا «گونه»، عامل مقابله با بازگشت ویروسی را شامل میشود.[۱۵۸] درمان اولیه نوعاً یک مهارکننده ترانس «کریپتاز» معکوس آنالوگ غیر نوکلئوزیدی (NNRTI) به اضافه دو مهارکننده ترانس «کریپتاز» معکوس آنالوگ نوکلئوزیدی (NRTIs) است.[۱۵۸] NRTIs معمولاً شامل: زیدوودین (AZT) یا تنوفوویر (TDF) و لامیوودین (3TC) یا امتریسیتابین (FTC) است.[۱۵۸] ترکیب این عوامل که شامل مهارکننده پروتئازها (PI) میباشد و در صورتی که دستور بالا کارایی لازم را نداشته باشد مورد استفاده قرار میگیرد.[۱۵۸]
زمان شروع درمان مقابله با بازگشت ویروس مورد مناقشه است.[۱۷][۱۵۹] هم سازمان بهداشت جهانی، هم دستورالعملهای اروپایی و هم ایالت متحده آمریکا استفاده از درمان مقابله با بازگشت ویروس را در تمام افراد نوجوان، بزرگسال و زنان بارداری توصیه میکنند که CD4 آنها کمتر از ۳۵۰ میکرولیتر است یا بدون توجه به CD4 نشانههای بیماری را دارند.[۱۷][۱۵۸] این واقعیت که شروع درمان در این سطح خطر مرگ و میر را کاهش میدهد از این توصیه پشتیبانی میکند.[۱۶۰] علاوه بر این آمریکا این درمان را برای همه افراد آلوده به ویروس HIV بدون در نظر گرفتن CD4 و علایم آنها توصیه میکند، اگرچه، این توصیه را برای افرادی که میزان CD4 آنها بیشتر است با اطمینان کمتری تجویز میکند.[۱۶۱] این درحالی است که سازمان بهداشت جهانی این درمان را برای افراد مبتلا به بیماری سل و مبتلایان به هپاتیت ب مزمن و فعال پیشنهاد میکند.[۱۵۸] پیشنهاد میشود زمانی که این درمان آغاز شد بدون وقفه یا «تعطیلی» ادامه یابد.[۱۷] در بسیاری از افراد بیماری زمانی تشخیص داده میشود که زمان ایدئال آغاز درمان از دست رفتهاست.[۱۷] نتیجه مطلوب درمان این است که در مدت زمان طولانی تعداد پلاسمای HIV-RNA زیر ۵۰ کپی بر میلیلیتر باشد.[۱۷] توصیه میشود سطوح تعیینکننده مؤثر بودن درمان در وهلهٔ اول بعد از چهار هفته اندازهگیری شوند و زمانی که سطوح به پایینتر از ۵۰ کپی بر میلیلیتر رسید معمولاً کنترل آن هر سه تا شش ماه یک بار کافی خواهد بود.[۱۷] به نظر میرسد که در کنترل ناموثر چیزی بیش ۴۰۰ کپی بر میلیلیتر دیده خواهد شد.[۱۷] بر اساس این معیار در بیش از ۹۵٪ از افراد درمان در سال اول مؤثر خواهد بود.[۱۷]
مزیتهای درمان شامل کاهش خطر پیشروی ایدز و کاهش خطر مرگ میباشد.[۱۶۲] همچنین در کشورهای در حال توسعه درمان باعث بهبود اوضاع جسمی و سلامت روحی فرد میشود.[۱۶۳] در صورت اقدام به درمان تا ۷۰٪ خطر ابتلاء به سل کاهش خواهد یافت.[۱۵۸] مزیتهای دیگر درمان شامل کاهش خطر انتقال بیماری به شریک جنسی و کاهش امکان انتقال از مادر به فرزند میباشد.[۱۵۸] تأثیر درمان تا حد زیادی به انطباق بستگی دارد.[۱۷] دلایل عدم انطباق عبارتند از: دسترسی معدود به مراقبتهای پزشکی،[۱۶۴] عدم حمایتهای اجتماعی کافی، بیماری روانی و سوء مصرف مواد.[۱۶۵] همچنین پیچیدگی روشهای درمانی (به دلیل تعدد قرصها و دوزها) و اثرات جانبی آنها ممکن است موجب عدم تابعیت اختیاری فرد شود.[۱۶۶] البته در کشورهای با درآمد کم تابعیت از درمان افراد به خوبی کشورهایی است که افراد آن درآمد بالایی دارند.[۱۶۷]
عوارض جانبی خاص به داروی مصرفی مربوط میشوند.[۱۶۸] رایجترین آنها عبارتند از: سندرم دیستروفی، دیسلیپیدمی و مرض قند که به ویژه با مهارکنندههای پروتئاز عارض میشوند.[۱۳] سایر علائم شایع عبارتند از: اسهال،[۱۶۸][۱۶۹] و افزایش خطر ابتلاء به بیماری قلبی-عروقی.[۱۷۰] البته عوارض جانبی برخی از درمانهای پیشنهاد شده اخیر کمتر هستند.[۱۷] مشکل برخی از داروها ممکن است گرانقیمت بودن آنها باشد.[۱۷۱] البته، از سال ۲۰۱۰، ۴۷٪ کسانی که به این داروها احتیاج پیدا میکنند متعلق به کشورهای با درآمد کم یا متوسط هستند.[۱۵۷] برخی از داروها میتوانند موجب بیماری مادرزادی بشوند و بنابراین برای زنانی که امید به بچهدار شدن دارند مناسب نیست.[۱۷]
درمانهای پیشنهادی برای کودکان تا حدی متفاوت از درمان بزرگسالان است. در کشورهای در حال توسعه، از سال ۲۰۱۰، ۲۳٪ کودکانی که نیاز به معالجه داشتهاند تحت درمان قرار گرفتهاند.[۱۷۲] هم سازمان بهداشت جهانی و هم ایالت متحده آمریکا توصیه میکنند که همه کودکان کمتر از دوازده ماه تحت درمان قرار بگیرند.[۱۷۳][۱۷۴] ایالت متحده برای کودکانی که بین یک تا پنج سال هستند توصیه میکند که آنهایی تحت درمان قرار بگیرند که میزانHIV RNA آنها بیشتر از ۱۰۰٫۰۰۰ کپی بر میلیلیتر باشد، و کودکانی که سن آنها بالای پنج سال است زمانی که تحت درمان قرار بگیرند که میزان CD4 آنها کمتر از ۵۰۰ در هر میکرولیتر باشد.[۱۷۳]
در سال ۲۰۱۴ محققان دانشگاه آرهوس در دانمارک، تلاش کردند از رومیدپسین برای بیرون کشیدن ویروس اچآیوی (ویروس ایدز) از مخفیگاه به هنگام پنهان شدن آن در مقابل داروهای ضد ویروس و دستگاه ایمنی، استفاده کنند تا با فعال کردن ویروس پنهان شده، از باقی ماندن ویروسهای غیرفعال پنهان در بدن به هنگام درمان ضد ویروسی جلوگیری کنند.[۱۷۵]
عفونتهای فرصتطلب[ویرایش]
اقدامات انجام شده در جهت جلوگیری از عفونتهای فرصتطلب در بسیاری از افراد مبتلا به ایدز مؤثر میباشد. غالباً درمانهای ضد ویروسی عفونتهای فرصتطلب موجود را بهبود میدهند و همچنین باعث کاهش خطر ابتلاء به آن در آینده میشوند.[۱۶۸] پیشنهاد میشود افرادی که در معرض ابتلاء به HIV هستند قبل از ابتلاء به عفونت خود را در برابر، هپاتیت آ و ب واکسینه کنند، اگرچه بعد از عفونت نیز میتوانند این کار را انجام دهند.[۱۷۶] توصیه میشود برای نوزادان بین چهار تا شش هفته و نوزادانی که دوره استفاده از شیر مادر آنها به پایان رسیده و مادران آنها مبتلا به HIV، در موارد محدود از درمان پیشگیرانه تری متوپریم/سولفامتوکسازول استفاده شود.[۱۷۲] همچنین این دارو برای جلوگیری از PCP در افرادی که اندازه CD4 آنها کمتر از ۲۰۰ سلول بر میکرولیتر است و در کسانی که در حال حاضر یا قبلاً PCP داشتهاند توصیه میشود.[۱۷۷] به افرادی که از ایمنی قابل توجهی برخوردار هستند نیز توصیه میشود تا برای جلوگیری از ابتلاء به توکسوپلاسموز و مننژیت کریپتوکوکوس از درمان پیشگیرانه بهرهمند شوند.[۱۷۸] بین سالهای ۱۹۹۲ و ۱۹۹۷اقدامات مناسب پیشگیرانه میزان ابتلاء به این عفونتها را تا ۵۰٪ کاهش داده بود.[۱۷۹]
داروهای جایگزین[ویرایش]
در آمریکا، تقریباً ۶۰٪ افراد مبتلا به HIV از اشکال مختلف داروهای مکمل یا جایگزین استفاده میکنند.[۱۸۰] البته مؤثر بودن اکثر این درمانها تأیید نشدهاست.[۱۸۱] با توجه به مشاوره رژیم غذایی، برخی از شواهد نشان میدهند که مصرف ریزخوراکهای مکمل سودمند است.[۱۸۲] شواهد تجربی و آزمایشها نشان دادهاند که مکملهایی که دارای سلنیم هستند نیز فایده مند هستند.[۱۸۳] شواهدی وجود دارند که نشان میدهند مصرف مکمل ویتامین آ در کودکان میزان مرگ و میر را کاهش داده و روند رشد را بهبود میبخشد.[۱۸۲] در آفریقا در زنان باردار و شیرده که در معرض خطر کمبود مواد مغذی هستند مصرف مولتی ویتامین منجر به بهبود وضعیت مادر و فرزند شدهاست.[۱۸۲] سازمان بهداشت جهانی مصرف غذایی ریز خوراکها در سطوح RDA بزرگسالان مبتلا به HIV را توصیه میکند.[۱۸۴][۱۸۵] سازمان بهداشت جهانی اعلام کردهاست که تحقیقات متعدد نشان دادهاند مکمل ویتامین آ، روی و آهن میتواند باعث بروز عوارض HIV در بزرگسالان مبتلا به این بیماری شود.[۱۸۵] شواهد کافی برای حمایت از مصرف داروهای گیاهی وجود ندارد.[۱۸۶]
نتایج بررسیهایی که بهطور همزمان در نشریات (Science) و (Nature) به چاپ رسیدهاست، نشان میدهد یک داروی آزمایشی ضدالتهاب که توسط شرکت ورتکس (Vertex) تولید شدهاست و پیش از این روی مبتلایان به بیماری صرع آزمایش شدهاست احتمالاً به عنوان داروی جدید ضد ایدز نیز قابل استفاده است. دانشمندان سالها تصور میکردند ویروس ایدز با حمله مستقیم، سلولهای ایمنی را میکشد و بر سازوکار دی ان ای آنان مسلط میشود و از آن برای تکثیر خودش استفاده میکند؛ ولی این مسئله تنها برای درصد اندکی از سلولهای ایمنی (CD4T) اتفاق میافتد. چراکه بررسیها نشان دادهاست زمانی که سلولهای ایمنی (CD4T) به ویروس ایدز حمله میکنند و نمیتوانند آن را از بین ببرند، نوعی پروتئین تولید میکنند و این پروتئین آنزیمی به نام «کاسپاس» -۱ (caspase-۱)را فعال میکند و این آنزیم، سبب خودکشی سلولها میشود. به گفتهٔ وارنر گرین پژوهشگری که این تحقیق را انجام دادهاست: از بین رفتن سلولهای ایمنی سی دی۴ تی بیش از آن که به علت حمله ویروس ایدز باشد ناشی از سیستم خودایمنی آنها است. دانشمندان از داروی شرکت ورتکس برای جلوگیری از فعال شدن این آنزیم «کاسپاس» -۱ کمک میگیرند.[۱۸۷]
پیشبینی[ویرایش]
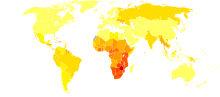
بدون داده ≤ ۱۰ ۱۰–۲۵ ۲۵–۵۰ ۵۰–۱۰۰ ۱۰۰–۵۰۰ ۵۰۰–۱۰۰۰ | ۱۰۰۰–۲۵۰۰ ۲۵۰۰–۵۰۰۰ ۵۰۰۰–۷۵۰۰ ۷۵۰۰–۱۰۰۰۰ ۱۰۰۰۰–۵۰۰۰۰ ≥ ۵۰۰۰۰ |
ایدز در بسیاری از مناطق دنیا بیشتر به عنوان یک بیماری مزمن شناخته میشود تا یک بیماری عفونی کشنده.[۱۸۸] شیوع آن بین افراد متفاوت بوده، و هر دوی شمار سلولهای CD4 و بار ویروسی برای پیشبینی نتایج مفید هستند.[۱۶] بدون درمان، مدت زمان زنده ماندن پس از عفونت HIV بهطور متوسط ۹ تا ۱۱ سال تخمین زده میشود، که به نوع HIV نیز بستگی دارد.[۷] پس از تشخیص ایدز، اگر درمان در دسترس نباشد، مدت زنده ماندن بین ۶ تا ۱۹ ماه خواهد بود.[۱۸۹][۱۹۰] HAART و پیشگیری مناسب از عفونتهای فرصت طلب میزان مرگ و میر را تا ۸۰٪ کاهش میدهد، و امید به زندگی برای یک فرد بالغ ۲۰ تا ۵۰ سال را افزایش میدهد.[۱۸۸][۱۹۱][۱۹۲] این مقدار بین دو سوم[۱۹۱] و تقریباً کل جمعیت است.[۱۷][۱۹۳] اینکه درمان دیرهنگام بعد از تشخیص عفونت آغاز گردد خوب نیست،[۱۷] برای نمونه اگر درمان پس از تشخیص ایدز آغاز گردد، امید به زندگی ۱۰ تا ۴۰ سال خواهد بود.[۱۷][۱۸۸] نیمی از کودکانی که مبتلا به HIV به دنیا میآیند بدون درمان قبل از دو سالگی میمیرند.[۱۷۲]
عوامل اصلی مرگ با ایدز، عفونت فرصتطلب و سرطان میباشد، هر دوی آنها در خیلی از موارد نتیجه از کارافتادگی تدریجی دستگاه ایمنی میباشند.[۱۷۹][۱۹۴] به نظر میرسد که وقتی شمار سلولهای CD 4 به کمتر از ۵۰۰ در هر میکرولیتر برسد، خطر سرطان افزایش مییابد.[۱۷] میزان پیشرفت بالینی بیماری در هر فرد متفاوت است و ثابت شدهاست که تحت تأثیر عواملی چون مستعد بودن فرد، عملکرد دستگاه ایمنی،[۱۹۵] دسترسی آنها به موسسههای بهداشت و حضور عفونتهای دیگر میباشد،[۱۸۹][۱۹۶] و همچنین گونه (یا گونههای) بخصوصی از ویروس را شامل میشود.[۱۹۷][۱۹۸]
سل یکی از عوامل عمده بیماری و مرگ مبتلایان به ایدز است و در یک سوم افراد مبتلا به HIV ظاهر میشود و علت مرگ ۲۵ درصد موارد HIV میباشد.[۱۹۹] همچنین HIV مهمترین عامل ابتلاء به سل میباشد.[۲۰۰] هپاتیت سی عفونت رایج دیگری است که هر بیماری پیشرفت بیماری دیگر را افزایش میدهد.[۲۰۱] دو سرطان رایجی در ارتباط با ایدز، سارکوم کاپوزی و لنفوم غیر هاجکین است.[۱۹۴]
حتی با درمان ضد ویروسی، افراد آلوده به HIV در دراز مدت ممکن است دچار اختلالات عصبی،[۲۰۲] پوکی استخوان،[۲۰۳] بیماری عصبی،[۲۰۴] سرطان،[۲۰۵][۲۰۶] سرطان کلیه،[۲۰۷] و بیماری قلبی-عروقی[۱۶۹] شوند. دقیقاً مشخص نیست که این علائم حاصل عفونت HIV یا از اثرات درمان هستند.
گسترهٔ شیوع[ویرایش]

ایدز یک بیماری همهگیر جهانی است.[۲۰۹] تا سال ۲۰۲۲ حدود ۳۹ میلیون نفر در دنیا مبتلا به HIV بودهاند.[۱۵۷] تعداد متبلایان جدید در آن سال حدود ۱٫۳ میلیون نفر تخمین زده شدهاست.[۲۱۰] این تعداد از ۲٫۱ میلیون ابتلا جدید در سال ۲۰۱۰، روند کاهشی را تجربه کرده[۲۱۰] که در این میان، ۴۶ درصد سهم زنان و کودکان در سراسر جهان است.[۲۱۰] ۶۳۰۰۰۰ مورد مرگ ناشی از ایدز در سال ۲۰۲۲ وجود داشته که نسبت به ۲ میلیون نفر مرگ و میر در سال ۲۰۰۵ به طرز چشمگیری کاهش یافتهاست.[۲۱۰]
بیشترین درصد مبتلایان به HIV در شرق و جنوب آفریقا (۲۰٫۶ میلیون، ۵۴٫۶٪) ساکن هستند. این منطقه همچنین دارای بالاترین میزان مرگ و میر بزرگسالان و کودکان به دلیل ایدز در سال ۲۰۲۰ (۳۱۰۰۰۰، ۴۶٫۶ درصد) بودهاند.[۲۱۰] دختران و زنان جوان آفریقای جنوب صحرا (۱۵ تا ۲۴ سال) ۷۷ درصد از عفونتهای جدید در این محدوده سنی در سطح جهان تشکیل میدهند.[۲۱۰] در این مناطق، برخلاف سایر بخشهای جهان، احتمال ابتلای دختران و زنان جوان سه برابر بیشتر نسبت به مردان هم سن است.[۲۱۰] با این وجود، بهطور کلی، موارد جدید ابتلا به HIV و مرگ و میرهای مرتبط با ایدز در این منطقه از سال ۲۰۱۰ بهطور قابل توجهی کاهش یافتهاست.[۲۱۱]

اروپای شرقی و آسیای مرکزی از سال ۲۰۱۰ شاهد افزایش ۴۳ درصدی در موارد جدید عفونت HIV و ۳۲ درصد افزایش در مرگ و میرهای مرتبط با ایدز بوده که بالاترین میزان در بین تمام مناطق جهانی است.[۲۱۲] افراد تزریقی مواد مخدر، مردان همجنسگرا و سایر مردانی که با مردان رابطه جنسی دارند یا افرادی که درگیر روابط جنسی معاملهای هستند، به ترتیب بیشترین مبتلایان به ایدز در این منطقه را تشکیل میدهند.[۲۱۳]
در پایان سال ۲۰۱۹، در ایالات متحده تقریباً ۱٫۲ میلیون نفرِ بالای ۱۳ سالِ دارای HIV زندگی میکردند که از این تعداد ۱۸۵۰۰ نفر فوتی در سال ۲۰۲۰ گزارش شد.[۲۱۴] همچنین در این سال، ۳۴۸۰۰ عفونت جدید به ثبت رسید که ۵۳ درصد آن در مناطق جنوبی این کشور صورت گرفته بود.[۲۱۴] علاوه بر موقعیت جغرافیایی، تفاوتهای قابل توجهی در بروز HIV در میان مردان، جمعیتهای سیاهپوست یا اسپانیاییتبار و مردانی که تماس جنسی مرد با مرد را گزارش کردهاند، وجود دارد. مرکز کنترل و پیشگیری از بیماری ایالات متحده تخمین زد که در آن سال، ۱۵۸۵۰۰ نفر/۱۳ درصد از آمریکاییهای آلوده، از عفونت خود بی اطلاع بودند.[۲۱۴]
در بریتانیا تا سال ۲۰۱۵، تقریباً ۱۰۱۲۰۰ ابتلا مورد وجود داشت که منجر به مرگ ۵۹۴ نفر شد.[۲۱۵] همچنین در سال ۲۰۰۸، کانادا حدود ۶۵٬۰۰۰ مورد بیماری را گزارش داد که ۵۳ مورد از آن فوت کردند.[۲۱۶] جنوب و جنوب شرق آسیا دومین منطقه آسیب دیده در سال ۲۰۱۰ بودند و بهطور تخمینی ۴ میلیون یا ۱۲٪ افراد مبتلا به HIV زندگی میکردهاند که ۲۵۰ هزار نفر از آنها منجر به مرگ شد[۲۱۷] و از این تعداد حدود ۲٫۴ میلیون سهم مردان در هند بود.[۲۱۸]
ایدز از زمان شناخته شدن برای نخستین بار در سال ۱۹۸۱ تا سال ۲۰۰۹ باعث مرگ نزدیک به ۳۰ میلیون نفر در سراسر جهان شدهاست.[۲۱۹] شمال آفریقا و خاورمیانه (۰٫۱٪ یا کمتر)، آسیای شرقی (۰٫۱٪) و اروپای غربی و مرکزی (۰٫۲٪) کمترین نرخ HIV در مناطق مختلف جهان را دارا میباشند.[۲۲۰] در بین کشورهای شمال آفریقا و خاورمیانه کشورهای سودان، امارات متحده عربی، تونس و ایران بیشترین موارد جدید و سودان، امارات، عمان و مراکش بیشترین مرگ و میر را تجربه کردهاند.[۲۲۱] با وجود پایین بودن نرخ ابتلا در کشورهای خاورمیانه[۲۲۲] نرخ رشد مبتلایان به ایدز در برخی کشورهای نظیر ایران[۲۲۳] (افزایش ۳۱۸۱ نفری بین سالهای ۲۰۱۸ تا 2019[۲۲۴]) و مصر[۲۲۵] مثبت بوده و در دهه گذشته رشدی ۳۱ درصدی را تجربه کردهاست.[۲۲۱] کشورهای اروپایی که در سالهای ۲۰۰۹ و ۲۰۱۲ بیشترین آمار بیماری را گزارش دادهاند، روسیه، اوکراین، لتونی، مولداوی، پرتغال و بلاروس، شاهد کاهش همهگیری این بیماری در سالهای اخیر بودهاند.[۲۲۶]
گروههای شامل افراد درگیر در رابطه جنسی مبادلهای، مردان همجنسگرا و سایر مردانی که با مردان رابطه جنسی دارند، افرادی که مواد مخدر تزریق میکنند، افراد تراجنسیتی، و کسانی که در زندان یا بازداشت هستند، در معرض خطر بالاتر ابتلا به HIV قرار دارند.[۲۱۰][۲۲۷]
رسوایی فابیوس[ویرایش]
در زمان نخستوزیری لوران فابیوس نخستوزیر فرانسه رسوایی صادرات فراوردههای خونی آلوده به ایدز و هپاتیت رخ داد که تبعات بسیار گستردهای داشت. در دوران نخستوزیری او انستیتو مریو فرانسه فراورده فاکتورهای انعقاد خونی آلوده به ویروسHIV و هپاتیت را به برخی از کشورها مانند آلمان غربی، ایتالیا، آرژانتین، عربستان، عراق و ایران و … صادر کرد. این فاکتور در کمک به انعقاد خون بیماران مبتلا به هموفیلی مصرف میشود. در نتیجه سهل انگاری انستیتوی فرانسوی تعدادی از بیماران هموفیلی کشورهای دریافت کننده به ویروسHIV و بیماری ایدز و هپاتیت مبتلا شدند.[۲۲۸] مطابق آمار تنها در کشور فرانسه ۱۲۵۰ بیمار هموفیلی در اثر تزریق خون آلوده به ویروس HIV به ایدز مبتلا شدند که از میان آنها ۴۰۰ نفر در اثر این بیماری جان باختند.[۲۲۹]
وزیر بهداشت فابیوس، در دادگاه اعتراف کرد که باید از تابستان سال ۱۹۸۴ خونهای توزیعی آزمایش و خالصسازی میشدند که در این زمینه سهلانگاری شدهاست. با این حال مدیران ارشد خدمات بهداشتی خود را بیتقصیر دانسته و دولت را مسئول رسوایی به وجود آمده معرفی میکردند.[۲۲۸]
تاریخچه[ویرایش]
کشف[ویرایش]
ایدز اولین بار در سال ۱۹۸۱ در آمریکا مشاهده شد.[۲۴] اولین مواردی که مشاهده شد در بین معتادان تزریقی و همچنین همجنسگرایان مرد قرار داشتند که به دلیل نامعلومی سیستم دفاعی بدن آنها ضعیف شده بود و علایم بیماری التهاب ریه پنوموسیستیک کارینی (PCP) در آنها مشاهده میشد که این بیماری در افرادی دیده میشود که سیستم دفاعی بدنی ضعیفی دارند.[۲۳۰] سپس نوعی سرطان پوست نادر با نام کاپوسی سارکوما (KS) در میان مردان همجنسگرا گزارش شد.[۲۳۱][۲۳۲] موارد بیشتری از بیماری PCP و KS مشاهده شد و این زنگ خطری برای مرکز پیشگیری و کنترل بیماری بود و گروهی از طرف این مرکز برای بررسی این واقعه تشکیل شد.[۲۳۳]
در آن اوایل مرکز کنترل بیماری هنوز نامی رسمی برای این بیماری انتخاب نکرده بود و معمولاً نام این بیماری را با بیماری که مریض با آن در ارتباط بود بیان میکردند، برای مثال تا قبل از کشف HIV از نام لنفادنوپاتی که بیماری عامل بود استفاده میشد.[۲۳۴][۲۳۵] همچنین اسامی مانند سارکوم کاپوزی یا عفونت فرصتطلب نامهایی بودهاند که توسط این گروه در سال ۱۹۸۱ استفاده میشدهاست.[۲۳۶] از آنجا که این سندرم در هائیتی، همجنسگرایان، هموفیلی، و مصرفکنندگان هروئین ظاهر شده بود، مرکز کنترل بیماری عبارت «بیماری ۴ه» را ابداع کرد.[۲۳۷] در مطبوعات از اصطلاح «گرید» که مخفف معادل انگلیسی عبارت نقص ایمنی مرتبط با همجنسگرایی استفاده میشد.[۲۳۸] اما بعداً که معلوم شد که ایدز فقط محدود به جامعه همجنسگرایان نمیشود،[۲۳۶] این نتیجه گرفته شد که استفاده از اصطلاح گرید گمراهکننده است و واژه ایدز در همایشی در ژوئیه ۱۹۸۲ معرفی شد.[۲۳۹] از سپتامبر ۱۹۸۲، مرکز کنترل بیماری از واژه ایدز برای نسبت دادن این بیماری استفاده کرد.[۲۴۰]

در سال ۱۹۸۳، دو گروه تحقیقاتی جداگانه به رهبری رابرت گالو و لوک مونتانیه بهطور مستقل اعلام کردند که یک ویروس پسگرد جدید بیماران مبتلا به ایدز را آلوده کرده، و یافتههایشان را در یک شماره از مجله ساینس منتشر کردند.[۲۴۱][۲۴۲] گلو ادعا کرد که ویروسی که گروه خود از یک بیمار مبتلا به ایدز برای تحقیقات جدا کرده بود از نظر شکل کاملاً مشابه سایر ویروسهای تی-لنفوتروپیک انسانی (HTLV) بوده که گروهش در همان ابتدا جدا کرده بود. گروه گالو نام آن ویروس را HTLV-III گذاشتند. در همان زمان، گروه مونتانیه ویروسی از یک بیمار مبتلا به تورم غدد لنفاوی گردن و ضعف فیزیکی که دو مشخصه از علائم ایدز است، جدا کرده بود. تناقض در گزارشهای گروه گالو و مونتانیه و همکارانشان نشان میداد که هسته پروتئینهای این ویروس از لحاظ ایمنیشناسی، کاملاً متفاوت از HTLV-I است. گروه مونتانیه اسم ویروسی که جدا کرده بودند را ویروس مرتبط با لنفادنوپاتی (LAV) گذاشتند.[۲۳۳] از آنجا که مشخص شد هر دوی این ویروسها یکسان هستند، در سال ۱۹۸۶ LAV و HTLV-III هر دو به HIV تغییر نام دادند.[۲۴۳]
منشأ[ویرایش]
اچآیوی شکلی جهشیافته از ویروسی است که شامپانزهها را گرفتار میکند و ویروس «نقص ایمنی میمونی» نام دارد.[۲۴۴] به نظر میرسد که هر دو ویروس HIV-۱ و HIV-۲ در اصل متعلق به نخستیسانان مرکز آفریقا بوده و در اوایل سده بیستم میلادی به بدن انسان منتقل شدهاند.[۲۴۵] به نظر میآید که ویروس HIV-۱ در اصل متعلق به مناطق جنوبی کامرون و تکامل یافتهٔ ویروس نقص ایمنی میمونی (SIV) که در میان شمپانزههای وحشی شیوع دارد، بودهاست.[۲۴۶][۲۴۷] ویروس HIV-۲ تکامل یافتهٔ ویروس SIV میان گونهای میمون به نام منگابی دودی بودهاست که در غرب آفریقا (از جنوب سنگال تا غرب ساحل عاج) زندگی میکردهاست.[۷۷] پخبینیانی مانند میمون شب نسبت به ویروس HIV-۱ مقاوم هستند و این احتمالاً به دلیل یک نوع ژن پیوندی دو گونه مقاوم ویروس در آنها میباشد.[۲۴۸] به نظر میرسد که HIV-1 حداقل در سه مرحله جهش داشته و به سه گروه از ویروسهای M, N و O جهش یافتهاست.[۲۴۹]
مدارکی موجود است که نشان میدهد انسانهایی که در شکار یا فروش حیوانات دخالت داشتند یا در مواردی تحریکهای جنسی با میمونها داشتهاند دچار ویروس SIV شدهاند.[۲۵۰] اگرچه SIV ویروس ضعیفی است که سیستم دفاعی بدن انسان با آن مقابله میکند و بیش از چند هفته در بدن انسان باقی نمیماند، اما انتقال سریع و متوالی آن بین انسانهای مختلف زمان کافی را به این ویروس برای تبدیل آن به HIV میدهد.[۲۵۱]
برای شناسایی منشأ ایدز، پژوهشگران دانشگاه آکسفورد و دانشگاه لون رشته فعالیتهایی در حوزه دیرینشناسی ویروسها داشتند و با استفاده از نمونههایی بایگانیشده از کدهای ژنتیکی اچآیوی، توانستند این ویروس را ردیابی کنند و به دهه ۱۹۲۰ میلادی در کینشاسا، واقع در جمهوری دموکراتیک کنگو برسند.[۲۴۴]
مطالعات ژنتیکی ویروسی نشان میدهد که اجداد گروه اچآیوی-۱ M به سال ۱۹۱۰ بر میگردد.[۲۵۲] افرادی که مدعی هستند که HIV در این تاریخ شیوع یافته، آن را به ظهور و رشد استعمار و شهرهای مستعمره آفریقایی ارتباط میدهند که منجر به تغییرات اجتماعی شامل بی بند و باری جنسی، گسترش تنفروشی، و بیماریهای زخم تناسلی (مانند سیفیلیس) در شهرهای مستعمره شدهاست.[۲۵۳] در حالی که میزان انتقال HIV در رابطه جنسی واژینال در حالت عادی کم است، اما اگر یکی از طرفین مبتلا به یک بیماری آمیزشی عفونی باشد، احتمال انتقال هم افزایش خواهد یافت. در اوایل دهه ۱۹۰۰ شهرهای مستعمره به دلیل شیوع بالای تنفروشی و بیماریهای زخم تناسلی معروف بودند و به نظر میرسید که در سال ۱۹۲۸ به اندازه ۴۵٪ زنان ساکن کینشاسا شرقی تنفروشی میکردند و در سال ۱۹۳۳ در حدود ۱۵٪ ساکنان همان شهر به یکی به بیماری سیفیلیس مبتلا شده بودند.[۲۵۳]
از نگاهی دیگر مشاهده میشود که اعمال خطرناک پزشکی در آفریقا در طول جنگ جهانی دوم، مانند استریل نبودن، استفاده مجدد از سرنگها در واکسنهای عمومی، آنتیبیوتیک و آنتی مالاریا از عواملی بودهاند که باعث پخش ویروس و سازگاری آن با انسانها شدهاست.[۲۵۱][۲۵۴][۲۵۵]
بررسی نمونههای خونی به جا مانده از گذشته نشان میدهد که اولین انسانی که مبتلا به ایدز شده در سال ۱۹۵۹ در کنگو جان خود از دست دادهاست. این نخستین و قدیمیترین مورد مرگ شناخته شده در اثر ابتلاء به این بیماری محسوب میشود.[۲۵۶] همچنین ممکن است ویروس اچآیوی نخستین بار در سال ۱۹۶۶ به آمریکا رسیده باشد،[۲۵۷] ولی عمده شیوع HIV مربوط به خارج از صحرای آفریقا (و همچنین آمریکا) میشود و میتوان آن را به فردی ناشناس و مبتلا به ایدز نسبت داد که در هائیتی زندگی میکردهاست و با ورود به آمریکا در سال ۱۹۶۹ به آن شیوع بخشیدهاست.[۲۵۸] پس از آن به سرعت بین گروههای پرخطر (در ابتدا در بین مردان همجنسگرا) پخش شد. در سال ۱۹۷۸ شیوع ویروس HIV-1 در بین مردان همجنسگرای ساکن نیویورک و سان فرانسیسکو، ۵ درصد تخمین زده شد که بیانگر این است که هزاران نفر در کشور مبتلاً به ایدز بودهاند.[۲۵۸]
جامعه و فرهنگ[ویرایش]
داغ ننگ[ویرایش]

در سراسر دنیا داغ ننگ به طرق مختلف در مورد ایدز وجود دارد، از قبیل محرومیت از حقوق اجتماعی، عدم پذیرش از سوی جامعه، تبعیض و دوری از افراد مبتلا به HIV، اجبار به انجام آزمایش HIV بدون رضایت قبلی یا مخفی نگه داشتن این راز، خشونت علیه افراد مبتلا به HIV که بیمار بودن آنها فاش شدهاست و قرنطینه افراد مبتلا به HIV.[۲۵۹] خشونتهای مربوط به داغ ننگ یا ترس از خشونت مانع از آن میشود که بسیاری از افراد به دنبال آزمایشهای HIV، گرفتن جواب آزمایش، یا انجام درمان آن باشند، مسایلی که میتوانند چنین بیماری مزمن مدیریتپذیری را تبدیل به حکم مرگ کنند و باعث گسترش آن بشوند.[۲۶۰]
داغ ننگ ایدز را میتوان به سه مقوله تقسیم کرد:
- داغ ننگ ابزاری ایدز – بازتابی از ترس و هراسی است که ممکن است با هر بیماری مرگبار و قابل انتقال دیگری نیز همراه باشد.[۲۶۱]
- داغ ننگ نمادین ایدز – استفاده از ایدز برای بیان نگرشهای مربوط به گروههای اجتماعی یا سبک زندگی همراه با این بیماری.[۲۶۱]
- داغ ننگ احترام به ایدز – انگ زنی به افرادی که با مسایل مربوط به ایدز درگیر هستند یا افراد مبتلا به HIV.[۲۶۲]
غالباً، داغ ننگ ایدز در ارتباط با سایر داغهای ننگ بیان میشود به خصوص داغهای مربوط به همجنسگرایی، دوجنسگرایی، بیبندوباری جنسی، تنفروشی و تزریق درون وریدی مواد مخدر.[۲۶۳]
در بسیاری از کشورهای توسعهیافته، ارتباط نزدیکی بین ایدز و همجنسگرایی، یا دوجنسگرایی وجود دارد، و این تداعی مرتبط است با سطوح بالاتری از نگرشهای موجود دربارهٔ قضاوتهای جنسی از قبیل ترس از همجنسگرایی/دوجنسگرایی.[۲۶۴] همچنین بین ایدز و رفتارهای جنسی مرد با مرد، مانند رابطه جنسی میان افراد غیرآلوده رابطه نزدیکی وجود دارد.[۲۶۱] البته حالت غالب در گسترش HIV در تمام دنیا انتقال از طریق دوجنسگرایان است.[۲۶۵]
تأثیرات اقتصادی[ویرایش]

ایدز هم بر اقتصاد افراد و هم کشورها تأثیر میگذارد.[۲۶۶] تولید ناخالص داخلی بیشتر کشورهای تحت تأثیر به خاطر فقدان سرمایه انسانی کاهش یافتهاست.[۲۶۶][۲۶۷] بدون تغذیه، بهداشت و داروی مناسب، بسیاری از مردم به دلیل اثرات ناشی از ایدز جان خود را از دست خواهند داد. آنها نه تنها قادر به کار کردن نیستند، بلکه نیازمند مراقبتهای پزشکی خاصی نیز هستند. برآورد شدهاست که از سال ۲۰۰۷ تعداد ۱۲ میلیون کودک به خاطر ایدز یتیم شدهاند.[۲۶۶] بسیاری از آنها توسط پدربزرگ و مادربزرگهای پیر خود نگهداری میشوند.[۲۶۸]
از آنجا که غالباً جوانان مبتلا به ایدز میشوند، این بیماری جمعیت مشمول مالیات را کاهش میدهد، و در عوض منابع موجود برای هزینههای عمومی از قبیل آموزش و پرورش و خدمات بهداشتی که ارتباطی با ایدز ندارند کاهش مییابند و در نتیجه فشارها بر منابع مالی دولت افزایش یافته و رشد اقتصاد کاهش مییابد. این مسئله موجب کند شدن رشد پایه مالیاتی میشود، و اگر هزینههای عمومی برای درمان بیماران، آموزش افراد جدید (برای جایگزین کردن کارگران بیمار)، حقوق بیمار و مراقبت از کودکان یتیم شده به خاطر ایدز افزایش یابند، وضعیت بغرنجتر خواهد شد.[۲۶۸]
در سطح خانواده، ایدز هم بر پایین آمدن سطح درآمد تأثیر خواهد گذاشت و هم موجب افزایش هزینههای درمانی میشود. مطالعهای در ساحل عاج نشان دادهاست هزینههای درمانی خانوادههایی که بیماران HIV/ایدز دارند، دو برابر سایر خانوادههاست. این هزینههای اضافی همچنین باعث میشود که برای آموزش و پرورش و سایر سرمایهگذاریهای شخصی و خانوادگی هزینههای کمتری مصرف شود.[۲۶۹]
مذهب و ایدز[ویرایش]
تحقیقات نشان میدهد که ادیان میتوانند نقش مهمی در مقابله با همهگیری اچآیوی/ایدز ایفا کنند. آنها میتوانند به کاهش انگ و تبعیض علیه افراد مبتلا به اچآیوی/ایدز و ترویج آموزش بهداشت و پیشگیری از این بیماری کمک کنند.[۲۷۰] در سالهای اولیه همهگیری ایدز، واکنشهای مذهبی بهطور کلی منفی بود. بسیاری از گروههای مذهبی، به ویژه آنهایی که دیدگاههای محافظهکارانه در مورد همجنسگرایی داشتند، ایدز را مجازات الهی برای گناه میدانستند. این نگرشها منجر به تبعیض و طرد افراد مبتلا به ایدز، حتی در داخل جوامع مذهبی شد. برخی از گروههای مذهبی از افراد مبتلا به ایدز حمایت کردند. با این حال، این موارد استثنا بودند و واکنش عمومی مذهبی به ایدز در سالهای اولیه این بیماری همهگیر منفی بود. این واکنشهای منفی به ایدز ناشی از عوامل مختلفی بود، از جمله عدم آگاهی در مورد نحوه انتقال HIV، ترس از سرایت و دیدگاههای اخلاقی در مورد همجنسگرایی.[۲۷۱]
موضوع مذهب و ایدز چند دهه گذشته به شدت بحثبرانگیز بودهاست، برخی از مقامات دینی بهطور عمومی مخالفت خود را با استفاده از کاندوم بیان داشتهاند.[۲۷۲][۲۷۳] در اوایل شیوع این بیماری، ترس از بیماری و مرگ، همراه با دیدگاههای مذهبی دربارهٔ جنسیت و رفتارهای ناشناخته، به ویژه در جوامع مذهبی، تشدید شد. برخی رهبران مذهبی از ایدز به عنوان دلیلی منزوی کردن مبتلایان استفاده کردند و آن را با دلایل اخلاقی توجیه کردند. به عنوان مثال، کشیش جری فالول ادعا کرد که ایدز ناشی از گناهان جنسی بود و محکومیت شدیدی را بر تمایلات جنسی همجنسگرایان اعمال کرد.[۲۷۱]
برخی از سازمانهای مذهبی ادعا کردند که عبادت میتواند ایدز را درمان کند. در سال ۲۰۱۱، بیبیسی گزارش کرد که برخی از کلیساها در لندن ادعا میکردند که عبادت موجب درمان ایدز میشود، و مرکز مستقر در هاکنی در مطالعه بهداشت جنسی و HIV گزارش داد که چندین نفر به پیشنهاد پیشوای روحانی خود درمان بیماریشان را متوقف کردند و جان خود را از دست دادند.[۲۷۴] یکی از کلیساهای کاتولیک، «آب تدهین» را به عنوان چیزی تبلیغ میکرد که باعث شفای بیمار از طرف خدا میشد، این درحالیست که پزشکان و متخصصان تأکید دارند که این بیماران حتماً باید دارو مصرف کنند.[۲۷۴]
برخی پژوهشها، سطح پایینتری از رفتارهای جنسی پرخطر مرتبط با HIV را در میان مسلمانان یافتهاند، اما بسیاری از این پژوهشها بیشتر بر شیوع ایدز متمرکز بودند تا نتایج رفتاری خاص. اکثر پژوهشها رابطهای را بین افزایش میزان مذهبی بودن و کاهش سطح رفتارهای جنسی پرخطر مرتبط با ایدز شناسایی کردند.[۲۷۵]
تصویرسازی رسانهها[ویرایش]
یکی از مشهورترین شخصیتهای مبتلا به ایدز راک هادسن آمریکایی، بازیگر همجنسگرایی است که در ابتدای زندگی خود یک بار ازدواج کرد و طلاق گرفت، وی در ۲ اکتبر ۱۹۸۵ اعلام کرد که در ۲۵ ژوئیه آن سال مبتلا به ویروس شدهاست. بیماری او در سال ۱۹۸۴ تشخیص داده شدهبود.[۲۷۶] قابل توجهترین تلفات بریتانیا از ایدز در آن سال نیکولاس ادن، سیاستمدار همجنسگرا و پسر نخستوزیر سابق آنتونی ادن بود.[۲۷۷] در ۲۴ نوامبر ۱۹۹۱، ویروس زندگی ستاره راک بریتانیایی فردی مرکوری، خواننده گروه کوئین را گرفت، وی در حالی از بیماری مرتبط با ایدز جان سپرد که تنها روز قبل از مرگش بیماری خود را در رسانهها اعلام کرده بود.[۲۷۸] البته، در سال ۱۹۸۷ تشخیص داده شده بود که وی مبتلا به HIV است.[۲۷۹] یکی از معروفترین چهرههای دگرجنسگرای مبتلا به ایدز آرتور اش، بازیکن آمریکایی تنیس است. در ۳۱ اوت ۱۹۸۸ تشخیص داده شد که وی مبتلا به HIV است، ویروس از راه انتقال خون طی جراحی قلب در اوایل دهه ۱۹۸۰ به او منتقل شده بود. آزمایشهای بیشتر در عرض ۲۴ ساعت بعد از تشخیص اولیه نشان دادند که اش ایدز دارد، اما او تا آوریل ۱۹۹۲ به عموم چیزی نگفت.[۲۸۰] وی در سن ۴۹ سالگی در تاریخ ۶ فوریه ۱۹۹۳ بر اثر این بیماری جان خود را از دست داد.[۲۸۱]
عکس ترزا فرار از یکی از فعالان هم جنسگرای، دیوید کیربی، درحالیکه بر روی تخت به دلیل بیماری ایدز جان خود را از دست داده بود و خانوادهاش در اطرافش بودند، در آوریل ۱۹۹۰ گرفته شده بود. مجله لایف ادعا کرد که این عکس تبدیل به تصویری شد که «به نحوی قدرتمند مسری بودن ایدز را نشان میدهد.» این عکس که در مجله لایف نمایش داده شده بود برنده عکس مطبوعات جهان شد، و بعد از اینکه در سال ۱۹۹۲ در یک تبلیغ برای کمپین یونایتد کالر آو بنتون استفاده شد در سراسر جهان بدنام شد.[۲۸۲] در سال ۱۹۹۶ فردی اهل اوگاندا با نام جانسون آزیگا که به کانادا مهاجرت کرده بود، حامل ویروس HIV تشخیص داده شد و علیرغم آگاهی از بیمار بودن خود، با ۱۱ زن نزدیکی داشت بدون آنکه از کاندوم استفاده کند یا اینکه آنها را از بیماری خود آگاه سازد. این کار وی منجر به مبتلا شدن هفت نفر از آنها به HIV و همچنین کشته شدن دو نفر از آنان بر اثر ایدز شد که این موضوع در سال ۲۰۰۳ فاش شد.[۲۸۳][۲۸۴] پس از برگزاری دادگاههای متوالی، در نهایت آزیگا در سال ۲۰۰۹ به قتل عمد متهم شده و به حبس ابد محکوم شد.[۲۸۵]
انکار و تصورات غلط[ویرایش]
عده کمی هنوز دربارهٔ ارتباط بین HIV و ایدز[۲۸۶] وجود خود HIV، یا اعتبار آزمایش HIV و روشهای درمان آن اختلاف نظر دارند.[۲۸۷][۲۸۸] جامعه علمی این ادعاها، که به انکارگرایی ایدز معروفند، را مورد بررسی قرار داده و آنها را رد کردهاست.[۲۸۹] البته، آنها تأثیرات سیاسی چشمگیری داشتهاند، بهخصوص آنکه در آفریقای جنوبی، جایی که دولت با آغوش باز از انکارگرایان ایدز استقبال میکند، آنها مسئول بیمبالاتی دولت در خصوص اپیدمی ایدز در کشور هستند، و مقصر صدها هزار مرگ قابل اجتناب و عفونتهای HIV نیز میباشند.[۲۹۰][۲۹۱][۲۹۲] عملیات اینفکشن عملیات جهانی سنجش فعال اتحاد جماهیر شوروی بود تا همگان را از این امر مطلع کند که ایدز را آمریکا به وجود آوردهاست. تحقیقات نشان میدهند که تعداد زیادی از مردم این ادعا را باور داشته و هنوز هم دارند.[۲۹۳]
تصورات غلط زیادی دربارهٔ HIV و ایدز وجود دارد. سه نوع رایج آنها عبارتند از اینکه ایدز میتواند از راه تماس معمولی منتقل شود، و اینکه نزدیکی جنسی با یک باکره بیماری ایدز را درمان میکند، و نیز HIV تنها میتواند مردان همجنسگرا و مصرفکنندگان مواد مخدر را آلوده کند. سایر تصورات غلط عبارتند از اینکه هر نوع نزدیکی مقعدی بین دو مرد همجنسگرا غیرآلوده میتواند منجر به ابتلاء به HIV شود، و بحثهای باز و آزاد دربارهٔ همجنسگرایی و HIV در مدارس منجر به افزایش میزان همجنسگرایی و ایدز میشود.[۲۹۴][۲۹۵]
تحقیقات[ویرایش]
پژوهشهای انجام شده برای بهبود درمانهای فعلی شامل کاهش عوارض جانبی داروهای کنونی، برنامههای دارویی سادهتر با هدف تعیین برنامههای مناسبتر برای مقاومت در برابر دارو میشود. با این حال، به نظر میرسد که فقط با یک واکسن میتوان این بیماری همهگیر را متوقف کرد؛ زیرا واکسن هزینه کمتری دارد و برای کشورهای در حال توسعه مقرون به صرفهتر است و به درمان روزانه نیاز ندارد.[۲۹۶] با این حال، پس از بیش از ۲۰ سال تحقیق، واکسن HIV-1 به هدفی دشوار تبدیل شدهاست،[۲۹۶][۲۹۷] و هنوز هیچ درمانی برای آن وجود ندارد.
پیوند سلولهای بنیادی[ویرایش]
در سال ۲۰۰۷، به تیموتی ری براون،[۲۹۸] یک فرد ۴۰ ساله مبتلا به HIV، که با نام «بیمار برلین» نیز شناخته میشود، پیوند سلولهای بنیادی به عنوان بخشی از درمانش برای لوسمی میلوئید حاد (AML) داده شد.[۲۹۹] پیوند دوم یک سال پس از عود کردن بیماری انجام شد. اهداکننده نه تنها برای سازگاری ژنتیکی بلکه همچنین برای هموزیگوت بودن برای جهش CCR5-Δ۳۲ انتخاب شد تا مقاومت بیشتری در برابر عفونت HIV صورت گیرد.[۳۰۰][۳۰۱] پس از ۲۰ ماه بدون هیچ گونه درمانی با داروی ضدویروسی، گزارش شد که سطح HIV در خون، مغز استخوان و روده براون زیر حد تشخیص داده شده بود.[۳۰۱] این ویروس تا بیش از سه سال پس از اولین پیوند قابل شناسایی نبود.[۲۹۹] اگر چه محققان و برخی از مفسران، نتیجه را درمان بیان کردهاند، اما دیگران بر این عقیدهاند که این ویروس ممکن است به صورت پنهان در بافتها[۳۰۲] مانند مغز (که به عنوان منبع ذخیره ویروسی عمل میکند) وجود داشته باشد.[۳۰۳] درمان از طریق سلولهای بنیادی به دلیل طبیعت داستانگونهای خود، بیماری و احتمال از بین رفتن پیوند سلولهای بنیادی، و دشواریهای تحقیقاتی پیدا کردن اهداکنندگان مناسب، در حال بررسی است.[۳۰۲][۳۰۴]
عوامل دستگاه ایمنی[ویرایش]
در طی تلاشهای انجام شده برای کنترل تکثیر ویروس، ایمن درمانی که میتواند به بهبود دستگاه ایمنی کمک کند، در آزمایشهایی از جمله IL-۲ و IL-۷ بررسی گردیدهاست.[۳۰۵]
ناتوانی محافظت داوطلبان واکسن در برابر عفونت HIV و پیشرفت ایدز در ساختمان زیستشناختی، به پنهان شدن HIV منجر شدهاست. شاید روزی با یک دوره محدود درمان ترکیبی ضدویروس و داروی منبع ذخیره نهانی پنهان بتوان عفونت HIV را ریشهکن کرد.[۳۰۶] محققان آبزیمی کشف کردهاند که میتواند پروتئین gp120 متصل به CD4 را از بین ببرد. از آنجا که این پروتئین نقطه اشتراک لنفوسیتهای بی و خطرات احتمالی دستگاه ایمنی بدن است، در همه انواع HIV شایع است.[۳۰۷]
جستارهای وابسته[ویرایش]
پانویس[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ "Stages of HIV". U.S. Department of Health & Human Services (به انگلیسی). Dec 2010. Archived from the original on 19 March 2013. Retrieved 13 June 2012.
- ↑ "HIV Classification: CDC and WHO Staging Systems | AIDS Education and Training Centers National Coordinating Resource Center (AETC NCRC)". aidsetc.org (به انگلیسی). AIDS Education and Training Center Program. Archived from the original on October 18, 2017. Retrieved September 10, 2017.
- ↑ "Wear your red ribbon this World AIDS Day | UNAIDS". www.unaids.org. UNAIDS Secretariat. Archived from the original on September 10, 2017. Retrieved September 10, 2017.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ ۴٫۴ ۴٫۵ ۴٫۶ ۴٫۷ ۴٫۸ "HIV/AIDS Fact sheet N°360". World Health Organization. نوامبر 2015. Archived from the original on February 17, 2016. Retrieved February 11, 2016.
- ↑ ۵٫۰ ۵٫۱ "About HIV/AIDS". CDC. دسامبر 6, 2015. Archived from the original on February 24, 2016. Retrieved February 11, 2016.
- ↑ ۶٫۰ ۶٫۱ UNAIDS (May 18, 2012). "The quest for an HIV vaccine". Archived from the original on May 24, 2012.
- ↑ ۷٫۰ ۷٫۱ UNAIDS, World Health Organization (December 2007). "2007 AIDS epidemic update" (PDF). Archived from the original (PDF) on May 27, 2008. Retrieved March 12, 2008.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ ۸٫۴ "Global HIV & AIDS statistics — 2022 fact sheet". UNAIDS. Archived from the original on December 4, 2019. Retrieved July 20, 2023.
- ↑ Sepkowitz KA (2001). "AIDS—the first 20 years". N. Engl. J. Med. (به انگلیسی). ۳۴۴ (۲۳): ۱۷۶۴–۷۲. doi:10.1056/NEJM200106073442306. PMID 11396444.
- ↑ Gallo RC (2006). "A reflection on HIV/AIDS research after 25 years". Retrovirology (به انگلیسی). ۳: ۷۲. doi:10.1186/1742-4690-3-72. PMC 1629027. PMID 17054781. Archived from the original on 19 March 2013.
- ↑ "NIH launches new collaboration to develop gene-based cures for sickle cell disease and HIV on global scale". National Institutes of Health (NIH). October 23, 2019. Archived from the original on September 4, 2021. Retrieved September 24, 2021.
- ↑ Guideline on when to start antiretroviral therapy and on pre-exposure prophylaxis for HIV (PDF). World Health Organization. 2015. p. 13. ISBN 978-92-4-150956-5. Archived (PDF) from the original on October 14, 2015.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ ۱۳٫۳ ۱۳٫۴ ۱۳٫۵ Mandell, Bennett, and Dolan (2010). Chapter 121.
- ↑ ۱۴٫۰۰ ۱۴٫۰۱ ۱۴٫۰۲ ۱۴٫۰۳ ۱۴٫۰۴ ۱۴٫۰۵ ۱۴٫۰۶ ۱۴٫۰۷ ۱۴٫۰۸ ۱۴٫۰۹ ۱۴٫۱۰ ۱۴٫۱۱ ۱۴٫۱۲ ۱۴٫۱۳ ۱۴٫۱۴ WHO case definitions of HIV for surveillance and revised clinical staging and immunological classification of HIV-related disease in adults and children (PDF) (به انگلیسی). Geneva: World Health Organization. 2007. p. 6–16. Archived from the original (PDF) on 31 October 2013. Retrieved 18 January 2013.
- ↑ Diseases and disorders (به انگلیسی). Tarrytown, NY: Marshall Cavendish. 2008. p. ۲۵. Archived from the original on 19 March 2013.
- ↑ ۱۶٫۰۰ ۱۶٫۰۱ ۱۶٫۰۲ ۱۶٫۰۳ ۱۶٫۰۴ ۱۶٫۰۵ ۱۶٫۰۶ ۱۶٫۰۷ ۱۶٫۰۸ ۱۶٫۰۹ ۱۶٫۱۰ ۱۶٫۱۱ ۱۶٫۱۲ Mandell, Bennett, and Dolan (2010). Chapter 118.
- ↑ ۱۷٫۰۰ ۱۷٫۰۱ ۱۷٫۰۲ ۱۷٫۰۳ ۱۷٫۰۴ ۱۷٫۰۵ ۱۷٫۰۶ ۱۷٫۰۷ ۱۷٫۰۸ ۱۷٫۰۹ ۱۷٫۱۰ ۱۷٫۱۱ ۱۷٫۱۲ ۱۷٫۱۳ ۱۷٫۱۴ ۱۷٫۱۵ ۱۷٫۱۶ ۱۷٫۱۷ ۱۷٫۱۸ Vogel, M (2010). "The treatment of patients with HIV". Deutsches Ärzteblatt international (به انگلیسی). ۲۸–۲۹: ۵۰۷–۱۵. doi:10.3238/arztebl.2010.0507. PMC 2915483. PMID 20703338.
- ↑ Evian, Clive (2006). Primary HIV/AIDS care: a practical guide for primary health care personnel in a clinical and supportive setting (به انگلیسی) (Updated 4th ed.). Houghton [South Africa]: Jacana. p. 29. Archived from the original on 19 March 2013.
- ↑ Reeders, J. W. A. J. (2001). P. C. Goodman; J. Bedford (eds.). Radiology of AIDS (به انگلیسی). Berlin [u.a.]: Springer. p. 19. Archived from the original on 19 March 2013.
- ↑ Elliott, Tom (2012). Lecture Notes: Medical Microbiology and Infection (به انگلیسی). John Wiley & Sons. p. 273. Archived from the original on 19 March 2013.
- ↑ ۲۱٫۰ ۲۱٫۱ Blankson, JN (2010). "Control of HIV-1 replication in elite suppressors". Discovery medicine (به انگلیسی). 9 (46): 261–6. PMID 20350494.
- ↑ Holmes CB, Losina E, Walensky RP, Yazdanpanah Y, Freedberg KA (2003). "Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa". Clin. Infect. Dis. (به انگلیسی). ۳۶ (۵): ۶۵۶–۶۶۲. doi:10.1086/367655. PMID 12594648.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Chu, C; Selwyn, PA (۲۰۱۱). "Complications of HIV infection: a systems-based approach". American family physician (به انگلیسی). ۸۳ (۴): ۳۹۵–۴۰۶. PMID 21322514.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ ۲۴٫۳ Mandell, Bennett, and Dolan (2010). Chapter 169.
- ↑ Mittal R, Rath S, Vemuganti GK (July 2013). "Ocular surface squamous neoplasia – Review of etio-pathogenesis and an update on clinico-pathological diagnosis". Saudi Journal of Ophthalmology. 27 (3): 177–86. doi:10.1016/j.sjopt.2013.07.002. PMC 3770226. PMID 24227983.
- ↑ "AIDS". MedlinePlus (به انگلیسی). A.D.A.M. Archived from the original on 19 March 2013. Retrieved 14 June 2012.
- ↑ Sestak K (2005). "Chronic diarrhea and AIDS: insights into studies with non-human primates". Curr. HIV Res. (به انگلیسی). ۳ (۳): ۱۹۹–۲۰۵. doi:10.2174/1570162054368084. PMID 16022653.
- ↑ Murray ED, Buttner N, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Bradley WG, Daroff RB, Fenichel GM, Jankovic J (eds.). Bradley's Neurology in Clinical Practice: Expert Consult – Online and Print, 6e (Bradley, Neurology in Clinical Practice e-dition 2v Set). Vol. 1 (6th ed.). Philadelphia: Elsevier/Saunders. p. 101. ISBN 978-1-4377-0434-1.
- ↑ Rosen, Allyson. "Neurocognitive Disorders of the DSM-5" (PDF). stanford.edu. Retrieved 2 October 2017.
- ↑ Gray, F.; Adle-Biassette, H.; Chretien, F.; Lorin de la Grandmaison, G.; Force, G.; Keohane, C. (July 2001). "Neuropathology and neurodegeneration in human immunodeficiency virus infection. Pathogenesis of HIV-induced lesions of the brain, correlations with HIV-associated disorders and modifications according to treatments". Clinical Neuropathology. 20 (4): 146–155. ISSN 0722-5091. PMID 11495003.
- ↑ Adle-Biassette, H.; Levy, Y.; Colombel, M.; Poron, F.; Natchev, S.; Keohane, C.; Gray, F. (June 1995). "Neuronal apoptosis in HIV infection in adults". Neuropathology and Applied Neurobiology. 21 (3): 218–227. doi:10.1111/j.1365-2990.1995.tb01053.x. ISSN 0305-1846. PMID 7477730.
- ↑ انجمن علوم اعصاب، مترجم رضا پناهی. بهنام سور، علی شهبازی، عباس حقپرست، حقایق مغز. تهران: مؤسسه انتشارات ستایش هستی، ۱۳۹۸ شابک ۹۷۸−۶۲۲−۶۴۴۵−۶۳−۴، ص ۱۹۶.
- ↑ MacIntosh, Peter W.; Moss, Heather E. (2013-10-01). "The 5-Minute Neurology Consult, 2nd Edition". Neuro-Ophthalmology. 37 (5): 227–228. doi:10.3109/01658107.2013.824005. ISSN 0165-8107. PMC 5290998.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ "HIV-Associated Dementia - Neurologic Disorders". MSD Manual Professional Edition (به انگلیسی). Retrieved 2021-11-05.
- ↑ Grant I, Sacktor H, McArthur J (2005). "HIV neurocognitive disorders" (PDF). In Gendelman HE, Grant I, Everall I, Lipton SA, Swindells S (eds.). The Neurology of AIDS (2nd ed.). London, UK: Oxford University Press. pp. 357–373. ISBN 978-0-19-852610-0. Archived from the original (PDF) on 23 September 2009. Retrieved 5 November 2021.
- ↑ ۳۶٫۰ ۳۶٫۱ Smith, DK; Grohskopf, LA; Black, RJ; Auerbach, JD; Veronese, F; Struble, KA; Cheever, L; Johnson, M; Paxton, LA; Onorato, IM; Greenberg, AE (21 January 2005). "Antiretroviral postexposure prophylaxis after sexual, injection-drug use, or other nonoccupational exposure to HIV in the United States: recommendations from the U.S. Department of Health and Human Services". U.S. Department of Health and Human, Services. MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control 54 (به انگلیسی) (RR-2): 1–20. PMID 15660015.
- ↑ Coovadia H (2004). "Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS". N. Engl. J. Med. 351 (به انگلیسی) (3): 289–292. doi:10.1056/NEJMe048128. PMID 15247337.
- ↑ ۳۸٫۰ ۳۸٫۱ ۳۸٫۲ ۳۸٫۳ Kripke, C (1 August 2007). "Antiretroviral prophylaxis for occupational exposure to HIV". American family physician 76 (به انگلیسی) (3): 375–6. PMID 17708137.
- ↑ ۳۹٫۰ ۳۹٫۱ ۳۹٫۲ ۳۹٫۳ ۳۹٫۴ ۳۹٫۵ ۳۹٫۶ Dosekun, O; Fox, J (July 2010). "An overview of the relative risks of different sexual behaviours on HIV transmission". Current opinion in HIV and AIDS 5 (به انگلیسی) (4): 291–7. doi:10.1097/COH.0b013e32833a88a3. PMID 20543603.
- ↑ Cunha, Burke (2012). Antibiotic Essentials 2012 (به انگلیسی) (11 ed.). Jones & Bartlett Publishers. p. 303.
- ↑ ۴۱٫۰ ۴۱٫۱ ۴۱٫۲ ۴۱٫۳ ۴۱٫۴ ۴۱٫۵ ۴۱٫۶ ۴۱٫۷ ۴۱٫۸ Boily, MC; Baggaley, RF; Wang, L; Masse, B; White, RG; Hayes, RJ; Alary, M (February 2009). "Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies". The Lancet infectious diseases 9 (به انگلیسی) (2): 118-29. doi:10.1016/S1473-3099(09)70021-0. PMID 19179227.
- ↑ Baggaley, RF; White, RG; Boily, MC (December 2008). "Systematic review of orogenital HIV-1 transmission probabilities". International Journal of Epidemiology 37 (به انگلیسی) (6): 1255-65. doi:10.1093/ije/dyn151. PMC 2638872. PMID 18664564.
- ↑ ۴۳٫۰ ۴۳٫۱ ۴۳٫۲ ۴۳٫۳ ۴۳٫۴ ۴۳٫۵ ۴۳٫۶ William N. Rom; Steven B. Markowitz, eds. (2007). Environmental and occupational medicine (به انگلیسی) (4th ed.). Wolters Kluwer/Lippincott Williams & Wilkins. p. 745. Archived from the original on 19 March 2013.
- ↑ van der Kuyl AC, Cornelissen M (September 2007). "Identifying HIV-1 dual infections". Retrovirology. 4: 67. doi:10.1186/1742-4690-4-67. PMC 2045676. PMID 17892568.
- ↑ McCray, Eugene; Mermin, Jonathan (September 27, 2017). "Dear Colleague: September 27, 2017". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on January 30, 2018. Retrieved February 1, 2018.
- ↑ LeMessurier, J; Traversy, G; Varsaneux, O; Weekes, M; Avey, MT; Niragira, O; Gervais, R; Guyatt, G; Rodin, R (November 19, 2018). "Risk of sexual transmission of human immunodeficiency virus with antiretroviral therapy, suppressed viral load and condom use: a systematic review". Canadian Medical Association Journal. 190 (46): E1350–E1360. doi:10.1503/cmaj.180311. PMC 6239917. PMID 30455270.
- ↑ ۴۷٫۰ ۴۷٫۱ Vernazza, P; Bernard, EJ (January 29, 2016). "HIV is not transmitted under fully suppressive therapy: The Swiss Statement – eight years later". Swiss Medical Weekly. 146: w14246. doi:10.4414/smw.2016.14246. PMID 26824882.
- ↑ "HIV and Men". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on December 1, 2019. Retrieved November 3, 2019.
- ↑ "HIV and Gay and Bisexual Men". U.S. Centers for Disease Control and Prevention (CDC). Archived from the original on November 2, 2019. Retrieved November 3, 2019.
- ↑ "HIV Among Gay and Bisexual Men" (PDF). Archived (PDF) from the original on December 18, 2016. Retrieved January 1, 2017.
- ↑ Yu, M (August 2010). "Mucosal HIV transmission and vaccination strategies through oral compared with vaginal and rectal routes". Expert opinion on biological therapy 10 (به انگلیسی) (۸): ۱۱۸۱–۹۵. doi:10.1517/14712598.2010.496776. PMC 2904634. PMID 20624114.
- ↑ Stürchler, Dieter A. (2006). Exposure a guide to sources of infections (به انگلیسی). ASM Press. p. ۵۴۴. Archived from the original on 19 March 2013.
- ↑ Pattman R, et al., eds. (2010). Oxford handbook of genitourinary medicine, HIV, and sexual health (2nd ed.). Oxford: Oxford University Press. p. 95. ISBN 978-0-19-957166-6.
- ↑ ۵۴٫۰ ۵۴٫۱ Ng BE, Butler LM, Horvath T, Rutherford GW (March 2011). Butler LM (ed.). "Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection". The Cochrane Database of Systematic Reviews (3): CD001220. doi:10.1002/14651858.CD001220.pub3. PMID 21412869.
- ↑ Anderson J (February 2012). "Women and HIV: motherhood and more". Current Opinion in Infectious Diseases. 25 (1): 58–65. doi:10.1097/QCO.0b013e32834ef514. PMID 22156896. S2CID 6198083.
- ↑ Klimas N, Koneru AO, Fletcher MA (June 2008). "Overview of HIV". Psychosomatic Medicine. 70 (5): 523–30. doi:10.1097/PSY.0b013e31817ae69f. PMID 18541903. S2CID 38476611.
- ↑ Draughon, JE (2012). "Nonoccupational post exposure prophylaxis following sexual assault in industrialized low-HIV-prevalence countries: a review". Psychology, health & medicine 17 (به انگلیسی) (۲): ۲۳۵–۵۴. doi:10.1080/13548506.2011.579984. PMID 22372741.
- ↑ ۵۸٫۰ ۵۸٫۱ Baggaley, RF (2006-04-04). "Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis". AIDS (London, England) (به انگلیسی). 20: 12-805. doi:10.1097/01.aids.0000218543.46963.6d. PMID 16549963.
- ↑ "HIV in the United States: An Overview". Center for Disease Control and Prevention (به انگلیسی). March 2012. Archived from the original on 19 March 2013. Retrieved 19 January 2013.
- ↑ "Will I need a blood transfusion?" (PDF). NHS patient information (به انگلیسی). National Health Services. 2011. Archived from the original (PDF) on 19 March 2013. Retrieved 20 January 2013.
- ↑ UNAIDS 2011 pg. 60–70
- ↑ "Blood safety ... for too few" (به انگلیسی). WHO. 2001. Archived from the original on 10 March 2013. Retrieved January 17, 2006.
- ↑ ۶۳٫۰ ۶۳٫۱ Reid, SR (2009-08-28). "Injection drug use, unsafe medical injections, and HIV in Africa: a systematic review". Harm reduction journal (به انگلیسی): 24. doi:10.1186/1477-7517-6-24. PMC 2741434. PMID 19715601.
- ↑ ۶۴٫۰ ۶۴٫۱ "Basic Information about HIV and AIDS". Center for Disease Control and Prevention (به انگلیسی). April 2012. Archived from the original on 19 March 2013. Retrieved 20 January 2013.
- ↑ "Why Mosquitoes Cannot Transmit AIDS [HIV virus]" (به انگلیسی). Rci.rutgers.edu. 2010-07-28. Archived from the original on 19 March 2013. Retrieved 15 November 2013.
- ↑ ۶۶٫۰ ۶۶٫۱ ۶۶٫۲ ۶۶٫۳ ۶۶٫۴ ۶۶٫۵ Coutsoudis, A; Kwaan, L; Thomson, M (2010). "Prevention of vertical transmission of HIV-1 in resource-limited settings". Expert review of anti-infective therapy (به انگلیسی). 8 (10): 1163–75. doi:10.1586/eri.10.94. PMID 20954881.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ "Fluids of transmission". AIDS.gov (به انگلیسی). United States Department of Health and Human Services. 1 November 2011. Archived from the original on 19 March 2013. Retrieved 20 January 2013.
- ↑ ۶۸٫۰ ۶۸٫۱ Thorne, C (2007-06-01). "HIV". Seminars in fetal & neonatal medicine (به انگلیسی) (۳): ۱۷۴–۸۱. doi:10.1016/j.siny.2007.01.009. PMID 17321814.
- ↑ Alimonti JB, Ball TB, Fowke KR (2003). "Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS". J. Gen. Virol. (به انگلیسی). 84 (7): 1649–1661. doi:10.1099/vir.0.19110-0. PMID 12810858.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ International Committee on Taxonomy of Viruses (2002). "61.0.6. Lentivirus" (به انگلیسی). National Institutes of Health. Archived from the original on 18 April 2006. Retrieved 2012-06-25.
- ↑ International Committee on Taxonomy of Viruses (2002). "61. Retroviridae" (به انگلیسی). National Institutes of Health. Archived from the original on 29 June 2006. Retrieved 13 March 2013.
- ↑ Lévy, J. A. (1993). "HIV pathogenesis and long-term survival". AIDS (به انگلیسی). 7 (11): 1401–10. doi:10.1097/00002030-199311000-00001. PMID 8280406.
- ↑ Smith, Johanna A. ; Daniel, René (Division of Infectious Diseases, Center for Human Virology, Thomas Jefferson University, Philadelphia) (2006). "Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses". ACS Chem Biol (به انگلیسی). 1 (4): 217–26. doi:10.1021/cb600131q. PMID 17163676.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Martínez, Miguel Angel (2010). RNA interference and viruses: current innovations and future trends (به انگلیسی). Norfolk: Caister Academic Press. p. 73. Archived from the original on 19 March 2013.
- ↑ Gerald B. Pier,Immunology, infection, and immunity (به انگلیسی). Washington, D.C.: ASM Press. 2004. p. 550. Archived from the original on 19 March 2013.
- ↑ Gilbert, PB; McKeague, IW; Eisen, G; Mullins, C; Guéye-Ndiaye, A; Mboup, S; Kanki, PJ (28 February 2003). "Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal". Statistics in Medicine (به انگلیسی). 22 (4): 573–593. doi:10.1002/sim.1342. PMID 12590415.
- ↑ ۷۷٫۰ ۷۷٫۱ Reeves, J. D. and Doms, R. W (2002). "Human Immunodeficiency Virus Type 2". J. Gen. Virol. (به انگلیسی). 83 (Pt 6): 1253–65. doi:10.1099/vir.0.18253-0. PMID 12029140.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Xue, Guangai; Yu, Hyun Jae; Buffone, Cindy; Huang, Szu-Wei; Lee, KyeongEun; Goh, Shih Lin; Gres, Anna T.; Guney, Mehmet Hakan; Sarafianos, Stefan G.; Luban, Jeremy; Diaz-Griffero, Felipe; KewalRamani, Vineet N. (2023). "The HIV-1 capsid core is an opportunistic nuclear import receptor". Nature Communications (به انگلیسی). Nature Publishing Group. 14. doi:10.1038/s41467-023-39146-5. PMID 37355754. Retrieved 2023-12-27.
- ↑ ویروس اچ آی وی در روند تکامل 'خفیف تر شدهاست' - BBC Persian. بیبیسی فارسی. جیمز گالاگر، سردبیر اخبار بهداشتی، بیبیسی نیوز. بازبینی شده در تاریخ ۲ دسامبر ۲۰۱۴. پیوند پایدار (دائمی) بایگانیشده در ۱۹ دسامبر ۲۰۱۴ توسط Wayback Machine
- ↑ Piatak, M. ، Jr, Saag, M. S. , Yang, L. C. , Clark, S. J. , Kappes, J. C. , Luk, K. C. , Hahn, B. H. , Shaw, G. M. and Lifson, J.D. (1993). "High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR". Science (به انگلیسی). ۲۵۹ (۵۱۰۲): ۱۷۴۹–۱۷۵۴. Bibcode:1993Sci...259.1749P. doi:10.1126/science.8096089. PMID 8096089.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Pantaleo G, Demarest JF, Schacker T, Vaccarezza M, Cohen OJ, Daucher M, Graziosi C, Schnittman SS, Quinn TC, Shaw GM, Perrin L, Tambussi G, Lazzarin A, Sekaly RP, Soudeyns H, Corey L, Fauci AS. (1997). "The qualitative nature of the primary immune response to HIV infection is a prognosticator of disease progression independent of the initial level of plasma viremia". Proc Natl Acad Sci U S A. (به انگلیسی). ۹۴ (۱): ۲۵۴–۲۵۸. Bibcode:1997PNAS...94..254P. doi:10.1073/pnas.94.1.254. PMC 19306. PMID 8990195.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Guss DA (1994). "The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1". J Emerg Med (به انگلیسی). ۱۲ (۳): ۳۷۵–۸۴. doi:10.1016/0736-4679(94)90281-X. PMID 8040596.
- ↑ Hel Z, McGhee JR, Mestecky J (2006). "HIV infection: first battle decides the war". Trends Immunol. (به انگلیسی). ۲۷ (۶): ۲۷۴–۸۱. doi:10.1016/j.it.2006.04.007. PMID 16679064.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Arie J. Zuckerman (2007). Principles and practice of clinical virology (به انگلیسی) (6th ed.). Hoboken, N.J.: Wiley. p. ۹۰۵. Archived from the original on 19 March 2013.
- ↑ Mehandru S, Poles MA, Tenner-Racz K, Horowitz A, Hurley A, Hogan C, Boden D, Racz P, Markowitz M (2004). "Primary HIV-1 infection is associated with preferential depletion of CD4+ T cells from effector sites in the gastrointestinal tract". J. Exp. Med. (به انگلیسی). ۲۰۰ (۶): ۷۶۱–۷۰. doi:10.1084/jem.20041196. PMC 2211967. PMID 15365095.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Brenchley JM, Schacker TW, Ruff LE, Price DA, Taylor JH, Beilman GJ, Nguyen PL, Khoruts A, Larson M, Haase AT, Douek DC (2004). "CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract". J. Exp. Med. (به انگلیسی). ۲۰۰ (۶): ۷۴۹–۵۹. doi:10.1084/jem.20040874. PMC 2211962. PMID 15365096.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۸۷٫۰ ۸۷٫۱ Aliberti, Julio (2011). Control of Innate and Adaptive Immune Responses During Infectious Diseases (به انگلیسی). New York, NY: Springer Verlag. p. ۱۴۵. Archived from the original on 19 March 2013.
- ↑ Appay V, Sauce D (2008). "Immune activation and inflammation in HIV-1 infection: causes and consequences". J. Pathol. (به انگلیسی). ۲۱۴ (۲): ۲۳۱–۴۱. doi:10.1002/path.2276. PMID 18161758.
- ↑ Brenchley JM, Price DA, Schacker TW, Asher TE, Silvestri G, Rao S, Kazzaz Z, Bornstein E, Lambotte O, Altmann D, Blazar BR, Rodriguez B, Teixeira-Johnson L, Landay A, Martin JN, Hecht FM, Picker LJ, Lederman MM, Deeks SG, Douek DC (2006). "Microbial translocation is a cause of systemic immune activation in chronic HIV infection". Nat. Med. (به انگلیسی). ۱۲ (۱۲): ۱۳۶۵–۷۱. doi:10.1038/nm1511. PMID 17115046.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ US Preventive Services Task, Force; Owens, DK; Davidson, KW; Krist, AH; Barry, MJ; Cabana, M; Caughey, AB; Curry, SJ; Doubeni, CA; Epling JW, Jr; Kubik, M; Landefeld, CS; Mangione, CM; Pbert, L; Silverstein, M; Simon, MA; Tseng, CW; Wong, JB (June 18, 2019). "Screening for HIV Infection: US Preventive Services Task Force Recommendation Statement". JAMA. 321 (23): 2326–2336. doi:10.1001/jama.2019.6587. PMID 31184701.
- ↑ "HIV/AIDS Testing". CDC. March 16, 2018. Archived from the original on April 14, 2018. Retrieved April 14, 2018.
- ↑ "Who Should Get Tested for HIV & AIDS?". HIV.gov (به انگلیسی). 2023-03-06. Retrieved 2023-12-07.
- ↑ «HIV Testing | Understanding HIV/AIDS | AIDSinfo». بایگانیشده از اصلی در ۲۷ آوریل ۲۰۱۷. دریافتشده در ۳۰ آوریل ۲۰۱۷.
- ↑ مرکز ملی پیشگیری از ایدز ایران. بازبینی شده در تاریخ ۱۸ ژانویهٔ ۲۰۱۶. پیوند پایدار (نسخه دائمی بایگانی شده).
- ↑ مرکز ملی پیشگیری از ایدز ایران بایگانیشده در ۲۹ اکتبر ۲۰۱۶ توسط Wayback Machine. بازبینی شده و بایگانی شده در تاریخ ۱۵ ژانویهٔ ۲۰۱۶. پیوند پایدار (دائمی) یا نسخۀ بایگانی شده بایگانیشده در ۲۴ ژوئیه ۲۰۲۱ توسط Wayback Machine.
- ↑ HIV/AIDS | معاونت بهداشتی | دانشگاه علوم پزشکی | کاشان بایگانیشده در ۱۰ اوت ۲۰۱۶ توسط Wayback Machine. معاونت بهداشتی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی کاشان. بازبینی و بایگانی در تاریخ ۱۵ ژانویهٔ ۲۰۱۶..
- ↑ ۹۷٫۰ ۹۷٫۱ Kellerman, S; Essajee, S (2010). "HIV testing for children in resource-limited settings: what are we waiting for?". PLoS medicine (به انگلیسی). ۷ (۷): e1000285. doi:10.1371/journal.pmed.1000285. PMC 2907270. PMID 20652012.
- ↑ ۹۸٫۰ ۹۸٫۱ ۹۸٫۲ UNAIDS 2011 pg. 70–80
- ↑ ۹۹٫۰ ۹۹٫۱ ۹۹٫۲ ۹۹٫۳ Schneider, E; Whitmore, S; Glynn, KM; Dominguez, K; Mitsch, A; McKenna, MT; Centers for Disease Control and Prevention, (CDC) (2008-12-05). "Revised surveillance case definitions for HIV infection among adults, adolescents, and children aged <18 months and for HIV infection and AIDS among children aged 18 months to <13 years--United States, 2008". MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control (به انگلیسی). 57 (RR–10): 1–12. PMID 19052530.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Crosby, R; Bounse, S (2012). "Condom effectiveness: where are we now?". Sexual health (به انگلیسی). 9 (1): 10–7. doi:10.1071/SH11036. PMID 22348628.
- ↑ "Condom Facts and Figures" (به انگلیسی). WHO. 2003. Archived from the original on 19 March 2013. Retrieved January 17, 2006.
- ↑ Gallo, MF; Kilbourne-Brook, M; Coffey, PS (2012). "A review of the effectiveness and acceptability of the female condom for dual protection". Sexual health (به انگلیسی). 9 (1): 18–26. doi:10.1071/SH11037. PMID 22348629.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ ۱۰۳٫۰ ۱۰۳٫۱ Celum, C; Baeten, JM (2012). "Tenofovir-based pre-exposure prophylaxis for HIV prevention: evolving evidence". Current opinion in infectious diseases (به انگلیسی). 25 (1): 51–7. doi:10.1097/QCO.0b013e32834ef5ef. PMC 3266126. PMID 22156901.
- ↑ Baptista, M; Ramalho-Santos, J (2009-11-01). "Spermicides, microbicides and antiviral agents: recent advances in the development of novel multi-functional compounds". Mini reviews in medicinal chemistry (به انگلیسی). 9 (13): 1556–67. doi:10.2174/138955709790361548. PMID 20205637.
- ↑ Siegfried, N; Muller, M; Deeks, JJ; Volmink, J (2009-04-15). Siegfried, Nandi (ed.). "Male circumcision for prevention of heterosexual acquisition of HIV in men". Cochrane database of systematic reviews (Online) (به انگلیسی) (2): CD003362. doi:10.1002/14651858.CD003362.pub2. PMID 19370585.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ "WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention" (به انگلیسی). World Health Organization. Mar 28, 2007. Archived from the original on 19 March 2013. Retrieved 25 January 2013.
- ↑ Larke, N (2010). "Male circumcision, HIV and sexually transmitted infections: a review". British journal of nursing (Mark Allen Publishing) (به انگلیسی). 19 (10): 629–34. PMID 20622758.
- ↑ Eaton, L; Kalichman, SC (2009). "Behavioral aspects of male circumcision for the prevention of HIV infection". Current HIV/AIDS reports (به انگلیسی). 6 (4): 187–93. doi:10.1007/s11904-009-0025-9. PMID 19849961.(subscription required)
- ↑ Kim, HH; Li, PS, Goldstein, M (2010). "Male circumcision: Africa and beyond?". Current opinion in urology (به انگلیسی). 20 (6): 515–9. doi:10.1097/MOU.0b013e32833f1b21. PMID 20844437.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Templeton, DJ; Millett, GA, Grulich, AE (2010). "Male circumcision to reduce the risk of HIV and sexually transmitted infections among men who have sex with men". Current opinion in infectious diseases (به انگلیسی). 23 (1): 45–52. doi:10.1097/QCO.0b013e328334e54d. PMID 19935420.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Wiysonge, CS.; Kongnyuy, EJ. (2011). Wiysonge, Charles Shey (ed.). "Male circumcision for prevention of homosexual acquisition of HIV in men". Cochrane Database Syst Rev (به انگلیسی) (6): CD007496. doi:10.1002/14651858.CD007496.pub2. PMID 21678366.
- ↑ Utz-Billing I, Kentenich H (2008). "Female genital mutilation: an injury, physical and mental harm". J Psychosom Obstet Gynaecol (به انگلیسی). 29 (4): 225–9. doi:10.1080/01674820802547087. PMID 19065392.
- ↑ Underhill K, Operario D, Montgomery P (2008). Operario, Don (ed.). "Abstinence-only programs for HIV infection prevention in high-income countries". Cochrane Database of Systematic Reviews (به انگلیسی) (4): CD005421. doi:10.1002/14651858.CD005421.pub2. PMID 17943855. Archived from the original on 19 March 2013.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Tolli, MV (2012-05-28). "Effectiveness of peer education interventions for HIV prevention, adolescent pregnancy prevention and sexual health promotion for young people: a systematic review of European studies". Health education research (به انگلیسی). doi:10.1093/her/cys055. PMID 22641791.
- ↑ Ljubojević, S; Lipozenčić, J (2010). "Sexually transmitted infections and adolescence". Acta dermatovenerologica Croatica: ADC (به انگلیسی). 18 (4): 305–10. PMID 21251451.
- ↑ Patel VL, Yoskowitz NA, Kaufman DR, Shortliffe EH (2008). "Discerning patterns of human immunodeficiency virus risk in healthy young adults". Am J Med (به انگلیسی). 121 (4): 758–764. doi:10.1016/j.amjmed.2008.04.022. PMC 2597652. PMID 18724961.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Fonner VA, Denison J, Kennedy CE, O'Reilly K, Sweat M (September 2012). "Voluntary counseling and testing (VCT) for changing HIV-related risk behavior in developing countries". The Cochrane Database of Systematic Reviews. 9 (9): CD001224. doi:10.1002/14651858.CD001224.pub4. PMC 3931252. PMID 22972050.
- ↑ Lopez, LM; Grey, TW; Chen, M; Denison, J; Stuart, G (August 9, 2016). "Behavioral interventions for improving contraceptive use among women living with HIV". The Cochrane Database of Systematic Reviews. 2016 (8): CD010243. doi:10.1002/14651858.CD010243.pub3. PMC 7092487. PMID 27505053.
- ↑ National Institute of Allergy and Infectious Diseases (NIAID), "Treating HIV-infected People with Antiretrovirals Protects Partners from Infection", NIH News, 2011 May
- ↑ Anglemyer, A; Rutherford, GW; Baggaley, RC; Egger, M; Siegfried, N (2011). Rutherford, George W (ed.). "Antiretroviral therapy for prevention of HIV transmission in HIV-discordant couples". Cochrane database of systematic reviews (Online) (به انگلیسی) (۸): CD009153. doi:10.1002/14651858.CD009153.pub2. PMID 21833973.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Anglemyer A, Rutherford GW, Horvath T, Baggaley RC, Egger M, Siegfried N (April 2013). "Antiretroviral therapy for prevention of HIV transmission in HIV-discordant couples". The Cochrane Database of Systematic Reviews. 4 (4): CD009153. doi:10.1002/14651858.CD009153.pub3. PMC 4026368. PMID 23633367.
- ↑ Chou R, Selph S, Dana T, Bougatsos C, Zakher B, Blazina I, Korthuis PT (November 2012). "Screening for HIV: systematic review to update the 2005 U.S. Preventive Services Task Force recommendation". Annals of Internal Medicine. 157 (10): 706–18. doi:10.7326/0003-4819-157-10-201211200-00007. PMID 23165662. S2CID 27494096.
- ↑ Owens, Douglas K.; Davidson, Karina W.; Krist, Alex H.; Barry, Michael J.; Cabana, Michael; Caughey, Aaron B.; Curry, Susan J.; Doubeni, Chyke A.; Epling, John W.; Kubik, Martha; Landefeld, C. Seth; Mangione, Carol M.; Pbert, Lori; Silverstein, Michael; Simon, Melissa A.; Tseng, Chien-Wen; Wong, John B. (June 11, 2019). "Preexposure Prophylaxis for the Prevention of HIV Infection". JAMA. 321 (22): 2203–2213. doi:10.1001/jama.2019.6390. PMID 31184747.
- ↑ Choopanya K, Martin M, Suntharasamai P, Sangkum U, Mock PA, Leethochawalit M, Chiamwongpaet S, Kitisin P, Natrujirote P, Kittimunkong S, Chuachoowong R, Gvetadze RJ, McNicholl JM, Paxton LA, Curlin ME, Hendrix CW, Vanichseni S (June 2013). "Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial". The Lancet. 381 (9883): 2083–90. doi:10.1016/S0140-6736(13)61127-7. PMID 23769234. S2CID 5831642.


 French
French Deutsch
Deutsch