Polonio-210 , la enciclopedia libre
| Polonio-210 | ||
|---|---|---|
| Isótopo de polonio | ||
| General | ||
| Símbolo | 210Po | |
| Neutrones | 126 | |
| Protones | 84 | |
| Datos del núclido | ||
| Abundancia natural | Traza | |
| Período de semidesintegración | 138,376 días ± 0,002 días[1] | |
| Isótopos padres | 210Bi | |
| Productos de desintegración | 206Pb | |
| Masa atómica | 209,9828736 u u | |
| Espín | 0 | |
| Modo y energía de desintegración | ||
| Desintegración alfa | 5,40753 eV | |
| Véase también: Isótopos de polonio | ||
El polonio-210 (210Po, Po-210, históricamente radio F) es un isótopo de polonio. Sufre desintegración alfa al isótopo estable 206Pb, y posee una vida media de 138,376 días, el más largo de todos los isótopos de polonio naturales.[1] Identificado por primera vez en 1898, y también marcando el descubrimiento del elemento polonio, se puede generar 210Po en la cadena de desintegración del uranio-238 y radio-226. 210Po es un contaminante prominente del medio ambiente, que afecta principalmente a los mariscos y al tabaco. También es extremadamente tóxico para los humanos como resultado de su intensa radiactividad.
Historia[editar]

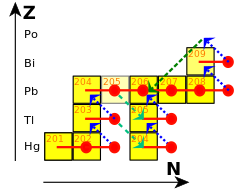
En 1898, Marie y Pierre Curie descubrieron una sustancia fuertemente radiactiva en la uraninita y determinaron que era un elemento nuevo; Fue uno de los primeros elementos radioactivos descubiertos. Habiéndolo identificado como tal, llamaron al elemento polonio por el país de origen de Marie, Polonia. Willy Marckwald descubrió una actividad radioactiva similar en 1902 y lo llamó radio-telurio, y más o menos al mismo tiempo, Ernest Rutherford identificó la misma actividad en su análisis de la cadena de descomposición del uranio y lo llamó radio F (originalmente radio E). Para 1905, Rutherford concluyó que todas estas observaciones se debían a la misma sustancia, 210Po. Otros descubrimientos y el concepto de isótopos, propuesto por primera vez en 1913 por Frederick Soddy, colocó firmemente a 210Po como el penúltimo paso en la serie del uranio.[2]
En 1943, 210Po fue estudiado como un posible iniciador de neutrones en armas nucleares, como parte del Proyecto Dayton. En décadas posteriores, la preocupación por la seguridad de los trabajadores que manejaban 210Po llevó a estudios extensos sobre sus efectos en la salud.[3]
En la década de 1950, los científicos de la Comisión de Energía Atómica de los Estados Unidos en los Laboratorios Mound, Ohio, exploraron la posibilidad de usar 210Po en generadores termoeléctricos de radioisótopos (RTG) como fuente de calor para alimentar satélites. En 1958 se desarrolló una batería nuclear de 2,5 vatios con 210Po. Sin embargo, se eligió el isótopo plutonio-238, ya que tiene una vida media más larga (87,7 años).[4]
El polonio-210 se usó para matar al disidente ruso y exoficial del FSB Alexander Litvinenko en 2006,[5][6] y se sospechó que era una posible causa de la muerte de Yasser Arafat, luego de la exhumación y el análisis de su cadáver en 2012-2013.[7]
Propiedades de desintegración[editar]
El 210Po es un emisor alfa que tiene una vida media de 138,376 días,[1] se descompone directamente a isótopos estables de 206Pb. La mayoría de las veces, 210Po decae solo por emisión de una partícula alfa, no por emisión de una partícula alfa y un rayo gamma; aproximadamente uno de cada 100 000 desintegraciones resulta en la emisión de un rayo gamma.[8] Esta baja tasa de producción de rayos gamma hace que sea más difícil encontrar e identificar este isótopo. En lugar de la espectroscopía de rayos gamma, la espectroscopía alfa es el mejor método para medir este isótopo.
Debido a su vida media mucho más corta, un miligramo de 210Po emite tantas partículas alfa por segundo como 5 gramos de 226Ra.[9] Unos pocos curios de 210Po emiten un brillo azul causado por la excitación del aire circundante.
210Po ocurre en cantidades diminutas en la naturaleza, donde es el penúltimo isótopo en la cadena de descomposición de la serie del uranio. Se genera a través de la desintegración beta de 210Pb y 210Bi.
El proceso S se termina en la descomposición de 210Po, ya que el flujo de neutrones es insuficiente para conducir a más capturas neutrónicas en la corta vida útil de 210Po. En cambio, 210Po decae a 206Pb mediante desintegración alfa, que luego captura más neutrones para convertirse en 210Po y repetir el ciclo, consumiendo así los neutrones restantes. Esto da como resultado una acumulación de plomo y bismuto, y asegura que los elementos más pesados como el torio y el uranio solo se produzcan en procesos R.[10]
Producción[editar]
Aunque 210Po se produce en pequeñas cantidades en la naturaleza, no es lo suficientemente abundante (0,1 ppb) para que la extracción del mineral de uranio sea factible. En cambio, la mayoría de 210Po se produce sintéticamente, a través del bombardeo de neutrones de 209Bi en un ciclotrón. Este proceso convierte 209Bi a 210Bi, que mediante desintegración beta decae a 210Po con una vida media de cinco días. Mediante este método, se producen aproximadamente 8 gramos de 210Po en Rusia y se envían a los Estados Unidos cada mes para aplicaciones comerciales.[3]
Aplicaciones[editar]
Un solo gramo de 210Po genera 140 vatios de potencia.[11] Debido a que emite muchas partículas alfa, que se detienen dentro de una distancia muy corta en medios densos y liberan su energía, 210Po se ha utilizado como una fuente de calor liviana para alimentar células termoeléctricas en satélites artificiales; por ejemplo, una fuente de calor de 210Po también estaba en cada uno de los rovers Lunojod desplegados en la superficie de la Luna, para mantener calientes sus componentes internos durante las noches lunares.[12] Algunos cepillos antiestáticos, utilizados para neutralizar la electricidad estática en materiales como películas fotográficas, contienen algunos microcurios de 210Po como fuente de partículas cargadas.[13] 210Po también se usó en iniciadores para bombas atómicas a través de la reacción (α, n) con berilio.[14]
Peligros[editar]
El 210Po es extremadamente tóxico; él y otros isótopos de polonio son algunas de las sustancias más radiotóxicas para los humanos.[5][15] Con un microgramo es más que suficiente para matar al adulto promedio. 210Po es 250 000 veces más tóxico que el cianuro de hidrógeno en peso;[16] también se cree que un gramo de 210Po es suficiente para matar a 100 millones de personas.[5] Esto es una consecuencia de su radiación alfa ionizante, ya que las partículas alfa son especialmente dañinas para los tejidos orgánicos dentro del cuerpo. Sin embargo, 210Po no representa una amenaza fuera del cuerpo, ya que las partículas alfa no pueden penetrar en la piel humana.[5]
La toxicidad de 210Po proviene completamente de su radioactividad. No es químicamente tóxico en sí mismo, pero su solubilidad en solución acuosa, así como la de sus sales, representa un peligro porque su propagación por todo el cuerpo se facilita en solución.[5] La ingesta de 210Po se produce principalmente a través del aire, alimentos o agua contaminados, así como a través de heridas abiertas. Una vez dentro del cuerpo, 210Po se concentra en los tejidos blandos (especialmente en el sistema reticuloendotelial) y el torrente sanguíneo. Su semivida de eliminación es de aproximadamente 50 días.[17]
En el medio ambiente, 210Po pueden acumularse en los mariscos.[18] Se ha detectado en varios organismos en el Mar Báltico, donde puede propagarse y contaminar así la cadena alimentaria.[15] También se sabe que 210Po contamina la vegetación, principalmente originada por la descomposición del radón 222.[19]
En particular, 210Po se adhiere y se concentra en las hojas de tabaco.[3][17] Se documentaron concentraciones elevadas de 210Po en tabaco ya en 1964, y se descubrió que los fumadores de cigarrillos estaban expuestos a dosis considerablemente mayores de radiación de 210Po y 210Pb.[19] Los fumadores empedernidos pueden estar expuestos a la misma cantidad de radiación (las estimaciones varían de 100 µSv[15] a 160 mSv[20] por año) que los polacos afectados por el desastre de Chernobyl.[15] Como resultado, el 210Po es más peligroso cuando se inhala del humo del cigarrillo, lo que proporciona más evidencia de un vínculo entre fumar y el cáncer de pulmón.[21]
Referencias[editar]
- ↑ a b c Nuclear Data Center at KAERI; Table of Nuclides http://atom.kaeri.re.kr/nuchart/?zlv=1
- ↑ Thoennessen, M. (2016). The Discovery of Isotopes: A Complete Compilation. Springer. pp. 6–8. doi:10.1007/978-3-319-31763-2. ISBN 978-3-319-31761-8. LCCN 2016935977.
- ↑ a b c Roessler, G. (2007). «Why 210Po?». Health Physics News (Health Physics Society) 35 (2). Archivado desde el original el 3 de abril de 2014. Consultado el 20 de junio de 2019.
- ↑ Idaho National Laboratory (2015). «The Early Years: Space Nuclear Power Systems Take Flight». Atomic power in space II: a history of space nuclear power and propulsion in the United States. pp. 2-5. OCLC 931595589.
- ↑ a b c d e McFee, R. B.; Leikin, J. B. (2009). «Death by polonium-210: lessons learned from the murder of former Soviet spy Alexander Litvinenko». Seminars in Diagnostic Pathology 26 (1): 61-67. PMID 19292030. doi:10.1053/j.semdp.2008.12.003.
- ↑ Cowell, A. (24 de noviembre de 2006). «Radiation Poisoning Killed Ex-Russian Spy». The New York Times. Archivado desde el original el 19 de junio de 2019. Consultado el 19 de junio de 2019.
- ↑ «Arafat's death: what is Polonium-210?». Al Jazeera. 10 de julio de 2012. Archivado desde el original el 19 de junio de 2019. Consultado el 19 de junio de 2019.
- ↑ «210PO A DECAY». Korea Atomic Energy Research Institute. Archivado desde el original el 24 de febrero de 2015.
- ↑ C. R. Hammond. «The Elements». Fermi National Accelerator Laboratory. pp. 4-22. Archivado desde el original el 26 de junio de 2008. Consultado el 19 de junio de 2019.
- ↑ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). «Synthesis of the Elements in Stars». Reviews of Modern Physics 29 (4): 547-650. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ↑ «Polonium». Argonne National Laboratory. Archivado desde el original el 10 de marzo de 2012.
- ↑ A. Wilson, Solar System Log, (London: Jane's Publishing Company Ltd, 1987), p. 64.
- ↑ «Staticmaster Alpha Ionizing Brush». Company 7. Archivado desde el original el 27 de septiembre de 2018. Consultado el 19 de junio de 2019.
- ↑ Hoddeson, L.; Henriksen, P. W.; Meade, R. A. (12 de febrero de 2004). Critical Assembly: A Technical History of Los Alamos During the Oppenheimer Years, 1943-1945. Cambridge University Press. ISBN 978-0-521-54117-6.
- ↑ a b c d Skwarzec, B.; Strumińska, D. I.; Boryło, A. (2006). «Radionuclides of iron (55Fe), nickel (63Ni), polonium (210Po), uranium (234U, 235U, 238U), and plutonium (238Pu, 239+240Pu, 241Pu) in Poland and Baltic Sea environment». Nukleonika 51: S45-S51. Archivado desde el original el 19 de junio de 2019. Consultado el 19 de junio de 2019.
- ↑ Ahmed, M. F.; Alam, L.; Mohamed, C. A. R.; Mokhtar, M. B.; Ta, G. C. (2018). «Health risk of polonium-210 ingestion via drinking water: An experience of Malaysia». International Journal of Environmental Research and Public Health 15 (10): 2056-1-2056-19. PMC 6210456. PMID 30241360. doi:10.3390/ijerph15102056.
- ↑ a b Frequently asked questions about polonium-210., Centers for Disease Control and Prevention, archivado desde el original el 7 de junio de 2017, consultado el 19 de junio de 2019.
- ↑ Richter, F.; Wagmann, M.; Zehringer, M. (2012). «Polonium – on the Trace of a Powerful Alpha Nuclide in the Environment». CHIMIA International Journal for Chemistry 66 (3): 131. doi:10.2533/chimia.2012.131. Archivado desde el original el 17 de febrero de 2019. Consultado el 19 de junio de 2019.
- ↑ a b Persson, B. R. R.; Holm, E. (2009). Polonium-210 and Lead-210 in the Terrestrial environment: A historical review. International Topical Conference on Po and Radioactive Pb Isotopes. Seville, Spain.
- ↑ «F. Typical Sources of Radiation Exposure». National Institute of Health. Archivado desde el original el 13 de junio de 2013. Consultado el 20 de junio de 2019.
- ↑ Radford, E. P.; Hunt, V. R. (1964). «Polonium-210: A Volatile Radioelement in Cigarettes». Science 143 (3603): 247-249. Bibcode:1964Sci...143..247R. JSTOR 1712451. PMID 14078362. doi:10.1126/science.143.3603.247.


 French
French Deutsch
Deutsch