Karbonat turşusu — Vikipediya
| Karbonat turşusu | |
|---|---|
 | |
 | |
| Ümumi | |
| Sistematik adı | Karbonat turşusu |
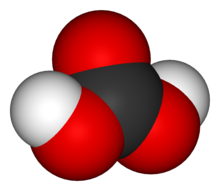
| Kimyəvi formulu | H2CO3 |
| Nisbi mol. kütl. | 62.03 а. k. v. |
| Molyar kütlə | 62.03 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1.00 q/sm³ |
| Kimyəvi xassələri | |
| Turşunun dissosasiya sabiti | 6.36, 10.25 |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 463-79-6 |
| PubChem | 767 |
| SMILES | C(=O)(O)O |
| ChEBI | 28976 |
| ChemSpider | 747 |
Karbonat turşusu — kimyəvi formulu H2CO3 olan zəif ikiəsaslı turşu. Turşuların bütün xassələrinə malikdir.
Karbonat turşusu normal şəraitdə suya və karbon qazına parçalandığına görə sərbəst halda mövcud deyil:
CO2 + H2O ↔ H2CO3
Karbonat turşusunun molekulundakı kimyəvi rabitə polyar kovalent rabitələrdir.
Karbonat turşusunun törəmələri[redaktə | mənbəni redaktə et]
Karbonat turşusunun da başqa üzvi turşular kimi müvafiq törəmələri vardır. Bu törəmələrdən karbonat turşusunun xloranhidridlərini, esterlərini və amidlərini göstərmək olar.
Karbonat turşusunun xloranhidridləri[redaktə | mənbəni redaktə et]
Karbonat turşusunun iki cür xloranhidridi ola bilər. Bunalrada xlorkarbonat turşusu, ikincisi karboksixlorid və fosgen adlanır. Fosgen və ya karboksixlorid birinci dəfə Devi tərəfindən dəm qazına günəz işiğının təsiri ilə xlor birləşdirməklə alınmışdır, buna görə də fosgen (fos-yunanca) işıq adlanmışdır. İndi, fosgen üçün dəm qazı ilə xloru 2000-də kömür katalizatoru üzərindən buraxılırlar. Fosgen zəhərli boğucu qazdır, 80C-də qaynayır, benzolda yaxşı həll olur, su ilə parçalanır, karbon qazı ilə xlorid turşusu əmələ gətirir. Fosgen spirt ilə xlorkarbonat esteri, daha uzun müddət çox spirt təsirində karbonat esteri əmələ gətirir. Fosgen birinci dünya müharibəsi zamanı zəhərləyici qaz kimi işlənilirdi. Onu bəzi üzvi sintezlər (molekula CO qrupu daxil etmək) üçün də işlədirlər. Xlorkarbonat turşusu Cl-CO-OH qeyri-sabit birləşmə olub, öz-özünə karbon qazına və hidrogenxloridə parçalanır. Xlorkarbonat turşusunun esterlərinə xlorla, və ya fosgenə spirtlərlə təsir etdikdə alına bilir. Xlorkarbonat esterləri kəskinliyi iyli, boğucu mayelərdir. Bunlardan xlorkarbonat turşusunun metil esteri 71,50C-də qaynayır. Bunu xlorlaşdırdıqda xlorkarbonat turşusunun qrixlormetil esteri alınır. Empirik düsturu C2O2Cl4 olan ester fosgenin COCl2 iki misli olduğu üçün, difosgen adlanır. Difosgen zəhərləyici, ağır mayedir. Onu qızdırdıqda fosgenə parçalanır. Difosgen də fosgen kimi birinci dünya müharibəsində zəhərləyici maddə olaraq işlənirdi.
Karbonat turşusunun amidləri[redaktə | mənbəni redaktə et]
Karbonat turşusunun amidləri də iki cür ola bilər.
- Qeyri-tam amid karbamin turşusu NH2-CO-OH
- Tam amid karbamid və ya sidik cövhəri H2N-CO-NH2
Karbamin turşusu və onun törəmələri[redaktə | mənbəni redaktə et]
Karbamin turşusu H2N-COOH özü məlum deyil. Onun duzlarından ammonium duzu susuz karbon qazı və amonyakdan alına bilər. Bu duz ammonium –karbonatın (NH4)2CO3 sulu məhlulunda rast gəlinir, qızdırdıqda bir molekul su ayrılaraq karbamidə çevrilir. Karbamin turşusunun xlor anhidridi H2N-COCl və esterləri H2N-COOR məlumdur. Karbamin turşularının esterlərinə uretanlar deyilir. Uretanlar aşağıdakı üsullarla alına bilir.
- Xlorkarbonat esterlərinə ammonyak ilə təsir etməklə
- Karbamin turşusunun xloranhidridinə spirtlə təsir etməklə
- Karbamidi spirtlə qızdırmaqla
Uretanlar bərk maddələr olub, təbabətdə sakitləşdirici və yuxugətirici vasitələr kimi işlənir. Bunlardan uretan (etil –uretan H2C-COOC2H5, aponal (üçlüamil-uretan)H2NCOOC5H11, kedonal (ikiliamid-uretan), eyforin (fenil-uretan) H2N-COOC5H5 və s. göstərmək olar. Karbamid və ya sidik cövhəri H2N-CO-NH2 sidikdə rast gəlir. Orta yaşlı adam sutkada 28-30q sidik cövhəri ifraz edir. Sidik cövhərinin üzvi kimyada tarixi əhəmiyyəti vardır. Bu sintetik sürətdə alınan ilk üzvi maddələrdəndi. Bəzi nənbələrdə sidik cövhərinin Veler tərəfindən ammonium-sianatdan alındığını göstəmişlər. Indi sidik cövhərinin fosgenə ammonyakla təsir etməklə alırlar. Ancaq bu üsul ilə karbamid almaq nisbətən baha başa gəlir. Bundan başqa texnikada karbamidi sianamiddən, onu mineral turşuların zəif məhlulu ilə qızdırmaqla da alırlar. Karbamid 1330C-də əriyən, suda həll olan maddədir. Turşularala və ya qələvilərlə qızdırdıqda, habelə adi temperaturda enzimlərin təsirindən karbamid parçalanır, ammonyak və karbon qazı əmələ gəlir. Susuz karbamid molekulları, ehtiyatla və tədricən 150-1600C-də qızdırıldıqda ammonya çıxır və 1980C əriyən bərk maddə0 biuretə çevrilir. Biuret qələvi mühitdə mis duzları ilə bənövşəyi rəng verir. Biuret reaksiyası adlanan bu rəngli reaksiya zülali maddələr üçün də xarakterik olub, onları almaq üçün işlənir. Karbamid neytral maddə olduğuna baxmayaraq, bəzi turşularla duzlar əmələ gətirə bilir. Bu zaman karbamidin yalnız bir amin NH2 qrupu hesabına duz əmələ gəlir, ikinci amin qrupu isə reaksiyaya girmir. Bu duzlardan karbamidnitrat H2N-CO-NH2 ∙HNO3 və ya karbamidokslat H2N-CO-NH2∙H2C2O4∙H2N-CO-NH2 duzları suda həll olmur. Karbamidə üzvi turşular, onların anhidridləri və xloranhidridləri ilə təsir etdikdə, onun bir amin qrupunda hidroksillərdən birini turşu qalığı ilə əvəz etmək olur. Bunun nəticəsində ureid adlanan maddələr alınır. Sirkə anhidridi ilə karbamidə təsir etdikdə asetilkarbamid CH3CO-NH-CO-NH2: α-bromizovalerian turşusunun təsiri ilə α-bromizovalerilkarbamid (CH3)2-CH-CHBr-CO-NH-CO-NH2 və ya bromural, α-yodizovalerian turşusunun təsiri ilə yodival alınır. Bu ureidlər yuxugətirici maddələr olub, təbabətdə işlədilir. Ikiəsaslı turşulrın ureidlərindən oksalur turşusu H2N-CO-NH-CO-COOH və ya qapalı ureid paraban turşusu karbamidin osalat turşusu ilə əmələ gətirdiyi reaksiya məhsuludur. Malon turşusu ilə karbamid təsir etdikdə iki moklekul su ayrır və barbitur turşusu əmələ gətirir. Barbitur turşusunun homoloqu dietilarbitur turşusu təbabətdə veronal adı ilə sakitləşdirici kimi işlədilir. Karbamid gübrə kimi, nitrosellulozu sabitləşdirmək üçün, yuxugətirici və sakitləşdirici dərmalar almaq üçün işlədilir. Bundan başqa karbamidi qarışqa aldehidi ilə kondensləşdirməklə, ondan metilokarbamid və dimetilolkarbamid . Sonra NH-CO-NH-CH2-NH-CO-NH-CH2- və başqa tipli karbamid-formaldehid qatranları (aminplastlar) almaq üçün istifadə olunur. Karbamid və ya onun qatı məhlulu, az miqdarda metil spirtinin iştirakı ilə alifatik karbohidrogenlərlə qrışıqda, normal quruluşlu karbohidrogenlərlə bərk kompleks birləşmə əməmlə gətirir, izoqurululu karbohidrogenlərə isə toxunmur. Buna əsaslanaraq, neft məhsullarında olan normal və izoquruluşlu doymuş karbohidrogenləri karbamid vasitəsilə bir-birindən ayırmaq olar. Hazırda neft sənayesində, yüksək keyfiyyətli yağlar almaq üçün karbamidlə təmizləmə (parafinsizləşdirmə) geniş surətdə tətbiq olunur. Quanidin olduqca hiqroskopik, ağ rəngli bərk kristallik maddədir. Quanidin Quano adlanan quş peyini yataqlarında rast gələn və onun müəyyən hissəsini təşkil edən quaninin parçalanmasında alınır. Quanidin törəmələrinə zülali maddələrlə, əzələdə və başqa yerlərdə təsadüf edilir. Quanidin, sianidin ammonium-xloridlə qızdırmaqla almaq olar. Quanidin şidətli qələvi xarakter daşıyır. Barit suyu ilə quanidin parçalanır və sidik cövhərinə çevrilir. Tiokarbamid suda yaxşı hall olan kristallik maddədir. Məhlulu acı dadır,neytraldır. Müəyyən ərimə temperaturu yoxdur, onu qızdırda izomerləşərək, ammonium-tiosianata çevrilir. Tiokarbamid sianamiddən, ona hidrogen-sulfidin təsiri ilə alırlar. Qüvvətli oksidləşdiricilərin təsirinə qarşı həssasdır. Bir çox reaksiyalarına görə karbamidə bənzəyir və onun müvafiq tio-törəmələrinin əmələ gətirə bilir. Sənayedə bəzi dərman preparatları (sulfotiaol, tobarbituratlar) və plastik kütlələr almaq üçün işlədilir.
Karbonat turşusunun esterləri[redaktə | mənbəni redaktə et]
Karbonat turşusunun iki (yarımçıq və tam) esteri ola bilər. Bunlardan metilkarbonat esteri və etilkarbonat esteri yalnız duzlar halında məlumdur. Özləri isə sərbəst yaşamayaraq, asanlıqla spirtə və karbon qazına parçalanır. Karbonat turşusunun dimetil esteri dimetilkarbonat və başa tam esterləri möhkəm birləşmələr olub, xoş iyli mayelərdir, bunlardan adi esterlrin xassələrinin daşıyır.
Karbonat turşusunun kükürdlü törəmələri[redaktə | mənbəni redaktə et]
Karboksisulfid COS. Dəm qazına yüksək temperaturda kükürdün təsiri ilə CO+S → COSvə 4000C-də karbon sulfidə suyun təsiri ilə alınır. Karboksisulfid pis iyli rəngsiz qazdır. Karbon-sulfid CS2 kükürd buxarlarına 800-9000C qızmış kömür üzərindən buraxmaqla alınır. Karbon-sulfid 460C qaynayan və tez alovlanan, efir iyli zəhərli mayedir. Qatranları, yağları, piylri və başqa maddələri asan həll edir. Karbon-sulfid həlledici kimi, kauçukun vulkanlaşdırılması üçün, kənd təsərrüfatı ziyanvericiləri ilə mübarizədə və bəzi birləşmələrin sintezində işlədilir.
Ksantogen turşuları[redaktə | mənbəni redaktə et]
Karbon-sulfid qələvilərin iştirakı ilə spirtlərlə reaksiya nəticəsində ksantogen duzları-ksantogenatlar verir. Qələvi metalların ksantogenatları suda həll olur. Bu ksantogenatlardan ksantogen turşuları almaq olar. Bunlar qeyri-sabit qatı mayelər olub, asan parçalanır, spirtə və karbon-sulfidə ayrılır. Ksantogenatlara halogenalalkillərlə təsir etdikdə onların esterlərin almaq mümükündür.
Mənbə[redaktə | mənbəni redaktə et]
- M.Mövsümzadə, P.Qurbanov "Üzvi kimya", Maarif-1983.


 French
French Deutsch
Deutsch