İmmun sistemi — Vikipediya

İmmun sistemi — orqanizmin vacib sistemlərdən biri olub,orqanizmin müxtəlif infeksion agentlərdən spesifik müdafiəsini təmin edir. İmmunitet sistemi düzgün işləməsi üçün, viruslardan parazitar qurdlara qədər patogenlər kimi tanınan çox sayda helmint aşkar etməli və orqanizmin özünün sağlam toxumasından ayırmalıdır. İmmunitet sisteminin iki əsas alt sistemi mövcuddur: anadangəlmə immun sistemi və adaptiv immun sistemi. Hər iki alt sistem funksiyalarını yerinə yetirmək üçün humoral toxunulmazlıq və hüceyrə vasitəçiliyi toxunulmazlığından istifadə edir. İnsanlardakı qan-beyin maneəsi, qan-beyin boşluğu maye maneəsi və bənzər maye-beyin maneələri, periferik immunitet sistemini beyini qoruyan neyroimmun sistemdən ayırır.
Patogenlər sürətlə inkişaf edə və uyğunlaşa bilər, bununla da immunitet sistemi tərəfindən təsbit edilmədən və zərərsizləşdirilmədən qaçılır; lakin patogenləri tanımaq və zərərsizləşdirmək üçün çoxsaylı müdafiə mexanizmləri də hazırlanmışdır. Hətta bakteriya kimi sadə bir hüceyrəli orqanizmlər də bakteriofaj infeksiyalarından qoruyan fermentlər şəklində əsas immunitet sisteminə malikdirlər. Digər zəruri immunitet mexanizmləri qədim nüvəlilərdə inkişaf etmiş bitki və onurğasızlar kimi müasir nəvələrində qalmışdır. Bu mexanizmlərə faqositoz, defensinlər adlanan antimikrobiyal peptidlər və komplement sistemi daxildir. İnsanlar da daxil olmaqla Ağızçənəlilər daha inkişaf etmiş müdafiə mexanizmlərinə malikdirlər[1] və müəyyən patogenləri daha effektiv şəkildə tanımaq üçün zamanla uyğunlaşma qabiliyyəti də daxil olmaqla. Adaptiv (və ya qazanılmış) toxunulmazlıq, müəyyən bir patogenə ilk reaksiya verdikdən sonra immunoloji yaddaş yaradır, bu da eyni patogenlə sonrakı qarşılaşmalara daha çox reaksiya gətirir. Müəyyən bir patogenə ilk reaksiya verildikdən sonra, eyni patogenlə növbəti qarşılaşmada daha çox reaksiya doğurur. Əldə edilən bu immun proses peyvəndin əsasını təşkil edir.
İmmunitet sisteminin pozğunluğu otoimmün xəstəliklərə, iltihab xəstəliklərinə və Xərçəng xəstəliyinə səbəb ola bilər.[2] İmmun çatışmazlığı, immunitet sistemi adi haldan daha az aktiv olduqda təkrarlanan və həyati təhlükə yaradan infeksiyalara səbəb olur. İnsanlarda immun çatışmazlığı ya ağır birləşmiş immun çatışmazlığı, HİV / AİDS kimi qazanılmış şərtlər və ya immunosupressiv dərmanların istifadəsi kimi bir genetik xəstəliyin nəticəsi ola bilər. Bunun əksinə olaraq, otoimmunitet, hiperaktiv bir immunitet sisteminin normal toxumalara sanki xarici orqanizm kimi hücum etməsi nəticəsində yaranır. Ümumi otoimmün xəstəliklər arasında Hashimoto tiroiditi, romatoid artrit, şəkərli diabet tipi 1 və sistemik lupus eritematosus var. Immunologiya immunitet sisteminin bütün aspektlərinin öyrənilməsini əhatə edir.
Təbəqə qorunması[redaktə | mənbəni redaktə et]
İmmunitet sistemi getdikcə daha çox xüsusi laylı müdafiə ilə orqanizmləri infeksiyadan qoruyur. Fiziki maneələr bakteriya və virus kimi patogenlərin orqanizmə daxil olmasının qarşısını alır. Bir patogen bu maneələri pozarsa, doğuşdan immunitet sistemi təcili, lakin qeyri-spesifik bir cavab verir.[3] Patogenlər fitri cavabdan müvəffəqiyyətlə qaçsa, onurğalılar ikinci bir qorunma təbəqəsinə, doğma reaksiya ilə aktivləşdirilən adaptiv immunitet sisteminə sahibdirlər. Burada immunitet sistemi patogenin tanınmasını yaxşılaşdırmaq üçün bir infeksiya zamanı verdiyi cavabı uyğunlaşdırır. Bu yaxşılaşdırılmış cavab patogen aradan qaldırıldıqdan sonra immunoloji yaddaş şəklində saxlanılır və adaptiv immunitet sisteminin bu patogenlə qarşılaşdıqda hər dəfə daha sürətli və güclü hücumlar etməyə imkan verir.[4][5]
| Anadangəlmə immun sistemi | Adaptiv immun sistemi |
|---|---|
| Cavab spesifik deyil | Patogen və antigenə xüsusi reaksiya |
| Lökositlərdən ibarətdir | Antigenlərdən, B hüceyrələrindən, T hüceyrələrindən ibarətdir |
| Ekspozisiya dərhal maksimum reaksiyaya səbəb olur | Ekspozisiya ilə maksimum cavab arasında gecikmə vaxtı |
| Hüceyrə vasitəçiliyi və yumoral komponentlər | Hüceyrə vasitəçiliyi və yumoral komponentlər |
| İmmunoloji yaddaş yoxdur | Ekspozisiya immunoloji yaddaşa səbəb olur |
| Təxminən bütün həyat formalarında tapılmışdır | Yalnız ağızçənəlilərdə tapılmışdır |
Həm anadangəlmə, həm də adaptiv toxunulmazlıq immunitet sisteminin özünü və özünü olmayan molekulları ayırd etmək qabiliyyətindən asılıdır. İmmunologiyada, öz-özünə molekullar bir orqanizmin bədəninin immun sistemi tərəfindən xarici maddələrdən fərqlənə bilən komponentləridir.[6] Əksinə, öz-özünə olmayan molekullar xarici molekullar kimi tanınanlardır. Kortəbii olmayan molekulların bir sinfinə antigenlər deyilir (antikor generatorları üçün qısa) və xüsusi immun reseptorlarına bağlanan və immun reaksiya verən maddələr olaraq təyin olunur.[7]
Yenidoğulmuş körpələrdə əvvəlcədən mikroblara məruz qalmırlar və xüsusilə infeksiyaya həssasdırlar. Bir neçə qat passiv qorunma ana tərəfindən təmin edilir. Hamiləlik dövründə İmmunoglobulin G adlı bir növ antikor birbaşa anadan körpəyə cift vasitəsilə nəql olunur, buna görə insan körpələrində anaları ilə eyni antigen spesifikliyi yüksək olan antikorlar, hətta doğuş zamanı da olur.[8] Ana südü və ya kolostrum da körpənin bağırsağına köçürülən və yeni doğulmuş öz antikorlarını sintez edə bilənə qədər bakterial infeksiyalardan qoruyan antikorları ehtiva edir.[9] Bu passiv toxunulmazlıqdır, çünki fetus əslində heç bir yaddaş hüceyrəsi və ya antikor yaratmır — yalnız onları borc alır. Bu passiv toxunulmazlıq ümumiyyətlə bir neçə gündən bir neçə aya qədər davam edən qısamüddətlidir. Tibbdə qoruyucu passiv toxunulmazlıq da antikorla zəngin olan serum vasitəsi ilə süni şəkildə bir fərddən digərinə ötürülə bilər.[10]
Anadangəlmə immun sistemi[redaktə | mənbəni redaktə et]
Bir orqanizmə uğurla daxil olan mikroorqanizmlər və ya toksinlər təbii immunitet sisteminin hüceyrələri və mexanizmləri ilə qarşılaşırlar. Mikroblar mikroorqanizmlərin geniş qrupları arasında qorunan komponentləri tanıyan,[11] və ya zədələnmiş, xəsarət almış və ya stress keçirən hüceyrələr siqnal siqnalları göndərdikdə,[12] əksəriyyəti (lakin hamısı da deyil) mikroblar tanıma reseptorları tərəfindən müəyyən edildikdə, doğuş reaksiyası ümumiyyətlə tetiklenir.[7] Patogenləri tanıyanlarla eyni reseptorlar tərəfindən tanınır.[3]
Nümunələrin hüceyrələr tərəfindən tanınması[redaktə | mənbəni redaktə et]
Doğuşdan immunitet sistemindəki hüceyrələr mikrob patogenlərinin yaratdığı molekulyar quruluşları tanımaq üçün nümunə tanıma reseptorlarından (PRR) istifadə edirlər. PRR, patogenlər üçün tipik molekulları aşkar edən germline kodlanmış ana sensorlardır.[13]Bunlar əsasən dendritik hüceyrələr, makrofaglar, monositlər, neytrofillər və epitel hüceyrələri kimi təbii immun hüceyrə hüceyrələri tərəfindən ifadə edilən zülallardır,[14][15]molekulların iki sinifini müəyyən etmək: mikrob patogenləri ilə əlaqəli patogenlə əlaqəli molekulyar nümunələr (PAMP) və hüceyrələrin zədələnməsi və ya ölümü zamanı sərbəst buraxılan ev sahibi hüceyrələrinin komponentləri ilə əlaqəli olan ziyanla əlaqəli molekulyar nümunələr (DAMP).
Toll kimi reseptorlar[redaktə | mənbəni redaktə et]
Hüceyrədənkənar və ya endosomal patogenlə əlaqəli molekulyar nümunələrin (PAMP) tanınması, toll kimi reseptorlar (TLR) kimi tanınan transmembran zülalları ilə vasitəçilik edilir.[16]TLR'lər tipik bir quruluş motivini, Leucine zəngin təkrarlarını (LRR) bölüşür, bunlar özlərinə xüsusi görünüş verir və eyni zamanda TLR funksionallığından məsuldur.[17]Toll kimi reseptorlar ilk dəfə Drosophilada kəşf edilmiş və sitokinlərin sintezi və ifraz olunmasına və həm təbii, həm də adaptiv immun reaksiya üçün tələb olunan digər ev müdafiə proqramlarının aktivləşdirilməsinə səbəb olmuşdur. İndiyə qədər insanlarda TLR ailəsinin on funksional üzvü müəyyən edilmişdir.[18]
Sitozolik reseptorlar[redaktə | mənbəni redaktə et]
Anadangəlmə immunitet sistemindəki hüceyrələrdə sitozolda infeksiya və ya hüceyrə ziyanını aşkar edən nümunə tanıma reseptorları vardır. Bu sitosolik reseptorların üç əsas sinifi NOD kimi reseptorlar, RIG (retinoik turşuya bağlı gen) bənzər reseptorlar və sitosolik DNT sensorlardır.[19]
İnflammasoma[redaktə | mənbəni redaktə et]
İnflammasomalar, sitozolik PAMP və DAMP-a cavab olaraq fəaliyyət göstərən, iltihablı sitokinlərin IL-1β aktiv formalarını istehsal edən multiprotein kompleksləridir (bir NLR, adapter protein ASC və effector molekulu pro-kaspaza-1).[20]
Səth maneələri[redaktə | mənbəni redaktə et]
Müxtəlif maneələr, orqanizmləri mexaniki, kimyəvi və bioloji maneələr də daxil olmaqla, infeksiyadan qoruyur. Əksər yarpaqların kutikula hissəsi, həşəratların ekzoskeletonu, xaricə qoyulmuş yumurtaların qabıqları və membranları və dəri infeksiyaya qarşı ilk hücum xətləri olan vasitələrin görünüşü.[7]Bununla birlikdə, orqanizmlərin mühitindən tamamilə möhürlənə bilmədiyi üçün digər sistemlər ağciyərlər, bağırsaqlar və genitouriya sistemi kimi bədən açılışlarını qorumaq üçün fəaliyyət göstərir. Göz yaşları və sidik axan hərəkət patogenləri də mexaniki olaraq ifraz edir, tənəffüs və mədə-bağırsaq traktından ifraz olunan mikroorqanizmləri tələyə salmağa kömək edir.[21]
Kimyəvi maneələri də infeksiyadan qoruyur. Dəri və tənəffüs yolları β-defensinlər kimi antimikrob peptidləri ifraz edir.[22]Tüpürcək, göz yaşıana südündə lizozim və fosfolipaza A2 kimi fermentlər də antibakterial maddələrdir.[23][24] Veginal sekresiyalar menarxdan sonra bir az turşu olduqda kimyəvi bir maneə rolunu oynayır, spermanın tərkibində patogenləri öldürmək üçün defensin və sink var.[25][26]Mədədə mədə turşusu, qəbul edilən patogenlərə qarşı güclü bir kimyəvi müdafiə rolunu oynayır.[27]
Genitoüriner və mədə-bağırsaq traktının daxilində, mütənasib flora qida və məkan üçün patogen bakteriyalarla rəqabət apararaq bioloji maneə rolunu oynayır və bəzi hallarda pH və ya mövcud dəmir kimi mühitdəki şərtləri dəyişdirərək.[28]Kommensallar və immunitet sistemi simbiotik arasındakı əlaqə nəticəsində patogenlərin xəstəliyə səbəb olmaq üçün kifayət qədər saya çatma ehtimalı azalır. Lakin, əksər antibiotiklər qeyri-spesifik bakteriyaları hədəflədikləri və göbələklərə təsir etmədiyi üçün ağızdan gələn antibiotiklər göbələklərin "çoxalmasına" səbəb ola bilər və vaginal kandidoz (maya infeksiyası) kimi hallara səbəb ola bilər.[29]Normal olaraq təmizlənməmiş qatıqda olan laktobacillinin saf mədəniyyətləri kimi probiotik floranın təkrar tətbiqi, uşaqlarda bağırsaq infeksiyalarında mikrob populyasiyasının sağlam tarazlığının bərpa olunmasına və bakterial qastroenterit, iltihablı bağırsaq üzərində aparılan tədqiqatlarda ilkin məlumatların həvəsləndirilməsinə dair yaxşı sübutlar mövcuddur. xəstəliklər, sidik yollarının infeksiyası və əməliyyatdan sonrakı infeksiyalardır.[30][31][32]
Hüceyrə komponentləri[redaktə | mənbəni redaktə et]

Leykositlər (ağ qan hüceyrələri) müstəqil, tək hüceyrəli orqanizmlər kimi fəaliyyət göstərir və doğuş immun sisteminin ikinci qoludur.[7]Doğuşdan leykositlərə faqositlər (makrofaqlar, neytrofillər və dendritik hüceyrələr), doğuşdan lenfoid hüceyrələr, mastosit hüceyrələr, eozinofillər, basofillər və təbii killer hüceyrələrii daxildir. Bu hüceyrələr, ya da əlaqə vasitəsi ilə daha böyük patogenlərə hücum edərək ya da mikroorqanizmləri öldürərək patogenləri müəyyənləşdirir və aradan qaldırır.[33]Doğulmuş hüceyrələr də limfoid orqan inkişafında və uyğunlaşma immunitet sisteminin aktivləşməsində vacib vasitəçidir.[34]
Faqositoz patogenlər və ya hissəcikləri bürüyən və ya yeyən fagositlər adlanan hüceyrələr tərəfindən həyata keçirilən hüceyrə içi toxunulmazlığın vacib bir xüsusiyyətidir. Faqositoz ümumiyyətlə patogenləri axtaran orqanı patrul edir, lakin sitokinlər tərəfindən müəyyən yerlərə çağırıla bilər.[7]Bir patogen bir faqosit tərəfindən tutulduqdan sonra bir faqosit adlanan hüceyrə daxili bir vesikülə qapılır və sonradan bir phagolysosome meydana gətirmək üçün lizosoma adlanan başqa bir vesikül ilə birləşir. Patogen, həzm fermentlərinin fəaliyyətindən və ya sərbəst radikalları faqositoza buraxan tənəffüs partlamasından sonra öldürülür.[35][36]Faqositoz, qida əldə etmək üçün bir vasitə kimi inkişaf etdi, lakin bu rol patogenlərin müdafiə mexanizmi olaraq daxil olmasını təmin etmək üçün faqositlərdə genişləndirildi.[37]Faqositoz, ehtimal ki, ana müdafiəsinin ən qədim formasını təmsil edir, çünki həm onurğalı, həm də onurğasız heyvanlarda faqositlər müəyyən edilmişdir.[38]
Faqositlər[redaktə | mənbəni redaktə et]
Neytrofillər və makrofaqlar, bədənin hər tərəfinə hücum edən patogenlərin ardınca gedən faqositlərdir.[39]Neytrofillər normal olaraq qan dövranında olur və ümumi dövran edən leykositlərin 50% -dən 60% -ni təşkil edən[40] və neytrofil-qatil neytrofil-cager altpopulyasiyalarından ibarət olan ən çox bol faqosit növüdür. İltihabın kəskin dövründə, xüsusən də bakterial infeksiya nəticəsində neytrofillər kemotaksis adlanan bir prosesdə iltihab yerinə doğru hərəkət edirlər və ümumiyyətlə infeksiya yerinə gələn ilk hüceyrələrdir. Makrofajlar toxumaların içərisində yaşayan və fermentlər, zülallar və sitokinlər daxil olmaqla çox sayda kimyəvi maddə istehsal edən çox yönlü hüceyrələrdir, eyni zamanda köhnəlmiş hüceyrələrin və digər zibillərin bədənini təmizləyən zibilçi və antigen təqdim edən hüceyrələr kimi də iştirak edə bilərlər.[41]
Dendritik hüceyrələr[redaktə | mənbəni redaktə et]
Dendritik hüceyrələr (DC) xarici mühitlə təmasda olan toxumalarda faqositlərdir; buna görə də onlar əsasən dəri, burun, ağciyər, mədə və bağırsaqda yerləşirlər.[42] Neyronal dendritlərə bənzədiklərinə görə adlandırıldı, çünki hər ikisində də onurğa bənzər proqnozlar var, lakin dendritik hüceyrələr sinir sisteminə heç bir şəkildə bağlı deyildir. Dendritik hüceyrələr, adaptiv immunitet sisteminin əsas hüceyrə növlərindən biri olan T hüceyrələrinə antigenlər təqdim etdikləri üçün bədən toxumaları ilə doğma və adaptiv immun sistemlər arasında əlaqə rolunu oynayır.[42]
Qranulositlər[redaktə | mənbəni redaktə et]
Qranulositlər sitoplazmasında qranullar olan lökositlərdir. Həmçinin bu kateqoriyaya neytrofillər, mast hüceyrələri, bazofillər və eozinofillər daxildir. Mast hüceyrələri birləşdirici toxumalarda, selikli qişalarda yaşayır və iltihab reaksiyasını tənzimləyir.[43]Onlar ən çox allergiya və anafilaksiya ilə əlaqələndirilir.[40]Bazofillər və eozinofillər neytrofillərə aiddir. Parazitlərə qarşı müdafiədə iştirak edən və astma kimi allergik reaksiyalarda rol oynayan kimyəvi vasitəçiləri gizlədirlər.[44]
Doğuşdan limfoid hüceyrələr[redaktə | mənbəni redaktə et]
Doğuşdan limfoid hüceyrələr (İLC) ümumi limfoid progenitordan (CLP) əmələ gələn və limfoid nəslinə aid olan fitri immun hüceyrələr qrupudur. Bu hüceyrələr, rekombinasiya aktivləşdirən genin (RAG) olmaması səbəbindən antigen spesifik B və ya T hüceyrə reseptorunun olmaması ilə təyin olunur. ILCs miyeloid və ya dendritik hüceyrə markerlərini ifadə etmir.[45]
Üzvi İLC-lərdən biri olan təbii killer hüceyrələri limfositlərdir və işğalçı mikroblara birbaşa hücum etməyən fitri immunitet sistemidir.[46] Əksinə, NK hüceyrələri şiş hüceyrələri və ya virusa yoluxmuş hüceyrələr kimi güzəştli ana hüceyrələri məhv edir və bu hüceyrələri "özünü itirmək" olaraq bilinən bir vəziyyətlə tanıyır. Bu termin, MHC I adlı (hüceyrələrin uyğunsuzluğu kompleksi) — ana hüceyrələrin viral infeksiyalarında yarana biləcək bir vəziyyət olan hüceyrə səthinin markerinin aşağı səviyyədə olduğu hüceyrələri təsvir edir.[33] İlkin təsəvvürə görə "özünü itirən" hüceyrələri öldürmək üçün aktivləşdirmə tələb etmədiklərinə görə "təbii qatil" adlandırıldı. Uzun illər NK hüceyrələrinin şiş hüceyrələrini və yoluxmuş hüceyrələri necə tanıdığı məlum deyildi. Artıq bu hüceyrələrin səthindəki MHC makiyajının dəyişdirildiyi və "itkin özünü" tanımaqla NK hüceyrələrinin aktivləşdiyi məlum oldu. Normal bədən hüceyrələri NK hüceyrələri tərəfindən tanınmır və hücum edilmir, çünki onlar özlərini MHC antigenlərini ifadə edirlər. Bu MHC antigenləri NK hüceyrələrinə tormozlar qoyan qatil hüceyrə immunoglobulin reseptorları (KIR) tərəfindən tanınır.[47]
İltihab[redaktə | mənbəni redaktə et]
İltihab immunitet sisteminin infeksiyaya verdiyi ilk cavablardan biridir.[48]İltihab əlamətləri toxuma qan axınının artması ilə meydana gələn qızartı, şişkinlik, istilik və ağrıdır. İltihab yaralı və ya yoluxmuş hüceyrələr tərəfindən sərbəst buraxılan eikosanoidlər və sitokinlər tərəfindən istehsal olunur. Eikosanoidlər arasında qızdırma və iltihabla əlaqəli qan damarlarının genişlənməsinə səbəb olan prostaqlandinlər və müəyyən ağ qan hüceyrələrini (lökositlər) cəlb edən lökotrienlər vardır.[49][50]Ümumi sitokinlərə ağ qan hüceyrələri arasında əlaqə üçün cavabdeh olan interleykinlər daxildir; kemotaksisi təşviq edən hemokinlər; və ana hüceyrədəki protein sintezini bağlamaq kimi antiviral təsir göstərən interferonlar.[51] Böyümə amilləri və sitotoksis amillər də sərbəst buraxıla bilər. Bu sitokinlər və digər kimyəvi maddələr immun hüceyrələri infeksiya yerinə cəlb edir və patogenlərin çıxarılmasından sonra zədələnmiş toxumaların sağalmasına kömək edir.[52]
Tamamlayıcı sistem[redaktə | mənbəni redaktə et]
Tamamlayıcı sistemi xarici hüceyrələrin səthlərinə hücum edən biokimyəvi kaskaddır. 20-dən çox fərqli protein ehtiva edir və patogenlərin öldürülməsini antikorlar tərəfindən "tamamlaya" bilmə qabiliyyətinə görə adlandırılmışdır. Komplement doğuş immun cavabının əsas humoral komponentidir.[53][54] Bir çox növdə bitkilər, balıqlar və bəzi onurğasızlar kimi qeyri-məməlilər də daxil olmaqla tamamlayıcı sistemlərə malikdir.[33]
İnsanlarda bu reaksiya bu mikroblarla əlaqəli antikorların bağlanması və ya mikrob səthlərindəki karbohidratlara zülalların bağlanması ilə aktivləşdirilir. Bu tanınma siqnalı sürətli bir öldürmə reaksiyasına səbəb olur.[55] Reaksiya sürəti həm də proteaz olan tamamlayıcı molekulların ardıcıl proteolitik aktivləşməsindən sonra meydana gələn siqnal gücləndirməsinin nəticəsidir. Tamamlayıcı zülallar əvvəlcə mikroblarla bağlandıqdan sonra digər tamamlayıcı proteazları aktivləşdirən proteaz fəaliyyətlərini aktivləşdirirlər və s. Bu nəzarət müsbət rəy ilə başlanğıc siqnalını artıran bir kataliz istehsal edir.[56] Kaskad, immun hüceyrələri cəlb edən, damar keçiriciliyini artıran və bir patogenin səthini pozaraq işarə edən peptidlərin istehsalına səbəb olur. Bu tamamlayıcı yığım plazma membranlarını pozaraq hüceyrələri birbaşa öldürə bilər.[53]
Adaptiv immunitet sistemi[redaktə | mənbəni redaktə et]
Uyğunlaşan immunitet sistemi erkən onurğalılarda inkişaf etmiş və daha güclü bir immun reaksiya təmin edir, eyni zamanda immunoloji yaddaş da mövcuddur, burada hər bir patogen bir imza antigeni ilə "xatırlanır".[57] Adaptiv immun reaksiya antigenə xasdır və antigen təqdimatı adlanan bir proses zamanı özünəməxsus antigenlərin tanınmasını(təqdimatını) tələb edir. Antigenin spesifikliyi xüsusi patogenlər və ya patogen yoluxmuş hüceyrələrə uyğun cavablar əmələ gətirməyə imkan verir. Bu uyğunlaşdırılmış cavabları toplamaq qabiliyyəti bədəndəki "yaddaş hüceyrələri" ilə qorunur. Bir patogen bədənə bir dəfədən çox yoluxursa, bu xüsusi yaddaş hüceyrələri onu tez bir zamanda aradan qaldırmaq üçün istifadə olunur.
Antigenin tanınması[redaktə | mənbəni redaktə et]
Adaptiv immunitet sisteminin hüceyrələri lenfosit adlanan lökositlərin xüsusi növləridir. B hüceyrələri ilə T hüceyrələri limfositlərin əsas növləridir və sümük iliyindəki hematopoetik kök hüceyrələrdən əmələ gəlir.[33] B hüceyrələri humoral immun cavabında, T hüceyrələri isə hüceyrə ilə əlaqəli immun reaksiyasında iştirak edirlər.
Killer T hüceyrələri yalnız I sinif MHC molekullarına bağlı olan antigenləri, köməkçi T hüceyrələri və tənzimləyici T hüceyrələri yalnız II sinif MHC molekullarına bağlı antigenləri tanıyırlar. Bu iki antigen təqdim edən mexanizm, iki T hüceyrə növünün fərqli rollarını əks etdirir. Üçüncüsü, kiçik bir növü MHC reseptorlarına bağlanmayan antigenləri tanıyan γδ T hüceyrələridir.[58]İkiqat müsbət T hüceyrələri, Çəngələbənzər vəzin inkişafı və fəaliyyəti üçün yodun tələb olunduğu timusda çox sayda vacib antigenlərə məruz qalır.[59]
Bunun əksinə olaraq B hüceyrəsi antigeninə aid reseptor B hüceyrə səthində bir antikor molekuludur və antigen emal etmədən bütün patogenləri tanıyır. B hüceyrəsinin hər bir gərginliyi fərqli bir antikor ifadə edir, buna görə də B hüceyrəsi antigen reseptorlarının hamısı bədənin istehsal etdiyi bütün antikorları təmsil edir.[33]
T limfositlərində antigen təqdimatı[redaktə | mənbəni redaktə et]
Həm B hüceyrələri, həm də T hüceyrələri xüsusi hədəfləri tanıyan reseptor molekullarını daşıyırlar. T hüceyrələri patogen kimi bir "qeyri-spontan" hədəfi tanıyır, yalnız antigenlər (patogenin kiçik parçaları) işləndikdən sonra və böyük bir histokompozisiya kompleksi (MHC) adlı bir "öz" reseptoru ilə birlikdə.
Hüceyrə vasitəçiliyi toxunulmazlığı[redaktə | mənbəni redaktə et]
T hüceyrələrinin iki əsas alt növü var: qatil T hüceyrəsi və köməkçi T hüceyrəsi. Bundan əlavə, immun cavabın modullanmasında rol oynayan tənzimləyici T hüceyrələri var.
Qatil T hüceyrəsi[redaktə | mənbəni redaktə et]
Killer T hüceyrələri, viruslara (və digər patogenlərə) yoluxmuş və ya başqa bir şəkildə zədələnmiş və ya funksiyasız olan hüceyrələri öldürən T hüceyrələrinin bir hissəsidir.[60] B hüceyrələrində olduğu kimi, hər T hüceyrə növü fərqli bir antijeni tanıyır. Öldürücü T hüceyrələri, T hüceyrə reseptorunun (TCR) başqa bir hüceyrənin MHC Sinif I reseptoru ilə bir kompleksdə bu xüsusi antijeni bağladığı zaman aktiv olur. Bu MHC-nin tanınması: antigen kompleksi T hüceyrəsində CD8 adlı bir reseptora kömək edir. Bundan sonra T hüceyrəsi MHC I reseptorlarının bu antigeni daşıdığı hüceyrələri axtarmaq üçün bədən boyu gəzir. Aktiv bir T hüceyrəsi bu hüceyrələrlə təmasda olduqda, hədəf hüceyrənin plazma membranında məsamələr meydana gətirən perforin kimi sitotoksinləri buraxaraq ionların, su və toksinlərin daxil olmasına imkan verir. Qranulalar (bir proteaz) adlı başqa bir toksinin tətbiqi hədəf hüceyrəni apoptoza təşviq edir.[61]Əsas hüceyrələrin T hüceyrələrinin öldürülməsi virusların çoxalmasının qarşısını almaq üçün xüsusilə vacibdir. T hüceyrələrinin aktivləşdirilməsi ciddi şəkildə idarə olunur və adətən çox güclü MHC antigen aktivləşdirmə siqnalı və ya "köməkçi" T hüceyrələri tərəfindən təmin olunan əlavə aktivasiya siqnalları tələb olunur.[61]
Köməkçi T hüceyrəsi[redaktə | mənbəni redaktə et]
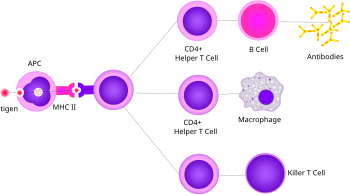
Köməkçi T hüceyrələri həm təbii, həm də adaptiv immun reaksiyaları tənzimləyir və bədənin müəyyən bir patogenə hansı immun cavablarını verdiyini müəyyənləşdirməyə kömək edir.[62][63] Bu hüceyrələrin sitotoksik aktivliyi yoxdur və yoluxmuş hüceyrələri öldürmür və ya birbaşa patogenləri təmizləmir. Bunun əvəzinə, digər hüceyrələri bu vəzifələri yerinə yetirməyə istiqamətləndirərək immun reaksiyasını idarə edirlər.
Köməkçi T hüceyrələri II Sinif MHC molekullarına bağlı antigeni tanıyan T hüceyrə reseptorlarını ifadə edir. MHC: antigen kompleksi, T hüceyrəsinin aktivləşməsinə cavabdeh olan T hüceyrəsi daxilində molekulları toplayan köməkçi hüceyrənin CD4 köməkçi reseptoru tərəfindən də tanınır. Yardımçı T hüceyrələri MHC ilə daha zəif bir əlaqəyə malikdir: qatil T hüceyrələri üçün müşahidə olunan antigen kompleksi, yəni köməkçi T hüceyrəsindəki bir çox reseptor (təxminən 200–300) bir MHC ilə birləşməlidir: köməkçi hüceyrəni aktivləşdirmək üçün antigen, tək MHC-də qatil T hüceyrələri, antigen molekulunun birləşməsi ilə aktivləşdirilə bilər. Köməkçi T hüceyrəsinin aktivləşdirilməsi antigen təqdim edən bir hüceyrə ilə daha uzun bir qarşılıqlı vaxt tələb edir.[64] İstirahət edən bir köməkçi T hüceyrəsinin aktivləşdirilməsi bir çox hüceyrə növünün fəaliyyətinə təsir edən sitokinlərin sərbəst buraxılmasına səbəb olur. Köməkçi T hüceyrələri tərəfindən istehsal edilən sitokin siqnalları, makrofagların mikrobisid funksiyasını və qatil T hüceyrələrinin fəaliyyətini artırır.[7] Bundan əlavə, köməkçi T hüceyrəsinin aktivləşdirilməsi T40-nin səthində ifadə olunan və adətən antikor istehsal edən antikorları aktivləşdirmək üçün tələb olunan əlavə stimullaşdırıcı siqnalları təmin edən CD40 ligand (CD154 kimi də tanınır) kimi molekulların tənzimlənməsinə səbəb olur.[65]
Gamma delta T hüceyrələri[redaktə | mənbəni redaktə et]
Gamma delta T hüceyrələri (γδ T hüceyrələri) CD4 + və CD8 + (a) T hüceyrələrindən fərqli olaraq alternativ bir T hüceyrə reseptoruna (TCR) malikdir və köməkçi T hüceyrələrinin, sitotoksik T hüceyrələrinin və NK hüceyrələrinin xüsusiyyətlərini bölüşürlər. γδ T Hüceyrələrdən cavab verən şərtlər tam olaraq aydın deyildir. CD1d ilə məhdudlaşan təbii qatil T hüceyrələri kimi dəyişməz TCR lərini daşıyan digər "qeyri-adi" T hücrələri kimi, γδ T hüceyrələri də təbii və adaptiv toxunulmazlıq arasındakı sərhədi keçir.[66] Bir tərəfdən, γδ T hüceyrələri reseptorların müxtəlifliyini istehsal etmək üçün TCR genlərini yenidən qurduqları üçün bir yaddaş fenotipini inkişaf etdirdikləri üçün adaptiv toxunulmazlığın bir hissəsidir. Digər tərəfdən, müxtəlif alt qruplar təbii immun sisteminin bir hissəsidir, çünki məhdud TCR və ya NK reseptorları nümunə tanıma reseptorları olaraq istifadə edilə bilər. Məsələn, çox sayda insan Vγ9 / V2 T hüceyrələri bir neçə saat ərzində mikrobların yaratdığı ümumi molekullara cavab verir və epiteldə yüksək məhdud V1 + T hüceyrələri stresli epitel hüceyrələrinə cavab verir.[58]
Humoral immun cavab[redaktə | mənbəni redaktə et]

B hüceyrəsi, səthindəki antikorlar müəyyən bir xarici antijenə bağlandıqda patogenləri təyin edir.[68] Bu antigen/antikor kompleksi B hüceyrəsi tərəfindən qəbul edilir və proteoliz tərəfindən peptidlərə çevrilir. Sonra B hüceyrəsi bu antijenik peptidləri səthdə II sinif MHC molekullarında nümayiş etdirir. MHC və antigenin bu birləşməsi, limfokinləri buraxan və B hüceyrəsini aktivləşdirən uyğun bir köməkçi T hüceyrəsini özünə cəlb edir.[69] Aktivləşdirilmiş B hüceyrəsi bölünməyə başlayanda onun nəsli (plazma hüceyrələri) bu antigeni tanıyan milyonlarla antikor nüsxəsini ifraz edir.Bu antikorlar qan plazmasında və limfada gəzişər, antijeni ifadə edən patogenlərə bağlanır və onları tamamlayıcı aktivləşdirmə faqositlər tərəfindən məhv etmək üçün çalışır. Antikorlar həmçinin bakterial toksinlərə bağlanmaqla və ya bakteriyaların hüceyrələri yoluxdurmaq üçün istifadə etdikləri reseptorlara müdaxilə edərək çətinlikləri birbaşa neytrallaşdıra bilər.[70]
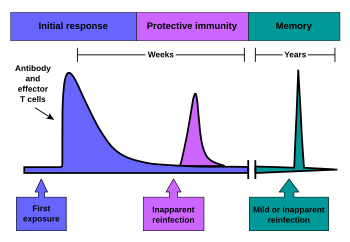
İmmunoloji yaddaş[redaktə | mənbəni redaktə et]
B və T hüceyrələri aktivləşib çoxalmağa başlayanda nəsillərinin bir hissəsi uzun ömürlü yaddaş hüceyrələrinə çevrilir. Bir heyvanın həyatı boyunca bu yaddaş hüceyrələri qarşılaşdığı hər bir patogeni xatırlayır və patogen yenidən aşkar edildikdə güclü reaksiya göstərə bilər. Bu "uyğunlaşa bilər", çünki bir insanın ömrü boyu bu patogenə yoluxma üçün bir uyğunlaşma olaraq meydana gəlir və immunitet sistemini gələcək çətinliklərə hazırlayır. Immunoloji yaddaş passiv qısamüddətli və ya aktiv uzunmüddətli yaddaş şəklində ola bilər.
Fizioloji tənzimləmə[redaktə | mənbəni redaktə et]
İmmunitet sistemi bədəndəki fizioloji tənzimlənmənin bir çox tərəfi ilə əlaqəlidir. İmmunitet sistemi də endokrin[71][72] və sinir[73][74][75] kimi digər sistemlərlə sıx əlaqəlidir. İmmunitet, embriogenezdə (embrionun inkişafı) və toxuma bərpasında mühüm rol oynayır.
Hormonlar[redaktə | mənbəni redaktə et]
Hormonlar immunitet sisteminin həssaslığını dəyişdirərək immunomodulyator kimi fəaliyyət göstərə bilər. Məsələn, qadın cinsi hormonları həm uyğunlaşma[76], həm də doğuş immun cavablarının immunostimulyatorları kimi tanınır.[77] Bəzi otoimmün xəstəliklər, məsələn lupus eritematosus, qadınlara üstünlük verir və onların başlaması ümumiyyətlə yetkinlik dövrünə təsadüf edir. Bunun əksinə olaraq, testosteron kimi kişi cinsi hormonları immunosupressiv görünür.[78] Digər hormonların immunitet sistemini, xüsusən prolaktin, böyümə hormonu və D vitamini tənzimlədiyi ortaya çıxır.[79][80]
D vitamini[redaktə | mənbəni redaktə et]
Bir T hüceyrəsi xarici bir patogenlə qarşılaşdıqda, D vitamini reseptorunu uzadır. Bu, əslində T hüceyrəsinin D vitamininin aktiv forması olan steroid hormonu kalsitriol ilə birləşməsinə imkan verən siqnal cihazıdır. T hüceyrələri ilə D vitamini simbiyotik bir əlaqəyə malikdir. T hüceyrəsi nəinki D vitamini reseptorunu genişləndirir, D vitamini əslində kalsitriolun steroid hormon versiyasına bağlanmaq istəyir, lakin T hüceyrəsi əvvəlcədən hormonun çevrilməsindən məsul olan CYP27B1 geninə aiddir. T hüceyrələri yalnız nəzərdə tutulmuş funksiyaları kalsitriola bağlandıqdan sonra yerinə yetirə bilər. CYP27B1 ifadə edən və bununla da D vitamini kalsidiolunu aktivləşdirən digər immun sistem hüceyrələri dendritik hüceyrələr, keratinositlər və makrofaqlardır.[81][82]
Yaşlanma hormonu səviyyəsinin tədricən azalması, qocalmış şəxslərdə zəifləmiş immun reaksiyalar üçün qismən cavabdeh olduğu təxmin edilir.[83] Əksinə, bəzi hormonlar immunitet sistemi, xüsusən tiroid hormonu fəaliyyəti ilə tənzimlənir.[84] İmmunitet funksiyasının yaşla bağlı azalması da yaşlılarda D vitamini səviyyəsinin azalması ilə əlaqələndirilir. İnsanlar yaşlandıqca, D vitamini səviyyələrini mənfi təsir edən iki şey meydana gəlir. Birincisi, fəaliyyət səviyyələrinin azalması səbəbindən daha çox məhdud yerlərdə qalırlar. Bu o deməkdir ki, onlar daha az günəş şüası alırlar və buna görə də UVB şüası ilə daha az xolekalsiferol istehsal edirlər. İkincisi, insan yaşlandıqca dəri D vitamini istehsal edərkən daha az həssas olur.[85]
Yuxu və istirahət[redaktə | mənbəni redaktə et]
İmmunitet sistemi yuxu və istirahətdən təsirlənir,[86] yuxu azaldılması immunitet funksiyasına zərərlidir.[87] İnfeksiyaya cavab olaraq istehsal olunan interleukin-1 və şiş nekrozu faktor-α kimi sitokinlər daxil olmaqla mürəkkəb geribildirim döngələri də gözlərin sürətli hərəkətinin (REM) tənzimlənməsində rol oynayır.[88] Buna görə, infeksiyaya qarşı immun reaksiya REM yuxusuna nisbətən yavaş dalğalı yuxu artımını da daxil olmaqla yuxu tsiklində dəyişikliklərə səbəb ola bilər.[89]
Yuxusuzluqdan əziyyət çəkərkən aktiv peyvəndlər azaldılmış bir təsir göstərə bilər və daha yaxşı antikor istehsalına və yaxşı istirahət edilən bir insana göstəriləndən daha aşağı immun reaksiya verə bilər. Bundan əlavə, həm T hüceyrə fərqliliyi, həm də sirkadiyalı ritmlərimiz, yuxu məhrumiyyətimiz, növbə işi və s. İlə sıx əlaqəli olduğu göstərilən NFIL3 kimi zülallar. Nəticədə bu pozuntular ürək xəstəliyi, xroniki ağrı və astma kimi xroniki şəraitin artmasına səbəb ola bilər.[90]
Yuxu məhrumiyyətinin mənfi nəticələrinə əlavə olaraq, yuxu və yuva qurmuş sirkadiyalı sistemin həm təbii, həm də adaptiv toxunulmazlığı təsir edən immunoloji funksiyalara güclü tənzimləyici təsiri olduğu göstərilmişdir. Əvvəla, erkən dalğa-yuxu mərhələsində kortizol, epinefrin və norepinefrin qan səviyyəsinin qəfil azalması leptin, hipofiz artım hormonu və prolaktin hormonlarının qan səviyyəsini artırır. Bu siqnallar iltihablı sitokinlərin interleukin-1, interleukin-12, TNF-alfa və IFN-qamma istehsalı yolu ilə bir iltihablı bir dövlət yaradır. Bu sitokinlər daha sonra immun hüceyrələrin aktivləşdirilməsi, yayılması və fərqlənməsi kimi immunitet funksiyalarını stimullaşdırır. Bu müddət ərzində sadəlövh və mərkəzi yaddaş zirvələri T hüceyrələri kimi fərqlənməmiş və ya daha az fərqlənmişdir (yəni, yavaş inkişaf edən adaptiv immun reaksiya zamanı). Bu təsirlərə əlavə olaraq, hazırda istehsal edilən hormonların (leptin, hipofiz böyümə hormonu və prolaktin) mühiti APC və T hüceyrələri arasındakı qarşılıqlı əlaqəni, Th1/Th2 sitokin balansını Th1, ümumi T hüceyrələrinin yayılmasını artırır və sadəlövh hüceyrələrin limfa düyünlərinə köçürülməsini dəstəkləyir. Bu mühitin Th1 immun cavabının başlaması ilə uzun müddətli immun yaddaşının formalaşmasına dəstək verəcəyi də düşünülür.[91]
Bundan fərqli olaraq, oyanan dövrlərdə sitotoksik təbii qatil hüceyrələri və CTL (sitotoksik T lenfosit) zirvəsi kimi fərqli effekt hüceyrələri hər hansı bir intruder patogenə təsirli bir cavab verə bilər. Kortizol və katekolaminlər kimi antiinflamatuar molekullar oyan aktiv vaxtlarda zirvəyə çatır. Pro-enflamatuar durumun neden uyku zamanı için ayrıldığına dair iki teori vardır. Birincisi, iltihab oyanma dövrlərində baş verərsə, ciddi idrak və fiziki pozuntulara səbəb olacaqdır. İkincisi, melatoninin olması səbəbindən iltihab yuxu zamanı baş verə bilər. İltihab çox miqdarda oksidləşdirici stresə səbəb olur və yuxu zamanı melatoninin olması bu müddət ərzində sərbəst radikal istehsalına aktiv şəkildə qarşı çıxa bilər.[91][92]
Qidalanma və Şəkərli diabet[redaktə | mənbəni redaktə et]
Bu, həddindən artıq bəslənmə, diabet və piylənmə kimi immunitet funksiyasına təsir etdiyi bilinən xəstəliklərlə əlaqələndirilir. Daha orta qidalanma, bəzi spesifik iz mineral və qidalanma çatışmazlığı da immunitet reaksiyasını poza bilər.[93]
Bəzi yağ turşuları ilə zəngin olan qidalar sağlam bir immunitet sistemini gücləndirə bilər.[94] Eynilə, fetusun qidalanması immunitet sistemində bir ömrün pozulmasına səbəb ola bilər.[95]
Təmir və bərpa[redaktə | mənbəni redaktə et]
İmmunitet sistemi, xüsusən də doğuşdan ibarət olan komponent, təhqirdən sonra toxuma bərpasında həlledici rol oynayır.[96][97][98][99][100] Əsas aktyorlara makrofaqlar və neytrofillər daxildir, lakin digər hüceyrə aktyorları da vacibdir, o cümlədən γδ T hüceyrələri, təbii limfoid hüceyrələr (İLC) və tənzimləyici T hüceyrələri (Treglər). İmmun hüceyrə plastikliyi və iltihab əleyhinə siqnallar arasındakı tarazlıq toxuma effektivliyinin vacib tərəfləridir.[100] İmmun komponentləri və yolları, məsələn, amfibiyalarda bərpada iştirak edir. Bir fərziyyəyə görə, bərpa olunan orqanizmlər bərpa olunmayan orqanizmlərə nisbətən daha az toxunulmazlığa sahib ola bilər.[101][102]
İnsan immunitetinin pozulması[redaktə | mənbəni redaktə et]
İmmunitet sistemi spesifikliyi, induksiyasızlığı və uyğunlaşmanı ehtiva edən yüksək təsirli bir quruluşdur. Bununla birlikdə, ev sahibi müdafiəsində uğursuzluqlar meydana çıxır və üç geniş kateqoriyaya düşür: immun çatışmazlığı, otoimmunitet və həssaslıq.
İmmun çatışmazlığı[redaktə | mənbəni redaktə et]
İmmun çatışmazlığı immunitet sisteminin bir və ya daha çox komponenti təsirsiz olduqda baş verir. İmmunitet sisteminin patogenlərə cavab vermə qabiliyyəti həm gənc, həm də yaşlılarda azalır, təqribən 50 yaşında immunozan səbəbiylə immunitet reaksiyaları azalmağa başlayır.[103][104]İnkişaf etmiş ölkələrdə piylənmə, alkoqolizm və narkotik istifadəsi zəif immun funksiyanın ümumi səbəbləridir, bəslənmə isə inkişaf etməkdə olan ölkələrdə immun çatışmazlığının ən çox yayılmış səbəbidir.[104]Kifayət qədər protein ehtiva etməyən diyetlər, pozulmuş hüceyrə ilə əlaqəli toxunulmazlıq, tamamlayıcı fəaliyyət, faqosit funksiyası, IgA antikor konsentrasiyası və sitokin istehsalı ilə əlaqələndirilir. Bundan əlavə, erkən yaşda timusun genetik mutasiya və ya cərrahi yolla çıxarılması nəticəsində ağır immun çatışmazlığı və infeksiyanın yüksək həssaslığı ilə nəticələnir.[105]
İmmun çatışmazlığı da miras qala bilər və ya 'əldə' edilə bilər.[7] Faqositlərin patogenləri məhv etmək qabiliyyətinin azaldığı xroniki qranulomatoz xəstəlik, irsi və ya anadangəlmə immun çatışmazlığının bir nümunəsidir. QİÇS və bəzi xərçəng növləri qazanılmış immun çatışmazlığına səbəb olur.[106][107]
Otoimmunitet[redaktə | mənbəni redaktə et]
Həddindən artıq immun cavablar immun disfunksiyanın digər ucunu, xüsusilə otoimmün pozğunluqları meydana gətirir. Burada immunitet sistemi özünü və özünü ayırd edə bilmir və bədənin bir hissəsinə hücum edir. Normal şəraitdə bir çox T hüceyrəsi və antikor öz "peptidləri" ilə reaksiya verir.[108] Xüsusi hüceyrələrin (timusda və sümük iliyində olan) funksiyalarından biri gənc limfositləri bədəndə istehsal olunan öz antijenləri ilə təqdim etmək və özünü antijeni tanıyan otoimmunitetə qarşı hüceyrələrin aradan qaldırılmasıdır.[68]
Həssaslıq[redaktə | mənbəni redaktə et]
Həssaslıq, bədənin öz toxumalarına zərər verən immun cavabdır. İştirak edən mexanizmlərdən və həssas reaksiya vaxtından asılı olaraq dörd sinfə bölünürlər (Tip I–IV). I tip həssaslıq, allergiya ilə əlaqəli, ani və ya anafilaktik reaksiya. Semptomlar yüngül narahatlıqdan ölümə qədər dəyişə bilər. I tip yüksək həssaslıq, antigen ilə kəsişdikdə mast hüceyrələri və bazofillərin deqranulyasiyasını işarələyən IgE vasitəçiliyi ilə həyata keçirilir.[109] II tip yüksək həssaslıq, antikorların xəstənin öz hüceyrələrindəki antigenlərə bağlandıqda və onları məhv etmək üçün qeyd edərkən meydana gəlir. Buna antikor asılı (və ya sitotoksik) həssaslıq deyilir və bu, IgG və IgM antikorları ilə vasitəçilik edilir.[109] Müxtəlif toxumalarda toplanan immun komplekslər (antigenlərin, tamamlayıcı zülalların və IgG və IgM antikorlarının yığılması) III tip yüksək həssaslıq reaksiyalarına səbəb olur.[109] IV tip yüksək həssaslığı (hüceyrə vasitəçiliyi və ya gecikmiş tipli həssaslıq kimi də tanınır) adətən inkişaf üçün iki-üç gün çəkir. IV tipli reaksiyalar bir çox otoimmün və yoluxucu xəstəliklərdə baş verir, eyni zamanda əlaqə dermatiti (zəhər ivyası) da ola bilər. Bu reaksiyalar T hüceyrələri, monositlər və makrofaqlar tərəfindən vasitəçilik olunur.[109]
İdiopatik iltihab[redaktə | mənbəni redaktə et]
İltihab immunitet sisteminin infeksiyaya ilk reaksiyalarından biridir[48], lakin məlum səbəb olmadan baş verə bilər.
İltihab, yaralı və ya yoluxmuş hüceyrələr tərəfindən sərbəst buraxılan eikosanoidlər və sitokinlər tərəfindən istehsal olunur. Eikosanoidlər arasında qızdırma və iltihabla əlaqəli qan damarlarının genişlənməsinə səbəb olan prostaqlandinlər və müəyyən ağ qan hüceyrələrini (lökositlər) cəlb edən lökotrienlər vardır.[49][50] Ümumi sitokinlər ağ qan hüceyrələri arasında əlaqə üçün cavabdeh olan interleukinlərdir; kemotaksisi təşviq edən kimyokinlər; və ana hüceyrədəki protein sintezini maneə törətmək kimi antiviral təsiri olan interferonlar.[51] Böyümə amilləri və sitotoksik amillər də sərbəst buraxıla bilər. Bu sitokinlər və digər kimyəvi maddələr infeksiya yerində immun hüceyrələri toplayır və patogenlər çıxarıldıqdan sonra zədələnmiş toxumaları sağaldır.[52]
Tibbdə manipulyasiya[redaktə | mənbəni redaktə et]
İmmun reaksiya otoimmunitet, allergiya və nəqli rədd etməkdən arzuolunmaz reaksiyaların qarşısını almaq və immunitet sistemini (toxunulmazlığa) və ya xərçəngə böyük zərər verən patogenlərə qarşı qoruyucu cavabları stimullaşdırmaq üçün idarə edilə bilər.
İmmunosupressiya[redaktə | mənbəni redaktə et]
İmmunosupressiv dərmanlar, həddindən artıq toxuma ziyan meydana gəldikdə otoimmün pozğunluqları və ya iltihabı idarə etmək üçün istifadə olunur və orqan transplantasiyasından sonra transplant rəddinin qarşısını alır.[33][110]
İltihab əleyhinə dərmanlar tez-tez iltihabın təsirini idarə etmək üçün istifadə olunur. Qlükokortikoidlər bu dərmanların ən güclüsüdür; Bununla birlikdə, bu dərmanlar mərkəzi piylənmə, hiperglisemiya, osteoporoz kimi bir çox arzuolunmaz yan təsirlərə səbəb ola bilər və onların istifadəsinə ciddi nəzarət edilməlidir.[111] İltihab əleyhinə olan dərmanların aşağı dozaları metotreksat və ya azatioprin kimi sitotoksik və ya immunosupressiv dərmanlarla birlikdə istifadə olunur. Sitotoksik dərmanlar, aktivləşdirilmiş T hüceyrələri kimi bölünən hüceyrələri öldürərək immun reaksiyasını maneə törədir. Bununla birlikdə öldürmə bir-birindən ayrılmazdır və daim bölünən hüceyrələrə və orqanlara zəhərli yan təsir göstərir.[110] Siklosporin kimi immunosupressiv dərmanlar T hüceyrələrinin siqnal ötürmə yollarını bloklayaraq siqnallara cavab verməsinə mane olur.[112]
İmmun stimullaşdırma[redaktə | mənbəni redaktə et]
Xərçəng immunoterapiyası xərçəng şişlərinə hücum etmək üçün immunitet sistemini stimullaşdırmaq üçün tibbi üsulları ehtiva edir.
Peyvənd[redaktə | mənbəni redaktə et]
Uzun müddətli aktiv yaddaş infeksiyadan sonra B və T hüceyrələrinin aktivləşdirilməsi yolu ilə əldə edilir. Aktiv toxunulmazlıq da peyvənd vasitəsilə süni şəkildə istehsal edilə bilər. Peyvənd etmə prinsipi (immunizasiya da deyilir) immunitet sistemini stimullaşdırmaq və bu orqanizmlə əlaqəli xəstəliyə yol açmadan müəyyən patogenlərə qarşı xüsusi toxunulmazlığı inkişaf etdirmək üçün bir patogendən bir antigen daxil etməkdir.[7] Bu immun reaksiyasının qəsdən induksiyası müvəffəqiyyətlidir, çünki immunitet sisteminin təbii özəlliyini, həssaslığını da istifadə edir. Yoluxucu xəstəlik insan əhalisində ölümün aparıcı səbəblərindən biri olaraq qaldıqda, aşılama bəşəriyyətin yaratdığı immunitet sisteminin ən təsirli manipulyasiyasını təmsil edir.[33][113] Viral peyvəndlərin əksəriyyəti canlı gərginləşdirilmiş viruslara əsaslanır, bir çox bakterial peyvənd zərərsiz toksin komponentləri daxil olmaqla mikroorqanizmlərin hüceyrə komponentlərinə əsaslanır.[7] Hüceyrədənkənar peyvəndlərdən alınan bir çox antigen uyğunlaşma reaksiyasına güclü təsir göstərmədiyi üçün bakterial peyvəndlərin əksəriyyəti doğuşdan immunitet sisteminin antigen təqdim edən hüceyrələrini aktivləşdirən və immunogenliyi artıran əlavə köməkçi maddələrlə təmin olunur.[114]
Xərçəng immunologiyası[redaktə | mənbəni redaktə et]

İmmunitet sisteminin digər vacib rolu şişləri müəyyənləşdirmək və aradan qaldırmaqdır. Buna immun nəzarəti deyilir. Transformasiya olunmuş şiş hüceyrələri normal hüceyrələrdə tapılmayan antigenləri ifadə edir. İmmunitet sistemi üçün bu antigenlər xarici görünür və onların iştirakı immun hüceyrələrin çevrilmiş şiş hüceyrələrinə hücum etməsinə səbəb olur. Şişlərlə ifadə olunan antigenlərin bir neçə mənbəyi var;[116] bəziləri servikal xərçəngə səbəb olan insan papillomavirusu kimi onkogen viruslardan,[117] vulva, vegina, penis, anus, ağız və boğazdan,[118] orqanizm normal hüceyrələrdə aşağı səviyyədə olur, lakin şiş hüceyrələrində yüksək səviyyədədir. özlərinə çatan zülallardır. Buna misal olaraq, yüksək səviyyədə ifadə edildikdə müəyyən dəri hüceyrələrini (məsələn, melanositlə ) melanoma adlanan şişlərə çevirən tirozinaz adlı bir ferment var. Şiş antigenlerinin üçüncü mümkün mənbəyi, hüceyrələrin böyüməsini və yaşamasını tənzimləmək üçün vacib olan, normal olaraq onkogenlər adlanan xərçəngə səbəb olan molekullara çevrilən zülallardır.[116]
İmmunogenliyi proqnozlaşdırmaq[redaktə | mənbəni redaktə et]
Təkamül və digər mexanizmlər[redaktə | mənbəni redaktə et]
Orqanlar[redaktə | mənbəni redaktə et]
İmmunitet sistemində aşağıdakı orqan və bədən hissələri önəmli rol oynayır.
İstinadlar[redaktə | mənbəni redaktə et]
- ↑ Beck G, Habitat GS. Immunity and the Invertebrates / Toxunulmazlıq və onurğasızlar (PDF). noyabr 1996. səh. 50-66.
- ↑ "Chronic immune activation and inflammation as the cause of malignancy / Xroniki immun aktivləşmə və iltihab malignliyin səbəbi kimi". 6 mart 2020 tarixində arxivləşdirilib. İstifadə tarixi: 2001.
- ↑ 1 2 Litman GW, Cannon JP, Dishaw LJ. "RECONSTRUCTING IMMUNE PHYLOGENY: NEW PERSPECTIVES". 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Restifo NP, Gattinoni L. "Lineage relationship of effector and memory T cells". 2013. 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Kurosaki T, Kometani K. "Memory B cells". 2015. 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Smith A.D. Oxford dictionary of biochemistry and molecular biology. Oxford University Press. 2000. səh. 592. ISBN 0-19-854768-4.
- ↑ 1 2 3 4 5 6 7 8 9 Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P. Molecular Biology of the Cell. Nyu-York, London: Garland Science. 2002. ISBN 978-0-8153-3218-3.
- ↑ Saji F, Samejima Y, Kamiura S, Koyama M. "Dynamics of immunoglobulins at the feto-maternal interface / Feto-ana interfeysindəki immunoqlobulinlərin dinamikası". researchgate.net. 1999. 17 may 2020 tarixində arxivləşdirilib. İstifadə tarixi: 1999 iyul.
- ↑ Van de Perre P. "Transfer of antibody via mother's milk". 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Keller MA, Stiehm ER. "Passive immunity in prevention and treatment of infectious diseases". 2000. 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Medzhitov R. "Recognition of microorganisms and activation of the immune response". oktyabr 2007. 6 mart 2020 tarixində arxivləşdirilib.
- ↑ Matzinger. P. The Danger Model: A Renewed Sense of Self (PDF). 2002.
- ↑ Kumar H, Kawai T, Akira S. Pathogen recognition by the innate immune system. 2001. səh. 16–34.
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Innate Immunity. Nyu-York. 2002.
- ↑ Schroder K, Tschopp J. The inflammasomes. 19 mart 2010. səh. 821–832.
- ↑ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann. Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large (PDF). səh. 353-389.
- ↑ Botos I, Segal DM, Davies DR. "The Structural Biology of Toll-Like Receptors". aprel, 2011. 2020-03-06 tarixində orijinalından arxivləşdirilib.
- ↑ Takeda K, Kaisho T, Akira S. "Toll-Like Receptors". 2003. 10 mart 2020 tarixində arxivləşdirilib.
- ↑ Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald KA. Pattern Recognition Receptors and the Innate Immune Response to Viral Infection. 2011. səh. 920-940.
- ↑ Platnich JM, Muruve DA. NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways. səh. 4-14.
- ↑ Boyton RJ, Openshaw PJ. Pulmonary defences to acute respiratory infection. 2002. səh. 1–12. ISBN 11997295.
- ↑ Agerberth B, Gudmundsson GH. Host antimicrobial defence peptides in human disease. 2006. səh. 67-90. ISBN 978-3-540-29915-8.
- ↑ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O'Callaghan RJ. Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus. 2001. səh. 2347–54.
- ↑ Hankiewicz J, Swierczek E. Lysozyme in human body fluids. 1974. səh. 205–209.
- ↑ Fair WR, Couch J, Wehner N. Prostatic antibacterial factor. Identity and significance. 1976. səh. 169–177.
- ↑ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH. . 2003. səh. 473–483 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1223422/ (#bare_url_missing_title).
- ↑ Smith JL. The role of gastric acid in preventing foodborne disease and how bacteria overcome acid conditions. 2003. səh. 1292–1303.
- ↑ Gorbach SL. Lactic acid bacteria and human health. 1990. səh. 37–41.
- ↑ Hill LV, Embil JA. Vaginitis: current microbiologic and clinical concepts. 1986. səh. 321-331.
- ↑ Reid G, Bruce AW. Urogenital infections in women: can probiotics help?. Postgraduate Medical Journal. 2003. səh. 428–432.
- ↑ Alminen SJ, Gueimonde M, Isolauri E. Probiotics that modify disease risk. The Journal of Nutrition. 2005. səh. 1294-98.
- ↑ Reid G, Jass J, Sebulsky MT, McCormick JK. Potential Uses of Probiotics in Clinical Practice. 2003. səh. 658-672.
- ↑ 1 2 3 4 5 6 7 Janeway CA, Jr. Immunobiology. 2005. ISBN 0-443-07310-4.
- ↑ Withers DR. Innate lymphoid cell regulation of adaptive immunity. səh. 123–30.
- ↑ Ryter A. Relationship between ultrastructure and specific functions of macrophages. 1985. səh. 119–33.
- ↑ Langermans JA, Hazenbos WL, van Furth R. Antimicrobial functions of mononuclear phagocytes. Journal of Immunological Methods. 1994. səh. 185–94.
- ↑ May RC, Machesky LM. Phagocytosis and the actin cytoskeleton. 2001. səh. 1061–77.
- ↑ Salzet M, Tasiemski A, Cooper E. Innate immunity in lophotrochozoans: the annelids. 2006. səh. 3043–50.
- ↑ Zen K, Parkos CA. Leukocyte-epithelial interactions. 2003. səh. 557–64.
- ↑ 1 2 Stvrtinová V, Jakubovský J, Hulín I. Inflammation and Fever from Pathophysiology: Principles of Disease. Academic Electronic Press. 1995. səh. 113. ISBN 80-967366-1-2.
- ↑ Rua R, McGavern DB. Elucidation of monocyte/macrophage dynamics and function by intravital imaging. 2015. səh. 319–32.
- ↑ 1 2 Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. Antigen presentation and T cell stimulation by dendritic cells. 2002. səh. 621–67.
- ↑ Krishnaswamy G, Ajitawi O, Chi DS. The human mast cell: an overview / İnsan mast hüceyrəsi: ümumi. 2006. səh. 13-34. ISBN 1-59259-967-2.
- ↑ Kariyawasam HH, Robinson DS. The eosinophil: the cell and its weapons, the cytokines, its locations / Eozinofil: hüceyrə və onun silahları, sitokinlər, yerləri. 2006. səh. 117–27.
- ↑ Spits H, Cupedo T. Innate lymphoid cells: emerging insights in development, lineage relationships, and function. 2012. səh. 647–75.
- ↑ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L. The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk. Journal of Immunology. 2016.
- ↑ Rajalingam R. Overview of the killer cell immunoglobulin-like receptor system. 2012. səh. 391–414. ISBN 978-1-61779-841-2.
- ↑ 1 2 Kawai T, Akira S. "Innate immune recognition of viral infection". Nature Immunology. 7 (2). Feb 2006: 131–37. doi:10.1038/ni1303. PMID 16424890.
- ↑ 1 2 Miller SB. "Prostaglandins in health and disease: an overview". Seminars in Arthritis and Rheumatism. 36 (1). Aug 2006: 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ↑ 1 2 Ogawa Y, Calhoun WJ. "The role of leukotrienes in airway inflammation". The Journal of Allergy and Clinical Immunology. 118 (4). Oct 2006: 789–98, quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ↑ 1 2 Le Y, Zhou Y, Iribarren P, Wang J. "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (PDF). 2004. səh. 95–104.
- ↑ 1 2 Martin P, Leibovich SJ. "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11). Nov 2005: 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ↑ 1 2 Rus H, Cudrici C, Niculescu F. The role of the complement system in innate immunity. 2005. səh. 103-12.
- ↑ Degn SE, Thiel S. Humoral pattern recognition and the complement system. 2013. səh. 181-93.
- ↑ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP. Control of the complement system / Tamamlayıcı sisteminə nəzarət. 1996. səh. 201-83. ISBN 978-0-12-022461-6.
- ↑ Sim RB, Tsiftsoglou SA (February 2004). ". Proteases of the complement system / Tamamlayıcı sisteminin zülalları. 2004. səh. 21-27. ISBN 14748705.
- ↑ Pancer Z, Cooper MD. "The evolution of adaptive immunity / Adaptiv toxunulmazlığın təkamülü". annualreviews.org. 4 may 2020 tarixində arxivləşdirilib. İstifadə tarixi: 16 yanvar 2006.
- ↑ 1 2 Holtmeier W, Kabelitz D. gammadelta T cells link innate and adaptive immune responses. 2005. səh. 151-183. ISBN 3-8055-7862-8.
- ↑ Venturi S, Venturi M. Iodine, thymus, and immunity / Yod, Çəngələbənzər vəzi və İmmunitet. İtaliya: University of Bologna. 2009. səh. 977-979. ISBN 19647627.
- ↑ Harty JT, Tvinnereim AR, White DW. CD8+ T cell effector mechanisms in resistance to infection. 2000. səh. 275-308.
- ↑ 1 2 Radoja S, Frey AB, Vukmanovic S. T-cell receptor signaling events triggering granule exocytosis. 2006. səh. 265-90.
- ↑ Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes / Köməkçi T limfositlərinin funksional müxtəlifliyi. Oktyabr 1996. səh. 787–93.
- ↑ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG. Helper T cell-regulated B cell immunity / Köməkçi T hüceyrə tərəfindən tənzimlənən B hüceyrə toxunulmazlığı. 2006. səh. 59-83. ISBN 978-3-540-32635-9.
- ↑ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH. Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation. 2002. səh. 15006–11.
- ↑ Grewal IS, Flavell RA. CD40 and CD154 in Cell-Mediated Immunity / CD40 və CD154 hüceyrə vasitəçiliyi toxunulmazlığı. 1998. səh. 111-35.
- ↑ Girardi M. Immunosurveillance and immunoregulation by gammadelta T cells. The Journal of Investigative Dermatology. 2006. səh. 25-31.
- ↑ Lauren M. Sompayrac. Understanding the Immune System: How it Works (PDF). 2003. səh. 2. ISBN 978-1118997772.
- ↑ 1 2 Sproul TW, Cheng PC, Dykstra ML, Pierce SK. A role for MHC class II antigen processing in B cell development. 2000. səh. 139-55.
- ↑ Parker, D. C. T cell-dependent B cell activation / T hüceyrəsinə bağlı B hüceyrəsinin aktivləşdirilməsi. 1993. səh. 331-360. ISBN 0732-0582.
- ↑ Murphy K, Weaver C. The Humoral Immune Response. 2016. səh. 10. ISBN 978-0-8153-4505-3.
- ↑ Wick G, Hu Y, Schwarz S, Kroemer G. Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases. 1993. səh. 539-63.
- ↑ Kroemer G, Brezinschek HP, Faessler R, Schauenstein K, Wick G. Physiology and pathology of an immunoendocrine feedback loop. 1988. səh. 163-5.
- ↑ Trakhtenberg EF, Goldberg JL. Immunology. Neuroimmune communication. 2011. səh. 47-8.
- ↑ Veiga-Fernandes H, Mucida D. Neuro-Immune Interactions at Barrier Surfaces. 2016. səh. 801-11.
- ↑ Neuroimmune communication. 2017. səh. 127.
- ↑ Wira CR, Crane-Godreau M, Grant K. Endocrine regulation of the mucosal immune system in the female reproductive tract. 2004. ISBN 0-12-491543-4.
- ↑ Lang TJ. Estrogen as an immunomodulator. 2004. səh. 224-30.
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y . "". Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle (PDF). 1999. səh. 656-61. - ↑ Fimmel S, Zouboulis CC. Influence of physiological androgen levels on wound healing and immune status in men. 2005. səh. 166-74.
- ↑ Dorshkind K, Horseman ND. The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency. Endocrine Reviews. 2000. səh. 292-312.
- ↑ Nagpal S, Na S, Rathnachalam R. Noncalcemic actions of vitamin D receptor ligands. 2005. səh. 662-87.
- ↑ von Essen MR, Kongsbak M, Schjerling P, Olgaard K, Odum N, Geisler C. Vitamin D controls T cell antigen receptor signaling and activation of human T cells. 2010. səh. 344–49.
- ↑ Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC. DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27. 2007. səh. 285-93.
- ↑ Hertoghe T. A multidisciplinary approach to the study of T cell migration. Nyu-York akademiyası. 2005. səh. 448-65.
- ↑ Klein JR. The immune system as a regulator of thyroid hormone activity. Experimental Biology and Medicine. 2006. səh. 229–36.
- ↑ Mosekilde L. Vitamin D and the elderly. 2005. səh. 265–81.
- ↑ Lange T, Perras B, Fehm HL, Born J. Sleep Enhances the Human Antibody Response to Hepatitis A Vaccination. 2003. 831–35.
- ↑ Bryant PA, Trinder J, Curtis N. Sick and tired: Does sleep have a vital role in the immune system?. Nature Reviews. 2004. səh. 457-67.
- ↑ Krueger JM, Majde JA. Humoral links between sleep and the immune system: research issues. Nyu-York akademiyası. 2003. səh. 9-20.
- ↑ Majde JA, Krueger JM. Links between the innate immune system and sleep. The Journal of Allergy and Clinical Immunology. 2005. səh. 1188–98.
- ↑ Elizabeth Norton. "Sleep's Effects On Your Immune System Revealed In New 'Body Clock' Study / Yeni "Bədən Saatı" Tədqiqatında Yuxu İmmunitet Sisteminizə Təsirlər". huffpost.com. 15 may 2020 tarixində arxivləşdirilib. İstifadə tarixi: 8 noyabr 2013.
- ↑ 1 2 Besedovsky L, Lange T, Born J. Sleep and immune function. 2012. səh. 121–37. ISBN 3256323.
- ↑ Denise Mann. "Can Better Sleep Mean Catching Fewer Colds? / Daha yaxşı yuxu daha az soyuq qavrayış deməkdirmi?". webmd.com. 9 may 2014 tarixində arxivləşdirilib. İstifadə tarixi: 28 aprel 2014.
- ↑ R.M. Suskind, C.L. Lachney, J.N. Udall, Jr. Malnutrition and the Immune Response. CRC Press. 1994. səh. 285–300. ISBN 978-0890040607.
- ↑ Pond CM. Adipose tissue and the immune system. 2005. səh. 17-30.
- ↑ Langley-Evans SC, Carrington LJ. Diet and the developing immune system. Lupus. 2006. səh. 746-52.
- ↑ Park JE, Barbul A. Understanding the role of immune regulation in wound healing. American Journal of Surgery. 2004. səh. 11-16.
- ↑ Burzyn D, Kuswanto W, Kolodin D, Shadrach JL, Cerletti M, Jang Y, Sefik E, Tan TG, Wagers AJ, Benoist C, Mathis D. A special population of regulatory T cells potentiates muscle repair. 2013. səh. 1282-95. ISBN 24315098.
- ↑ Leoni G, Neumann PA, Sumagin R, Denning TL, Nusrat A. Wound repair: role of immune-epithelial interactions. 2015. səh. 959-68. ISBN 26174765.
- ↑ Wynn TA, Vannella KM :. Macrophages in Tissue Repair, Regeneration, and Fibrosis. 2016. səh. 450-62.
- ↑ 1 2 Laurent P, Jolivel V, Manicki P, Chiu L, Contin-Bordes C, Truchetet ME, Pradeu T. Immune-Mediated Repair: A Matter of Plasticity. 2017. səh. 454.
- ↑ Eming SA, Hammerschmidt M, Krieg T, Roers A. Interrelation of immunity and tissue repair or regeneration. 2009. səh. 517-27.
- ↑ Godwin JW, Pinto AR, Rosenthal NA. Chasing the recipe for a pro-regenerative immune system. 2017. səh. 71-79.
- ↑ Aw D, Silva AB, Palmer DB. Immunosenescence: emerging challenges for an ageing population. Immunology. 2007. səh. 435-46. ISBN 17313487.
- ↑ 1 2 Chandra RK. "Nutrition and the immune system: an introduction". The American Journal of Clinical Nutrition. 66 (2). 1997: 460S–63S. doi:10.1093/ajcn/66.2.460S. PMID 9250133.
- ↑ Miller JF. "The discovery of thymus function and of thymus-derived lymphocytes". Immunological Reviews. 185 (1). Jul 2002: 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917.
- ↑ Joos L, Tamm M. "Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy". Proceedings of the American Thoracic Society. 2 (5). 2005: 445–48. doi:10.1513/pats.200508-097JS. PMID 16322598.
- ↑ Copeland KF, Heeney JL. "T helper cell activation and human retroviral pathogenesis". Microbiological Reviews. 60 (4). Dec 1996: 722–42. doi:10.1128/MMBR.60.4.722-742.1996. PMC 239461. PMID 8987361.
- ↑ Miller JF. "Self-nonself discrimination and tolerance in T and B lymphocytes". Immunologic Research. 12 (2). 1993: 115–30. doi:10.1007/BF02918299. PMID 8254222.
- ↑ 1 2 3 4 Ghaffar, Abdul. "Immunology – Chapter Seventeen: Hypersensitivity States". Microbiology and Immunology On-line. University of South Carolina School of Medicine. 2006. 18 May 2016 tarixində arxivləşdirilib. İstifadə tarixi: 29 May 2016.
- ↑ 1 2 Taylor AL, Watson CJ, Bradley JA. "Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy". Critical Reviews in Oncology/Hematology. 56 (1). Oct 2005: 23–46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ↑ Barnes PJ. "Corticosteroids: the drugs to beat". European Journal of Pharmacology. 533 (1–3). Mar 2006: 2–14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ↑ Masri MA. "The mosaic of immunosuppressive drugs". Molecular Immunology. 39 (17–18). Jul 2003: 1073–77. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ↑ "Death and DALY estimates for 2002 by cause for WHO Member State /Ümumdünya Səhiyyə Təşkilatının, ölüm və DALY, səbəbləri ilə əlaqədar 2002-ci il üçün təxminlər". who.int. 21 may 2020 tarixində arxivləşdirilib. İstifadə tarixi: 1 yanvar 2007.
- ↑ Singh M, O'Hagan D. "Advances in vaccine adjuvants". Nature Biotechnology. 17 (11). Nov 1999: 1075–81. doi:10.1038/15058. PMID 10545912.
- ↑ Morgan RA, Dudley ME, Wunderlich JR. Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes. 2006. səh. 126–29.
- ↑ 1 2 Andersen MH, Schrama D, Thor Straten P, Becker JC. "Cytotoxic T cells". The Journal of Investigative Dermatology. 126 (1). Jan 2006: 32–41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ↑ Boon T, van der Bruggen P. "Human tumor antigens recognized by T lymphocytes". The Journal of Experimental Medicine. 183 (3). Mar 1996: 725–29. doi:10.1084/jem.183.3.725. PMC 2192342. PMID 8642276.
- ↑ Ljubojevic S, Skerlev M. "HPV-associated diseases". Clinics in Dermatology. 32 (2). 2014: 227–34. doi:10.1016/j.clindermatol.2013.08.007. PMID 24559558.


 French
French Deutsch
Deutsch